2. 宁夏大学生命科学学院, 银川 750021
2. College of Life Science, Ningxia University, Yinchuan 750021, China
2021年世界卫生组织(WHO)发布的《2021年全球结核病报告》显示,2020年全球结核潜伏感染人群近20亿,新发结核病(tuberculosis,TB)患者约987万,发病率为127/10万,我国估算结核病发病数位居世界第2位,死亡率为2.1/10万,由于新型冠状病毒肺炎(COVID-19)大流行,结核病死亡人数出现了十余年来的首次增加[1]。结核分枝杆菌(Mycobacterium tuberculosis,Mtb)是结核病的致病菌,其通过宿主代谢和能量代谢途径侵扰受感染细胞的自噬和凋亡[2],Mtb可侵入机体各种器官,主要是肺,引起肺结核[3]。肺泡上皮细胞(alveolar epithelial cells,AECs)是抵抗外来物入侵的第一道防线,在肺免疫中担负着由先天免疫到获得性免疫的桥梁作用[4]。Mtb在AECs内有更高的复制增殖能力,刺激AECs分泌各种细胞因子,产生细胞毒性,以促进Mtb的传播和结核病的发生与发展[5]。虽然目前有多种方法来分离AECs,但仍未有一种公认的方法能够得到纯度高且产量大的上皮细胞,因此,探讨高效分离培养原代AECs的方法对肺功能特性研究意义重大。
自噬在维持细胞体内平衡中起着至关重要的作用,在调控细胞命运和抗感染性疾病进程中至关重要[6]。Wnt5a是Wnt蛋白家族成员之一,通过与膜受体或共受体复合物结合激活细胞中磷酸化蛋白传递信号,既作用于经典Wnt/β-catenin信号通路,又活化非经典Wnt信号通路[7]。Wnt5a通过激活钙/钙调蛋白依赖的蛋白激酶II(calcium/calmodulin-dependent protein kinase II,CaMKII)及钙调磷酸酶的作用,促进细胞内Ca2+释放,使胞内Ca2+浓度升高,活化T细胞核因子(nuclear factor of the activated T cell, NFAT),发挥抑癌作用[8-9]。胞内Ca2+在自噬调控中起着重要作用[10],也在结核发病机制中起着至关重要的作用,Mtb操纵Ca2+信号以阻止吞噬体成熟及吞噬体和溶酶体融合的能力被广泛研究[11],特异性阻断Ca2+显著减少自噬小体的形成,且升高Mtb细菌载量,表明Ca2+在Mtb胞内存活和细胞自噬中发挥重要作用[12]。但Ca2+在Mtb感染过程中调节自噬的确切作用尚不清楚,因此,探讨Wnt5a是否通过非经典Wnt/Ca2+信号通路调控BCG感染的BAECs细胞自噬,对宿主导向的抗结核治疗方法的研究具有重要意义。
本课题组前期已证明Wnt5a对BCG感染的小鼠肺上皮细胞自噬有调控作用[13],因此,本研究通过分离BAECs,用BCG感染BAECs建立模型,抑制Wnt5a的表达处理,Western blot和免疫荧光染色检测自噬相关蛋白及非经典Wnt/Ca2+信号通路相关因子的蛋白水平表达,以明确Wnt5a对BCG感染的BAECs细胞自噬的调控机制,为肺结核治疗和预防提供新视角。
1 材料与方法 1.1 试验材料成年健康牛肺组织。
1.2 主要试剂及仪器硫酸链霉素、氨苄青霉素(Amersco,美国),两性霉素(Sigma,美国),胶原酶I(Gibco,美国),RNase-Free DNase I、红细胞裂解液(天埂生化科技有限公司),Biolaminin包被液(上海逍鹏生物科技有限公司),Wnt5a特异性抑制剂Box-5(Sigma,美国),DMEM/F12培养基(BI,美国),胎牛血清及TrypleTM胰酶(Gibco,美国),青霉素/链霉素溶液(北京索莱宝科技有限公司),全蛋白提取试剂盒(赛默飞世尔科技有限公司),BCA蛋白含量检测试剂盒(南京凯基公司),脱脂奶粉(BD,美国),一抗Cytokeratin14、Cytokeratin5、Atg5、P62、内参GAPDH兔多克隆抗体、二抗HRP-Goat、LC3荧光一抗和山羊抗兔荧光二抗(Proteintech,美国),LC3一抗(CST,美国),Atg7一抗(Abcam,美国),预染彩虹蛋白Marker(大连美伦生物技术有限公司),ECL显影液(环亚生物科技有限公司),4%多聚甲醛(BD,美国),Triton X-100(Sigam,美国),封闭用驴血清、含DAPI的荧光封片剂(北京索莱宝科技有限公司)。CO2细胞培养箱(SANYO,日本),全自动细胞计数仪(Bio-Rad美国),高通量组织细胞破碎仪(北京仪嘉林科技有限公司),电转仪和电泳仪(Bio-Rad,美国),GE化学发光检测仪(Gene,美国),光学显微镜(Motic公司,中国),荧光显微镜(Olympics,日本)。
1.3 结核分枝杆菌BCG来源及培养将购自成都生物制品研究所有限公司牛结核分枝杆菌卡介苗(BCG)疫苗株粉末用7H9培养液(含0.2% Tween-80和10% ADC)溶解重悬,置于细胞培养瓶中于饱和湿度、5% CO2、37 ℃恒温培养箱中培养,待达到对数生长期时进行感染试验。
1.4 牛原代肺泡上皮细胞的分离培养参考Xu等[14]和廖伟等[15]分离原代肺上皮细胞的方法,并进一步优化:取成年健康牛肺组织,纵切支气管并切成小块,置于无菌50 mL离心管,加入预冷的PBS(含双抗及两性霉素B)漂洗至洗液澄清。将组织块置于预冷消化液(PBS+20% DMEM+ 15%胎牛血清+5%双抗+1 g·L-1胶原酶I+胰酶+10 mg·L-1 DNase I+2.5 mg·L-1两性霉素B),放入4 ℃冰箱消化至出现浑浊,加等体积PBS终止消化。将管腔面向上,刮刷管腔,收集洗液,1 000 r·min-1离心5 min,加入红细胞裂解液去除红细胞,补加DMEM/F12培养液(DMEM/F12+12%胎牛血清+1%双抗)于200目细胞筛过滤,接种于培养皿中2~4 h,使易于贴壁的成纤维细胞等贴壁。收集未贴壁的细胞悬液,1 000 r·min-1离心5 min,用含DMEM/F12培养液重悬,接种于提前用Biolaminin包被液包被的培养皿中,饱和湿度下,5% CO2,37 ℃培养。
1.5 BAECs鉴定将分离的细胞以2×105个·孔-1接种于提前放置玻璃片的12孔板中贴壁8 h,弃培养液,PBS漂洗,5 min×3;4% 多聚甲醛固定20 min,同上PBS漂洗;0.2% TritonX-100通透细胞20 min,PBS漂洗;10% 驴血清/PBS封闭1 h,PBS润洗,5 min×2;37 ℃静置孵育CK14和CK5一抗(稀释比200∶1) 2 h,PBS洗涤后37 ℃避光孵育荧光二抗(稀释比100∶1)30 min,PBS洗涤3次后用含DAPI封片剂染核指甲油封片,荧光显微镜观察结果。
1.6 BCG感染及抑制Wnt5a处理BAECs待BAECs生长至80%左右时,用胰酶消化后台盼蓝染色计数,将细胞以4×105个·孔-1接种于6孔板培养皿,贴壁8 h,弃培养基,补加1 mL培养液,根据已有试验[13]基础用感染复数10∶1的BCG感染BAECs 4 h,设置对照组(C组)和BCG感染组(BCG);不同浓度Wnt5a特异性抑制剂Box-5处理BAECs 6 h收样,设置对照组(C组)及Box-5浓度为5、10、30、50和100 μmol·L-1处理组;用适宜浓度Box-5预处理BAECs 2 h,BCG继续感染BAECs 4 h(MOI=10),设置对照组(C组),BCG感染组(BCG),Box-5抑制剂组(Box-5)和抑制剂与BCG共处理组(Box-5+BCG)。
1.7 总蛋白提取及Western blot检测将不同处理组BAECs用PBS缓冲液润洗2次,每孔加100 μL全蛋白裂解液,置于4 ℃摇床15 min,使细胞充分裂解。将细胞刮下,收集于提前加了细胞磁珠的1.5 mL离心管中,置于细胞破碎仪破碎1 min左右至裂解液澄清,于低温离心机离心(4 ℃,14 000 r·min-1,15 min),收集上清液。BCA检测试剂盒测定蛋白浓度后定量加入上样缓冲液,于沸水浴灭活5 min后于-20 ℃保存备用。将30 μg变性蛋白经SDS-PAGE电泳后,湿转至PVDF膜上,用含5% 脱脂奶粉的TBS室温封闭2 h,TBS洗涤,4 ℃过夜孵育一抗,TBST洗涤,室温孵育二抗2 h,TBST洗涤,加ECL化学发光液,用GE化学发光检测仪记录蛋白条带。
1.8 免疫荧光染色检测将BAECs以2×105个·孔-1接种于提前放置玻璃片的12孔板中贴壁8 h,同“1.6”处理,弃培养基用PBS洗涤2次,用4%多聚甲醛室温固定20 min,PBS洗涤5 min×3,0.2% Triton X-100通透20 min,PBS洗涤5 min×3,用10%的驴血清室温静置封闭1 h,PBS洗涤5 min×2,37 ℃静置孵育LC3一抗(一抗稀释液按照稀释比200∶1稀释)2 h,PBS洗涤5 min×3,37 ℃避光孵育荧光二抗(PBS按照稀释比100∶1)30 min,PBS洗涤5 min×3,用含DAPI封片剂染核指甲油封片,荧光显微镜观察结果。
1.9 统计学分析所有试验数据均经过3次独立试验验证,采用ImageJ软件进行灰度值分析,试验数据均采用GraphPad Prism7.0软件中的One-way ANOVA或T-test进行统计学分析,数据均使用“均数±标准差(x±s)”表示。图中标注*代表P < 0.05,**代表P < 0.01,***代表P < 0.001。
2 结果 2.1 牛肺泡上皮细胞的分离培养对牛肺组织进行细胞分离,在培养36 h视野中出现明显的细胞团(图 1A),第一代细胞经胰酶消化离心重悬后,用台盼蓝染色计数发现细胞活率均在85%~92%之间,显微镜观察传代培养24 h细胞形态(图 1B)。

|
A. 分离培养36 h原代细胞;B. 传代培养24 h的原代细胞 A. Primary cells isolated and cultured for 36 h; B. Primary cells of passage culture for 24 h 图 1 牛肺泡上皮细胞分离培养(100×) Fig. 1 Isolation and culture of BAECs (100×) |
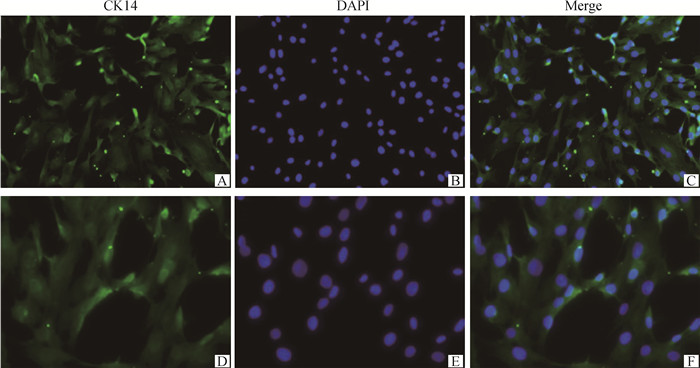
2.2.1 免疫荧光染色检测CK14的表达 为了鉴定分离肺细胞类型,依据上皮细胞类型的特异性表面标记抗原,CK14是一种具有特异性的上皮标记蛋白[16],免疫荧光染色检测CK14的表达,结果发现绝大部分细胞表达CK14(图 2),提示分离的肺细胞是BAECs。
|
免疫荧光染色检测细胞CK14的表达,CK14为绿色,DAPI为蓝色;A~C. 放大倍数100;D~F. 放大倍数200 Immunofluorescence was used to detect the expression level of CK14, CK14 was green, DAPI was blue; A-C. Magnification are 100; D-F. Magnification are 200 图 2 免疫荧光染色检测细胞CK14表达 Fig. 2 Immunofluorescence was used to detect the expression level of CK14 in cell |
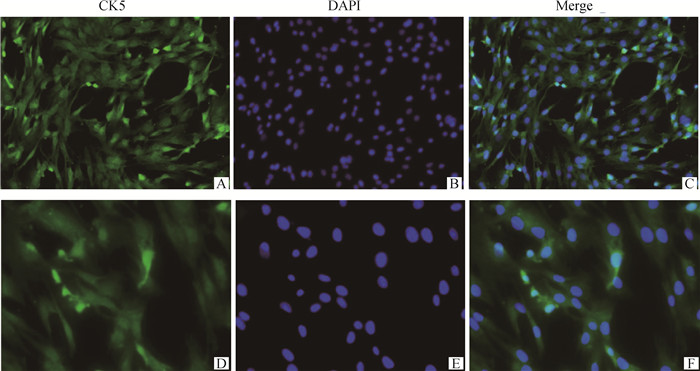
2.2.2 免疫荧光染色检测角蛋白5的表达 CK5为细胞骨架中间丝蛋白,具有维持上皮细胞形态完整性作用,免疫荧光染色检测CK5的表达,结果显示绝大部分细胞表达CK5(图 3),进一步表明分离的细胞是BAECs。
|
免疫荧光染色检测细胞CK5的表达,CK5为绿色,DAPI为蓝色;A~C. 放大倍数100;D~F. 放大倍数200 Immunofluorescence was used to detect the expression level of CK5, CK5 was green, DAPI was blue; A-C. Magnification are 100; D-F. Magnification are 200 图 3 免疫荧光染色检测细胞CK5表达 Fig. 3 Immunofluorescence was used to detect the expression level of CK5 in cell |
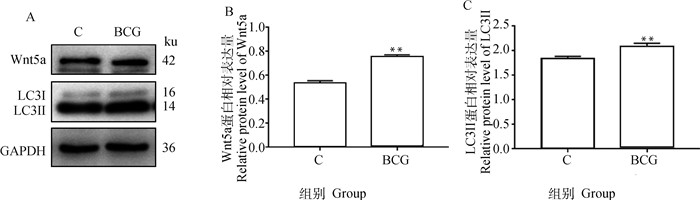
为确定BCG感染BAECs的细胞自噬及Wnt5a表达水平,用BCG感染BAECs后,Western blot检测细胞内Wnt5a及自噬相关因子LC3蛋白水平表达。结果显示,相较对照组(C组),BCG组Wnt5a及自噬相关蛋白LC3II蛋白表达水平均显著升高(P < 0.01,图 4),表明BCG感染BAECs上调Wnt5a表达水平,增加细胞自噬。
|
A. 蛋白表达印迹图;B、C.直方图。**. P < 0.01,下同 A. Western blot; B, C. Histograms. **. P < 0.01, the same as below 图 4 BCG感染BAECs内Wnt5a和自噬相关蛋白水平表达 Fig. 4 Expression of Wnt5a and autophagy-related proteins in BCG infected BAECs |
为了确定Wnt5a特异性抑制剂Box-5抑制Wnt5a的表达水平,不同浓度Box-5作用BAECs,Western blot检测胞内Wnt5a及自噬相关蛋白LC3表达水平显示,Box-5浓度为50 μmol·L-1时Wnt5a的表达水平显著低于其他组(P < 0.001),且LC3II较C组(0 μmol·L-1)显著升高(P < 0.001, 图 5)。因此确定Box-5处理浓度50 μmol·L-1为抑制BAECs中Wnt5a表达的最适浓度。

|
A. 蛋白表达印迹图;B、C. 直方图。ns.无差异;*. P < 0.05;***. P < 0.001。下同 A. Western blot; B, C. Histograms. ns. Represent no statistical significance; *. P < 0.05; ***. P < 0.001. The same as below 图 5 不同浓度Box-5作用BAECs内Wnt5a及LC3蛋白水平表达 Fig. 5 Expression of Wnt5a and LC3 protein in BAECs treated with different concentrations of Box-5 |
为确定Wnt5a对BCG感染BAECs自噬的调控作用,用Box-5与BCG单独或共处理BAECs,Western blot检测自噬相关蛋白LC3、Atg5、Atg7及P62的表达水平,结果显示,Box-5+BCG组较BCG组自噬相关因子LC3II、Atg5、Atg7及P62的蛋白水平表达均明显降低(P < 0.01, 图 6)。表明Wnt5a对BCG诱导的BAECs细胞自噬有调控作用,且抑制Wnt5a的表达下调BCG诱导的BAECs细胞自噬。

|
A. 蛋白表达印迹图;B~E. 直方图 A. Western blot; B-E. Histograms 图 6 Box-5对BCG感染BAECs自噬相关蛋白表达的影响 Fig. 6 The effect of Box-5 inhibition of Wnt5a on autophagy in BAECs infected with BCG |
LC3是自噬体成膜过程中的重要参与因子,被用来作为自噬体形成的标记[18],自噬形成时,RFP-LC3融合蛋白转位至自噬体膜,在荧光显微镜下形成荧光斑点。为了进一步探究Wnt5a对BCG感染的BAECs细胞自噬的调控作用,免疫荧光染色检测BAECs内LC3绿色荧光斑点数量及亮度。结果显示,BCG感染BAECs内LC3荧光斑点(绿色)数量与荧光强度较C组均明显增加,且Box-5+BCG组较BCG组细胞荧光斑点数量和强度均明显降低(图 7)。表明抑制Wnt5a对BCG感染BAECs细胞自噬体的形成有抑制作用,进一步证明抑制Wnt5a的表达下调了BCG诱导的BAECs细胞自噬。

|
免疫荧光检测细胞内LC3的表达,LC3为绿色,DAPI为蓝色,放大倍数100 Immunofluorescence was used to detect the expression level of LC3, Green dots represent LC3 protein and blue dots represent nucleus, magnification are 100 图 7 Box-5对BCG感染BAECs细胞自噬体的影响 Fig. 7 The effect of Box-5 on BAECs autophagosomes infected with BCG |
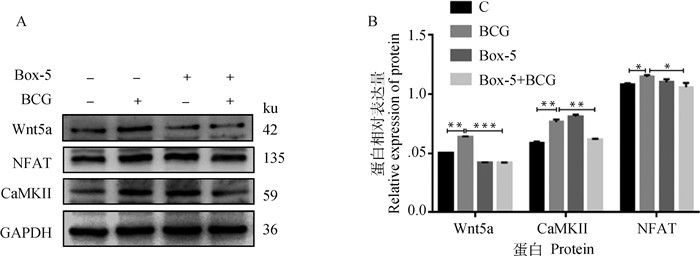
为了探讨Wnt5a调控BCG感染的BAECs细胞自噬机制,用Box-5及BCG单独或共处理BAECs,Western blot检测非经典Wnt/Ca2+通路相关因子Wnt5a、CaMKII及NFAT蛋白水平表达。结果显示,BCG感染BAECs内Wnt5a、CaMKII及NFAT的蛋白水平较C组均升高(P < 0.05),Box-5+BCG组相较于BCG组Wnt5a、CaMKII及NFAT的蛋白水平均降低(P < 0.05, 图 8),结果表明,Wnt5a介导非经典Wnt/Ca2+通路调控BCG诱导的BAECs细胞自噬。
|
A. 蛋白表达印迹图;B. 直方图 A. Western blot; B. Histograms 图 8 Wnt5a对BCG感染BAECs的Wnt/Ca2+信号通路相关蛋白水平表达的影响 Fig. 8 Effect of Wnt5a on expression of Wnt/Ca2+ signaling pathway related proteins in BCG infected BAECs |
结核病是由Mtb感染引发通过呼吸道传播的人畜共患传染病,也是世界上最致命的单一病原体死因,肺结核为最常见的结核病[19]。肺作为机体与外界之间的主要屏障,通过不同类型上皮细胞组成一层连续的上皮细胞层,构成对吸入物质和病原体的物理和生物屏障[20],肺上皮细胞是抵御肺部感染的第一道防线,具有防止病原体和毒素侵害的作用[21],也是微生物防御的积极效应器,对肺的先天免疫功能和适应性免疫功能都起着重要的作用[22]。目前分离BAECs方法有机械分散法、组织块培养法和酶消化分离法等,各有优缺点[23-24]。本研究采用酶联合消化法和机械刮刷法获取BAECs,而在分离BAECs过程中可能混合其他细胞(如纤维细胞和肌肉细胞等),利用不同细胞贴壁时间不同,差速贴壁纯化BAECs。角蛋白(cytokeratin,CK)是细胞骨架中间丝蛋白,特异性表达于上皮细胞,其在维持上皮细胞形态完整性中扮演重要角色[25-26],研究表明,CK14是上皮细胞基底细胞特异性表面标记抗原[27-28],CK5为细胞骨架中间丝蛋白,具有维持上皮细胞形态完整性作用,因此,本研究将CK5和CK14作为鉴定上皮细胞的标记,采用免疫荧光鉴定分离的细胞,发现分离纯化的上皮细胞纯度极高,因此,本研究提供了一种纯度较高的分离BAECs的方法,对探究牛属动物结核病感染及发病机制具有重要作用。
自噬是一种细胞内分解代谢过程,通过溶酶体降解过程维持体内平衡或清除入侵的病原体,自噬及其相关途径是免疫和炎症的中心稳态机制[29]。Wnt5a是一种主要的非经典Wnt配体,存在于上皮细胞中[30],Wnt5a介导相关自噬通路是宿主细胞先天免疫的重要组成部分,也是限制病原菌感染的关键[31]。ESAT-6分泌系统-1(ESX-1)作为Mtb毒力决定因子,ESX-1基因是阻止吞噬体成熟的关键,由RD1基因位点编码,缺乏RD1是导致BCG毒力减弱的原因,也是诱导细胞自噬关键[32]。因此,研究Wnt5a与自噬的关系对肺结核的预防和治疗具有现实意义。本研究探讨抑制胞内Wnt5a对BCG感染BAECs细胞自噬的影响,结果表明Wnt5a对BCG诱导的BAECs细胞自噬有调控作用,且抑制Wnt5a的表达下调了BCG诱导的BAECs细胞自噬。进一步探究Wnt5a对BCG诱导BAECs细胞自噬的调控机制对结核预防和治疗具有重要意义。
Wnt5a与细胞膜上的Fzd受体和Ror2受体结合,通过CaMKII及钙调磷酸酶的作用,引起细胞内Ca2+浓度的增加,进而激活非经典Wnt/Ca2+信号途径。Ca2+在结核发病机制中起着至关重要的作用,Mtb操纵Ca2+信号以阻止吞噬体成熟及吞噬体和溶酶体融合的能力已被广泛研究[33]。Kim等[34]在体外试验中发现Wnt5a/Ca2+信号通路在炎症内皮细胞中被激活,能迅速诱发COX-2、IL-6及IL-8等炎性因子的表达;BLANC等[35]发现,Wnt5a通过Wnt/Ca2+信号参与神经母细胞瘤的发病;也有研究发现非经典Wnt5a/Ca2+/CaN/NFAT信号在胚胎手指细胞发育中发挥了关键作用[36],非经典Wnt/Ca2+信号途径成为目前研究的热点。本研究探究抑制Wnt5a对BCG感染BAECs的Wnt/Ca2+信号通路相关蛋白表达的影响,结果表明,Wnt5a介导非经典Wnt/Ca2+信号通路调控BCG诱导BAECs细胞自噬。根据是否有mTOR信号参与可将自噬分为mTOR信号依赖性自噬和mTOR非依赖性自噬[37],异丙酚通过Ca2+/CaMKKβ/AMPK/mTOR通路抑制自噬而介导氧糖剥夺再充氧诱发的神经元损伤[38],细胞内Ca2+浓度的积累激活CaMKKβ/AMPK信号级联,导致mTOR信号抑制,从而诱导自噬[39],因此,Wnt5a/CaMKII对BCG诱导BAECs细胞自噬的调控所依赖的自噬通路有待进一步探究,这将为结核病预防和控制提供新依据。
4 结论应用胶原酶I、胰酶和DNase I酶联合消化法结合细胞刮刷法,成功分离培养纯度和活率较高的BAECs,BCG感染促进BAECs胞内Wnt5a的表达及细胞自噬,抑制Wnt5a的表达下调BCG诱导的BAECs细胞自噬,且Wnt5a介导非经典Wnt/Ca2+信号通路调控BCG诱导的BAECs细胞自噬。
| [1] |
World Health Organization. Global tuberculosis report 2021[R]. Geneva: WHO, 2021.
|
| [2] |
ALIPOOR S D, ADCOCK I M, TABARSI P, et al. MiRNAs in tuberculosis: their decisive role in the fate of TB[J]. Eur J Pharmacol, 2020, 886: 173529. DOI:10.1016/j.ejphar.2020.173529 |
| [3] |
LARA-ESPINOSA J V, SANTANA-MARTÍNEZ R A, MALDONADO P D, et al. Experimental pulmonary tuberculosis in the absence of detectable brain infection induces neuroinflammation and behavioural abnormalities in male BALB/c mice[J]. Int J Mol Sci, 2020, 21(24): 9483. DOI:10.3390/ijms21249483 |
| [4] |
YAMAMOTO K, AHYI A N N, PEPPER-CUNNINGHAM Z A, et al. Roles of lung epithelium in neutrophil recruitment during pneumococcal pneumonia[J]. Am J Respir Cell Mol Biol, 2014, 50(2): 253-262. DOI:10.1165/rcmb.2013-0114OC |
| [5] |
TOMIOKA H, SATO K, SANO C, et al. Intramacrophage passage of Mycobacterium tuberculosis and M. avium complex alters the drug susceptibilities of the organisms as determined by intracellular susceptibility testing using macrophages and type Ⅱ alveolar epithelial cells[J]. Antimicrob Agents Chemother, 2002, 46(2): 519-521. DOI:10.1128/AAC.46.2.519-521.2002 |
| [6] |
RAVANAN P, SRIKUMAR I F, TALWAR P. Autophagy: the spotlight for cellular stress responses[J]. Life Sci, 2017, 188: 53-67. DOI:10.1016/j.lfs.2017.08.029 |
| [7] |
陈琪, 李勇, 徐金瑞, 等. Wnt5a在肺相关疾病发生发展过程中作用的研究进展[J]. 吉林大学学报: 医学版, 2021, 47(1): 237-242. CHEN Q, LI Y, XU J R, et al. Research progress in roles of Wnt5a in occurrence and development of lung-related diseases[J]. Journal of Jilin University: Medicine Edition, 2021, 47(1): 237-242. (in Chinese) |
| [8] |
ZHANG H, QI Y H, GENG D C, et al. Expression profile and clinical significance of Wnt signaling in human gliomas[J]. Oncol Lett, 2018, 15(1): 610-617. |
| [9] |
ZINS K, SCHÄFER R, PAULUS P, et al. Frizzled2 signaling regulates growth of high-risk neuroblastomas by interfering with β-catenin-dependent and β-catenin-independent signaling pathways[J]. Oncotarget, 2016, 7(29): 46187-46202. DOI:10.18632/oncotarget.10070 |
| [10] |
JI T R, ZHANG C W, MA L L, et al. TRPC6-mediated Ca2+ signaling is required for hypoxia-induced autophagy in human podocytes[J]. Cell Physiol Biochem, 2018, 48(4): 1782-1792. DOI:10.1159/000492351 |
| [11] |
SHARMA S, MEENA L S. Potential of Ca2+ in Mycobacterium tuberculosis H37Rv pathogenesis and survival[J]. Appl Biochem Biotechnol, 2017, 181(2): 762-771. DOI:10.1007/s12010-016-2247-9 |
| [12] |
LIU F, CHEN J X, WANG P, et al. MicroRNA-27a controls the intracellular survival of Mycobacterium tuberculosis by regulating calcium-associated autophagy[J]. Nat Commun, 2018, 9(1): 4295. DOI:10.1038/s41467-018-06836-4 |
| [13] |
陈琪, 郑雪迪, 聂雪伊, 等. Wnt5a调节BCG感染肺泡上皮细胞自噬的作用研究[J]. 中国病原生物学杂志, 2021, 16(8): 878-883. CHEN Q, ZHENG X D, NIE X Y, et al. Effects of Wnt5a on autophagy induced by BCG in alveolar epithelial cells[J]. Journal of Pathogen Biology, 2021, 16(8): 878-883. DOI:10.13350/j.cjpb.210803 (in Chinese) |
| [14] |
XU W L, JANOCHA A J, LEAHY R A, et al. A novel method for pulmonary research: Assessment of bioenergetic function at the air-liquid interface[J]. Redox Biol, 2014, 2: 513-519. DOI:10.1016/j.redox.2014.01.004 |
| [15] |
廖伟, 钱桂生, 雷撼, 等. 人气道上皮细胞的体外原代培养研究[J]. 解放军医学杂志, 2007, 32(6): 565-567. LIAO W, QIAN G S, LEI H, et al. Studies on primary culturing of human bronchial epithelial cells[J]. Medical Journal of Chinese People's Liberation Army, 2007, 32(6): 565-567. DOI:10.3321/j.issn:0577-7402.2007.06.006 (in Chinese) |
| [16] |
GREEN M D, HUANG S X L, SNOECK H W. Stem cells of the respiratory system: From identification to differentiation into functional epithelium[J]. Bioessays, 2013, 35(3): 261-270. DOI:10.1002/bies.201200090 |
| [17] |
HASHMI A A, HUSSAIN Z F, IRFAN M, et al. Cytokeratin 5/6 expression in bladder cancer: Association with clinicopathologic parameters and prognosis[J]. BMC Res Notes, 2018, 11(1): 207. DOI:10.1186/s13104-018-3319-4 |
| [18] |
CAO W Y, LI J H, YANG K P, et al. An overview of autophagy: Mechanism, regulation and research progress[J]. Bull Cancer, 2021, 108(3): 304-322. DOI:10.1016/j.bulcan.2020.11.004 |
| [19] |
HARRIS R C, SUMNER T, KNIGHT G M, et al. Age-targeted tuberculosis vaccination in China and implications for vaccine development: A modelling study[J]. Lancet Glob Health, 2019, 7(2): e209-e218. DOI:10.1016/S2214-109X(18)30452-2 |
| [20] |
GUILLOT L, NATHAN N, TABARY O, et al. Alveolar epithelial cells: Master regulators of lung homeostasis[J]. Int J Biochem Cell Biol, 2013, 45(11): 2568-2573. DOI:10.1016/j.biocel.2013.08.009 |
| [21] |
ARDAIN A, MARAKALALA M J, LESLIE A. Tissue-resident innate immunity in the lung[J]. Immunology, 2020, 159(3): 245-256. DOI:10.1111/imm.13143 |
| [22] |
INVERNIZZI R, LLOYD C M, MOLYNEAUX P L. Respiratory microbiome and epithelial interactions shape immunity in the lungs[J]. Immunology, 2020, 160(2): 171-182. DOI:10.1111/imm.13195 |
| [23] |
ROWE R K, BRODY S L, PEKOSZ A. Differentiated cultures of primary hamster tracheal airway epithelial cells[J]. In Vitro Cell Dev Biol Anim, 2004, 40(10): 303-311. DOI:10.1290/0408056.1 |
| [24] |
白东梅, 李玉霞, 王薇, 等. 一种原代肺上皮细胞体外培养方法[J]. 生物技术通讯, 2014, 25(5): 676-681. BAI D M, LI Y X, WANG W, et al. One method of primary alveolar epithelial cells in vitro[J]. Letters in Biotechnology, 2014, 25(5): 676-681. DOI:10.3969/j.issn.1009-0002.2014.05.018 (in Chinese) |
| [25] |
NAKAI T, ICHIHARA S, KADA A, et al. The unique luminal staining pattern of cytokeratin 5/6 in adenoid cystic carcinoma of the breast may aid in differentiating it from its mimickers[J]. Virchows Arch, 2016, 469(2): 213-222. DOI:10.1007/s00428-016-1963-4 |
| [26] |
RICKMEYER T, JAGER K, SCHONIGER S, et al. Cytokeratin expression profiles of canine epithelial tissues[J]. Histol Histopathol, 2019, 34(6): 683-696. |
| [27] |
ROCK J R, ONAITIS M W, RAWLINS E L, et al. Basal cells as stem cells of the mouse trachea and human airway epithelium[J]. Proc Natl Acad Sci USA, 2009, 106(31): 12771-12775. DOI:10.1073/pnas.0906850106 |
| [28] |
ZUO W, ZHANG T, WU D Z, et al. p63+Krt5+ distal airway stem cells are essential for lung regeneration[J]. Nature, 2015, 517(7536): 616-620. DOI:10.1038/nature13903 |
| [29] |
ONORATI A V, DYCZYNSKI M, OJHA R, et al. Targeting autophagy in cancer[J]. Cancer, 2018, 124(16): 3307-3318. DOI:10.1002/cncr.31335 |
| [30] |
YUAN K, SHAMSKHOU E A, ORCHOLSKI M E, et al. Loss of endothelium-derived Wnt5a is associated with reduced pericyte recruitment and small vessel loss in pulmonary arterial hypertension[J]. Circulation, 2019, 139(14): 1710-1724. DOI:10.1161/CIRCULATIONAHA.118.037642 |
| [31] |
JATI S, KUNDU S, CHAKRABORTY A, et al. Wnt5A signaling promotes defense against bacterial pathogens by activating a host autophagy circuit[J]. Front Immunol, 2018, 9: 679. DOI:10.3389/fimmu.2018.00679 |
| [32] |
WONG K W. The role of ESX-1 in Mycobacterium tuberculosis pathogenesis[J]. Microbiol Spectr, 2017, 5(3). DOI:10.1128/microbiolspec.TBTB2-0001-2015 |
| [33] |
JAYACHANDRAN R, SUNDARAMURTHY V, COMBALUZIER B, et al. Survival of mycobacteria in macrophages is mediated by coronin 1-dependent activation of calcineurin[J]. Cell, 2007, 130(1): 37-50. DOI:10.1016/j.cell.2007.04.043 |
| [34] |
CAVALLOTTI C, FRATI A, SAGNELLI P, et al. Re-evaluation and quantification of the different sources of nerve fibres supplying the rat eye[J]. J Anat, 2005, 206(3): 217-224. DOI:10.1111/j.1469-7580.2005.00390.x |
| [35] |
BLANC E, GOLDSCHNEIDER D, DOUC-RASY S, et al. Wnt-5a gene expression in malignant human neuroblasts[J]. Cancer Lett, 2005, 228(1-2): 117-123. DOI:10.1016/j.canlet.2004.11.061 |
| [36] |
FARRERA-HERNÁNDEZ A, MARÍN-LLERA J C, CHIMAL-MONROY J. WNT5A-Ca2+-CaN-NFAT signalling plays a permissive role during cartilage differentiation in embryonic chick digit development[J]. Dev Biol, 2021, 469: 86-95. DOI:10.1016/j.ydbio.2020.10.003 |
| [37] |
CHEN Y F, ZHOU X P. Research progress of mTOR inhibitors[J]. Eur J Med Chem, 2020, 208: 112820. DOI:10.1016/j.ejmech.2020.112820 |
| [38] |
SUN B, OU H, REN F, et al. Propofol inhibited autophagy through Ca2+/CaMKKβ/AMPK/mTOR pathway in OGD/R-induced neuron injury[J]. Mol Med, 2018, 24(1): 58. DOI:10.1186/s10020-018-0054-1 |
| [39] |
SHI W W, XU D C, GU J H, et al. Saikosaponin-d inhibits proliferation by up-regulating autophagy via the CaMKKβ-AMPK-mTOR pathway in ADPKD cells[J]. Mol Cell Biochem, 2018, 449(1-2): 219-226. DOI:10.1007/s11010-018-3358-0 |
(编辑 范子娟)



