禽白血病病毒(avian leukosis virus,ALV)是一类可导致禽类多器官肿瘤和免疫抑制的逆转录病毒,其诱发的肿瘤主要包括淋巴白血病、血管瘤、神经胶质瘤等[1-2]。根据病毒表面囊膜糖蛋白gp85抗原性,可将ALV分为A~K共11个亚群,其中,感染鸡的为A~E、J和K亚群,A、B、J亚群为临床上常见的可引起鸡肿瘤的外源性ALV,C、D亚群在鸡群中很少分离到,而ALV-E属于内源性ALV,对鸡无致病作用[2-3]。ALV-K是王鑫等于2012年从我国芦花鸡的肿瘤病例中首次分离鉴定的,其gp85与已知的各亚群明显不同,但与日本可引起禽胶质瘤的毒株Sp-53、Km_5844等和我国台湾地区土著鸡分离株TW-3593等相似性超过90%[4-5]。近年来,江苏、山东、广东等地陆续有ALV-K分离鉴定的报道[6-8]。研究发现,多数ALV-K复制能力和致病性弱,因此容易长期在鸡群中潜伏传播[8]。广东作为养禽大省,拥有很多优质地方品种鸡,而许多地方品种鸡ALV净化进展相对缓慢。此外,由于ALV基因组易于突变,近来,不断有ALV-K基因组突变或与其他外源性ALV发生重组的报道,且有毒力增强的趋势[9-12]。因此,了解当前广东地区ALV-K流行株的分子特征十分必要。本研究旨在对广东规模化种禽场进行ALV-K分子流行病学调查,并进一步探究分离株gag基因12 bp的规律性缺失对病毒体外复制能力的影响,以期为这些种禽场改进AL净化方案提供科学依据。
1 材料与方法 1.1 样品、细胞及主要试剂2020年6月—2021年11月,从广东7家规模化种禽场(A~G)核心群采集抗凝血样品共8 042份;鸡胚成纤维细胞系(DF-1细胞)由本实验室保存。DMEM高糖培养基、胎牛血清、0.25%胰酶是美国GIBCO公司产品;SQ Tissue DNA提取试剂盒、DNA胶回收试剂盒、去内毒素质粒中量提取试剂盒是美国OMEGA公司产品;pBluescript Ⅱ SK(+)载体购自淼灵质粒平台;Phanta Max Super-Fidelity DNA Polymerase、ClonExpressⓇ MultiS One Step Cloning kit购自南京诺唯赞生物科技有限公司;EcoRⅠ、KpnⅠ限制性内切酶为NEB公司产品;LipofectaminTM3000转染试剂盒购自上海Invitrigen公司;ALV p27单克隆抗体由美国ADOL实验室惠赠;FITC标记羊抗鼠IgG二抗购自北京全式金有限公司;禽白血病ELISA抗原检测试剂盒为美国IDEXX公司产品。
1.2 病毒分离与鉴定将无菌操作采集的抗凝血样品于4 ℃、2 000 r·min-1离心6 min,分离上层血浆。取80 μL血浆样品接种于24孔细胞培养板的DF-1细胞悬液中,于37 ℃、5.0%CO2的培养箱中培养24 h,换成含1.0%FBS的新鲜培养液,维持9 d。细胞板于-80 ℃反复冻融3次,取100 μL细胞培养上清进行ALV p27抗原检测。对ELISA结果S/P值0.2~0.6的150份阳性样品,离心收集细胞沉淀,提取细胞DNA。参考文献[13],合成ALV-K特异性引物ALV-K-gp85-F/R(表 1),以前病毒DNA为模板进行亚群鉴定。
|
|
表 1 本试验所用引物序列 Table 1 Primers used in this study |
参考相关论文,合成扩增gag、pol、env、UTR区引物[14](表 1)。以ALV-K前病毒DNA为模板,进行全基因组分段扩增。PCR产物连接至pMD19-T载体,转化DH5α,随机各挑取3个阳性菌株送上海生工公司进行测序。利用MEGA 7软件Neighbor-joining方法分别构建gp85和LTR基因遗传进化树,Bootstrap值为1 000;用DNASTAR 7.1软件中MegAlign程序的Clustal W方法对分离株gag、pol、gp85、gp37、LTR等与ALV各亚群参考株进行多序列比对,相似性以及突变分析。ALV各亚群毒株信息及GenBank登录号见表 2。
|
|
表 2 ALV各亚群参考毒株信息表 Table 2 ALV reference strains used in this study |
构建策略如图 1所示,以pBluescript Ⅱ SK(+)质粒为载体,选取KpnⅠ、EcoRⅠ两个酶切位点,基于GD20 JM10全基因组序列,设计6条分段克隆引物(表 3),其中AF/A1R、A2F/AR为回补扩增引物。通过AF/R、BF/R分A、B两段扩增全长,AF/A1R、A2F/AR扩增A1、A2段。A、B两段和A1、A2、B 3段回收纯化后,分别经同源重组克隆至pBluescript Ⅱ SK(+)线性化载体中,所得的重组质粒分别命名为p-rGD20 JM10(原缺失质粒)和p-rGD20 JM10 A12(回补质粒),并进行测序验证。
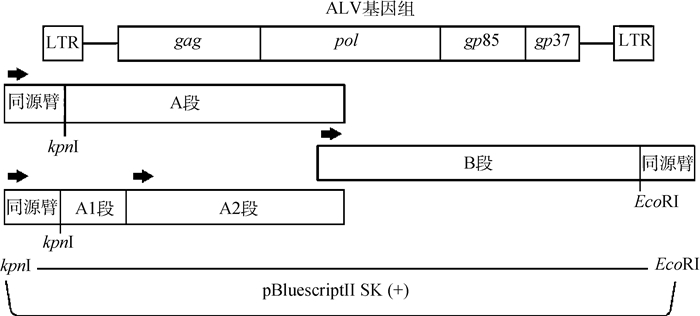
|
图 1 GD20 JM10和GD20 JM10 A12感染性克隆构建示意图 Fig. 1 Schematic diagrams showing the construction of the GD20 JM10 and GD20 JM10 A12 infectious clones |
|
|
表 3 同源重组引物 Table 3 Homologous recombination primers |
在LipofectaminTM3000介导下,将测序鉴定正确的两个质粒转染DF-1细胞,5 h后弃去转染液,换成含1.0%FBS的DMEM培养基,隔天进行传代培养,盲传3代后,维持培养9 d,收集病毒液,通过ELISA检测p27抗原。进一步将病毒液接种DF-1细胞,5 d后,以ALV p27单克隆抗体为一抗,FITC标记的羊抗鼠IgG为二抗,对感染的DF-1细胞进行IFA鉴定,并设置阴性对照,拯救成功的病毒分别命名为rGD20 JM10(原缺失株)和rGD20 JM10 A12(回补株)。同时测定病毒的滴度,将病毒液按10-1~10-6进行倍比稀释,每个稀释度8个重复,并接种至96孔板的DF-1细胞表面,孵育3 h后弃去病毒液,换成含1.0%FBS的DMEM培养液维持9 d,通过ELISA测定p27抗原,根据Reed-Muench方法计算TCID50值,进行3次独立重复试验。
1.6 rGD20 JM10和rGD20 JM10 A12体外复制能力比较将DF-1细胞均匀接种于7块6孔细胞板中,将两株病毒分别以MOI=0.01感染DF-1细胞,每个病毒设置3个重复,连续7 d每天取一块细胞板冻存于-80 ℃。通过ELISA检测每天细胞培养上清的OD650 nm值,并计算S/P值,绘制病毒生长曲线。
2 结果 2.1 病毒分离与亚群鉴定8 042份抗凝血样品经病毒分离鉴定,共检出357份阳性,阳性率为4.4%(357/8 042),其中,A场阳性率为0.7%(7/1 000),B场阳性率为1.8%(27/1 515),C场阳性率为3.9%(27/695),D场阳性率为6.8%(198/2 907),E场阳性率为8.6%(63/736),F场阳性率为1.0%(10/1 048),G场阳性率为17.7%(25/141)。经亚群鉴定和env基因测序分析共分离到32株ALV-K(表 4),根据env中的gp85核苷酸序列构建遗传进化树(图 2A),所有分离株均和ALV-K参考株在同一进化分支上,但进一步可以划分为3个小的拓扑群,将其命名为Group 1~Group 3,其中,15.6%(5/32)的分离株与日本毒株Sp-53等位于Group 1分支,46.9%(15/32)的分离株与广东分离株GDFX0601等位于Group 2分支,37.5%(12/32)的分离株与ALV-K原型株JS11C1等位于Group 3分支。进一步发现,B场和D场的毒株在3个分支上均有分布,表明这两个场的毒株遗传背景复杂多样化,并且不同种禽场存在序列相似性很高的毒株,这意味着同一毒株可能会以不同方式进入不同场。
|
|
表 4 32个ALV-K分离株背景信息 Table 4 Background information of 32 ALV-K isolates |

|
A.32个ALV分离株与各亚群参考毒株gp85核苷酸序列遗传进化树; B.16个ALV-K分离株和参考毒株LTR核苷酸序列遗传进化树。▲、◆表示本研究的分离毒株 A. Phylogenetic relationship for gp85 nucleotide sequences of 32 isolates and ALV reference strains; B. Phylogenetic relationship for LTR nucleotide sequences of sixteen isolates and ALV reference strains. ▲, ◆ represent isolates in this study 图 2 ALV分离株gp85、LTR基因系统进化树(Neighbor-joining法) Fig. 2 The phylogenetic trees based on gp85 and LTR of ALV isolates (Neighbor-joining method) |
为进一步分析ALV-K分离株的分子特征,选取16株进行全基因组测序分析。16个分离株全长为7 481~7 496 bp,所有毒株基因组均符合5′-LTR-UTR-gag-pol-env-UTR-LTR-3′典型的反转录病毒结构,其中,未发现已知病毒致癌基因。就全基因组而言,分离株间序列相似性很高(97.7%~99.8%),与NCBI已收录毒株序列BLAST比对分析显示,Group 1分支的分离株与广东分离株GD1701相似性最高(99.30%~99.63%),Group 2分支的分离株与河北分离株DT190906相似性最高,为99.40%~99.65%,而Group 3分支毒株与广东分离株GDFX0601相似性最高,为99.08%~99.44%。
分离株的gag、pol基因在亚群内及亚群间均比较保守,与各亚群参考株核苷酸相似性>95%(表 5)。16个分离株中有5株的gag基因全长为2 094 bp,其他11株gag基因全长均为2 106 bp,该12 bp的缺失位于gag基因第373—384核苷酸位点,属于gag基因编码的p19蛋白区域,并且该缺失在河北分离株DT190101和江苏分离株JS13LY19也有报道。
|
|
表 5 各分支代表毒株与不同亚群参考毒株核苷酸序列比较 Table 5 Comparison of nucleotide sequences of representative strains of each branch and reference strains |
ALV的env基因编码gp85和gp37蛋白,分离株gp85基因全长为1 002或1 005 bp。分离株间gp85核苷酸序列相似性很高(95.1%~99.9%),与J亚群的相似性最低,在50%左右,与A~E亚群相似性在82.6%~88.8%,而与ALV-K参考株GD1701、GDFX0601和DT190906等相似性最高(95.2%~99.6%)(表 5)。分离株的gp37基因均为609 bp,亦高度保守。
位于ALV前病毒基因组两端的LTR,由U3、R和U5组成。对LTR基因进行遗传进化树构建(图 2B),结果显示,16个分离株的LTR均与ALV-E和大多数ALV-K参考株GDFX0601、TW-3593等在一个进化分支上,相似性为91.4%~99.5%,而与其他亚群及ALV-K原型株JS11C1亲缘关系较远。16个分离株的LTR长度为274~281 bp,分离株间LTR相似性为92.1%~100.0%,其中,R和U5区高度保守,分别为21和78 bp,U3区在175~182 bp,不同毒株间的主要区别在U3区,该区存在碱基缺失或突变。分离株和各亚群参考株U3区序列比对结果显示(图 3),16个分离株与内源性ALV具有相似的转录调控元件,均只包含1个CAAT LTR Enhancer[T(T/G)NNG(C/T)AA(T/G)]、CArG Box[CC(A/T)6GG]、Y Box(ATTGG)、PRE Box(GGTGG)、TATA Box(TATT/ATAA)和poly A(AATAAA)。与大多数外源性ALV相比,由于个别碱基突变导致缺失了位于U3区5′端上游的CAAT LTR Enhancer、1个CAAT Box、PRE Box、CArG Box和Y Box。不同毒株在U3转录调控元件区和非调控元件区均存在个别碱基的突变、缺失及插入,与参考毒株ev-1、GDFX0601相比,16个分离株中有13株在U3区第13-16位存在AGGA/C四碱基的插入,在第123-125位存在CTG三碱基的插入,这些位点的插入现象与JS13LY19参考株一致,关于其是否会影响病毒的生物学特性有待进一步研究。
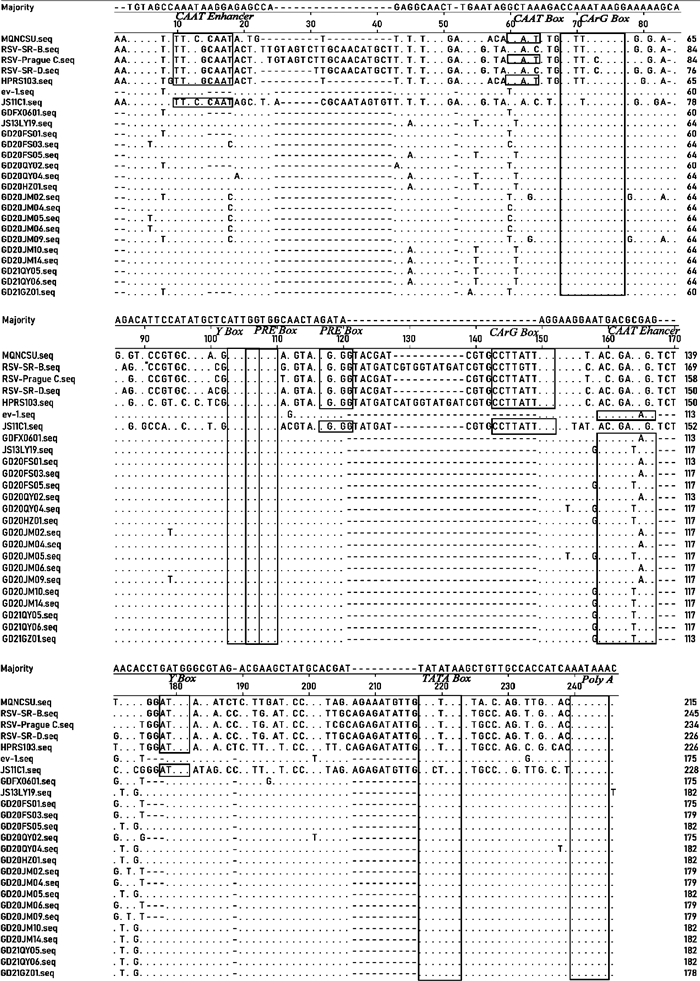
|
点“.”表示序列一致;横杠“-”表示碱基缺失;字母表示碱基突变;方框为推测的转录调控元件 Dots (.) indicate identical residues; Dash (-) indicate gapsin the alignment; The base letters indicate the substituted residues; The boxes are the putative transcriptional regulatory elements 图 3 16个ALV-K分离株与各亚群参考毒株U3区核苷酸序列比对 Fig. 3 Nucleotide sequence alignments of the ALV LTR region of the sixteen isolates and ALV reference strains |
将重组质粒转染DF-1细胞,盲传3代后维持7~9 d,收取细胞上清,通过ELISA检测p27抗原,计算S/P值分别为2.369和2.438,表明两株病毒拯救成功。IFA结果显示,感染组均能观察到特异性绿色荧光,而阴性对照DF-1细胞无荧光出现(图 4a)。通过Reed-Muench方法计算TCID50值,重复测定3次,如图 4b所示,rGD20 JM10的滴度为103.56TCID50·0.1 mL-1,rGD20 JM10 A12的滴度为103.52TCID50·0.1 mL-1。
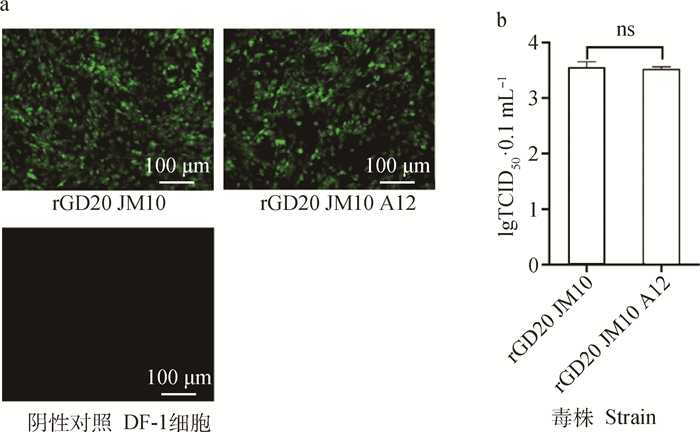
|
ns. P>0.05 图 4 拯救病毒IFA鉴定(a)及TCID50测定(b) Fig. 4 Identification of the rescued viruses by IFA (a) and determination of the virus titers (b) |
为评估拯救病毒的体外复制特性,以MOI=0.01感染DF-1细胞,连续7 d收集细胞培养上清检测p27抗原,结果显示(图 5),两株毒株在体外复制无显著差异(P>0.05)。
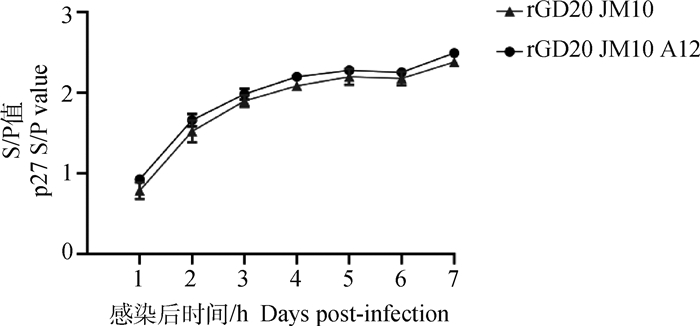
|
图 5 拯救病毒的体外复制动力学曲线 Fig. 5 Proliferation kinetics curve of the rescued viruses |
近十年来,ALV-K不断在我国地方品种鸡群中流行,为进一步了解近几年广东地方品种鸡ALV-K流行株的分子特征,本研究于2020-2021年,从广东7个种禽场采集的抗凝血样品中共分离到32株ALV-K,对其中16株的全基因组序列分析显示,基因组全长为7 481~7 496 bp,与广东黄羽肉鸡分离株GD1701、GDFX0601以及河北分离株DT190906相似性最高(99.08%~99.65%),推测这些毒株可能具有共同的祖先。
gp85基因是ALV基因组中突变率最高的基因,且与宿主范围、病毒与细胞受体结合及不同亚群分类密切相关[15-16]。分离株gp85基因遗传进化分析表明,其与日本禽胶质瘤病毒突变株Sp-53、中国台湾地区分离株TW-3593及大陆ALV-K分离株处于一个大的进化分支上,进一步证实,ALV-K已在我国大陆地方品种鸡群中广泛流行,并且已在我国乃至东亚地区存在很长一段时间,很可能拥有共同的祖先[5]。与以往的广东分离株GDFX0601、GD1701等相比,相似性>95.3%,无特殊缺失或插入出现。这表明近几年广东地区流行的ALV-K在分子特征上较为稳定,未见特殊突变。
ALV的LTR也是较易发生突变的基因,不同亚群间及同一亚群内均存在差异[17]。本研究中分离株的LTR基因与ALV-K参考株JS11C1、Km_5845和Km_6249等分属于不同的进化分支,亲缘关系较远,其中,JS11C1分离自患有肝肿瘤的芦花鸡,Km_5845和Km_6249分离自患有禽胶质瘤的日本本土鸡,而本研究分离株均来自临床表现健康的鸡群。这些毒株的env基因具有较高的相似性,感染鸡后的临床表现差异却很大,推测与其LTR的差异有关。在内外源性LTR中,U3区的差异最大,其含有多种重要的转录调控元件,与病毒的复制、组织细胞嗜性和致瘤能力密切相关[18]。本研究分离株的LTR基因与内源性ALV相似,U3区具有相同的转录调控元件,内源性LTR启动子活性弱,而大多数ALV-K携带内源性LTR。Zhao等[8]研究发现,华南地区黄羽肉鸡群分离到的6株携带内源性LTR的ALV-K的复制能力显著低于其他外源性毒株,且致病性较低。因此,可以推测本研究分离株很可能为低致病性毒株,后续可以通过反向遗传技术进行体内外试验加以验证。
成熟的gag蛋白在RNA病毒复制过程中发挥重要作用,特别是在病毒粒子组装、未成熟粒子的出芽和释放过程中[19]。其编码多种非糖基化蛋白,其中,p19蛋白负责介导gag与细胞膜的结合,并诱导病毒释放。鸡Viperin蛋白通过与p19蛋白相互作用,从而抑制ALV-J的复制[20]。因此,gag基因的突变可能会影响影响病毒的复制,且p19蛋白发挥重要作用。gag基因在ALV各亚群中均较为保守,其中p19的突变相对较高,本研究发现B、D、E 3个场的部分净化分离株在p19蛋白区域出现12 bp的规律性缺失,进而导致gag基因编码第125-128位甘氨酸-谷氨酸-谷氨酸-缬氨酸(G-E-E-V)4个氨基酸的缺失。猜测这种缺失可能具有宿主特异性,病毒在复制过程中朝着有竞争优势的方向进化,发生的突变才能稳定遗传。基于此,利用反向遗传技术并通过同源重组的方法构建了原缺失株和回补株的感染性克隆,并成功拯救了病毒。通过反向遗传技术拯救出的分子克隆化病毒克服了天然毒株遗传背景及分子水平上的差异,可以单一起源上对病毒的复制和致病特性等进行研究,且同源重组法构建感染性克隆相比于经典酶切法更为快速方便,不需要考虑酶切位点。进一步的体外试验表明,该缺失不影响病毒的体外复制能力,但其对鸡体内致病性的影响还有待进一步研究。
尽管目前临床上大多数ALV-K分离株,复制能力和致病性弱,而容易被忽略,加上RNA病毒遗传不稳定,故ALV基因组容易突变或发生亚群间重组,可能会导致ALV-K毒力增强。已陆续有很多关于ALV不同亚群间的重组报道,包括携带J亚群env、内源性ALV LTR的重组株[21];ALV-A、ALV-E和ALV-J重组毒株[22];具有ALV-J U3区的ALV-K/E/J多重重组毒株,并且该毒株可诱导感染鸡大脑皮层胶质细胞增殖,且伴有嗜神经现象[12];携带ALV-J LTR和U3区、ALV-B gp85、ALV-C 5′UTR和ALV-E gp37的新型重组株[23];以及含有部分ALV-B gp85区域的ALV-E重组株[24]。Su等[10]分离到pol基因突变的ALV-K,该突变导致了病毒的复制和垂直传播能力均显著增强。故ALV不同亚群间的自然重组频繁发生,ALV-K也可能会导致复杂的临床表现,加强对其分子特征监测十分必要。
4 结论所调查的广东7个种禽场均存在ALV-K感染,且均流行携带内源性LTR的ALV-K,其分子特征较为稳定。故种禽场在实施AL净化时,应注重采用更敏感的检测技术,此外,gag基因第373—384位的规律性缺失对病毒的体外复制能力无显著影响。
| [1] |
CHENG Z Q, LIU J Z, CUI Z Z, et al. Tumors associated with avian leukosis virus subgroup J in layer hens during 2007 to 2009 in China[J]. J Vet Med Sci, 2010, 72(8): 1027-1033. DOI:10.1292/jvms.09-0564 |
| [2] |
PAYNE L N, NAIR V. The long view: 40 years of avian leukosis research[J]. Avian Pathol, 2012, 41(1): 11-19. DOI:10.1080/03079457.2011.646237 |
| [3] |
LI H J, WANG P K, LIN L L, et al. The emergence of the infection of subgroup J avian leucosis virus escalated the tumour incidence in commercial yellow chickens in southern China in recent years[J]. Transbound Emerg Dis, 2019, 66(1): 312-316. DOI:10.1111/tbed.13023 |
| [4] |
王鑫, 赵鹏, 崔治中. 我国地方品种鸡分离到的一个禽白血病病毒新亚群的鉴定[J]. 病毒学报, 2012, 28(6): 609-614. WANG X, ZHAO P, CUI Z Z. Identification of a new subgroup of avian leukosis virus isolated from Chinese indigenous chicken breeds[J]. Chinese Journal of Virology, 2012, 28(6): 609-614. DOI:10.13242/j.cnki.bingduxuebao.002329 (in Chinese) |
| [5] |
CUI N, SU S, CHEN Z M, et al. Genomic sequence analysis and biological characteristics of a rescued clone of avian leukosis virus strain JS11C1, isolated from indigenous chickens[J]. J Gen Virol, 2014, 95(11): 2512-2522. DOI:10.1099/vir.0.067264-0 |
| [6] |
DONG X, ZHAO P, XU B, et al. Avian leukosis virus in indigenous chicken breeds, China[J]. Emerg Microbes Infect, 2015, 4(12): e76. |
| [7] |
SHAO H X, WANG L, SANG J J, et al. Novel avian leukosis viruses from domestic chicken breeds in mainland China[J]. Arch Virol, 2017, 162(7): 2073-2076. DOI:10.1007/s00705-017-3344-y |
| [8] |
ZHAO Z J, RAO M Z, LIAO M, et al. Phylogenetic analysis and pathogenicity assessment of the emerging recombinant subgroup K of avian leukosis virus in south China[J]. Viruses, 2018, 10(4): 194. DOI:10.3390/v10040194 |
| [9] |
SU Q, LI Y, LI W H, et al. Molecular characteristics of avian leukosis viruses isolated from indigenous chicken breeds in China[J]. Poult Sci, 2018, 97(8): 2917-2925. DOI:10.3382/ps/pex367 |
| [10] |
SU Q, LI Y, CUI Z Z, et al. The emerging novel avian leukosis virus with mutations in the pol gene shows competitive replication advantages both in vivo and in vitro[J]. Emerg Microbes Infect, 2018, 7(1): 1-11. |
| [11] |
SUN T, WANG X M, HAN W, et al. Complete genome sequence of a novel recombinant avian leukosis virus isolated from a three-yellow chicken[J]. Arch Virol, 2020, 165(11): 2615-2618. DOI:10.1007/s00705-020-04764-7 |
| [12] |
LI X Y, YU Y, MA M G, et al. Molecular characteristic and pathogenicity analysis of a novel multiple recombinant ALV-K strain[J]. Vet Microbiol, 2021, 260: 109184. DOI:10.1016/j.vetmic.2021.109184 |
| [13] |
CHEN J, ZHAO Z J, CHEN Y Y J, et al. Development and application of a SYBR green real-time PCR for detection of the emerging avian leukosis virus subgroup K[J]. Poult Sci, 2018, 97(7): 2568-2574. DOI:10.3382/ps/pey086 |
| [14] |
戚永娜. 山东省某地方品种鸡ALV-K的分离鉴定及其全基因组序列分析[D]. 泰安: 山东农业大学, 2019. QI Y N. Isolation, identification and evolution analysis of ALV-K isolated from local Chinese chickens in Shandong province[D]. Tai'an: Shandong Agricultural University, 2019. (in Chinese) |
| [15] |
SWANSTROM R, GRAHAM W D, ZHOU S T. Sequencing the biology of entry: the retroviral env gene[M]//HUNTER E, BISTER K. Viruses, Genes, and Cancer. Cham: Springer, 2017: 65-82.
|
| [16] |
WANG P K, LI M, LI H J, et al. Full-length cDNA sequence analysis of 85 avian leukosis virus subgroup J strains isolated from chickens in China during the years 1988-2018:coexistence of 2 extremely different clusters that are highly dependent upon either the host genetic background or the geographic location[J]. Poult Sci, 2020, 99(7): 3469-3480. DOI:10.1016/j.psj.2020.04.023 |
| [17] |
赵子君, 饶明章, 陈建, 等. K亚群禽白血病病毒5'LTR序列及启动活性分析[J]. 畜牧兽医学报, 2018, 49(4): 754-760. ZHAO Z J, RAO M Z, CHEN J, et al. The research of 5'LTR promoter activity of avian leukosis virus subgroup K[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(4): 754-760. (in Chinese) |
| [18] |
ROBINSON H L, BLAIS B M, TSICHLIS P N, et al. At least two regions of the viral genome determine the oncogenic potential of avian leukosis viruses[J]. Proc Natl Acad Sci U S A, 1982, 79(4): 1225-1229. DOI:10.1073/pnas.79.4.1225 |
| [19] |
KLINGLER J, ANTON H, RÉAL E, et al. How HIV-1 gag manipulates its host cell proteins: a focus on interactors of the nucleocapsid domain[J]. Viruses, 2020, 12(8): 888. DOI:10.3390/v12080888 |
| [20] |
王静. 鸡Viperin蛋白与ALV-J相互作用的研究[D]. 泰安: 山东农业大学, 2021. WANG J. Study on the interaction between chicken Viperin protein and ALV-J[D]. Tai'an: Shandong Agricultural University, 2021. (in Chinese) |
| [21] |
SU Q, CUI Z Y, ZHANG Z H, et al. Whole-genome analysis of an emerging recombinant avian leukosis virus in yellow chickens, south China[J]. Transbound Emerg Dis, 2020, 67(5): 2254-2258. |
| [22] |
WANG P K, SHI M Y, HE C W, et al. A novel recombinant avian leukosis virus isolated from gamecocks induced pathogenicity in Three-Yellow chickens: a potential infection source of avian leukosis virus to the commercial chickens[J]. Poult Sci, 2019, 98(12): 6497-6504. DOI:10.3382/ps/pez548 |
| [23] |
WANG P K, NIU J R, XUE C, et al. Two novel recombinant avian leukosis virus isolates from Luxi gamecock chickens[J]. Arch Virol, 2020, 165(12): 2877-2881. DOI:10.1007/s00705-020-04799-w |
| [24] |
LI J, LIU L L, NIU X X, et al. Research note: a novel recombinant subgroup E isolate of the avian leukosis virus with a subgroup B-like Gp85 region in China[J]. Poult Sci, 2021, 100(7): 101137. DOI:10.1016/j.psj.2021.101137 |
(编辑 白永平)



