2. 国家非洲猪瘟区域实验室(广州)/华南农业大学非洲猪瘟防控技术研究中心, 广州 510642;
3. 岭南现代农业科学与技术广东省实验室茂名分中心, 茂名 525000
2. African Swine Fever Regional Laboratory of China (Guangzhou)/Research Center for African Swine Fever Prevention and Control, Guangzhou 510642, China;
3. Maoming Branch of Guangdong Laboratory for Lingnan Modern Agriculture, Maoming 525000, China
非洲猪瘟是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种急性、热性和高度接触性传染病。近日,农业农村部报道,截至2022年4月7日,2022年发生的非洲猪瘟(African swine fever,ASF)疫情为野猪1 938起,家猪388起。ASFV是一种以软蜱和猪分别作为中间宿主和终末宿主的DNA病毒[1-2]。ASF起源于非洲,并于1921年在肯尼亚首次被报道,随后蔓延至欧洲、南美洲以及欧亚交界处等地区[3]。我国首例ASF病例于2018年8月3日被报告,在随后几个月内蔓延至全国。此外,ASF在亚洲迅速蔓延,包括越南、韩国、柬埔寨、缅甸等,严重影响猪相关产品的生产和贸易与国家的社会经济产业[4]。2022年,ASF疫情在全球持续蔓延,进一步表明需要加强对ASF疫情的监测。除了养猪企业应对ASF实行防控外,还需要对野猪感染ASFV采取有效的防控措施,以防止疫情的进一步蔓延。
ASFV是非洲猪瘟病毒科(Asfarviridae)、非洲猪瘟病毒属(Asfivirus)的成员,基因组长度为170~190 kb,为双链DNA病毒(dsDNA)。病毒在细胞质内复制,病毒颗粒呈二十面体对称,直径约为200 nm,具有同心结构,编码近200种蛋白质[5-6]。CD2v是ASFV外膜蛋白中唯一的特征性病毒蛋白,它能介导RBC与病毒产生吸附现象。CD2v由ORF EP402R基因编码,大小约45.3 ku,与T淋巴细胞表面的黏附受体CD2相似[7]。CD2v是一种糖蛋白,由一个信号肽、一个跨膜区和两个免疫球蛋白样结构域组成,它具有与CD2相似的氨基酸序列[8-11]。此外,猪红细胞(RBCs)表面有CD2受体,因此ASFV可以吸附猪RBCs。由于其他猪源病毒不能吸附RBCs,因此ASFV具有吸附RBCs的独特特性[12]。已发现从ASFV基因组中删除EP402R基因会降低ASFV引起的死亡率,并可以延缓病毒血症的发生和病毒向组织的传播,这表明CD2v介导的ASFV吸附RBCs的能力有助于病毒在宿主中的传播[11, 13]。基于此,本研究拟探讨ASFV吸附RBCs后对细胞凋亡的影响,以及ASFV吸附诱导RBCs发生凋亡后对猪外周血单核细胞(PBMs)吞噬能力的影响。
在这项研究中,作者通过感染ASFV的PAMs发现了血液吸附(haemadsorption,HAD)现象。进一步研究表明,ASFV可诱导RBCs发生凋亡。还发现凋亡的RBCs可以促进PBMs的吞噬作用,表明这种现象可能是加剧宿主ASFV感染传播的另一种方式,为ASFV的感染传播和致病机制的研究提供理论基础。
1 材料与方法 1.1 细胞和病毒猪肺泡巨噬细胞(PAMs)、猪外周血单核细胞(PBMs)和猪红细胞(RBCs)均取自4周龄的断奶仔猪;高毒力的ASFV分离株GZ201801分离自中国广州,为基因Ⅱ型。
1.2 主要试剂胎牛血清(FBS)、RPMI-1640培养基、细胞培养级别青霉素和链霉素抗生素、0.25% EDTA-胰酶均购自Gibco公司;十八烷基罗丹明B氯化物(R18)购自Life Technologies公司;Annexin V-APC染色试剂盒,购自Keygen Biotech公司;RIPA蛋白裂解液、蛋白酶抑制剂、4×Laemmle SDS-PAGE缓冲液(含有DL-二硫苏糖醇)、DAPI染色液购自Beyotime公司;Trans-Blot Turbo快速转移系统购自Bio-Rad公司;Cleaved-caspase3、α-Tublin一抗购自CST公司;IRDyeⓇ 800CW二抗购自LI-COR公司;Latex beads黄绿色荧光微球悬液购自Sigma公司。
1.3 主要仪器CO2培养箱购自Thermo公司;细胞计数仪购自Countstar公司;倒置显微镜购自Leica公司;流式细胞仪购自Cytoflex公司;Odyssey成像系统购自LI-COR公司;激光共聚焦显微镜购自Olympus公司。
1.4 方法1.4.1 病毒感染 将ASFV分别接种在PAMs和RBCs细胞中,并补充10%胎牛血清、2 mmol·L-1 L-谷氨酰胺、100 U·mL-1青霉素、100 U·mL-1链霉素和0.4 mmol·L-1非必需氨基酸的培养基,并将细胞放置于5% CO2的37 ℃培养箱中培养。
1.4.2 病毒HAD50测定 参照Zhao等[14]的方法,将原代PAMs培养在96孔板中,并将病毒液进行10倍被比稀释为8个梯度,感染于96孔板中接种的PAMs,在含有5% CO2的37 ℃细胞培养箱中孵育1 h后,弃掉上清液后换成10%胎牛血清的RPMI-1640培养基,同时添加含有1%的猪RBCs,在7 d内观察HAD现象,并使用Reed和Muench方法计算ASFV的HAD50[15]。
1.4.3 病毒侵染检测试验 将ASFV接种PAMs和猪RBCs,并采用流式细胞术来检测ASFV是否入侵猪RBCs。十八烷基罗丹明B(R18)是一种不溶于磷脂的亲脂性探针,可插入病毒包膜[16]。当R18插入脂质膜后,R18的荧光会自猝灭,当病毒囊膜与细胞膜融合时,探针逐渐被稀释并释放荧光信号(Ex/Em=560/590 nm),采用流式细胞仪通过检测荧光信号可以判断病毒对细胞的入侵[17]。本研究将5 mL ASFV (HAD50=10-5·0.1 mL-1)的病毒液与5 μL R18染料(3 μmol·L-1)混合并在37 ℃细胞培养箱中避光孵育20 min。随后,将混合物接种至分别铺有1×105细胞数的原代PAMs或猪RBCs的24孔板中,将其置于4 ℃冰箱中孵育1 h以使病毒黏附到细胞表面。接下来,将板转移到37 ℃细胞培养箱中培养1 h以使病毒进入细胞。此外,将5 mL RPMI-1640培养基和5 μL R18混合并接种细胞作为阴性对照。孵育后,收集PAMs和RBCs并使用流式细胞仪检测入侵病毒的百分率。
1.4.4 细胞凋亡检测 使用Annexin Ⅴ-APC细胞凋亡检测试剂盒测定RBC凋亡情况,通过Cytoflex流式细胞仪和Cyexpert软件进行检测和结果分析。作者在1、3、5和7 d的4个时间点检测感染0.1、1、3 MOI ASFV的RBC凋亡情况。将接种5×105RBCs的12孔细胞培养板中上清液弃掉,用1 mL PBS冲洗后接种ASFV,4 ℃冰箱放置1 h后转移至5% CO2的37 ℃细胞培养箱中,孵育1 h后更换含有10% FBS的RPMI-1640培养基;随后,将细胞置于37 ℃细胞培养箱中进行培养。在接种ASFV后的1、3、5和7 d收集红细胞并使用Annexin V-APC细胞凋亡检测试剂盒处理细胞,通过流式细胞术检测RBCs凋亡情况。
1.4.5 Western blot试验 将处理并收集的细胞在添加有蛋白酶抑制剂的RIPA蛋白裂解液中裂解,并添加4×Laemmle SDS-PAGE缓冲液(含有DL-二硫苏糖醇)在100 ℃下加热15 min变性。然后根据说明书在SDS-PAGE凝胶上分离蛋白质并使用Trans-Blot Turbo快速转移系统将蛋白转移到硝酸纤维素(NC)膜上。使用5%脱脂牛奶(溶解在Tris缓冲盐水中)在37 ℃下封闭NC膜1 h,然后与兔源Cleaved-Caspase3单克隆抗体室温下孵育1 h或在4 ℃下孵育过夜。使用洗涤缓冲液(含0.1% Tween20的TBS)将膜洗涤3次(每次15 min),并与IRDyeⓇ 800CW红外山羊抗兔源二抗在37 ℃下孵育1 h。将NC膜在洗涤缓冲液中洗涤3次,并使用Odyssey成像系统成像以显示蛋白质条带。α-Tublin蛋白用作蛋白上样内参。
1.4.6 PBMs吞噬能力检测 分别将接种1 MOI ASFV 1、2、3、4、5、6和7 d的5×105RBCs与10 μL黄绿色荧光微球悬浮液一起添加到接种有5×105PBMs的12孔细胞培养板中,12 h后弃掉细胞上清液,并在孔板中加入1 mL PBS后放在室温摇床上进行洗涤,共洗3次,每次15 min,以将未被吞入的黄绿色荧光微球充分清洗掉,使用DAPI对PBMs进行细胞核染色,5 min后用PBS在室温摇床上洗涤3次,每次5 min,随后通过激光共聚焦显微镜观察PBMs细胞对各组黄绿色荧光微球的吞噬数量。
2 结果 2.1 ASFV诱导RBCs发生凋亡为探讨ASFV吸附RBCs后对RBCs的影响,本研究检测了接种ASFV的RBCs的凋亡情况。参照Zhao等[14]的方法测得ASFV的HAD50结果为10-6.875·mL-1。使用0.1 MOI ASFV接种1、3、5和7 d后,RBCs的凋亡百分率分别为1.27%、3.23%、7.39%和8.56%。使用1 MOI ASFV接种1、3、5、7 d后细胞的凋亡百分率分别为1.54%、3.73%、8.46%和10.74%。使用3 MOI ASFV接种1、3、5和7 d后,细胞的凋亡百分率分别为2.65%、5.01%、12.44%和18.61%(图 1A)。接种0.1、1、3 MOI ASFV的1、3、5、7 d后,检测RBCs中Cleaved-caspase3蛋白表达水平,发现随着接种剂量和时间的增加,细胞凋亡Cleaved-caspase3蛋白的表达水平显著上调(图 1B)。以上结果表明,ASFV以剂量和时间依赖性诱导RBCs发生凋亡。
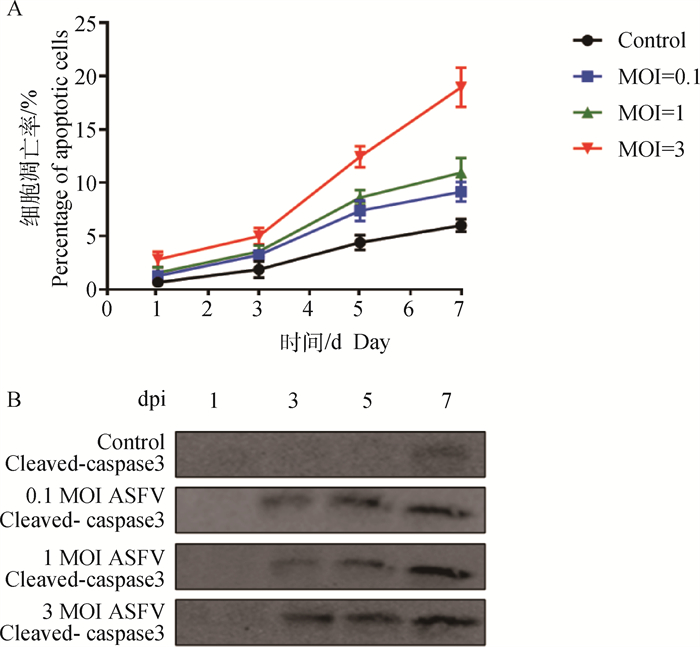
|
A.将RBCs分别接种0.1、1、3 MOI ASFV的1、3、5、7 d后,通过流式细胞术检测RBCs凋亡情况;B.检测凋亡蛋白Cleaved-Caspase3的表达水平 A. RBCs were inoculated with 0.1, 1, and 3 MOI ASFV for 1, 3, 5, and 7 days respectively, and RBCs apoptosis was detected by flow cytometry; B. Detection of the expression level of apoptotic protein, cleaved-Caspase3 图 1 ASFV诱导红细胞凋亡 Fig. 1 ASFV-induced RBCs apoptosis |
在接种GZ201801-ASFV后,即使在接种了100倍稀释病毒的孔中PAMs也显示出明显的HAD现象(图 2)。证实基因Ⅱ型ASFV具有吸附RBCs的能力。
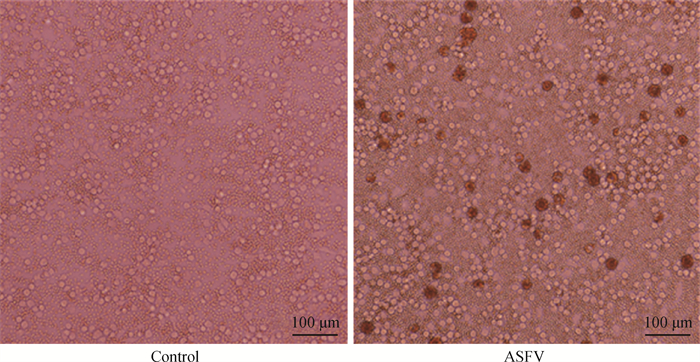
|
图 2 ASFV感染PAMs产生HAD现象 Fig. 2 The ASFV infection of pams produces red blood cell adsorption |
本研究以ASFV易感PAMs为阳性对照,通过检测ASFV病毒囊膜和细胞膜的融合来判断ASFV是否侵入RBCs。通过流式细胞仪检测R18在细胞膜表面的荧光,结果显示,ASFV感染的PAMs中具42.14%的细胞检测到荧光,表明ASFV可以有效侵入PAMs;而ASFV处理的RBCs中未检测到有荧光的细胞(0.2%在仪器误差范围内),表明ASFV不具有侵染RBCs的能力(图 3)。
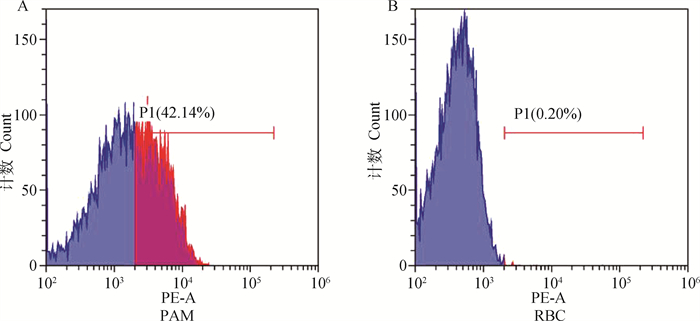
|
A. ASFV侵染PAMs的百分比;B. ASFV侵染RBCs的百分比 A. Percentage of PAMs infected by ASFV; B. Percentage of RBCs infected with ASFV 图 3 流式细胞术检测ASFV侵染宿主细胞 Fig. 3 Flow cytometry test ASFV invasion |
为确定凋亡的RBCs是否影响PBMs的吞噬能力,使用黄绿色荧光微球浮液来检测PBMs吞噬能力的变化。用1 MOI ASFV处理RBCs 1、2、3、4、5、6和7 d后收集RBCs,并将处理的RBCs与黄绿色荧光微球悬浮液一起添加到PBMs中。12 h后,通过激光共聚焦显微镜观察PBMs对黄绿色荧光微球的吞噬数量。结果显示,随着ASFV对RBCs处理的时间增加,被PBMs吞噬的黄绿色荧光微球数逐渐增加(图 4),蓝色为细胞核,绿色为荧光微球。通过对接种ASFV的RBCs和PBMs进行吉姆萨染色,红色箭头为加入培养PBMs中的RBCs,发现随着ASFV处理RBCs时间的增加,PBMs吞噬RBCs数逐渐增加(图 5)。结果表明,随着ASFV诱导RBCs凋亡数的增加,PBMs的吞噬能力也显著增强。
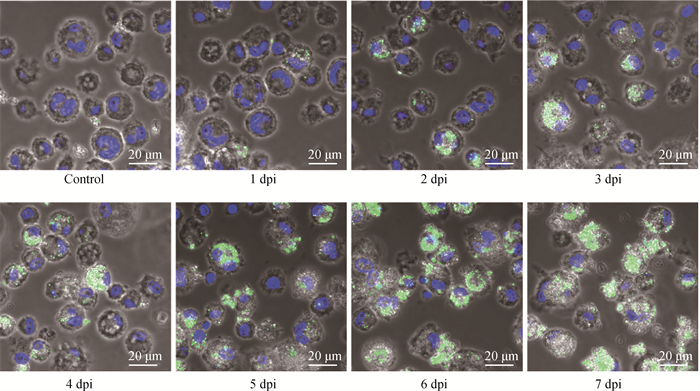
|
图 4 通过荧光微球观察ASFV处理RBCs的Control和1、2、3、4、5、6、7 dpi组的PBMs吞噬红细胞的能力 Fig. 4 The phagocytic ability of RBCs treated with ASFV and PBMs in 1, 2, 3, 4, 5, 6, 7 dpi groups were observed by fluorescence microspheres |

|
图 5 使用吉姆萨染色镜检观察ASFV处理RBCs的Control、MOCK和1、3、5、7 dpi组的PBMs吞噬红细胞的能力 Fig. 5 The phagocytic ability of RBCs treated with ASFV in Control, MOCK and PBMs in 1, 3, 5 and 7 dpi groups were observed by Giemsa staining microscopy |
RBCs是血液中最丰富的血细胞类型,它们也是无脊椎动物通过血液运输氧气的最重要介质,并且具有重要的免疫功能。RBCs程序性死亡的正常生理过程受多种内外因素影响,如氧化应激、渗透性休克、病原体感染、供能不足等。这些内在或外在因素对RBCs造成一定程度的损伤后,机体会加速受损RBCs程序性死亡,避免受损细胞破裂溶血,进一步引发炎症反应。本研究发现ASFV可诱导RBCs发生凋亡,凋亡的RBCs能促进PBMs的吞噬作用。因此,研究ASFV诱导RBCs凋亡的机制,将有助于更深入地了解ASFV的致病机制。红细胞膜由双层磷脂组成,内层含有磷脂酰丝氨酸(PS),细胞发生凋亡后,PS外翻到细胞膜外并被携带PS受体的巨噬细胞迅速识别,从而吞噬凋亡的RBCs[18]。RBCs暴露于Ca2+离子载体离子霉素后诱导细胞皱缩、细胞膜起泡形成凋亡小体和PS外翻,随后在细胞表面暴露PS,发生细胞凋亡,PS暴露在细胞膜外表面会刺激吞噬细胞吞噬凋亡的RBCs[19], 迅速将凋亡的RBCs从血液循环中清除,从而避免血液循环中存在有害的RBCs发生溶血和血红蛋白(Hb)释放[20]。PBMs是ASFV的靶细胞,当ASFV侵染猪体内后病毒进入血液感染PBMs,ASFV能诱导血液中RBCs发生凋亡并促进PBMs的吞噬功能,导致PBMs吞噬和感染病毒的数量增加。因此猜测ASFV诱导RBCs发生凋亡并促进单核细胞的吞噬功能是ASFV感染靶细胞的另一种方式。当ASFV感染PBMs时,受感染的PBMs会失去吞噬血液中凋亡RBCs的能力[21],这种现象可能与ASFV感染引起的溶血性贫血症状有关。此外,PS外翻后会增加红细胞之间的黏附程度,增大了红细胞与血管壁之间的摩擦力,并增加了细胞凋亡诱导的RBCs细胞膜的通透性,从而导致细胞质释放的Ca2+激活纤维蛋白和血小板,活化血小板产生纤维蛋白[22],这导致细胞黏附和聚集成明显的丝状发射状态,从而增加全血的黏度导致血管阻塞和血栓形成。
综上所述,虽然ASFV在感染猪后会吸附于RBCs,加速病毒在全身的传播,但ASFV不能侵染RBCs。说明RBCs不能成为潜在的ASFV靶细胞,然而ASFV可诱导RBCs发生凋亡并提升PBMs的吞噬能力。因此,阻止ASFV吸附RBCs可能会下调ASFV引起的RBCs凋亡水平,从而降低ASF感染引发的自身免疫性溶血性贫血的发生率。深入研究ASFV诱导RBCs细胞膜的脂质代谢、离子通道的激活等,可为ASF的防治提供更全面的理论依据。尽管针对ASF的疫苗正处于研发阶段,但仍需要对ASFV的致病机制进行深入研究。因此,通过阐明ASFV与宿主细胞的相互作用,可以对ASF实施更有效的预防、控制和治疗措施,以降低ASF对养猪业和国民经济造成的危害。
4 结论本试验检测ASFV对RBCs的作用,发现ASFV不能入侵RBCs,但以时间和剂量依赖性方式诱导RBCs发生凋亡。同时,通过吉姆萨染色试验和绿色荧光微球的处理发现,凋亡的RBCs可以增加PBMs的吞噬功能,ASFV诱导RBCs凋亡的百分比越高,PBMs的吞噬能力越强,表明这种现象是加剧宿主ASFV感染传播的另一种方式。本研究为ASFV的感染传播和致病机制的研究提供理论基础。
| [1] |
GAUDREAULT N N, MADDEN D W, WILSON W C, et al. African swine fever virus: An emerging DNA arbovirus[J]. Front Vet Sci, 2020, 7: 215. DOI:10.3389/fvets.2020.00215 |
| [2] |
GALINDO I, ALONSO C. African swine fever virus: A review[J]. Viruses, 2017, 9(5): 103. DOI:10.3390/v9050103 |
| [3] |
CISEK A A, DĄBROWSKA I, GREGORCZYK K P, et al. African swine fever virus: a new old enemy of Europe[J]. Ann Parasitol, 2016, 62(3): 161-167. |
| [4] |
ZHOU X T, LI N, LUO Y Z, et al. Emergence of African swine fever in China, 2018[J]. Transbound Emerg Dis, 2018, 65(6): 1482-1484. DOI:10.1111/tbed.12989 |
| [5] |
ALEJO A, MATAMOROS T, GUERRA M, et al. A proteomic Atlas of the African swine fever virus particle[J]. J Virol, 2018, 92(23): e01293-18. |
| [6] |
LI D, YANG W P, LI L L, et al. African swine fever virus MGF-505-7R negatively regulates cGAS-STING-mediated signaling pathway[J]. J Immunol, 2021, 206(8): 1844-1857. DOI:10.4049/jimmunol.2001110 |
| [7] |
MALOGOLOVKIN A, BURMAKINA G, TULMAN E R, et al. African swine fever virus CD2v and C-type lectin gene loci mediate serological specificity[J]. J Gen Virol, 2015, 96(4): 866-873. DOI:10.1099/jgv.0.000024 |
| [8] |
CHAULAGAIN S, DELHON G A, KHATIWADA S, et al. African swine fever virus CD2v protein induces β-interferon expression and apoptosis in swine peripheral blood mononuclear cells[J]. Viruses, 2021, 13(8): 1480. DOI:10.3390/v13081480 |
| [9] |
RODRÍGUEZ J M, YÁÑEZ R J, ALMAZÁN F, et al. African swine fever virus encodes a CD2 homolog responsible for the adhesion of erythrocytes to infected cells[J]. J Virol, 1993, 67(9): 5312-5320. DOI:10.1128/jvi.67.9.5312-5320.1993 |
| [10] |
BORCA M V, KUTISH G F, AFONSO C L, et al. An African swine fever virus gene with similarity to the T-lymphocyte surface antigen CD2 mediates hemadsorption[J]. Virology, 1994, 199(2): 463-468. DOI:10.1006/viro.1994.1146 |
| [11] |
GOATLEY L C, DIXON L K. Processing and localization of the African swine fever virus CD2v transmembrane protein[J]. J Virol, 2011, 85(7): 3294-3305. DOI:10.1128/JVI.01994-10 |
| [12] |
BORCA M V, CARRILLO C, ZSAK L, et al. Deletion of a CD2-like gene, 8-DR, from African swine fever virus affects viral infection in domestic swine[J]. J Virol, 1998, 72(4): 2881-2889. DOI:10.1128/JVI.72.4.2881-2889.1998 |
| [13] |
周晓慧, 肖景景, 张鑫宇, 等. 非洲猪瘟病毒强免疫原性重组CD2v抗原的制备与初步应用[J]. 畜牧兽医学报, 2020, 51(10): 2472-2480. ZHOU X H, XIAO J J, ZHANG X Y, et al. Preparation and preliminary application of highly immunogenic recombinant CD2v antigen of African swine fever virus[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(10): 2472-2480. DOI:10.11843/j.issn.0366-6964.2020.10.015 (in Chinese) |
| [14] |
ZHAO D M, LIU R Q, ZHANG X F, et al. Replication and virulence in pigs of the first African swine fever virus isolated in China[J]. Emerg Microbes Infect, 2019, 8(1): 438-447. DOI:10.1080/22221751.2019.1590128 |
| [15] |
CARRASCOSA A L, BUSTOS M J, DE LEON P. Methods for growing and titrating African swine fever virus: field and laboratory samples[J/OL]. Curr Protoc Cell Biol, 2011. doi: 10.1002/0471143030.cb2614s53.[2022-07-10].https://currentprotocols.onlinelibrary.wiley.com/doi/10.1002/0471143030.cb2614s53.
|
| [16] |
JUN Y, WICKNER W. Assays of vacuole fusion resolve the stages of docking, lipid mixing, and content mixing[J]. Proc Natl Acad Sci U S A, 2007, 104(32): 13010-13015. DOI:10.1073/pnas.0700970104 |
| [17] |
COBALEDA C, GARCÍA-SASTRE A, VILLAR E. Fusion between Newcastle disease virus and erythrocyte ghosts using octadecyl Rhodamine B fluorescence assay produces dequenching curves that fit the sum of two exponentials[J]. Biochem J, 1994, 300(2): 347-354. DOI:10.1042/bj3000347 |
| [18] |
UJIKE M, NAKAJIMA K, NOBUSAWA E. Influence of acylation sites of influenza B virus hemagglutinin on fusion pore formation and dilation[J]. J Virol, 2004, 78(21): 11536-11543. DOI:10.1128/JVI.78.21.11536-11543.2004 |
| [19] |
LANG F, BIRKA C, MYSSINA S, et al. Erythrocyte ion channels in regulation of apoptosis[J]. Adv Exp Med Biol, 2004, 559: 211-217. |
| [20] |
FÖLLER M, HUBER S M, LANG F. Erythrocyte programmed cell death[J]. IUBMB Life, 2008, 60(10): 661-668. DOI:10.1002/iub.106 |
| [21] |
LANG F, LANG K S, LANG P A, et al. Mechanisms and significance of eryptosis[J]. Antioxid Redox Signal, 2006, 8(7-8): 1183-1192. DOI:10.1089/ars.2006.8.1183 |
| [22] |
KARALYAN Z, ZAKARYAN H, ARAKELOVA E, et al. Evidence of hemolysis in pigs infected with highly virulent African swine fever virus[J]. Vet World, 2016, 9(12): 1413-1419. DOI:10.14202/vetworld.2016.1413-1419 |
(编辑 白永平)



