2. 西北农林科技大学动物医学院, 杨凌 712100;
3. 江苏高校动物重要疫病与人兽共患病防控协同创新中心, 扬州 225009
2. Northwest Agricultural & Forest University, College of Veterinary Medicine, Yangling 712100, China;
3. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China
伪狂犬病病毒(pseudorabies virus,PRV)是具有囊膜的双链DNA病毒,基因组大小约140 kb,编码至少70个蛋白,属于α-疱疹病毒亚科(Alphaherpesvirinae),水痘病毒属(Varicellovirus)[1]。猪是PRV的唯一自然宿主,PRV感染猪后引起的疾病称为伪狂犬病(pseudorabies, PR),常见的临床表现包括母猪繁殖障碍、仔猪神经症状以及中大猪呼吸道症状等[2-3]。PRV在我国猪群中具有较高的流行率,是危害我国养猪业的重要病原之一。此外,PRV还可感染狗、猫、牛、羊、狐狸、水貂和狼等多种动物,具有很广的感染谱,且除了猪以外,其他动物多在感染后24~48 h内死亡[4]。
US3蛋白是丝氨酸/苏氨酸蛋白激酶,存在于所有的α-疱疹病毒亚科成员中,也是PRV的一个重要毒力蛋白[5]。研究显示,US3可以诱导丝切蛋白(cofilin)去磷酸化和RhoA蛋白的磷酸化,从而影响细胞骨架重排[6-7];可以通过降解Bcl-2相关转录因子1(Bcl-2 associated transcription factor 1,Bclaf1)和诱导IRF3的高度磷酸化来抑制Ⅰ型干扰素信号[8];通过激活PI3-K/Akt和NF-κB信号通路来调控抗凋亡基因的表达等[9]。但目前对US3参与的生物学过程及其分子机理的揭示还很有限,有必要深入发掘鉴定新的和US3互作的宿主蛋白,从而进一步拓展对US3生物学功能的认知。
膜联蛋白A2(annexin A2,ANXA2)是一个具有多种生物学功能的钙磷脂结合蛋白,参与囊泡转运、细胞骨架膜动力学和信号转导等多个生物学过程[10-11]。在病毒感染过程中也发挥着重要作用,有报道显示,ANXA2可以和猪繁殖与呼吸综合征病毒(PRRSV)的Nsp9互作,从而促进PRRSV在MARC-145细胞上的增殖[11];ANXA2还可以和宿主波形蛋白(vimentin)互作,来促进PRRSV和猪圆环病毒2型(PCV2)的复制[12];ANXA2可以和猪瘟病毒(CSFV)NS5A和E2蛋白互作,促进CSFV在PK-15细胞上的增殖[13]。但目前尚没有针对ANXA2是否影响PRV复制增殖的相关研究报道。
本研究中,作者通过免疫共沉淀和pull-down分析验证了US3和ANXA2的相互作用,发现抑制ANXA2的表达可以显著影响PRV的增殖,过表达ANXA2对PRV和凋亡刺激剂诱导的细胞凋亡具有负调控作用。
1 材料与方法 1.1 材料PK-15细胞和3D4/21细胞由本实验室保存;PRV毒株HeNLH/2017(GenBank:MT775883)由本实验室从临床病料中分离鉴定[3];小干扰RNA由上海吉玛公司合成,引物由生工生物工程(上海)股份有限公司合成;pEGFP-C1、pEGFP-N1和pCMV-3xflag质粒由本实验室保存;pEGFP-US3、pEGFP-ANXA2、pCMV-3xflag-US3、pCMV-3xflag-A2和pEASY-Blunt-UL54重组质粒由本实验室构建并保存;Flag亲和磁珠购自ThermoFisher Scientific公司,GFP-Trap磁珠购自ChromTek公司;PRV gE蛋白单克隆抗体由本实验室制备、保存。
1.2 试剂无内毒素质粒提取试剂盒购自康为世纪生物科技有限公司;转染试剂Lipofectamine 2000购自Invitrogen公司;Q5超保真酶和限制性内切酶购自NEB公司;核酸提取试剂Mini Best Virus DNA/RNA Extraction kit和反转录试剂Prime ScriptTM RT reagent kit购自TaKaRa公司;TRIzolR Reagent购自索莱宝生物科技有限公司;RIPA细胞裂解液和细胞凋亡刺激剂(apoptotic stimulator)购自碧云天生物技术公司;ECL超敏化学发光液(P10300)购自新赛美公司;SYBR Green荧光定量试剂购自Roche公司;ProteoSilverTM Stain Kit银染试剂购自Sigma公司;GFP抗体(D5.1)、ANXA2抗体(D11G2)、Caspase-3抗体和Cleaved Caspase-3抗体购自Cell Signaling Technology公司;Flag抗体和β-tubulin抗体购自Abbkine公司;AnnexinV-APC/PI细胞凋亡检测试剂盒购自凯基生物公司。
1.3 US3潜在互作蛋白发掘pEGFP-N1和pEGFP-US3分别转染PK-15细胞,24 h后收取蛋白样品,并用GFP-Trap磁珠进行pull-down,制备的蛋白样品跑SDS-PAGE,按照ProteoSilverTM Stain Kit银染试剂的说明书进行银染,待加入终止液后,在白色背景板下比较银染后的pEGFP-N1和pEGFP-US3组的样品条带,用干净刀片切取差异性条带,送生工生物工程(上海)股份有限公司进行LC-MS质谱分析。
1.4 免疫共沉淀和pull-down分析pEGFP-ANXA2、pEGFP-N1、pCMV-3xflag和pCMV-3xflag-US3分别进行两两组合,转染HEK 293T细胞,转染36 h后,用Flag亲和磁珠和GFP-Trap磁珠分别进行免疫共沉淀分析。取pCMV-3xflag和pCMV-3xflag-US3质粒转染PK-15细胞,36 h后收取蛋白样品,用Flag亲和磁珠进行pull-down,用ANXA2和Flag抗体进行免疫印迹分析。
1.5 荧光定量RT-PCR利用TRIzolR法分别提取RNAi对照组和处理组细胞的总RNA,然后进行反转录获得cDNA,以获得的cDNA为模板,通过检测ANXA2和内参基因GAPDH的mRNA含量来验证ANXA2在转录水平的敲低效果;利用绝对荧光定量PCR评估敲低ANXA2的表达对PRV基因组复制的影响,按照病毒DNA/RNA提取试剂盒的说明书进行RNAi对照组和处理组病毒核酸的提取。然后以pEASY-Blunt-UL54质粒标准品建立标准曲线,用建立的针对PRV UL54基因的荧光定量PCR进行扩增,并根据标准曲线计算基因的拷贝数,用来代表各组中PRV DNA的含量。具体的引物和siRNA序列见表 1。
|
|
表 1 引物和siRNA序列信息 Table 1 The primers and siRNA sequence information |
采用半数细胞培养物感染量(50% tissue culture infective dose,TCID50)来进行测定,将PK-15细胞以1.0 ×104个细胞·孔-1铺于96孔板,待每个孔的单层细胞长至90%的丰度时,弃去上清培养基,用PBS润洗3次;然后加入用DMEM细胞维持液(含2.0%FBS)10倍倍比稀释的病毒液样品,获得稀释度依次为10-1~10-10的待测病毒稀释液;96孔板的第一列对应10-1稀释度的混合液,第二列对应10-2稀释度的混合液,依次类推,最后两列作为空白组,加入无病毒液的维持液,每个稀释度设8个重复。置于细胞培养箱,培养3~5 d,期间在显微镜下观察PRV感染引起的细胞病变情况,记录每个稀释度发生细胞病变的孔数,用Reed-Muench法计算TCID50。
1.7 Western blot分析利用RIPA细胞裂解液收取细胞蛋白样品,制备的蛋白样品经变性处理后,取适量加到12.0%变性蛋白预制胶上样孔中进行电泳(SDS-PAGE),然后经过转印将蛋白转移至硝酸纤维素膜,用5.0%的脱脂奶粉(0.5%PBST配制)对膜进行室温封闭2 h,接着分别用特异性的一抗或二抗(见“1.2”)继续室温孵育1 h,最后将配制的ECL超敏化学发光液均匀加到PVDF膜上,置于凝胶成像扫描仪调整合适的曝光时间进行观察。
1.8 流式细胞术PRV感染或者凋亡刺激剂刺激PK-15细胞,在指定时间点收取细胞,并用PBS进行悬浮,按照说明书用Annexin V-APC/PI对细胞进行避光染色5 min,然后使用Beckman CytoFLEX设备进行流式细胞检测分析,所有数据使用CytExpert软件进行分析处理。
1.9 数据统计荧光定量PCR/RT-PCR、病毒滴度测定和细胞凋亡的流式分析试验均进行了3次重复,各组数据用GraphPad Prism软件中的t检验或者ANOVA方法进行统计学差异性分析。P < 0.05(*)表示差异显著,P < 0.01(**)表示差异极显著,ns表示无显著差异。
2 结果 2.1 US3潜在互作蛋白筛选通过蛋白pull-down、银染和串联质谱(LC-MS)分析,发现了多个与PRV US3蛋白具有潜在相互作用的宿主蛋白(表 2)。
|
|
表 2 LC-MS质谱分析结果 Table 2 The results of LC-MS mass spectrometry |
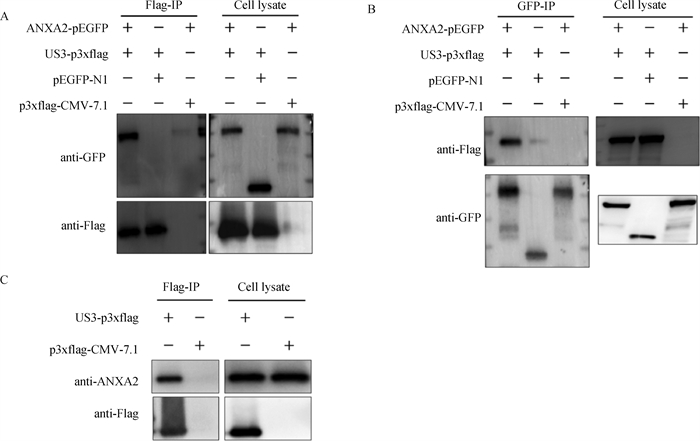
pEGFP-ANXA2与pCMV-3xflag-US3,pEGFP-N1与pCMV-3xflag-US3,pEGFP-ANXA2与pCMV-3xflag分别共转染HEK 293T细胞,收取蛋白样品后,用Flag亲和磁珠或GFP-Trap磁珠分别进行免疫共沉淀分析。结果如图 1所示,Flag亲和磁珠进行免疫沉淀分析时,可以检测到特异的GFP-ANXA2条带(图 1A);GFP-Trap磁珠进行免疫沉淀分析时,可以检测到特异性的Flag-US3条带(图 1B)。进一步用pCMV-3xflag和pCMV-3xflag-US3质粒转染PK-15细胞,36 h后收取蛋白样品,用Flag亲和磁珠进行pull-down,分别用ANXA2和Flag抗体进行免疫印迹分析,结果显示,US3可以和内源性的ANXA2发生特异的相互作用(图 1C)。
|
A、B.免疫共沉淀验证外源性ANXA2和US3的互作;C.Pull-down分析US3和内源性ANXA2的互作 A, B. The interaction between ANXA2 and US3 was detected by co-IP assay in vitro; C. The interaction between ANXA2 and US3 was verified by pull-down assay in vivo 图 1 ANXA2蛋白和US3蛋白之间的相互作用 Fig. 1 The interaction between ANXA2 and US3 |
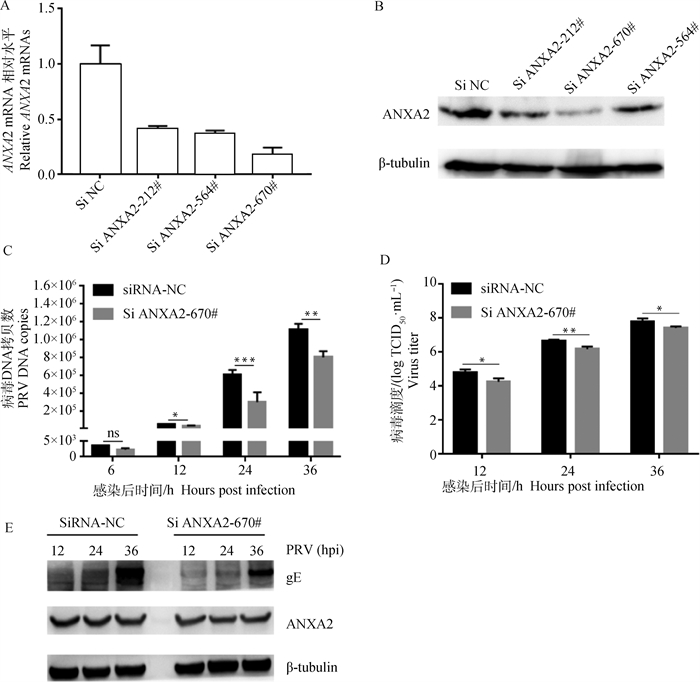
PK-15细胞转染小干扰RNA 36 h后,用相对荧光定量PCR和免疫印迹法检测ANXA2转录和表达的抑制效果,结果如图 2A和B所示,Si ANXA2-670#序列对的基因沉默效果最好,选择该序列进行后续的试验。为进一步验证ANXA2对PRV增殖的影响,PK-15细胞转染Si NC和Si ANXA2-670# 36 h后,用PRV进行感染(MOI=0.1),在指定的时间点收取样品,通过分析基因拷贝数、病毒滴度和gE蛋白的表达水平(图 2C~E),结果发现,与Si NC组相比较,敲低ANXA2的表达后显著抑制了PRV在PK-15细胞上的复制增殖。
|
A、B. qRT-PCR和免疫印迹评估ANXA2的敲低效果;C. 病毒基因含量的检测;D. 病毒滴度(TCID50)的检测;E. 病毒蛋白表达水平分析;*. P < 0.05, **. P < 0.01, ***. P < 0.001, ns. P>0.05 A, B. ANXA2 expression levels were elevated by qRT-PCR and Western blot; C. PRV genome copy numbers detected by qPCR; D. Viral load (TCID50) detected by virus titration; *. P < 0.05, **. P < 0.01. ***. P < 0.001, ns. P>0.05 图 2 敲低ANXA2的表达抑制PRV在PK-15细胞上的增殖 Fig. 2 Knockdown of ANXA2 in PK-15 cells inhibits the proliferation of PRV |
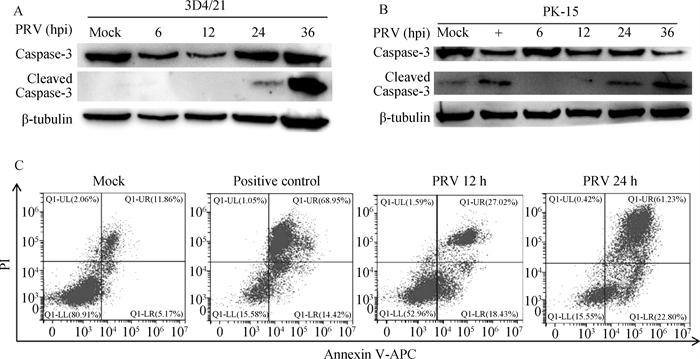
细胞凋亡是宿主细胞抵抗各种病原微生物感染的关键防御机制,作者分析了PRV感染对细胞凋亡的影响。结果如图 3所示,3D4/21细胞(图 3A)和PK-15细胞(图 3B)感染PRV(MOI=0.1)的指定时间点收集蛋白样品,通过免疫印迹检测显示,与对照组相比,凋亡效应蛋白Caspase-3发生了明显的活化剪切;进一步的利用流式细胞仪检测Annexin V和PI染色细胞情况,发现PRV感染后,Annexin V和PI双染的晚期凋亡细胞明显增多(图 3C)。这些结果表明,PRV感染宿主细胞后会诱导细胞凋亡的发生。
|
A、B. Western blot分析caspase-3剪切体蛋白水平的变化;C. 流式细胞术分析细胞凋亡情况 A, B. The cleaved caspase-3 were detected by Western blot; C. The cell death percentage was analyzed by flow cytometry 图 3 PRV感染诱导细胞凋亡 Fig. 3 The apoptosis induced by PRV infection |
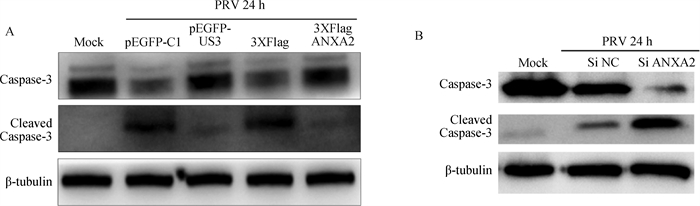
有研究报道ANXA2可以抵抗X射线辐射诱导的细胞凋亡[14],但ANXA2是否参与了病毒感染诱导的细胞凋亡调控尚不清楚。在PK-15细胞上分别过量或敲低ANXA2的表达,然后用PRV进行感染(MOI=0.1)24 h,收取蛋白样品进行免疫印迹分析。其中PRV US3蛋白是已知的具有抑制细胞凋亡的作用,作为阳性对照。结果显示,在过表达ANXA2的条件下(图 4A),ANXA2对PRV诱导的细胞凋亡显示出了明显的抑制效应;而敲低ANXA2的表达后(图 4B),则对PRV诱导的细胞凋亡具有显著的促进作用。
|
A. 过表达ANXA2抑制PRV感染诱导的细胞凋亡;B. 敲低ANXA2的表达促进PRV感染诱导的细胞凋亡 B. Overexpression of ANXA2 inhibited the apoptosis induced by PRV infection; B. Knockdown the expression of ANXA2 promoted the apoptosis induced by PRV infection 图 4 ANXA2蛋白影响PRV感染诱导的细胞凋亡 Fig. 4 The ANXA2 protein affects the apoptosis induced by PRV infection |
为进一步验证ANXA2对细胞凋亡的影响,同样在过表达或敲低ANXA2表达的条件下,用凋亡刺激剂刺激PK-15细胞10 h,然后收集样品用对应的抗体进行免疫印迹分析。结果如图 5A和B所示,ANXA2对凋亡刺激剂诱导的细胞凋亡具有显著的抑制作用。
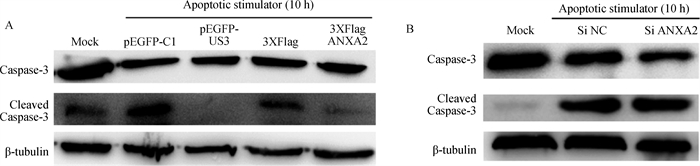
|
A. 过表达ANXA2抑制凋亡刺激剂诱导的细胞凋亡;B. 敲低ANXA2的表达增强凋亡刺激剂诱导的细胞凋亡 B. Overexpression of ANXA2 inhibited the apoptosis induced by apoptotic stimulator; B. Knockdown the expression of ANXA2 inhanced the apoptosis induced by apoptotic stimulator 图 5 ANXA2蛋白影响凋亡刺激剂诱导的细胞凋亡 Fig. 5 The ANXA2 protein affects the apoptosis induced by apoptotic stimulator |
PK-15细胞在ANXA2敲低或过表达的条件下,用凋亡刺激剂刺激2 h后,收取细胞用Annexin V-APC/PI凋亡检测试剂盒对细胞进行染色,然后进行流式细胞仪检测。结果如图 6A和B所示,敲低ANXA2的表达对凋亡刺激剂诱导的细胞凋亡呈现出促进效应,而过表达ANXA2的条件下,则表现出显著的抑制细胞凋亡的效应。

|
A. 过表达ANXA2抑制凋亡刺激剂诱导的细胞凋亡;B. 敲低ANXA2的表达增强凋亡刺激剂诱导的细胞凋亡。**.P < 0.01 B. Overexpression of ANXA2 inhibited the apoptosis induced by apoptotic stimulator; B. Knockdown the expression of ANXA2 enhanced the apoptosis induced by apoptotic stimulator. **.P < 0.01 图 6 流式细胞术分析ANXA2对细胞凋亡的影响 Fig. 6 The effects of ANXA2 to apoptosis were evaluated by flow cytometry assay |
US3蛋白激酶是一个在α疱疹病毒中高度保守的蛋白,已有的研究显示US3蛋白参与了细胞骨架重排、免疫调控和细胞凋亡等多个生物学过程,是PRV进入细胞后的入核和出核过程的重要调控蛋白[8, 15-16]。关于US3互作蛋白的筛选鉴定将有助于更好地理解US3蛋白的生物学功能,如Jansens等[5]利用磷酸化组学分析了过表达US3的条件下对宿主蛋白磷酸化的影响,鉴定发现了14个显著去磷酸化的蛋白和64个显著磷酸化的蛋白。在前期试验中,通过在PK-15细胞过表达GFP-US3蛋白,然后利用GFP-Trap磁珠pull down,结合银染和蛋白质谱技术(LC/MS),发现宿主ANXA2是一个潜在的与US3互作蛋白。在本研究中,作者通过免疫共沉淀技术和pull-down技术进一步验证了ANXA2和US3的相互作用。ANXA2作为一个新鉴定的和US3互作的宿主蛋白,拓展了对US3蛋白作用底物的认识,其具体行使的生物学功能及分子机制还有待进一步深入研究。
ANXA2在PRV感染过程中的作用尚不清楚。有研究显示,PRV感染神经细胞后,可以刺激轴突处局部的蛋白合成,丰度较高的蛋白有ANXA2和外周蛋白(peripherin),这些蛋白参与了PRV在神经细胞的逆向转运过程[17]。在对PRV病毒粒子包含宿主蛋白成分的鉴定研究中,也发现了ANXA2存在于成熟的病毒粒子中[18]。本研究中,作者利用小RNA干扰技术来抑制ANXA2的表达,发现敲低ANXA2的表达,可以显著抑制PRV在PK-15细胞上的复制增殖。结果提示ANXA2在PRV复制增殖的过程中发挥着一定的作用。
细胞凋亡是宿主细胞抵抗各种病原微生物感染的重要防御机制之一[19-20]。有报道显示,US3可以通过激活PI3-K/Akt和NF-κB信号通路来抑制PRV感染诱导的细胞凋亡[9];而也有报道显示,在P53基因诱导的凋亡过程中,ANXA2的表达受到显著抑制,ANXA2也可以抵抗X射线诱导的细胞凋亡[10]。本研究中,作者通过免疫印迹和流式细胞术,验证了过表达ANXA2对PRV和凋亡刺激剂诱导的细胞凋亡的影响,确定了ANXA2具有负调控细胞凋亡的作用,但其具体的分子机制尚需要进一步的研究证实。
4 结论ANXA2是一个新的可以和PRV US3蛋白相互作用的宿主蛋白,PRV的复制增殖需要ANXA2的参与,ANXA2具有负调控细胞凋亡的作用。
| [1] |
郭振华, 邢广旭, 翁茂洋, 等. 2株伪狂犬病毒变异株全基因组测序及主要保护性抗原氨基酸变异分析[J]. 河南农业科学, 2021, 50(8): 146-153. GUO Z H, XING G X, WENG M Y, et al. Genome sequencing of two pseudorabies virus variants and amino acid mutation analysis of major protective antigen[J]. Journal of Henan Agricultural Sciences, 2021, 50(8): 146-153. (in Chinese) |
| [2] |
解伟涛, 梁跃, 乔松林, 等. 2014-2016年河南省猪伪狂犬野毒感染和免疫情况血清学调查[J]. 河南农业科学, 2016, 45(12): 153-156, 160. XIE W T, LIANG Y, QIAO S L, et al. Serological survey of porcine pseudorabies virus infection and vaccine immunization from 2014 to 2016 in Henan province[J]. Journal of Henan Agricultural Sciences, 2016, 45(12): 153-156, 160. (in Chinese) |
| [3] |
李翔, 郭振华, 阮海宇, 等. 两株猪伪狂犬病病毒变异株的分离鉴定及gB、gC和gE基因的分子特征分析[J]. 中国畜牧兽医, 2019, 46(3): 881-890. LI X, GUO Z H, RUAN H Y, et al. Isolation and identification of two pseudorabies virus variants and analysis of molecular characteristics of gB, gC and gE genes[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(3): 881-890. (in Chinese) |
| [4] |
GUO Z H, CHEN X X, ZHANG G P. Human PRV infection in China: an alarm to accelerate eradication of PRV in domestic pigs[J]. Virol Sin, 2021, 36(4): 823-828. DOI:10.1007/s12250-021-00347-1 |
| [5] |
JANSENS R J J, MARMIROLI S, FAVOREEL H W. An unbiased approach to mapping the signaling network of the pseudorabies virus US3 protein[J]. Pathogens, 2020, 9(11): 916. DOI:10.3390/pathogens9110916 |
| [6] |
JACOB T, VAN DEN BROEKE C, VAN WAESBERGHE C, et al. Pseudorabies virus US3 triggers RhoA phosphorylation to reorganize the actin cytoskeleton[J]. J Gen Virol, 2015, 96(8): 2328-2335. DOI:10.1099/vir.0.000152 |
| [7] |
JACOB T, VAN DEN BROEKE C, VAN TROYS M, et al. Alphaherpesviral US3 kinase induces cofilin dephosphorylation to reorganize the actin cytoskeleton[J]. J Virol, 2013, 87(7): 4121-4126. DOI:10.1128/JVI.03107-12 |
| [8] |
QIN C, ZHANG R, LANG Y, et al. Bclaf1 critically regulates the type I interferon response and is degraded by alphaherpesvirus US3[J]. PLoS Pathog, 2019, 15(1): e1007559. DOI:10.1371/journal.ppat.1007559 |
| [9] |
CHANG C D, LIN P Y, LIAO M H, et al. Suppression of apoptosis by pseudorabies virus Us3 protein kinase through the activation of PI3-K/Akt and NF-κB pathways[J]. Res Vet Sci, 2013, 95(2): 764-774. DOI:10.1016/j.rvsc.2013.06.003 |
| [10] |
李辰跃, 顾操, 赵世红. 膜联蛋白A2磷酸化与功能调控研究进展[J]. 第二军医大学学报, 2019, 40(2): 213-218. LI C Y, GU C, ZHAO S H. Advance on phosphorylation and function regulation of annexin A2[J]. Academic Journal of Second Military Medical University, 2019, 40(2): 213-218. (in Chinese) |
| [11] |
TAYLOR J R, SKEATE J G, KAST W M. Annexin A2 in virus infection[J]. Front Microbiol, 2018, 9: 2954. DOI:10.3389/fmicb.2018.02954 |
| [12] |
CHANG X B, YANG Y Q, GAO J C, et al. Annexin A2 binds to vimentin and contributes to porcine reproductive and respiratory syndrome virus multiplication[J]. Vet Res, 2018, 49(1): 75. DOI:10.1186/s13567-018-0571-5 |
| [13] |
SHENG C, LIU X X, JIANG Q Y, et al. Annexin A2 is involved in the production of classical swine fever virus infectious particles[J]. J General Virol, 2015, 96(5): 1027-1032. DOI:10.1099/vir.0.000048 |
| [14] |
WATERS K M, STENOIEN D L, SOWA M B, et al. Annexin A2 modulates radiation-sensitive transcriptional programming and cell fate[J]. Radiat Res, 2013, 179(1): 53-61. DOI:10.1667/RR3056.1 |
| [15] |
TANG Y D, LIU J T, WANG T Y, et al. Comparison of pathogenicity-related genes in the current pseudorabies virus outbreak in China[J]. Sci Rep, 2017, 7(1): 7783. DOI:10.1038/s41598-017-08269-3 |
| [16] |
FAVOREEL H W, VAN MINNEBRUGGEN G, ADRIAENSEN D, et al. Cytoskeletal rearrangements and cell extensions induced by the US3 kinase of an alphaherpesvirus are associated with enhanced spread[J]. Proc Natl Acad Sci U S A, 2005, 102(25): 8990-8995. DOI:10.1073/pnas.0409099102 |
| [17] |
KOYUNCU O O, PERLMAN D H, ENQUIST L W. Efficient retrograde transport of pseudorabies virus within neurons requires local protein synthesis in axons[J]. Cell Host Microbe, 2013, 13(1): 54-66. DOI:10.1016/j.chom.2012.10.021 |
| [18] |
KRAMER T, GRECO T M, ENQUIST L W, et al. Proteomic characterization of pseudorabies virus extracellular virions[J]. J Virol, 2011, 85(13): 6427-6441. DOI:10.1128/JVI.02253-10 |
| [19] |
ARORA S, LIM W, BIST P, et al. Influenza A virus enhances its propagation through the modulation of Annexin-A1 dependent endosomal trafficking and apoptosis[J]. Cell Death Differ, 2016, 23(7): 1243-1256. DOI:10.1038/cdd.2016.19 |
| [20] |
ORZALLI M H, KAGAN J C. Apoptosis and necroptosis as host defense strategies to prevent viral infection[J]. Trends Cell Biol, 2017, 27(11): 800-809. DOI:10.1016/j.tcb.2017.05.007 |
(编辑 白永平)



