2. 山西农业大学动物科学学院, 太谷 030801
2. College of Animal Science, Shanxi Agricultural University, Taigu 030801, China
益生菌被认为是一类对宿主有益的活性微生物,能够通过改善和塑造肠道微环境,有效抑制肠道病原菌的定植,使家禽保持健康[1]。益生菌自身产生的抗菌化合物,可对竞争性肠道病原菌发挥直接抗菌作用[2]。Abdel-Hamid等[3]在体外试验中研究发现,屎肠球菌产生的细菌素可以在体外抑制金黄色葡萄球菌的增殖,且该细菌素能够减轻金黄色葡萄球菌感染大鼠后的组织器官损伤。已有研究发现,枯草芽孢杆菌可改善肉鸡的生长性能和免疫功能,并调节盲肠微生物菌群[4]。目前,家禽生产中常用的益生菌有乳酸菌、芽孢杆菌和肠球菌等[5]。本课题组前期研究发现,在健康成年鸽的嗉囊和肠道中存在大量屎肠球菌,且屎肠球菌在肠道内具有较强的定植优势。屎肠球菌属于革兰阳性乳酸菌,兼性厌氧,无荚膜,无芽孢,是存在于人和动物肠道中的主要菌群之一[6-7]。屎肠球菌可在肠道表面黏附形成保护屏障,其代谢产生的有机酸、细菌素等能够抑制或杀灭病原菌,从而发挥益生作用[8]。枯草芽孢杆菌广泛分布于土壤、植物等环境中,抗逆性较强,易于加工,因此,在商品化生产及动物生产中使用较为广泛。研究发现,枯草芽孢杆菌可提高动物胃肠道内酶的活性,从而提高动物饲粮养分利用率[9]。目前,屎肠球菌和枯草芽孢杆菌对乳鸽的影响报道较少。因此,本研究旨在研究单独添加屎肠球菌和枯草芽孢杆菌及二者混合添加对乳鸽生长性能、屠宰性能、免疫功能的影响,从而探究其调控乳鸽生长的作用机制,为益生菌在乳鸽生产中的应用提供理论依据。
1 材料与方法 1.1 试验材料试验所用屎肠球菌菌粉和枯草芽孢杆菌112025菌粉均购自河北沧州华雨生物科技有限公司,活菌数分别为3×109、2×1010 CFU·g-1。试验种鸽及乳鸽品种为山西某肉鸽养殖企业饲养的白羽王鸽。试验过程中涉及的动物饲养及乳鸽屠宰均遵照《Guide for the Care and Use of Agricultural Animals in Research and Teaching》中的原则和具体指南[10],并经中国农业科学院北京畜牧兽医研究所动物实验福利伦理委员会批准(批准参考编号:IAS2021-98)。
1.2 试验设计及饲粮配方试验选取240只12日龄、体重接近的健康白羽王鸽,公母各120只,随机分为4组,每个组6个重复,每个重复10只乳鸽,试验期16 d。人工哺育,对照组(A组)饲喂基础饲粮(表 1、表 2);屎肠球菌组(B组)在基础饲粮中添加屎肠球菌,有效活菌数为1.11×107 CFU·mL-1;枯草芽孢杆菌组(C组)在基础饲粮中添加枯草芽孢杆菌,有效活菌数为7.4×107 CFU·mL-1;混合组(D组)在基础饲粮中添加屎肠球菌和枯草芽孢杆菌,屎肠球菌有效活菌数为1.11×107 CFU·mL-1,枯草芽孢杆菌有效活菌数为7.4×107 CFU·mL-1。基础饲粮的组成和营养成分见表 1和表 2。鸽舍温度维持在29~32 ℃,定期观察鸽群精神状况、病死情况并做记录。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
|
|
表 2 颗粒料主要原料及营养水平(风干基础) Table 2 Composition and nutrient levels of pellet diets (air-dry basis) |
于乳鸽28日龄时,每个重复随机屠宰2只乳鸽。血清:颈部采血并分离血清,将血清分装至1.5 mL离心管中,迅速放入-20 ℃保存。
胸肌:屠宰后,采集左侧胸肌保存于4 ℃冰箱中用于肌肉品质指标测定。
肝:屠宰后,采集肝组织于液氮速冻后转至-80 ℃冰箱保存。
免疫器官:处死乳鸽后迅速剖开腹腔,摘取胸腺、脾和法氏囊,剔除脂肪组织,吸干表面水分并称重。
1.4 指标测定1.4.1 平均日增重 分别于乳鸽12和28日龄称重并记录,以每个重复为单位,计算各组乳鸽的平均日增重(ADG)。
1.4.2 屠宰性能和肌肉品质 剥离腹脂、双侧胸肌和腿肌并称重,参照NY/T823—2020测定乳鸽屠宰率、半净膛率、全净膛率、胸肌率、腿肌率。采集左侧胸肌,参照朱丽慧等[11]的方法测定胸肌肉色、pH和滴水损失。
1.4.3 血清生化、免疫指标 血清中总胆固醇(TC)、甘油三酯(TG)、总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)的含量使用相应试剂盒测定,并通过TP和ALB计算球蛋白(GLB)和白球比(A/G)。所用测定试剂盒均购自南京建成生物工程研究所,具体测定步骤按照试剂盒说明书进行。
血清中免疫球蛋白A(IgA)和免疫球蛋白G(IgG)的含量采用生物素双抗体夹心酶联免疫吸附法(ELISA)测定,委托北京莱博泰瑞科技发展有限公司测定。
1.4.4 肝组织抗氧化指标 肝中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)含量和总抗氧化能力(T-AOC)采用南京建成生物工程研究所试剂盒测定,测定步骤按照试剂盒说明书进行。
1.4.5 免疫器官指数 根据公式:免疫器官指数(%)=[免疫器官重(g)/乳鸽活体重(g)]×100,计算胸腺、脾和法氏囊器官指数。
1.4.6 肝组织生长相关基因表达量 从-80 ℃冰箱中取出冷冻保存的肝组织样品,按照TRIzol试剂盒(Invitrogen,USA)说明书步骤提取总RNA,用核酸定量仪NanoDrop ND 2000分光光度计(Thermo,USA)检测RNA的浓度和质量。cDNA反转录参照PrimeScript RT试剂盒(RR047a,TaKaRa,日本)说明书进行。按荧光定量测定,反应体系为10 μL:TB Green Premix EX Taq 5 μL,上游引物0.5 μL,下游引物0.5 μL,50(ROX Reference Dye 0.2 μL,cDNA 1.5 μL,加ddH2O至10 μL。扩增条件:95 ℃预变性3 min;95 ℃ 3 s,60 ℃ 32 s,40次循环;熔解曲线95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s。以对照组乳鸽肝的基因表达量为基准,以GAPDH作为内参基因,采用2-ΔΔCt法计算肝中生长相关基因生长激素(GH)、生长激素受体(GHR)、胰岛素样生长因子1(IGF-1)基因的相对表达量。基因引物序列见表 3,并由生工生物工程股份有限公司合成。
|
|
表 3 PCR引物序列 Table 3 PCR primer sequence |
数据经Excel 2010分析后,采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),并采用Tukey法进行多重比较。P < 0.05表示差异显著,P>0.05表示差异不显著,所有检验结果均以“平均值(标准差(Mean(SD)”表示。
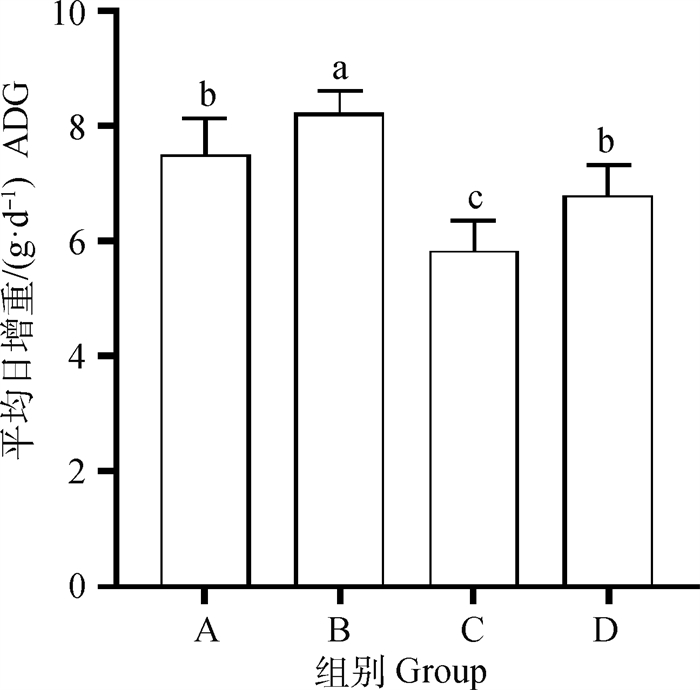
2 结果 2.1 乳鸽平均日增重由图 1可知,与对照组相比,屎肠球菌组显著提高了12~28日龄乳鸽平均日增重(P < 0.05),而枯草芽孢杆菌组显著降低了乳鸽平均日增重(P < 0.05),混合组对乳鸽的平均日增重无显著影响(P>0.05)。
|
A. 对照组;B. 屎肠球菌组;C. 枯草芽孢杆菌组;D. 混合组。图柱上附不同字母表示差异显著(P < 0.05),下同 A. Control group; B. Enterococcus faecium group; C. Bacillus subtilis group; D. Mixed group. Different letters on the column indicate significant difference(P < 0.05), the same as below 图 1 屎肠球菌和枯草芽孢杆菌对乳鸽平均日增重的影响 Fig. 1 Effect of Enterococcus faecium and Bacillus subtills on ADG of squabs |
由表 4可知,与对照组相比,3个处理组乳鸽的屠宰率、半净膛率、全净膛率、腿肌率、胸肌率、腹脂率均无显著影响(P>0.05);由表 5可知,与对照组相比,屎肠球菌组和混合组显著提高了乳鸽胸肌亮度(P < 0.05),混合组还显著提高了乳鸽胸肌红度(P < 0.05),但乳鸽胸肌黄度、pH及滴水损失各组间无显著差异(P>0.05)。
|
|
表 4 屎肠球菌和枯草芽孢杆菌对乳鸽屠宰性能的影响 Table 4 Effect of Enterococcus faecium and Bacillus subtills on carcass traits of squabs |
|
|
表 5 屎肠球菌和枯草芽孢杆菌对乳鸽胸肌肉品质的影响 Table 5 Effect of Enterococcus faecium and Bacillus subtills on chest muscle quality of squabs |
由表 6可知,与对照组相比,3个处理组乳鸽血清中IgA含量有提高趋势,但差异不显著(P>0.05);而屎肠球菌组、枯草芽孢杆菌组和混合组乳鸽血清中IgG含量显著升高(P < 0.05)。由表 7可知,与对照组相比,混合组能够显著提高乳鸽胸腺指数和法氏囊指数(P < 0.05),各组间的脾脏指数无显著性差异(P>0.05)。
|
|
表 6 屎肠球菌和枯草芽孢杆菌对乳鸽血清免疫球蛋白含量的影响 Table 6 Effect of Enterococcus faecium and Bacillus subtills on serum immunoglobulin content of squabs |
|
|
表 7 屎肠球菌和枯草芽孢杆菌对乳鸽免疫器官指数的影响 Table 7 Effect of Enterococcus faecium and Bacillus subtills on immune organ indexes of squabs |
由表 8可知,与对照组相比,屎肠球菌组显著提高乳鸽血清中GLB含量(P < 0.05),枯草芽孢杆菌组和混合组对乳鸽血清生化指标均无显著影响(P>0.05);由表 9可知,屎肠球菌组乳鸽肝中SOD活性显著高于对照组(P < 0.05),混合组肝中GSH-Px活性显著高于对照组(P < 0.05),枯草芽孢杆菌组肝中CAT活性显著高于对照组(P < 0.05),3个处理组对乳鸽肝中T-AOC和MDA的含量无显著影响(P>0.05)。
|
|
表 8 屎肠球菌和枯草芽孢杆菌对乳鸽血清生化指标的影响 Table 8 Effect of Enterococcus faecium and Bacillus subtills on serum biochemical indexes of squabs |
|
|
表 9 屎肠球菌和枯草芽孢杆菌对乳鸽肝组织抗氧化能力的影响 Table 9 Effect of Enterococcus faecium and Bacillus subtills on liver antioxidant capacity of squabs |
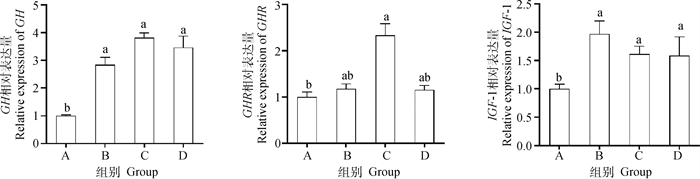
饲粮添加屎肠球菌和枯草芽孢杆菌对乳鸽肝组织GH、GHR、IGF-1基因相对表达量的影响如图 2所示,3个处理组的肝组织GH、IGF-1基因表达水平显著高于对照组(P < 0.05),枯草芽孢杆菌组肝组织GHR基因表达水平显著高于对照组(P < 0.05),屎肠球菌组和混合组的肝组织GHR基因表达水平与对照组差异不显著(P>0.05)。
|
图 2 屎肠球菌和枯草芽孢杆菌对乳鸽肝组织GH、GHR和IGF-1基因相对表达量的影响 Fig. 2 Effects of Enterococcus faecium and Bacillus subtills on liver GH、GHR and IGF-1 genes relative expression level of squabs |
乳鸽作为主要消费产品,其生长状况受到广泛关注。使用益生菌能够帮助机体迅速在肠道中形成优势菌群,降低肠道疾病的发生,促进乳鸽健康生长。Han等[12]研究表明,饲粮中添加微囊化粪肠球菌CG1.0007可提高肉仔鸡的生长性能,改善健康状况。陶振阳等[13]研究发现,在产蛋后期蛋鸡饲粮中添加粪肠球菌可提高蛋鸡的生产性能,改善肠道形态结构。袁文华等[14]研究表明,在种鸽饲粮中添加丁酸梭菌和乳酸菌能促进乳鸽生长,且丁酸梭菌和乳酸菌复合添加的效果优于单一添加。本研究发现,与对照组相比,屎肠球菌组乳鸽12~28日龄平均日增重显著提高,与前人研究结果一致。这可能由于屎肠球菌在机体内大量定植,改善动物的消化吸收能力,提高消化利用率,从而提高乳鸽平均日增重[15]。
贡筱[16]研究发现,饲粮中添加1×1010CFU·kg-1的枯草芽孢杆菌,蓝狐的营养物质消化率、氮沉积、净蛋白质利用率、蛋白质生物学价值较为理想,且可获得较好的生长性能。而本研究中添加枯草芽孢杆菌降低了乳鸽平均日增重,可能与其添加量或乳鸽特殊的消化系统有关。
3.2 饲粮添加屎肠球菌和枯草芽孢杆菌对乳鸽屠宰性能和肉品质的影响屠宰性能是反映肉用动物体内不同组织及同一组织不同部位营养物质沉积量的重要指标,直接影响乳鸽的销售价值。Mao等[17]研究发现,DGAT2基因与鸽子的胴体性状和肉质性状关系密切,G18398T和G22484C的SNPs可作为鸽子标记辅助育种的遗传标记。樊海苗等[18]研究显示,饲粮中添加复合益生菌对北京油鸡的屠宰性能无显著影响。Rehman等[19]在肉鸡饲粮中添加益生菌发现,对屠宰率、胸肌率和腿肌率没有显著影响。本次试验对乳鸽屠宰性能测定结果显示,屎肠球菌和枯草芽孢杆菌对乳鸽的屠宰率、半净膛率、全净膛率、腿肌率、胸肌率、腹脂率均无显著影响,与前人研究结果一致。
肉色的变化主要取决于肌红蛋白的含量和状态,是肉质评价中最直观的性状。肌红蛋白含量与肉色呈正相关,不同氧化还原态的肌红蛋白之间相互转化或与外源性化学物质结合,均会影响肉色[20-23]。白羽王鸽肉色泽红润,肉质滑嫩,肌纤维饱满,是一种高蛋白、低脂肪的理想食用肉类[24]。陆晶山等[25]研究发现,饲喂不同微生态制剂对乳鸽的肉色没有显著影响。HaščíK等[26]研究表明,在肉鸡饮水中添加发酵乳杆菌提高了胸肌红度,而对胸肌亮度和黄度没有显著影响。本试验结果显示,饲粮中屎肠球菌和枯草芽孢杆菌混合添加可显著提高乳鸽胸肌亮度和红度。
肌肉pH与糖酵解速率有关,糖酵解越快,产生的乳酸越多,pH就越低。pH处于正常范围内,有助于增强肌肉风味。卜柱等[24]研究表明,鸽肉pH在5.90~6.05之间,属于正常范围,且乳鸽肉的pH略高于老鸽肉。而何翔等[27]报道21日龄白羽王鸽的pH为5.68。本研究中,屎肠球菌和枯草芽孢杆菌不影响乳鸽胸肌pH,乳鸽的pH均在5.70~ 5.80之间。滴水损失是评价肉品保水能力的重要衡量标准之一,与肌肉中结缔组织含量有关,结缔组织越丰富,肌肉保水能力越强。肌肉的保水性会直接影响肉的滋味和嫩度,具有重要的经济意义[28]。Nduku等[29]研究发现,饲粮添加益生菌显著降低了肉仔鸡胸肌滴水损失率。而Park和Kim[30]在肉鸡饲粮中添加枯草芽孢杆菌发现胸肌滴水损失增加,具体原因尚不清楚。本研究显示,饲粮添加屎肠球菌和枯草芽孢杆菌对乳鸽胸肌滴水损失无显著影响。
3.3 饲粮添加屎肠球菌和枯草芽孢杆菌对乳鸽免疫功能的影响胃肠道中的微生物种类繁多,在黏膜免疫系统中发挥重要作用。口服益生菌能够通过Toll样受体与肠道上皮细胞或固有层相关免疫细胞相互作用,并减少细胞因子或趋化因子的产生[31]。IgG是血清浓度最高的免疫球蛋白,约占70%~80%,不仅含量多,作用时间也长,在抗体介导的防御反应中起主要作用[32]。IgA在血清中含量仅次于IgG,主要存在于黏膜组织。贺濛初等[33]研究表明,饲喂益生菌可提高肉仔鸡血清中IgG、IgM的含量,并且通过Toll样受体通路蛋白表达提高机体免疫力。陈功义和郝振芳[34]研究显示,乳酸菌微生态制剂能够提高白羽王鸽血清IgG含量。本研究发现,添加屎肠球菌和枯草芽孢杆菌均不同程度提高乳鸽血清中IgA和IgG的含量,与前人研究结果一致。
免疫器官的生长发育是判断乳鸽免疫力强弱的重要指标,胸腺、脾和法氏囊的重量和相对重量越大,表明禽类机体的细胞免疫和体液免疫机能越高[35-36]。李龙等[37]研究表明,饲粮添加益生菌显著提高了育肥期肉鸡的脾脏指数。Chen等[38]研究发现,给肉仔鸡饲喂干酪乳杆菌和植物乳杆菌可显著提高胸腺指数、脾脏指数。史自涛等[39]研究发现,饲粮中添加1 000 mg·kg-1的粪肠球菌后断奶仔猪脾脏指数比对照组提高19.70%。Guo等[40]研究结果显示,饲粮中添加枯草芽孢杆菌显著增加了樱桃谷肉鸭的胸腺指数、脾脏指数和法氏囊指数。本试验结果表明,屎肠球菌和枯草芽孢杆菌可显著提高乳鸽胸腺指数、法氏囊指数,且混合添加效果优于单一添加。
3.4 饲粮添加屎肠球菌和枯草芽孢杆菌对乳鸽血清生化指标的影响血清总蛋白和白蛋白能够反映肝的代谢能力以及对蛋白质消化利用的程度。本研究表明,饲喂屎肠球菌和枯草芽孢杆菌对乳鸽血清总蛋白和白蛋白的含量无显著影响,说明饲粮添加屎肠球菌和枯草芽孢杆菌不会对乳鸽肝组织造成损伤。俸祥仁等[41]研究显示,乳鸽饮水中添加益生菌对血清总蛋白和白蛋白无显著影响,与本研究结果一致。存在于动物血清中的球蛋白具有免疫作用,并且能够反应机体对碳水化合物的吸收程度和营养水平。本研究发现,饲粮添加屎肠球菌可显著提高乳鸽血清中球蛋白的含量,可能与其提高乳鸽血清中免疫球蛋白含量有直接关系,其余血清生化指标均无显著变化。陈晓帅等[42]研究表明,饲粮中添加复合益生菌显著降低了28~56日龄白羽王鸽血清总胆固醇、甘油三酯、白球比和尿素氮的含量。与本研究结果不一致,原因可能是饲喂方式、乳鸽日龄及益生菌添加的种类不同。
3.5 饲粮添加屎肠球菌和枯草芽孢杆菌对乳鸽肝组织抗氧化指标的影响动物体内SOD、GSH-Px、CAT、T-AOC和MDA含量或活性是衡量机体抗氧化能力的重要指标[43]。黄丽卿等[44]研究表明,饲粮添加屎肠球菌可缓解禽大肠杆菌O78感染导致的肉鸡抗氧化状态失衡。彭豫东等[45]研究发现,饲粮中添加枯草芽孢杆菌能够显著提高石门土鸡血清中GSH-Px活性。袁文华等[46]通过在青年鸽饲粮中添加丁酸梭菌和乳酸菌发现,益生菌组显著提高青年鸽肝组织中CAT、SOD、GSH-Px活性。本试验研究发现,饲粮中添加屎肠球菌和枯草芽孢杆菌均不同程度提高乳鸽肝组织中SOD、GSH-Px、CAT活性,与前人研究结果一致。这可能是由于屎肠球菌和枯草芽孢杆菌能代谢产生SOD和GSH等抗氧化酶或非酶抗氧化剂,通过调节肠道内环境清除体内过量的自由基,但其具体作用机理有待进一步探究。
3.6 饲粮添加屎肠球菌和枯草芽孢杆菌对乳鸽肝组织生长相关基因表达量的影响GH至IGF-1途径是动物生长发育的中心环节,只有GH与靶细胞上的GHR结合,通过细胞内的信号转导机制,使靶细胞分泌IGF-1,通过血液运输到全身,以调控机体生长。肝是生长激素-胰岛素样生长因子轴(GH/IGF-1 axis)的载体,是GHR基因表达量最高的器官,也是IGF-1分泌的主要场所[47]。李天杰[48]对蛋鸡的研究发现,饲粮中添加戊糖片球菌可显著提高蛋鸡肝中GH和GHR的表达量,添加枯草芽孢杆菌显著降低了蛋鸡卵巢中PRLR的表达量和肝GHR的表达量。本试验发现,乳鸽灌喂料中单一及混合添加屎肠球菌和枯草芽孢杆菌可显著提高肝组织中GH和IGF-1基因表达水平,添加枯草芽孢杆菌显著提高了乳鸽肝中GHR的基因表达量,可能与其提高肝中CAT活性和血清免疫球蛋白含量有关,具体作用机制有待进一步研究。Tanaka等[49]研究表明,鸡肝中IGF-1基因表达呈GH依赖模式,而在其他组织中的表达并不依赖于GH的作用,本研究结果也显示IGF-1基因的表达与GH表达量之间存在依赖关系。
4 结论本研究表明,饲粮添加屎肠球菌可显著提高乳鸽平均日增重,而枯草芽孢杆菌的添加显著降低了乳鸽的平均日增重;屎肠球菌能改善乳鸽肌肉品质,提高乳鸽肝组织抗氧化能力,增强机体的免疫调节能力,从而促进乳鸽生长。
| [1] |
AL-KHALAIFAH H S. Benefits of probiotics and/or prebiotics for antibiotic-reduced poultry[J]. Poult Sci, 2018, 97(11): 3807-3815. DOI:10.3382/ps/pey160 |
| [2] |
VAN ZYL W F, DEANE S M, DICKS L M T. Molecular insights into probiotic mechanisms of action employed against intestinal pathogenic bacteria[J]. Gut Microbes, 2020, 12(1): e1831339. DOI:10.1080/19490976.2020.1831339 |
| [3] |
ABDEL-HAMID M S, ANIS A, ELBAWAB R H, et al. Distinctive antagonistic role of new Enterococcus faecium ER-3M strain and its bacteriocin effect against Staphylococcus aureus Pneumonia[J]. Rend Lincei Sci Fis Nat, 2018, 29(3): 675-690. DOI:10.1007/s12210-018-0722-7 |
| [4] |
XU Y L, YU Y, SHEN Y Y, et al. Effects of Bacillus subtilis and Bacillus licheniformis on growth performance, immunity, short chain fatty acid production, antioxidant capacity, and cecal microflora in broilers[J]. Poult Sci, 2021, 100(9): 101358. DOI:10.1016/j.psj.2021.101358 |
| [5] |
杜秋玲. 益生菌饲料在养鸡行业中应用现状[J]. 北方牧业, 2018(15): 28-29. DU Q L. Application status of probiotic feed in chicken industry[J]. Animal Husbandry of North, 2018(15): 28-29. (in Chinese) |
| [6] |
颜晓庆, 陈宏运, 吴彬彬, 等. 肠道微生物与人体健康综述[J]. 集成技术, 2015, 4(4): 87-93. YAN X Q, CHEN H Y, WU B B, et al. The review of gut microbiota and human health[J]. Journal of Integration Technology, 2015, 4(4): 87-93. (in Chinese) |
| [7] |
ROSELLI M, FINAMORE A, BRITTI M S, et al. The novel porcine Lactobacillus sobrius strain protects intestinal cells from enterotoxigenic Escherichia coli K88 infection and prevents membrane barrier damage[J]. J Nutr, 2007, 137(12): 2709-2716. DOI:10.1093/jn/137.12.2709 |
| [8] |
HUGAS M, GARRIGA M, AYMERICH M T. Functionalty of Enterococci in meat products[J]. Int J Food Microbiol, 2003, 88(2-3): 223-233. DOI:10.1016/S0168-1605(03)00184-3 |
| [9] |
PARK I, LEE Y, GOO D, et al. The effects of dietary Bacillus subtilis supplementation, as an alternative to antibiotics, on growth performance, intestinal immunity, and epithelial barrier integrity in broiler chickens infected with Eimeria maxima[J]. Poult Sci, 2020, 99(2): 725-733. DOI:10.1016/j.psj.2019.12.002 |
| [10] |
MCGLONE J, FORD S, MITLOEHNER F, et al. Poultry[M]//Guide for the Care and Use of Agricultural Animals in Research and Teaching. 3rd ed. Champaign, IL: Federation of Animal Science Societies, 2010: 102-120.
|
| [11] |
朱丽慧, 肖长峰, 侯浩宾, 等. 不同蛋白质水平对天山雪乳鸽生长性能、屠宰性能及肉品质的影响[J]. 中国畜牧杂志, 2021, 57(4): 173-178. ZHU L H, XIAO C F, HOU H B, et al. Effects of different protein levels on growth performance, slaughter performance and meat quality of Tianshan snow squabs[J]. Chinese Journal of Animal Science, 2021, 57(4): 173-178. (in Chinese) |
| [12] |
HAN W, ZHANG X L, WANG D W, et al. Effects of microencapsulated Enterococcus fecalis CG1.0007 on growth performance, antioxidation activity, and intestinal microbiota in broiler chickens[J]. J Anim Sci, 2013, 91(9): 4374-4382. DOI:10.2527/jas.2012-5956 |
| [13] |
陶振阳, 张耀文, 曹忠洋, 等. 粪肠球菌对产蛋后期蛋鸡生产性能、蛋品质及肠道组织形态的影响[J]. 中国畜牧兽医, 2020, 47(5): 1421-1428. TAO Z Y, ZHANG Y W, CAO Z Y, et al. Effects of Enterococcus faecalis on production performance, egg quality and intestinal morphology of laying hens during the late laying period[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(5): 1421-1428. (in Chinese) |
| [14] |
袁文华, 李国勤, 赵文文, 等. 益生菌对乳鸽生长性能、血清生化指标及肠道功能的影响[J]. 动物营养学报, 2018, 30(11): 4721-4728. YUAN W H, LI G Q, ZHAO W W, et al. Effects of probiotics on growth performance, serum biochemical indexes and intestinal function of squabs[J]. Chinese Journal of Animal Nutrition, 2018, 30(11): 4721-4728. (in Chinese) |
| [15] |
TANG S G H, SIEO C C, KALAVATHY R, et al. Chemical compositions of egg yolks and egg quality of laying hens fed prebiotic, probiotic, and synbiotic diets[J]. J Food Sci, 2015, 80(8): C1686-C1695. DOI:10.1111/1750-3841.12947 |
| [16] |
贡筱. 饲粮中添加枯草芽孢杆菌和粪肠球菌对蓝狐生产性能、消化代谢及免疫功能的影响[D]. 北京: 中国农业科学院, 2014: 10-16. GONG X. The effects of Bacillus subtilis and Enterococcus faecium supplementations on performance, nutrient digestibility and immune function of blue foxes[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014: 10-16. (in Chinese) |
| [17] |
MAO H G, DONG X Y, CAO H Y, et al. Association of DGAT2 gene polymorphisms with carcass and meat quality traits in domestic pigeons (Columba livia)[J]. Br Poult Sci, 2018, 59(2): 149-153. DOI:10.1080/00071668.2017.1413232 |
| [18] |
樊海苗, 王海宏, 曾另超, 等. 复合益生菌对北京油鸡屠宰性能和肉品质的影响[J]. 中国饲料, 2021(1): 53-58. FAN H M, WANG H H, ZENG L C, et al. Effects of compound probiotics on slaughter performance and meat quality of Beijing You chicken[J]. China Feed, 2021(1): 53-58. (in Chinese) |
| [19] |
REHMAN A, ARIF M, SAJJAD N, et al. Dietary effect of probiotics and prebiotics on broiler performance, carcass, and immunity[J]. Poult Sci, 2020, 99(12): 6946-6953. DOI:10.1016/j.psj.2020.09.043 |
| [20] |
SEIDEMAN S C, CROSS H R, SMITH G C, et al. Factors associated with fresh meat color: A review[J]. J Food Qual, 1984, 6(3): 211-237. DOI:10.1111/j.1745-4557.1984.tb00826.x |
| [21] |
TROY D J, KERRY J P. Consumer perception and the role of science in the meat industry[J]. Meat Sci, 2010, 86(1): 214-226. DOI:10.1016/j.meatsci.2010.05.009 |
| [22] |
DECKER E A, FAUSTMAN C, LOPEZ-BOTE C J. Antioxidants in muscle foods: Nutritional strategies to improve quality[M]. New York: Wiley, 2000: 397-426.
|
| [23] |
朱宏星, 孙冲, 王道营, 等. 肌红蛋白理化性质及肉色劣变影响因素研究进展[J]. 肉类研究, 2019, 33(6): 55-63. ZHU H X, SUN C, WANG D Y, et al. Progress in the physicochemical properties of myoglobin and factors influencing meat color stability[J]. Meat Research, 2019, 33(6): 55-63. (in Chinese) |
| [24] |
卜柱, 常玲玲, 汤青萍, 等. 不同日龄和性别白羽王鸽肉品质、主要营养成分及肌纤维特性的比较研究[J]. 食品安全质量检测学报, 2018, 9(1): 13-18. BU Z, CHANG L L, TANG Q P, et al. Comparative study of meat quality, conventional nutrition composition and muscle fibre characteristics of White King pigeons between different age and gender[J]. Journal of Food Safety and Quality, 2018, 9(1): 13-18. (in Chinese) |
| [25] |
陆晶山, 韦巧燕, 麦喜汶, 等. 微生态制剂对肉鸽生产性能、血清生化指标、免疫机能及肉品质的影响[J]. 广西畜牧兽医, 2020, 36(2): 59-63. LU J S, WEI Q Y, MAI X W, et al. Effects of probiotics on performance, serum biochemical parameters, immune function and meat quality of pigeon[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine, 2020, 36(2): 59-63. (in Chinese) |
| [26] |
HAŠČÍK P, TREMBECKÁ L, BOBKO M, et al. Effect of different feed supplements on selected quality indicators of chicken meat[J]. Potravinarstvo, 2015, 9(1): 427-434. |
| [27] |
何翔, 屠云洁, 苏一军, 等. 白羽王鸽屠宰性能及肉品质研究[J]. 江苏农业科学, 2010(2): 215-217. HE X, TU Y J, SU Y J, et al. Study on slaughter performance and meat quality of White King pigeon[J]. Jiangsu Agricultural Sciences, 2010(2): 215-217. (in Chinese) |
| [28] |
祝超智, 赵改名, 张万刚, 等. 不同保水性鸡肉的品质比较和相关性研究[J]. 食品科学, 2013, 34(13): 45-49. ZHU C Z, ZHAO G M, ZHANG W G, et al. Comparison of chicken meat quality with different water-holding capacity and correlation analysis[J]. Food Science, 2013, 34(13): 45-49. (in Chinese) |
| [29] |
NDUKU X P, MABUSELA S P, NKUKWANA T T. Growth and meat quality of broiler chickens fed Moringa oleifera leaf meal, a probiotic and an organic acid[J]. S Afr J Anim Sci, 2020, 50(5): 710-718. |
| [30] |
PARK J H, KIM I H. The effects of the supplementation of Bacillus subtilis RX7 and B2A strains on the performance, blood profiles, intestinal Salmonella concentration, noxious gas emission, organ weight and breast meat quality of broiler challenged with Salmonella typhimurium[J]. J Anim Physiol Anim Nutr, 2015, 99(2): 326-334. |
| [31] |
GALDEANO C M, CAZORLA S I, DUMIT J M L, et al. Beneficial effects of probiotic consumption on the immune system[J]. Ann Nutr Metab, 2019, 74(2): 115-124. |
| [32] |
焦红梅, 崔治中. 抗鸽IgG单克隆抗体的制备及鉴定[J]. 中国兽药杂志, 2000, 34(2): 9-13. JIAO H M, CUI Z Z. Preparation and identification of monoclonal antibodies against pigeon IgG[J]. Chinese Journal of Veterinary Drug, 2000, 34(2): 9-13. (in Chinese) |
| [33] |
贺濛初, 李思婷, 王志, 等. 鸡源复合益生菌对肉仔鸡免疫球蛋白及Toll样受体通路的影响[J]. 华南农业大学学报, 2021, 42(2): 26-33. HE M C, LI S T, WANG Z, et al. Effects of chicken-derived compound probiotics on immunoglobulin and Toll-like receptor pathway of broilers[J]. Journal of South China Agricultural University, 2021, 42(2): 26-33. (in Chinese) |
| [34] |
陈功义, 郝振芳. 乳酸菌微生态制剂对白羽王鸽生产性能及免疫机能的影响[J]. 动物营养学报, 2015, 27(8): 2450-2455. CHEN G Y, HAO Z F. Effects of Lactobacillus microecologics on growth performance and immunity of White Wing Pigeons[J]. Chinese Journal of Animal Nutrition, 2015, 27(8): 2450-2455. (in Chinese) |
| [35] |
RIVAS A L, FABRICANT J. Indications of immunodepression in chickens infected with various strains of Marek's disease virus[J]. Avian Dis, 1988, 32(1): 1-8. |
| [36] |
HECKERT R A, ESTEVEZ I, RUSSEK-COHEN E, et al. Effects of density and perch availability on the immune status of broilers[J]. Poult Sci, 2002, 81(4): 451-457. |
| [37] |
李龙, 刘锁珠, 王宏辉, 等. 日粮添加益生菌对高海拔肉鸡免疫机能的影响[J]. 畜牧与兽医, 2018, 50(8): 40-43. LI L, LIU S Z, WANG H H, et al. Effects of dietary probiotics on immune functions of broilers reared in a hypoxic environment[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(8): 40-43. (in Chinese) |
| [38] |
CHEN C C, LI J Y, ZHANG H X, et al. Effects of a probiotic on the growth performance, intestinal flora, and immune function of chicks infected with Salmonella pullorum[J]. Poult Sci, 2020, 99(11): 5316-5323. |
| [39] |
史自涛, 姚焰础, 江山, 等. 粪肠球菌替代抗生素对断奶仔猪生长性能、腹泻率、血液生化指标和免疫器官的影响[J]. 动物营养学报, 2015, 27(6): 1832-1840. SHI Z T, YAO Y C, JIANG S, et al. Effects of Enterococcus faecalis substitute for antibiotic on growth performance, diarrhea rate, blood biochemical parameters and immune organs of weaner piglets[J]. Chinese Journal of Animal Nutrition, 2015, 27(6): 1832-1840. (in Chinese) |
| [40] |
GUO M J, HAO G G, WANG B H, et al. Dietary administration of Bacillus subtilis enhances growth performance, immune response and disease resistance in cherry valley ducks[J]. Front Microbiol, 2016, 7: 1975. |
| [41] |
俸祥仁, 何莫斌, 韦明, 等. 益生菌对乳鸽生产性能、肠道菌群及血清生化指标的影响[J]. 广西畜牧兽医, 2019, 35(4): 147-150. FENG X R, HE M B, WEI M, et al. Effects of probiotics on performance, intestinal microflora and serum biochemical parameters of pigeon[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine, 2019, 35(4): 147-150. (in Chinese) |
| [42] |
陈晓帅, 杨海明, 孟俊, 等. 复合益生菌制剂对白羽王鸽生长性能、屠宰性能、免疫器官指数和血清生化指标的影响[J]. 中国家禽, 2016, 38(16): 33-37. CHEN X S, YANG H M, MENG J, et al. Effects of compound probiotics on growth performance, slaughter performance immune organ index and serum biochemical index of White King pigeon[J]. China Poultry, 2016, 38(16): 33-37. (in Chinese) |
| [43] |
JAHNS F, WILHELM A, JABLONOWSKI N, et al. Butyrate modulates antioxidant enzyme expression in malignant and non-malignant human colon tissues[J]. Mol Carcinog, 2015, 54(4): 249-260. |
| [44] |
黄丽卿, 罗丽萍, 张亚茹, 等. 屎肠球菌NCIMB11181对大肠杆菌O78感染肉鸡生产性能、肠道微生物和血液抗氧化功能的影响[J]. 中国家禽, 2017, 39(11): 17-22. HUANG L Q, LUO L P, ZHANG Y R, et al. Effects of dietary Enterococcus faecium NCIMB11181 on growth performance, intestinal microflora and serum antioxidant capacity in broilers challenged with Escherichia coli O78[J]. China Poultry, 2017, 39(11): 17-22. (in Chinese) |
| [45] |
彭豫东, 康克浪, 曲湘勇, 等. 枯草芽孢杆菌对石门土鸡生长性能、屠宰性能、血清抗氧化指标和肠道形态的影响[J]. 动物营养学报, 2019, 31(5): 2119-2126. PENG Y D, KANG K L, QU X Y, et al. Effects of Bacillus subtilis on growth performance, slaughter performance, serum antioxidant indexes and intestinal morphology of Shimen chickens[J]. Chinese Journal of Animal Nutrition, 2019, 31(5): 2119-2126. (in Chinese) |
| [46] |
袁文华, 李国勤, 韩安法, 等. 益生菌对青年鸽生长、免疫和抗氧化性能及繁殖相关基因表达的影响[J]. 动物营养学报, 2019, 31(7): 3294-3301. YUAN W H, LI G Q, HAN A F, et al. Effects of probiotics on growth, immunity, antioxidation and expression of genes related to reproduction of young pigeons[J]. Chinese Journal of Animal Nutrition, 2019, 31(7): 3294-3301. (in Chinese) |
| [47] |
王直, 卢绮萍. 胰岛素样生长因子与肝脏疾病[J]. 临床外科杂志, 2008, 16(4): 275-276. WANG Z, LU Q P. Insulin-like growth factor and liver disease[J]. Journal of Clinical Surgery, 2008, 16(4): 275-276. (in Chinese) |
| [48] |
李天杰. 益生菌对蛋鸡生产性能及肠道微生物变化与基因表达研究[D]. 成都: 四川农业大学, 2016: 50-61. LI T J. Effects of early probiotics colonization on layers' growth, reproductive performance and gene expression[D]. Chengdu: Sichuan Agricultural University, 2016: 50-61. (in Chinese) |
| [49] |
TANAKA M, HAYASHIDA Y, SAKAGUCHI K, et al. Growth hormone-independent expression of insulin-like growth factor I messenger ribonucleic acid in extrahepatic tissues of the chicken[J]. Endocrinology, 1996, 137(1): 30-34. |
(编辑 范子娟)



