优质卵母细胞是成功受精和胚胎发育的重要基础,卵母细胞成熟过程中的任何异常都可能导致减数分裂停滞和受精失败。由于在减数分裂过程中卵母细胞缺乏转录活性,因此转录后和翻译后水平的调节对卵母细胞成熟至关重要[1]。特别是蛋白质翻译后修饰(post-translational modification,PTM)在卵母细胞成熟和胚胎发育过程中的多种细胞事件中起着关键作用,如DNA损伤应答、染色体凝聚和细胞骨架组装等[2]。O-β-N-乙酰葡糖胺(O-linked beta -N-acetylglucosamine, O-GlcNAc)修饰是一种与营养和应激关系密切的PTM,它将单个的N-乙酰葡糖胺以β-构型的O-糖苷键连接到蛋白质丝氨酸或苏氨酸(Ser/Thr)羟基上,是一种动态、可逆的修饰[3]。O-GlcNAc修饰中的糖基供体二磷酸尿嘧啶-N-乙酰葡糖胺(UDP-GlcNAc)是己糖胺生物合成途径(hexosamine biosynthesis pathway, HBP)的终产物。O-GlcNAc的可逆修饰由O-GlcNAc转移酶(O-GlcNAc transferase, OGT)和相应的糖苷酶(O-GlcNAcase, OGA)动态调控,前者负责将糖基供体UDP-GlcNAc中的GlcNAc基团添加到目标蛋白的Ser/Thr羟基上,而后者能特异移除O-GlcNAc修饰蛋白上的GlcNAc[4]。
O-GlcNAc修饰影响蛋白质空间构象、活性和定位,广泛参与信号传导、细胞代谢重塑、蛋白互作、免疫应答等生理过程[5]。特别是,O-GlcNAc修饰在调节卵母细胞减数分裂成熟、早期胚胎发育和维持胚胎干细胞多能性等方面发挥重要作用[6-8]。在牛和猪的IVM液中添加UDP-GlcNAc底物葡糖胺(glucosamine,GlcN)不会影响卵母细胞的核成熟,但卵母细胞受精后的囊胚发育率显著降低[9]。在小鼠上,GlcN处理不仅会降低MII期卵母细胞比例,受精后胚胎的卵裂率和囊胚率也显著减少[10-11]。采用OGA抑制剂破坏O-GlcNAc修饰的动态平衡后,卵母细胞的O-GlcNAc水平显著上调,尽管卵母细胞仍能正常进行减数分裂,但多精受精率显著增加,最终导致受精卵发育异常[8]。上述研究表明,维持胞内O-GlcNAc修饰水平的平衡对卵母细胞发育至关重要。
由于O-GlcNAc修饰反映了细胞所处代谢环境,可作为一种营养传感器,为临床医学上治疗糖尿病、肥胖和衰老等导致的卵母细胞质量下降提供新的靶点。因此,本试验从作为感受微环境营养状态的O-GlcNAc修饰层面研究O-GlcNAc修饰变化对牛卵母细胞体外成熟(in vitro maturation, IVM)和发育能力的影响,并进一步探究了O-GlcNAc修饰对OGT和OGA的反馈调节机制。
1 材料与方法 1.1 试验材料本试验所采用的牛卵巢均取自于河北省廊坊市大厂屠宰场,公牛冷冻精液购自于山东奥克斯生物技术有限公司。
1.2 试剂及溶液配制TCM199和胎牛血清购自Gibco公司;无特殊说明,其余试剂均购自Sigma公司。
各溶液配制:IVM液:TCM199、0.01 IU·mL-1 FSH、0.01 IU·mL-1 LH、1 μg·mL-1 E2、10 μg·mL-1肝素钠、50 ng·mL-1 EGF、100 ng·mL-1 IGF、10% FBS、100 U·mL-1青霉素、100 μg·mL-1链霉素;BO液:112 mmol·L-1 NaCl、4.02 mmol·L-1 KCl、2.25 mmol·L-1 CaCl2·2H2O、0.52 mmol·L-1 MgCl2·6H2O、0.83 mmol·L-1 NaH2PO4、37 mmol·L-1 NaHCO3、13.9 mmol·L-1葡萄糖、1.25 mmol·L-1丙酮酸钠、3 mg·mL-1 BSA;洗精液:40 mL BO液+135.32 mg咖啡因(10 mmol·L-1);受精液:10 mL BO液+200 mg BSA+0.05 mL肝素钠(20 μg·mL-1)+0.1 mL青霉素(100 U·mL-1) 和链霉素(100 μg·mL-1);胚胎体外培养液mCR1aa:109.5 mmol·L-1 NaCl、3.1 mmol·L-1 KCl、26.2 mmol·L-1 NaHCO3、0.8 mmol·L-1 MgCl2 · 6H2O、1.19 mmol · L-1 KH2PO4、0.4 mmol·L-1丙酮酸钠、1.5 mmol·L-1葡萄糖、5 mmol·L-1半乳糖酸钙、0.5% 酚红、2% EAA(50×)、1% Non-EAA(100×)、15 mg·mL-1谷氨酰胺。
1.3 卵母细胞采集和体外成熟从屠宰场收集卵巢,放入28~30 ℃含100 U·mL-1青霉素和100 μg·mL-1链霉素的灭菌生理盐水中,2 h内运回实验室。用提前预热30 ℃左右的灭菌生理盐水将卵巢洗涤2~3遍,使用真空蠕动泵抽取卵巢上直径3~6 mm卵泡内的卵泡液,在体式显微镜下捡出卵丘-卵母细胞复合体(cumulus-oocyte complexes,COCs),分级并计数。
将挑选出的COCs用洗卵液洗2遍,再用IVM液洗3遍,之后移入在培养箱中已经平衡2 h以上且覆盖矿物油的四孔板中(每孔750 μL IVM液,培养50枚COCs),IVM液中分别添加OGT抑制剂BADGP和OGA抑制剂PUGNAc,未添加组为对照。于38.5 ℃、5% CO2、饱和湿度的CO2培养箱中成熟培养22~24 h。
1.4 体外受精和胚胎的体外培养将1支0.25 mL的冷冻精液在38 ℃的水浴锅中解冻后,先加到含有2 mL洗精液(提前预热)的15 mL离心管底部,之后再加入4 mL洗精液,用移液枪轻轻吹打混匀,1 800 r·min-1离心8 min;弃上清,重新加入6 mL洗精液,用移液枪轻轻吹打混匀,1 800 r·min-1离心8 min;弃上清,用洗精液重新悬浮精子沉淀。用血细胞计数器计算精子密度,调整精子密度为2×106个·mL-1。用移液枪吸取50 μL处理好的精子悬液加入到含有卵母细胞的受精微滴中,在38.5 ℃、5% CO2、饱和湿度的培养箱中精卵共孵育8~18 h。
将受精后的合子用0.1%的透明质酸酶脱除卵母细胞表面的卵丘细胞后,用含6 mg·mL-1 BSA的mCR1aa液洗3遍,移入培养微滴中(每滴20~30枚)进行体外培养。培养48 h后,观察并记录受精卵的卵裂率。之后移入含10% FBS的mCR1aa液中(每100 μL中20~30枚),每2 d进行半量换液,体外培养7~8 d后,观察并记录囊胚发育率。
卵裂率(%)=(卵裂数/卵母细胞总数)×100;囊胚率(%)=(囊胚数/卵裂数)×100。
1.5 免疫荧光染色利用0.1%的透明质酸酶对体外成熟培养22 h后的COCs进行脱卵丘处理,然后利用终止液(TCM199 + 10% FBS)终止消化反应。用0.1%PVA/DPBS洗3遍后,移入4%多聚甲醛(PFA)+ 0.5%TritonX-100液中,37 ℃固定通透45 min;再用0.1%PVA/DPBS洗3遍后,将卵母细胞置于1%BSA溶液中4 ℃封闭过夜。用含有0.02% Triton X-100的1%BSA溶液稀释一抗(O-GlcNAc,Abcam,1∶500;TXNIP,Abcam,1∶500;OGT,Abcam,1∶500;OGA,Abcam,1∶500)并4 ℃孵育过夜,再用含有0.02%Triton X-100的1%BSA溶液稀释二抗(Alexa Fluor 594山羊抗兔IgG和Alexa Fluor 488山羊抗鼠IgG),并室温避光孵育1 h;洗3遍后采用DAPI压片,在激光共聚焦显微镜下(TCS SP8, Leica,德国)观察染色情况并采集图像。
1.6 荧光定量PCR检测采用NCBI设计引物序列,由华大基因公司合成引物序列(表 1)。利用qRT-PCR试剂盒(Thermo Fisher Scientific)在CFX384TM实时荧光定量PCR仪(BIO-RAD,美国)中进行定量分析。反应体系(10 μL):上、下游引物各0.2 μL,cDNA模板1 μL,SYBR 5 μL,无RNA酶水3.6 μL。反应程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,39个循环;95 ℃ 10 s,65 ℃ 5 s,95 ℃ 5 s;4 ℃ ∞。每个样品重复3次,每组卵母细胞样品为50枚。利用2ΔΔT法以GAPDH为内参基因计算各目的基因mRNA的表达水平。
|
|
表 1 RT-qPCR引物信息 Table 1 Primers information of RT-qPCR |
收集各组卵母细胞样品(每组50枚),震荡离心使其充分裂解。样品在20 000 r·min-1,4 ℃离心10 min,取上清并与样品缓冲液混合,100 ℃下煮沸变性。按照标准程序在4%~15%梯度SDS-PAGE凝胶上分离蛋白提取液,之后将蛋白转移至硝酸纤维素膜上。在室温下用5%的脱脂奶粉稀释1 h,阻断印迹。然后,4 ℃条件下,在5%的脱脂奶粉稀释的RL2中孵育过夜,TBST洗3次,每次5 min,二抗孵育1 h,TBST洗3次,每次5 min。ECL试剂盒显色,将膜置于化学发光仪(Tanon,中国上海)中进行曝光,拍照并保存。采用Image J软件对Western blot蛋白条带进行灰度值分析。
1.8 数据统计每个试验至少重复3次,试验结果以“平均数±标准差”表示。采用SAS统计软件进行One-Way-ANOVA分析,用Duncan′s检验判断不同处理间的差异显著性,P<0.05即认为差异显著。
2 结果 2.1 OGT、OGA及O-GlcNAc蛋白在牛体外成熟卵母细胞中的分布为了研究牛体外成熟卵母细胞中O-GlcNAc修饰调节的亚细胞分布,首先使用OGT和OGA的特异性抗体分别对卵母细胞中OGT和O-GlcNAc蛋白及OGA和O-GlcNAc蛋白进行免疫荧光共定位。结果显示,OGT和O-GlcNAc蛋白共定位于体外成熟卵母细胞的细胞质和细胞核中(图 1),而OGA和O-GlcNAc蛋白共定位于体外成熟卵母细胞的细胞质中,且相对集中在卵母细胞的皮质区(图 2)。
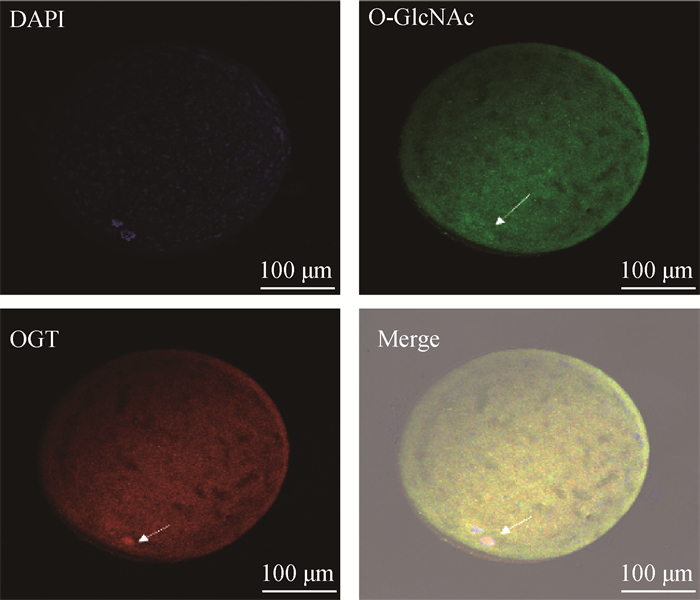
|
红色代表OGT蛋白;绿色代表O-GlcNAc蛋白;箭头所指为细胞核 OGT is showed in red; O-GlcNAc is showed in green; The arrow marks the nucleus 图 1 牛体外成熟卵母细胞中OGT和O-GlcNAc蛋白的免疫共定位 Fig. 1 Co-localization of OGT and O-GlcNAc proteins in bovine in vitro matured oocytes |

|
红色代表OGA蛋白;绿色代表O-GlcNAc蛋白;箭头所指为皮质区 OGA is showed in red; O-GlcNAc is showed in green; The arrows highlight the enrichment at the cortex 图 2 牛体外成熟卵母细胞中OGA和O-GlcNAc蛋白的免疫共定位 Fig. 2 Co-localization of OGA and O-GlcNAc proteins in bovine in vitro matured oocytes |
将622枚卵母细胞(重复4次)分别在添加4 mmol·L-1 BADGP和100 μmol·L-1 PUGNAc的IVM液中进行体外成熟,未添加组为对照组(control),研究O-GlcNAc修饰水平变化对牛卵母细胞体外成熟的影响。如表 2所示,与对照组相比(70.8%)相比,BADGP处理组(52.8%)和PUGNAc处理组(60.9%)均显著降低了牛卵母细胞第一极体排出率(P<0.05),但二者之间差异不显著(P>0.05)。
|
|
表 2 O-GlcNAc修饰水平变化对牛卵母细胞体外成熟的影响 Table 2 Effect of disrupted O-GlcNAc modification on in vitro maturation of bovine oocytes |
将上述不同处理组体外成熟卵母细胞进行体外受精,研究O-GlcNAc修饰水平变化对牛卵母细胞体外发育能力的影响。如表 3所示,BADGP处理组(61.0%)和PUGNAc处理组(62.0%)的卵裂率与对照组(68.9%)相比差异不显著(P>0.05)。与对照组(21.5%)相比,BADGP处理组(9.6%)和PUGNAc处理组(10.0%)的囊胚率显著降低(P<0.05)。
|
|
表 3 O-GlcNAc修饰水平变化对牛卵母细胞体外发育能力的影响 Table 3 Effect of disrupted O-GlcNAc modification on the development potential of bovine oocytes |
为了研究O-GlcNAc修饰水平变化对牛体外成熟卵母细胞中OGT和OGA表达的反馈调节机制,利用荧光定量PCR和Western blot技术检测了不同处理组卵母细胞内O-GlcNAc修饰水平及OGT、OGA的mRNA和蛋白表达情况。结果显示,与对照组相比,BADGP处理显著抑制了OGT的mRNA和蛋白表达(图 3B),卵母细胞的O-GlcNAc修饰水平随之显著下调(图 3A);OGA的mRNA和蛋白表达虽有所降低,但与对照组相比差异不显著(P>0.05;图 3C)。PUGNAc处理后,OGA的mRNA和蛋白表达显著低于对照组(P<0.05;图 3C),卵母细胞的O-GlcNAc修饰水平显著升高(P<0.05;图 3A);OGT的mRNA表达显著上调,而OGT蛋白表达显著下调(图 3B)。进一步对HBP的关键限速酶GFAT的表达检测发现,与对照组相比,BADGP处理组GFAT mRNA的表达显著上调,而PUGNAc处理组GFAT mRNA的表达显著下调(P<0.05;图 3D)。

|
A. O-GlcNAc修饰水平;B. OGT mRNA和蛋白表达;C. OGA mRNA和蛋白的表达;D. GFAT mRNA的表达 A. O-GlcNAc modification level; B. OGT mRNA and protein level; C. OGA mRNA and protein level; D. GFAT mRNA level 图 3 O-GlcNAc修饰水平变化对牛体外成熟卵母细胞OGT和OGA的反馈调节 Fig. 3 Feedback regulation of altered O-GlcNAc modification level on the expression of OGT and OGA in bovine oocytes matured in vitro |
为了进一步检测O-GlcNAc修饰水平变化对卵母细胞糖代谢的影响,检测了不同处理组卵母细胞中糖代谢关键调控因子TXNIP的mRNA和蛋白表达。结果显示,与对照组相比,BADGP处理后,卵母细胞TXNIP mRNA和蛋白的表达显著上调(P<0.05);而PUGNAc处理组卵母细胞的TXNIP mRNA和蛋白的表达虽有所升高,但与对照组相比无显著差异(P>0.05;图 4)。
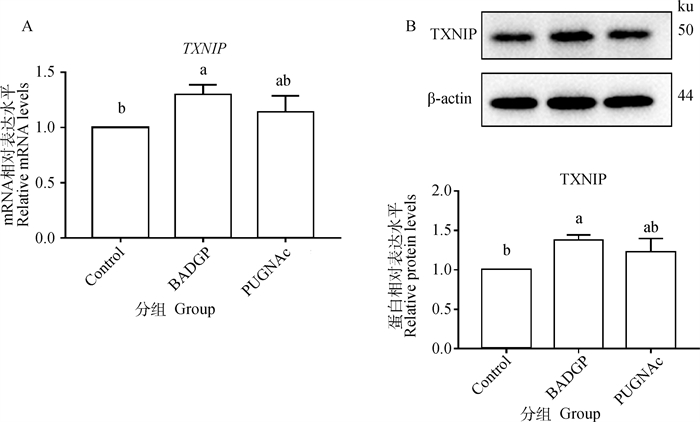
|
A. TXNIP mRNA的表达;B. TXNIP蛋白的表达 A. TXNIP mRNA level; B. TXNIP protein level 图 4 O-GlcNAc修饰水平变化对牛体外成熟卵母细胞TXNIP表达的影响 Fig. 4 Effect of altered O-GlcNAc modification level on the expression of TXNIP in bovine oocytes matured in vitro |
哺乳动物卵母细胞减数分裂成熟和受精过程的代谢需求旺盛,因此,卵母细胞对发育微环境中营养成分的变化高度敏感。而O-GlcNAc修饰是哺乳动物细胞重要的PTM之一,参与调节许多重要的生命活动,可作为一种营养物质传感器调节细胞内稳态[12]。本研究发现,在牛体外成熟卵母细胞中,OGT、OGA和O-GlcNAc蛋白存在不同的亚细胞定位,OGT和O-GlcNAc蛋白共定位于体外成熟卵母细胞的细胞质和细胞核中,而OGA和O-GlcNAc蛋白共定位于体外成熟卵母细胞的细胞质中,且相对集中在卵母细胞的皮质区,这与Zhou等[8]的研究结果部分一致。之前的研究发现,在小鼠、牛和人卵母细胞减数分裂进程中,OGT富集在减数分裂纺锤体上,而OGA在纺锤体的表达很低,主要富集在皮质区[6, 8]。OGT和OGA不同的亚细胞定位反映了二者在卵母细胞减数分裂成熟中可能具有各自独特的功能[13]。深入研究O-GlcNAc、OGT和OGA在减数分裂成熟过程中的精确功能将为揭示PTM对配子质量的影响提供新的思路。
O-GlcNAc修饰及其相关酶在生物体的正常发育过程中发挥重要作用。敲除OGT会导致斑马鱼胚胎生长受限、细胞活力受损[14]。而OGT或OGA缺失会对小鼠造成致命损伤[15-17]。事实上,OGT和OGA在哺乳动物细胞和组织中广泛表达[18]。研究发现,破坏O-GlcNAc修饰平衡会延迟卵母细胞减数分裂成熟进程[19],后续的报道也进一步证实了这一结论[20-21]。然而,在牛上的研究发现,O-GlcNAc修饰的改变不影响卵母细胞的减数分裂进程,但会影响精子头解聚及导致多精受精,进而造成早期胚胎发育受损[8]。在本研究中,成熟培养液中添加OGT或OGA的抑制剂显著降低了牛卵母细胞体外成熟率和受精后的囊胚发育率,与上述研究结果一致。这表明,维持胞内O-GlcNAc修饰平衡对卵母细胞成熟及早期胚胎发育至关重要。
OGT和OGA是添加和移除O-GlcNAc修饰基团、维持O-GlcNAc修饰动态平衡的唯一一对酶,二者实现了细胞内数千种O-GlcNAc修饰蛋白的精密调控[3, 22-23]。一些研究发现,OGT和OGA的表达对胞内O-GlcNAc修饰水平的变化颇为敏感[24-27]。利用OGA抑制剂来提高胞内O-GlcNAc修饰水平会导致OGT蛋白表达减少,OGA蛋白表达增加[24-26]。而采用OGT抑制剂或GFAT抑制剂降低O-GlcNAc修饰水平时,胞内OGT蛋白表达增多,OGA蛋白表达减少[26-27]。以上结果表明,机体通过反馈调节OGT和OGA的表达来应对O-GlcNAc修饰水平的波动,进而维持细胞O-GlcNAc修饰的内环境稳定。本研究检测不同处理组OGT和OGA的表达水平,发现OGT抑制剂BADGP处理显著降低了OGT的表达,卵母细胞的O-GlcNAc修饰水平发生下调,OGA的表达降低;在OGA抑制剂PUGNAc处理组中,卵母细胞OGA的表达显著下调,O-GlcNAc修饰水平升高,OGT的蛋白表达显著减少。本研究以卵母细胞为对象,得到的结果与已有的文献报道存在一定的差异,说明生殖细胞的反馈调节可能有别于体细胞。
HBP是葡萄糖代谢途径之一,生物机体利用碳水化合物(葡萄糖)、氨基酸(谷氨酰胺)、脂质(乙酰辅酶A)和核苷酸(尿苷)等4种主要大分子经HBP代谢最终生成UDP-GlcNAc,UDP-GlcNAc是O-GlcNAc修饰的糖基供体[28]。而GFAT是HBP的关键限速酶。研究发现,GFAT的表达和活性受UDP-GlcNAc的反馈抑制调节,在糖尿病和一系列癌症类型中均发现GFAT的异常表达[29-31]。实际上,GFAT、OGT和OGA均参与O-GlcNAc修饰内稳态的调控[32]。与野生型相比,敲除OGT的线虫模型GFAT的mRNA水平显著升高[33]。本研究发现,O-GlcNAc修饰水平的变化与GFAT mRNA表达呈负相关,抑制OGT显著上调了GFAT mRNA的表达,而抑制OGA显著下调了GFAT mRNA的表达。结果表明,HBP途径对O-GlcNAc修饰水平的变化可能存在一种补偿机制,机体通过调节GFAT表达应对GlcNAc修饰水平的波动,进而维持胞内O-GlcNAc修饰内稳态。然而,O-GlcNAc修饰水平的变化对GFAT活性的影响及转录后的调控机制还有待进一步研究。
硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein, TXNIP)是参与葡萄糖代谢的一个关键调控因子。本实验室前期利用RNA干扰技术降低TXNIP表达后,发现卵母细胞的葡萄糖摄取能力增强,卵母细胞成熟得到改善[34]。之前的研究发现,HBP的变化能够调控TXNIP的表达[35-36]。Filhoulaud等[37]报道,高糖诱导下,胰岛β细胞发生TXNIP的O-GlcNAc修饰,发生O-GlcNAc修饰的TXNIP通过促进炎性细胞因子IL-1β的分泌,调节炎性小体的激活。以上研究提示,O-GlcNAc修饰环境与TXNIP活性调节可能存在一定的关系。在本研究中,采用OGT或OGA抑制剂改变卵母细胞的O-GlcNAc修饰水平,发现TXNIP的表达均上调,表明O-GlcNAc修饰的改变可能影响了卵母细胞的糖摄取和糖代谢。然而,O-GlcNAc修饰对卵母细胞TXNIP活性的分子调控机制还需深入探究。
4 结论维持胞内O-GlcNAc修饰的平衡对卵母细胞成熟及早期胚胎发育至关重要。成熟培养液中添加OGT或OGA的抑制剂显著降低了牛卵母细胞体外成熟率和受精后的囊胚发育率,卵母细胞通过反馈调节OGT、OGA和GFAT的表达,以及上调葡萄糖调控关键因子TXNIP的表达应对O-GlcNAc修饰水平的波动。研究结果对研究哺乳动物生殖细胞代谢异常和改善卵母细胞质量具有参考意义。
| [1] |
KANG M K, HAN S J. Post-transcriptional and post-translational regulation during mouse oocyte maturation[J]. BMB Rep, 2011, 44(3): 147-157. DOI:10.5483/BMBRep.2011.44.3.147 |
| [2] |
WU Y, LI M, YANG M. Post-translational modifications in oocyte maturation and embryo development[J]. Front Cell Dev Biol, 2021, 9: 645318. DOI:10.3389/fcell.2021.645318 |
| [3] |
YANG X Y, QIAN K. Protein O-GlcNAcylation: emerging mechanisms and functions[J]. Nat Rev Mol Cell Biol, 2017, 18(7): 452-465. DOI:10.1038/nrm.2017.22 |
| [4] |
HART G W, HOUSLEY M P, SLAWSON C. Cycling of O-linked β-N-acetylglucosamine on nucleocytoplasmic proteins[J]. Nature, 2007, 446(7139): 1017-1022. DOI:10.1038/nature05815 |
| [5] |
HART G W. Nutrient regulation of signaling and transcription[J]. J Biol Chem, 2019, 294(7): 2211-2231. DOI:10.1074/jbc.AW119.003226 |
| [6] |
SLAWSON C, DUNCAN F E. Sweet action: the dynamics of O-GlcNAcylation during meiosis in mouse oocytes[J]. Mol Reprod Dev, 2015, 82(12): 915. DOI:10.1002/mrd.22577 |
| [7] |
MIURA T, KUME M, KAWAMURA T, et al. O-GlcNAc on PKCζ inhibits the FGF4-PKCζ-MEK-ERK1/2 pathway via inhibition of PKCζ phosphorylation in mouse embryonic stem cells[J]. Stem Cell Rep, 2018, 10(1): 272-286. DOI:10.1016/j.stemcr.2017.11.007 |
| [8] |
ZHOU L T, ROMAR R, PAVONE M E, et al. Disruption of O-GlcNAc homeostasis during mammalian oocyte meiotic maturation impacts fertilization[J]. Mol Reprod Dev, 2019, 86(5): 543-557. DOI:10.1002/mrd.23131 |
| [9] |
SUTTON-MCDOWALL M L, MITCHELL M, CETICA P, et al. Glucosamine supplementation during in vitro maturation inhibits subsequent embryo development: possible role of the hexosamine pathway as a regulator of developmental competence[J]. Biol Reprod, 2006, 74(5): 881-888. DOI:10.1095/biolreprod.105.048553 |
| [10] |
PANTALEON M, TAN H Y, KAFER G R, et al. Toxic effects of hyperglycemia are mediated by the hexosamine signaling pathway and O-linked glycosylation in early mouse embryos[J]. Biol Reprod, 2010, 82(4): 751-758. DOI:10.1095/biolreprod.109.076661 |
| [11] |
FRANK L A, SUTTON-MCDOWALL M L, RUSSELL D L, et al. Effect of varying glucose and glucosamine concentration in vitro on mouse oocyte maturation and developmental competence[J]. Reprod Fertil Dev, 2013, 25(8): 1095-1104. DOI:10.1071/RD12275 |
| [12] |
HART G W. Three decades of research on O-GlcNAcylation-a major nutrient sensor that regulates signaling, transcription and cellular metabolism[J]. Front Endocrinol (Lausanne), 2014, 5: 183. |
| [13] |
TAN E P, DUNCAN F E, SLAWSON C. The sweet side of the cell cycle[J]. Biochem Soc Trans, 2017, 45(2): 313-322. DOI:10.1042/BST20160145 |
| [14] |
WEBSTER D M, TEO C F, SUN Y H, et al. O-GlcNAc modifications regulate cell survival and epiboly during zebrafish development[J]. BMC Dev Biol, 2009, 9: 28. DOI:10.1186/1471-213X-9-28 |
| [15] |
O'DONNELL N, ZACHARA N E, HART G W, et al. Ogt-dependent X-chromosome-linked protein glycosylation is a requisite modification in somatic cell function and embryo viability[J]. Mol Cell Biol, 2004, 24(4): 1680-1690. DOI:10.1128/MCB.24.4.1680-1690.2004 |
| [16] |
YANG Y R, SONG M, LEE H, et al. O-GlcNAcase is essential for embryonic development and maintenance of genomic stability[J]. Aging Cell, 2012, 11(3): 439-448. DOI:10.1111/j.1474-9726.2012.00801.x |
| [17] |
KEEMBIYEHETTY C. Disruption of O-GlcNAc cycling by deletion of O-GlcNAcase (Oga/Mgea5) changed gene expression pattern in mouse embryonic fibroblast (MEF) cells[J]. Genom Data, 2015, 5: 30-33. DOI:10.1016/j.gdata.2015.04.026 |
| [18] |
MUHA V, AUTHIER F, SZOKE-KOVACS Z, et al. Loss of O-GlcNAcase catalytic activity leads to defects in mouse embryogenesis[J]. J Biol Chem, 2021, 296: 100439. DOI:10.1016/j.jbc.2021.100439 |
| [19] |
LEFEBVRE T, BAERT F, BODART J F, et al. Modulation of O-GlcNAc glycosylation during Xenopus oocyte maturation[J]. J Cell Biochem, 2004, 93(5): 999-1010. DOI:10.1002/jcb.20242 |
| [20] |
DEHENNAUT V, LEFEBVRE T, SELLIER C, et al. O-linked N-acetylglucosaminyltransferase inhibition prevents G2/M transition in Xenopus laevis oocytes[J]. J Biol Chem, 2007, 282(17): 12527-12536. DOI:10.1074/jbc.M700444200 |
| [21] |
DEHENNAUT V, HANOULLE X, BODART J F, et al. Microinjection of recombinant O-GlcNAc transferase potentiates Xenopus oocytes M-phase entry[J]. Biochem Biophys Res Commun, 2008, 369(2): 539-546. DOI:10.1016/j.bbrc.2008.02.063 |
| [22] |
ZHU Y, HART G W. Targeting O-GlcNAcylation to develop novel therapeutics[J]. Mol Aspects Med, 2021, 79: 100885. DOI:10.1016/j.mam.2020.100885 |
| [23] |
FEHL C, HANOVER J A. Tools, tactics and objectives to interrogate cellular roles of O-GlcNAc in disease[J]. Nat Chem Biol, 2022, 18(1): 8-17. DOI:10.1038/s41589-021-00903-6 |
| [24] |
SLAWSON C, ZACHARA N E, VOSSELLER K, et al. Perturbations in O-linked β-N-acetylglucosamine protein modification cause severe defects in mitotic progression and cytokinesis[J]. J Biol Chem, 2005, 280(38): 32944-32956. DOI:10.1074/jbc.M503396200 |
| [25] |
ZHANG Z, TAN E P, VANDENHULL N J, et al. O-GlcNAcase expression is sensitive to changes in O-GlcNAc homeostasis[J]. Front Endocrinol (Lausanne), 2014, 5: 206. |
| [26] |
LIN C H, LIAO C C, CHEN M Y, et al. Feedback regulation of O-GlcNAc transferase through translation control to maintain intracellular O-GlcNAc homeostasis[J]. Int J Mol Sci, 2021, 22(7): 3463. DOI:10.3390/ijms22073463 |
| [27] |
WEISS M, ANDERLUH M, GOBEC M. Inhibition of O-GlcNAc transferase alters the differentiation and maturation process of human monocyte derived dendritic cells[J]. Cells, 2021, 10(12): 3312. DOI:10.3390/cells10123312 |
| [28] |
MA J F, WU C, HART G W. Analytical and biochemical perspectives of protein O-GlcNAcylation[J]. Chem Rev, 2021, 121(3): 1513-1581. DOI:10.1021/acs.chemrev.0c00884 |
| [29] |
ZHANG H L, JIA Y W, COOPER J J, et al. Common variants in glutamine: fructose-6-phosphate amidotransferase 2 (GFPT2) gene are associated with type 2 diabetes, diabetic nephropathy, and increased GFPT2 mRNA levels[J]. J Clin Endocrinol Metab, 2004, 89(2): 748-755. DOI:10.1210/jc.2003-031286 |
| [30] |
CHIARADONNA F, RICCIARDIELLO F, PALORINI R. The nutrient-sensing hexosamine biosynthetic pathway as the Hub of cancer metabolic rewiring[J]. Cells, 2018, 7(6): 53. DOI:10.3390/cells7060053 |
| [31] |
AKELLA N M, CIRAKU L, REGINATO M J. Fueling the fire: emerging role of the hexosamine biosynthetic pathway in cancer[J]. BMC Biol, 2019, 17(1): 52. DOI:10.1186/s12915-019-0671-3 |
| [32] |
CHATHAM J C, YOUNG M E, ZHANG J H. Role of O-linked N-acetylglucosamine (O-GlcNAc) modification of proteins in diabetic cardiovascular complications[J]. Curr Opin Pharmacol, 2021, 57: 1-12. DOI:10.1016/j.coph.2020.08.005 |
| [33] |
GHOSH S K, BOND M R, LOVE D C, et al. Disruption of O-GlcNAc cycling in C. elegans perturbs nucleotide sugar pools and complex glycans[J]. Front Endocrinol (Lausanne), 2014, 5: 197.
|
| [34] |
JIANG X L, PANG Y W, ZHAO S J, et al. Thioredoxin-interacting protein regulates glucose metabolism and improves the intracellular redox state in bovine oocytes during in vitro maturation[J]. Am J Physiol Endocrinol Metab, 2020, 318(3): E405-E416. DOI:10.1152/ajpendo.00057.2019 |
| [35] |
PERRONE L, DEVI T S, HOSOYA K I, et al. Inhibition of TXNIP expression in vivo blocks early pathologies of diabetic retinopathy[J]. Cell Death Dis, 2010, 1(8): e65. DOI:10.1038/cddis.2010.42 |
| [36] |
STOLTZMAN C A, KAADIGE M R, PETERSON C W, et al. Mondoa senses non-glucose sugars: regulation of thioredoxin-interacting protein (TXNIP) and the hexose transport curb[J]. J Biol Chem, 2011, 286(44): 38027-38034. DOI:10.1074/jbc.M111.275503 |
| [37] |
FILHOULAUD G, BENHAMED F, PAGESY P, et al. O-GlcNAcylation links TxNIP to inflammasome activation in pancreatic β cells[J]. Front Endocrinol (Lausanne), 2019, 10: 291. DOI:10.3389/fendo.2019.00291 |
(编辑 郭云雁)



