磷脂酰肌醇特异的磷脂酶C(phospholipase C,PLC)可使磷脂酰肌醇-4,5-二磷酸(PIP2)水解为第二信使肌醇-1,4,5-三磷酸(PIP3)和二酰甘油(DAG)[1-3],在调节各种受体分子的细胞内信号转导中起着关键作用。PIP3可使内质网钙库释放出Ca2+[4-5],使细胞内Ca2+的浓度升高[6-8];DAG可激活蛋白激酶C(protein kinase C,PKC),继而引发下一步的信号传递[9-10]。PLC普遍存在于机体的各组织中,对机体多种生理活动做出了重要的调控[11-12]。PLCγ可作为一种传递信号参与受体酪氨酸激酶(receptor tyrosine kinase,RTK)介导的细胞分裂、抗原抗体结合引起免疫反应及卵细胞受精[13]等过程。磷脂酶Cγ1(phospholipase C-γ1, PLC-γ1)作为PLC家族的成员,至今已发现13种哺乳动物PLC的同工酶,分为β、γ、ε和δ四大类型[14],每一类型还有不同的亚型分支。PLC-γ1属于PLCγ的一个亚型[15]。除参与细胞分裂外,RTK介导的PLC-γ1信号通路在细胞迁移、运动和分化中也有重要作用。通常过度表达RTK下游分子会引起肿瘤转移,PLC-γ1也有这种作用[16-17];一般认为,RTK的下游分子能刺激或抑制细胞分化,也有报道证明PLC-γ1能诱导培养的神经细胞生长与分化[18-20]。Dittmar等[21]报道,表皮生长因子(epidermal growth factor,EGF)诱导乳腺癌细胞的迁移是由于PLC-γ1的短暂激活引起的。Smith等[22]报道,在小鼠3YI的纤维原细胞中PLC-γ1的过表达会导致细胞发生恶性转化。Zhang等[23]运用基因敲除技术,通过降低PLC-γ1活性来抑制胚胎血管内皮生长因子的下游转导,证明其对胚胎发育过程中血细胞的生成及血管内皮生长因子具有非常重要的调控作用。PLC-γ1蛋白在不同家畜、物种及进化过程中具有较高的序列保守性,对于细胞的生长、增殖、胚胎发育等都有着重要影响[24-25]。
本研究旨在获得真核过表达蛋白PLC-γ1,并通过注射纯化PLC-γ1蛋白制备多克隆抗体,以绵羊早期胚胎为模型研究PLC-γ1在其发育中的信号通路机制奠定基础。本研究通过常规分子克隆技术扩增获得PLC-γ1基因,构建pcDNA3.1-EGFP-P2A-Flag-PLC-γ1真核过表达载体后转染HEK-293T细胞表达,高质量的鼠源IgG1重组抗体与纳米磁珠共价偶联制备的Anti-Flag免疫磁珠对PLC-γ1蛋白进行纯化后混入弗氏佐剂免疫试验兔,使用间接ELISA确定血清的效价,WB检测抗体的特异性,饱和过硫酸铵对多克隆抗体进行纯化。将已构建的绵羊PLC-γ1基因真核表达重组质粒显微注射到绵羊MⅡ期卵母细胞胞质中以验证PLC-γ1基因是否对绵羊胚胎发育具有影响,孤雌激活卵裂后分别在mRNA及蛋白水平上进行PLC-γ1表达检测。
1 材料与方法 1.1 材料菌株、载体、细胞及试验动物:E.coli DH5α Electro-Cells购自TaKaRa有限公司,pcDNA3.1-EGFP(+)载体、Puc57-P2A-Flag-PLC-γ1菌株、HEK-293T细胞由本实验室保存并提供;试验兔(新西兰大白兔)由石河子大学动物疾病防控兵团重点实验室提供。
主要试剂:T4 DNA连接酶、Hind Ⅲ限制性内切酶、pMD19-T载体、Prime ScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒均购自TaKaRa公司;Anti-Flag免疫磁珠、磁力架、SYBR购自Bimake公司;Trizol、Age Ⅰ限制性内切酶、聚偏二氟乙烯膜、预染蛋白Marker、Ipofectamin TM2000 Reagent、Diethyl Pyrocar bonate均购自赛默飞世尔科技有限公司;Super DNA Marker、2xTaq PCR MasterMix、琼脂糖凝胶DNA回收试剂盒、氨苄青霉素(Amp+)、卡那霉素(Kan+)、DAB显色液、高纯度无内毒素质粒小提试剂盒、无内毒素质粒大提试剂盒均购自天根生化科技(北京)有限公司;脱脂奶粉购自美国BD公司;BCA蛋白浓度测定试剂盒、RIPA裂解液、PMSF均购自北京索莱宝科技有限公司;Flag标签一抗、β-actin一抗、羊抗兔辣根过氧化物酶标二抗均购自Abcam公司。
绵羊用割卵液、成熟培养液、SoFaa胚胎培养液配方(所用试剂均购自Sigma公司):割卵液:PBS 95 mL、Heperin 0.005 g、Penicillin 0.008 g、Streptomycin 0.005 5 g、Phenol red 0.001 g、FBS 5 mL。成熟培养液:TCM199 0.92 g、NaHCO3 0.25 g、Hepes 0.246 3 g、Na-Py 0.033 g、Glutamine 0.005 g、0.075 IU·mL-1HMG 1 mL、1 μg·mL-117 β-雌二醇1 mL、S/N 0.007 g、Phenol red 0.001 g、FBS 10 mL、无菌去离子水88 mL。SoFaa胚胎培养液:NaCl 0.632 5 g、KCl 0.048 2 g、KH2PO4 0.012 3 g、NaHCO3 0.265 1 g、Na-Py 0.003 6 g、L-Glutamine 0.015 8 g、BSA 0.8 g、CaCl2·2H2O 0.024 8 g、MgCl2·6H2O 0.01 g、BME(amino acids) 2 mL、MEM(amino acids) 1 mL、Sodium lactate 28.22 μL、Pencillin 0.008 g、Strep 0.005 5 g、Phenol red 0.001 g、无菌去离子水96.97 mL。
主要仪器:FormaTM Steri-CultTM CO2 Incubators(SANYO);PCR仪(TC400);电泳仪(北京六一DYY-8C);实时荧光定量PCR仪(瑞士罗氏公司);凝胶成像仪(英国Clearer公司);紫外分光光度计(美国BioTek公司);Protein simple成像仪(美国Protein Simple公司)。
1.2 方法1.2.1 引物设计与合成 利用Primer Premier 5.0软件以Puc57-P2A-Flag-PLC-γ1菌株为模板对所设计的引物上、下游分别引入Hind Ⅲ、Age Ⅰ酶切位点。根据绵羊P2A-Flag-PLC-γ1基因序列和绵羊β-actin基因(登录号:443052)设计实时荧光定量qPCR引物(表 1)。由生工(上海)生物技术有限责任公司对所设计的引物进行合成。
|
|
表 1 引物序列 Table 1 Primer sequences |
1.2.2 pMD19-T-P2A-Flag-PLC-γ1克隆载体的构建 使用设计好的引物以Puc57-P2A-Flag-PLC-γ1为模板进行目的基因的扩增,扩增体系(25 μL):2×GC Buffer Ⅰ 12.5 μL,ddH2O 6 μL,dNTP Mixture 4 μL,模板1 μL,上、下游引物(PLC-γ1)各0.5 μL,LA Taq酶0.5 μL。PCR反应条件:95 ℃预变性2 min;94 ℃变性20 s,58 ℃退火1 min,68 ℃延伸4 min,30个循环;68 ℃再延伸10 min;4 ℃保存。1.0%琼脂糖凝胶电泳(120 V 90 mA,45 min)对PCR产物进行验证。
根据DNA琼脂糖凝胶回收试剂盒产品的操作规范和说明书对符合目的片段大小的PCR产物进行回收试验操作,胶回收产物通过核酸定量仪Nano Drop 2000c测定浓度,验证合格的产物与T载体16 ℃过夜连接,连接体系(10 μL):10×ligation buffer*1 2 μL,T4 DNA Ligase 1 μL,T载体2 μL,插入DNA片段2 μL,ddH2O 3 μL。将过夜连接后的pMD19-T-P2A-Flag-PLC-γ1克隆载体转入E.coli DH5α Electro-Cells后涂布于带有氨苄抗性的LB固体培养基上,挑取单菌株进行PCR鉴定(反应所需体系同上,退火温度为56 ℃,上、下游引物为PLC-γ1-Yiyuan),提取PCR鉴定的阳性克隆菌株的质粒,使用Hind Ⅲ和Age Ⅰ进行双酶切鉴定后测序。
1.2.3 pcDNA3.1-EGFP-P2A-Flag-PLC-γ1真核过表达载体的构建 使用Hind Ⅲ、Age Ⅰ限制性内切酶酶切测序正确的阳性质粒pMD19-T-P2A-Flag-PLC-γ1及pcDNA3.1-EGFP(+)载体,回收P2A-Flag-PLC-γ1基因片段及载体片段,两者16 ℃过夜连接,构建pcDNA3.1-EGFP-P2A-Flag-PLC-γ1真核过表达载体,在冰上转入感受态细胞后涂布于带有载体抗性的LB固体培养基上,37 ℃恒温培养,挑取单菌落进行菌液PCR检测,阳性菌株提取质粒进行双酶切鉴定后进行测序。
1.2.4 过表达载体转染HEK-293T细胞 将含有重组质粒pcDNA3.1-EGFP-P2A-Flag-PLC-γ1的菌液接种于3 000 mL氨苄抗性的LB液体培养基中,37 ℃震荡过夜培养,然后根据天根公司无内毒素质粒大提试剂盒产品的操作规范和说明书对重组质粒进行提取试验操作。Lipofectamin TM2000 Reagent包裹真核过表达载体pcDNA3.1-EGFP-P2A-Flag-PLC-γ1转染HEK-293T细胞,转染后37 ℃、5%CO2孵育4~6 h后更换新鲜培养液去除细胞毒性,24 h后,荧光显微镜观测试验结果,确定转染效果以及PLC-γ1表达情况。
1.2.5 实时定量PCR检测PLC-γ1 mRNA表达情况 在冰上对转染后的293T细胞进行总RNA提取,进行反转录试验,对反转录后的产物进行qPCR反应,反应体系(20 μL):50×ROX Reference Dye(low Donc) 0.5 μL,ddH2O 6.5 μL,2×SYBR Green qPCR Master Mix 10 μL,cDNA 1 μL,上、下游引物(PLC-γ1-qPCR/β-actin-qPCR)各1 μL。qPCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,55个循环。每组样品均重复3次试验,反应结束后计算mRNA水平上PLC-γ1表达情况。
1.2.6 免疫印迹法检测HEK-293T细胞中PLC-γ1蛋白表达 根据RIPA裂解液以及PMSF使用说明书提取转染后293T细胞的总蛋白,对所提取的细胞总蛋白使用BCA试剂盒进行浓度测定,5×SDS蛋白上样液煮沸变性,免疫印迹法(Flag抗体为一抗,羊抗兔辣根过氧化物酶标二抗)检测PLC-γ1蛋白表达。
1.2.7 Anti-Flag免疫磁珠对PLC-γ1蛋白进行纯化 取20 μL磁珠悬液至新离心管,500 μL TBS吹打重悬3次后移除上清;加入200 μL细胞裂解液,室温孵育2.5 h后进行磁性分离,留取沉淀磁珠,移除上清用于阴性对照检测;500 μL PBST吹打重悬,上下翻转样品5 min,磁性分离后移除上清,该过程进行3次;取pH为3的0.1 mol·L-1 glycine HCl 100 μL在摇床上洗脱15 min;洗脱产物加入pH为8的1 mol·L-1 Tris-HCL调节pH直至中性。
1.2.8 纯化后的PLC-γ1蛋白进行SDS凝胶电泳及免疫印迹检测 SDS聚丙烯酰胺凝胶电泳及WB(Flag抗体为一抗,稀释后的羊抗兔辣根过氧化物酶标二抗为二抗)检测纯化后的PLC-γ1蛋白表达情况。
1.2.9 PLC-γ1多克隆抗体的制备 将纯化的PLC-γ1蛋白混入弗氏佐剂免疫健康状态良好的试验兔,免疫程序:免疫前对2只健康且状态良好的试验兔耳缘静脉抽血2 mL留作阴性对照;免疫第1天(第一次免疫),纯化的800 μg蛋白与完全佐剂等体积混合后形成稳定的乳化剂,在试验兔皮下采用五点法进行注射;第15天(第二次免疫)纯化的800 μg蛋白与完全佐剂等体积混合注射;第29天(第三次免疫)纯化的500 μg蛋白与不完全佐剂等体积混合注射;第36天耳动脉抽血2 mL,WB鉴定多克隆抗体产生情况,ELISA测其血清效价;第43天(第四次免疫)纯化的500 μg蛋白与不完全佐剂等体积混合注射;第50天耳动脉抽血2 mL,WB鉴定克隆抗体产生情况,ELISA测其血清效价;第53天心动脉采血50 mL。
1.2.10 间接ELISA法检测多抗血清效价 以纯化后的PLC-γ1蛋白作为抗原,以100 μL·孔-1包被于96孔的ELISA反应板,4 ℃过夜;PBST洗板3次后5%脱脂奶粉封闭1 h;PBST洗板3次,以免疫前的兔血清为阴性对照,其余的加入梯度倍比稀释的兔血清100 μL·孔-1,37 ℃培养箱孵育1 h,PBST洗板3次后100 μL·孔-1加入稀释后的HRP标记的山羊抗兔IgG,培养箱内孵育1 h,PBST洗板3次;在避光环境下每孔100 μL的TMB底物显色液孵育20 min后1.5 mol·L-1 H2SO4终止反应,在OD450 nm条件下检测吸光值,若阴性对照的吸光值小于或等于所测孔吸光值的2.1倍,则为阳性,重复试验3次;并分别对每试验组免疫后第0、36、50、53天的兔血清按上述方法进行间接ELISA检测。
1.2.11 使用饱和硫酸铵法纯化多克隆抗体 试验兔的心动脉血在4 ℃离心机内13 000 r·min-1离心30 min;收集血清后与生理盐水1∶1混合,缓慢滴加饱和硫酸铵(SAS),并不断搅拌下,4 ℃静置10 h,使蛋白充分沉淀;13 000 r·min-1离心10 min后弃上清;沉淀中缓慢加入生理盐水使其充分溶解后滴加SAS,4 ℃放置1 h;生理盐水溶解沉淀并装入透析袋放入盛有PBS的烧杯,于4 ℃冰箱数次更换透析液,-20 ℃保存。
1.2.12 WB鉴定多克隆抗体特异性 以稀释后的兔血清为一抗,WB鉴定多克隆抗体特异性,DAB显色后拍照留存。
1.2.13 卵母细胞的成熟培养 绵羊卵巢采自新疆石河子市屠宰场,在添加青链霉素(100 IU·mL-1) 的38.5 ℃生理盐水中保温,2 h内运回实验室。清理绵羊卵巢结缔组织后用生理盐水洗涤3次,在含2 mL割卵液的60 mm培养皿中收集胞质均匀、卵丘细胞包裹完整的卵丘-卵母细胞复合体(COCs),在成熟培养液润洗3次后成熟培养,培养条件为38.5 ℃、5% CO2饱和湿度。将卵丘-卵母细胞复合体(COCs) 体外成熟培养24 h后,在透明质酸酶(Sigma)中作用5 min除去颗粒细胞,然后在体视显微镜下挑选排出第一极体的成熟卵母细胞分组备用。
1.2.14 卵母细胞的孤雌激活 将成熟的卵母细胞随机分为Ion-6D组、PLC-γ1组、空载组3组。PLC-γ1组的卵母细胞采用显微注射pcDNA3.1-EGFP-P2A-Flag-PLC-γ1重组质粒的方式进行孤雌激活,空载组的卵母细胞进行显微注射pcDNA3.1-EGFP质粒。将PLC-γ1组的卵母细胞置于100 μL操作溶液(CB)中,用1 mL石蜡油覆盖制成微滴。在倒置荧光显微操作仪上用内径100 μm、外径为120 μm的固定针固定卵母细胞,用内径为5~7 μm的注入针吸取4 pL的[26]重组质粒pcDNA3.1-EGFP-P2A-Flag-PLC-γ1,注入针经透明带进入卵母细胞胞质内,缓慢将重组质粒注入胞质内,轻轻退出注入针完成显微注射,全部卵母细胞的显微注射操作于1 h内结束(图 1);以相同的显微注射方法,实现空载组卵母细胞的注入;Ion-6D组以离子霉素(Ion)结合6-DMAP发生孤雌激活,Ion-6D组的卵母细胞在离子霉素微滴中作用约5 min,后置于6-DMAP微滴中作用4 h。激活后将3组卵母细胞分别置于100 μL SoFaa培养液(自配,成分来自Sigma)微滴中培养48 h,后每隔48 h更换50 μL SoFaa培养液继续培养。参考李昊[27]对不同时期绵羊早期胚胎的研究方法,对3组不同处理方式的卵母细胞在卵裂后不同时期(2细胞期、4细胞期、8细胞期、桑椹胚期)的绵羊早期胚胎进行收集,各时期100个细胞,重复试验3次,对收集到的细胞进行总RNA提取及全蛋白提取。

|
A. 显微注射pcDNA3.1-EGFP-P2A-Flag-PLC-γ1质粒;B. 显微注射pcDNA3.1-EGFP质粒 A. Microinjection of pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 plasmid; B. Microinjection of pcDNA3.1-EGFP plasmid 图 1 卵母细胞显微注射(20×) Fig. 1 Oocytes microinjection (20×) |
1.2.15 实时定量PCR检测绵羊早期胚胎发育各时期PLC-γ1 mRNA表达情况 使用GenEluteTM单细胞RNA纯化试剂盒(Sigma)对绵羊早期胚胎发育各时期细胞进行总RNA提取,进行反转录试验,对反转录后的产物进行qPCR反应,反应体系、条件同“1.2.5”,反应结束后,计算mRNA水平上PLC-γ1表达情况。
1.2.16 WB检测绵羊早期胚胎发育各时期PLC-γ1蛋白表达情况 使用全蛋白提取试剂盒(Solarbio)对绵羊早期胚胎发育各时期细胞进行总蛋白提取,5×SDS蛋白上样液煮沸变性,免疫印迹法(稀释后的兔血清为一抗,稀释后的羊抗兔辣根过氧化物酶标二抗为二抗)检测PLC-γ1蛋白表达。
1.2.17 统计分析 采用GraphPad Prism 8.0绘制结果图形。并采用IBM SPSS Statistics 26软件对数据进行解析。各组之间的多重因素比较可以通过邓肯检验加以评定。单因素方差分析(ANOVA) 可以用来确定各组间的差异性。而两组间差异性可以使用学生t检测。数据以“平均值±SEM”表示。P < 0.05被认为具有统计学意义。每组数据中不同字母表示其平均值间有显著差异(P < 0.05)。
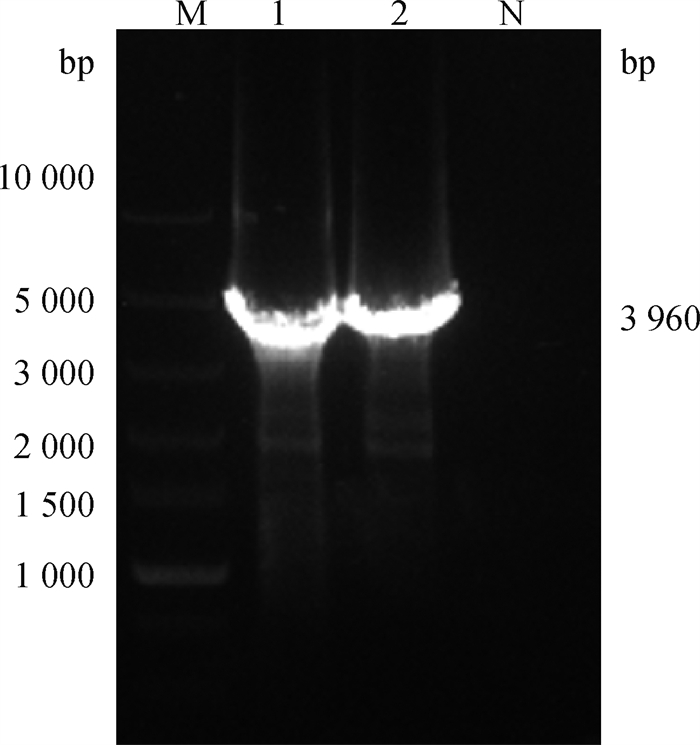
2 结果 2.1 pMD19-T-P2A-Flag-PLC-γ1克隆载体的构建以实验室保存的Puc57-P2A-Flag-PLC-γ1菌株为模板,成功扩增出约3 960 bp的目的片段(图 2),以PLC-γ1-Yiyuan为引物,经过菌液PCR验证,成功扩增出约330 bp基因片段(图 3)。筛选出阳性克隆测序,测序结果Blast后与NCBI数据库进行比对,结果显示与绵羊羊磷脂酶C γ1(PLCG1)转录本变体X3(登录号: XM_027977197.2)基因同源性为100%,X1(登录号: XM_027977196.2) 的同源性达到98.56%,与转录本变体X2(登录号: XM_042230134.1) 的同源性达到98.35%。表明成功构建pMD19-T-P2A-Flag-PLC-γ1克隆载体。
|
M.DNA相对分子质量标准;1~2.PCR产物;N.阴性对照 M. Super DNA marker; 1-2. PCR products; N. Negative control 图 2 P2A-Flag-PLC-γ1基因的PCR扩增 Fig. 2 PCR amplification of the P2A-Flag-PLC-γ1 gene |

|
M. DNA相对分子质量标准(50~1 031 bp);1~6. 菌液PCR产物;N. 阴性对照 M. DNA marker (50-1 031 bp); 1-6. PCR products of bacterial fluid; N. Negative control 图 3 菌液PCR验证 Fig. 3 PCR results of bacterial solution |
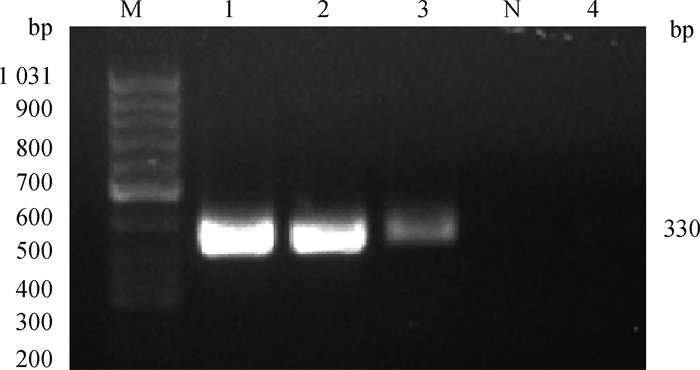
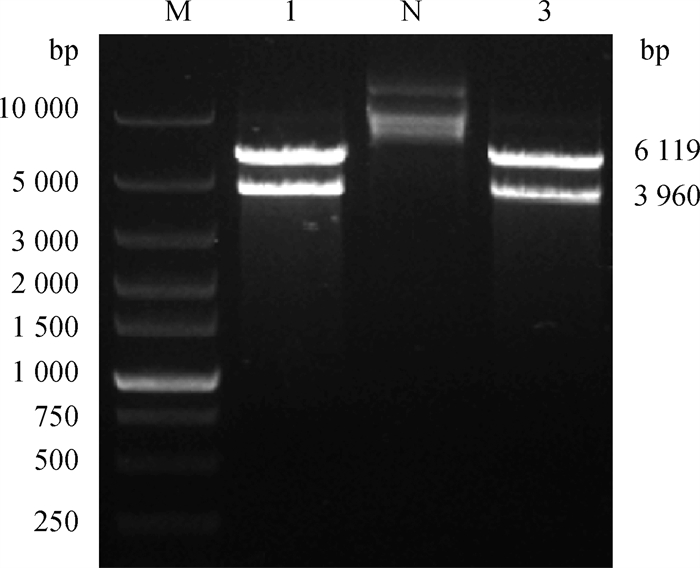
将克隆后的基因片段连接至pcDNA3.1-EGFP载体,转入大肠杆菌DH5α后,以PLC-γ1-Yiyuan为引物,经过菌液PCR验证,成功扩增出约330 bp基因片段(图 4),双酶切后琼脂糖凝胶电泳结果证实成功切出目的基因片段(图 5),测序结果正确,以上结果均表明,成功构建了pcDNA3.1-EGFP-P2A-Flag-PLC-γ1过表达载体。
|
M. DNA相对分子质量标准(50~1 031 bp);1~3. 菌液PCR产物;N. 阴性对照;4. pcDNA3.1-EGFP空载 M. DNA marker (50-1 031 bp); 1-3. PCR products of bacterial fluid; N. Negative control; 4. No-load pcDNA3.1-EGFP 图 4 菌液PCR验证 Fig. 4 PCR results of bacterial solution |
|
M. DNA相对分子质量标准;1、3. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 Hind Ⅲ、Age Ⅰ双酶切产物;N. 阴性对照 M. Super DNA marker; 1, 3. Double digestion products of pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 digested with Hind Ⅲ and Age Ⅰ; N. Negative control 图 5 pcDNA3.1-EGFP-P2A-Flag-PLC-γ1过表达载体的双酶切鉴定 Fig. 5 Double restriction enzyme digestion of pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 expression vector |
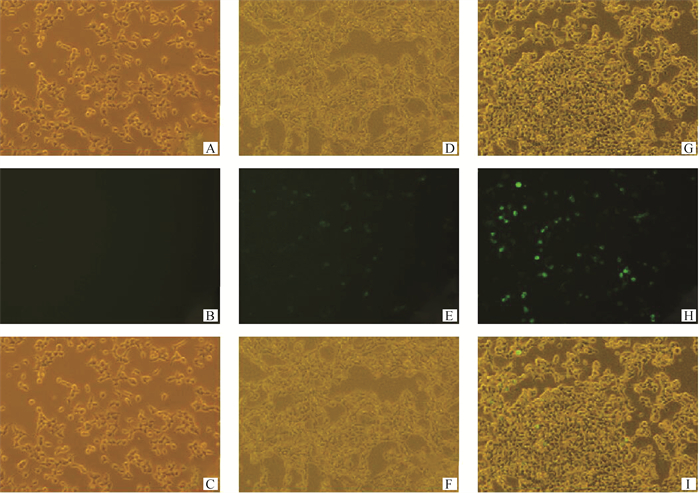
转染24 h后在荧光显微镜下观察HEK-293T细胞,成功观测到绿色荧光(图 6)。
|
A. 正常HEK-293T细胞(明场);B. 正常HEK-293T细胞(暗场);C. 正常HEK-293T细胞Merge图;D. pcDNA3.1-EGFP转染HEK-293T细胞(明场);E. pcDNA3.1-EGFP转染HEK-293T细胞(暗场);F. pcDNA3.1-EGFP转染HEK-293T细胞Merge图;G. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1转染HEK-293T细胞(明场);H. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1转染HEK-293T细胞(暗场);I. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1转染HEK-293T细胞Merge图 A. Normal HEK-293T cells (bright field); B. Normal HEK-293T cells (dark field); C.Normal HEK-293T cells Merge; D. pcDNA3.1-EGFP transfected into HEK-293T cells (bright field); E.pcDNA3.1-EGFP transfected into HEK-293T cells (dark field); F. pcDNA3.1-EGFP transfected into HEK-293T cells Merge; G. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 transfected into HEK-293T cells (bright field); H. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 transfected into HEK-293T cells (dark field); I. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 transfected into HEK-293T cells Merge 图 6 pcDNA3.1-EGFP-P2A-Flag-PLC-γ1转染HEK-293T细胞24 h(40×) Fig. 6 pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 transfected into HEK-293T cells for 24 h(40×) |
转染成功的HEK-293T细胞采用RT-qPCR检测方法对细胞的PLC-γ1基因进行mRNA表达量的检测,试验结果显示过表达组mRNA水平上PLC-γ1基因与Control组及空载组相比表达量明显升高,差异极显著(P < 0.01)。而空载组其表达量接近于Control组,因此两者之间没有差异(P> 0.05)(图 7)。
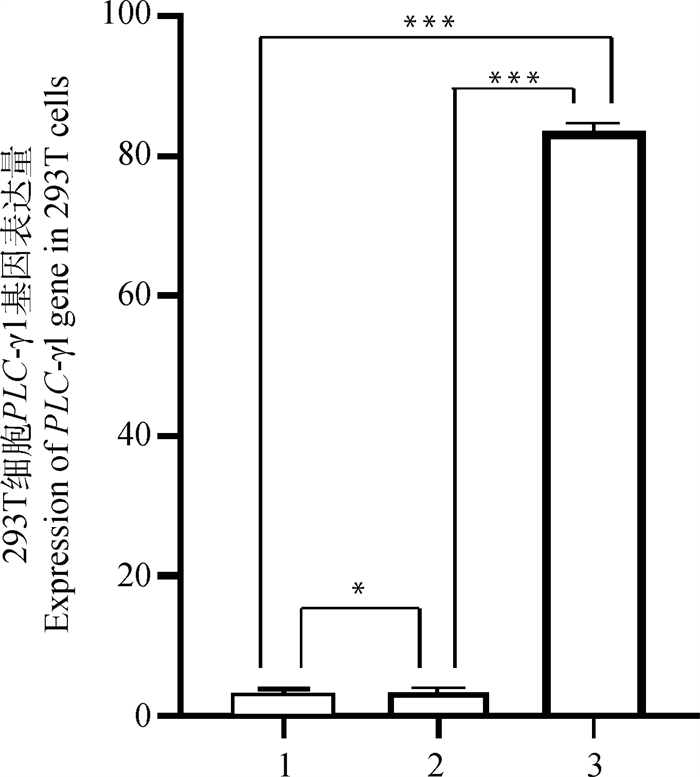
|
1.Control组;2.空载组;3.过表达组。*. P>0.05;**.P < 0.05;***.P < 0.01。下同 1. Control group; 2. No-load group; 3. Overexpression group. *.P>0.05;**.P < 0.05;***.P < 0.01. The same as below 图 7 HEK-293T细胞PLC-γ1基因表达 Fig. 7 Expression of PLC-γ1 gene in HEK-293T cells |
对转染成功后的HEK-293T细胞裂解收集总蛋白,同时设置正常HEK-293T细胞、空载体对照,进行WB分析。WB结果显示在149 ku大小处有目标条带(图 8),分析结果显示检测目的蛋白大小与PLC-γ1蛋白一致,且蛋白表达量存在差异(图 9)。

|
1. HEK-293T细胞总蛋白;2. pcDNA3.1-EGFP转染HEK-293T细胞总蛋白;3. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1转染HEK-293T细胞总蛋白 1. HEK-293T cell total protein; 2. pcDNA3.1-EGFP transfection of HEK-293T cell total protein; 3. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 transfection of HEK-293T cells total protein 图 8 Anti-Flag抗体检测PLC-γ1蛋白表达 Fig. 8 Detection of PLC-γ1 protein expression by Anti-Flag antibody |

|
1. HEK-293T细胞总蛋白;2. pcDNA3.1-EGFP转染HEK-293T细胞总蛋白;3. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1转染HEK-293T细胞总蛋白 1. HEK-293T cell total protein; 2. pcDNA3.1-EGFP transfection of HEK-293T cell total protein; 3. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 transfection of HEK-293T cells total protein 图 9 Anti-Flag抗体检测PLC-γ1蛋白表达相对丰度 Fig. 9 The relative abundance of PLC-γ1 protein detected by Anti-Flag antibody |
经Anti-Flag免疫磁珠纯化后的蛋白及Flag-tag蛋白进行SDS聚丙烯酰胺凝胶电泳及WB检测,结果显示使用Anti-Flag免疫磁珠成功纯化出目的蛋白(149 ku)(图 10)。
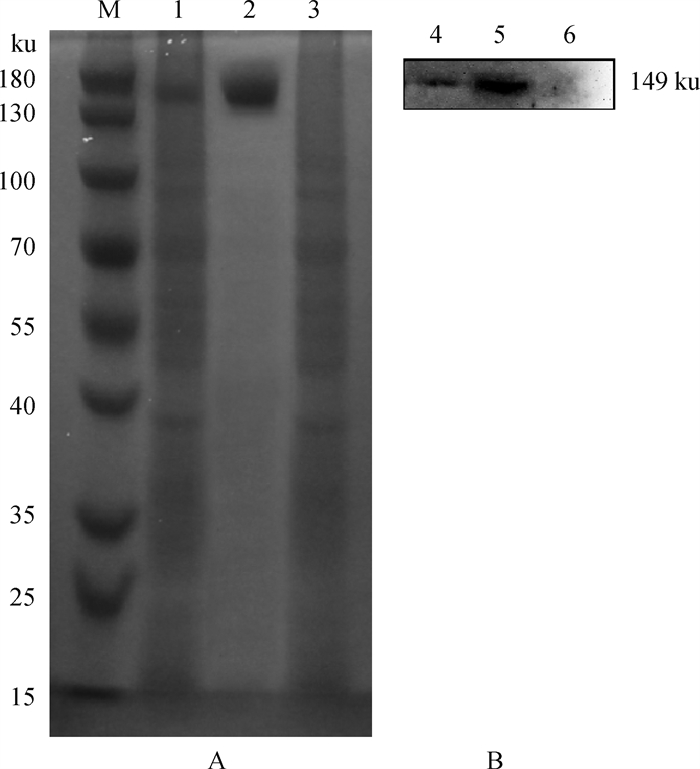
|
M.蛋白相对分子质量标准;1、4. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1转染HEK-293T细胞总蛋白;2、5.经Anti-Flag免疫磁珠纯化的PLC-γ1蛋白;3、6. Flag-tag蛋白 M. Protein marker; 1, 4. HEK-293T cell total protein was transfected with pcDNA3.1-EGFP-P2A-Flag-PLC-γ1; 2, 5. PLC-γ1 protein purified by Anti-Flag immunomagnetic beads; 3, 6. Flag-tag protein 图 10 Anti-Flag免疫磁珠纯化PLC-γ1蛋白的SDS-PAGE(A)和WB(B)鉴定结果 Fig. 10 SDS-PAGE(A) and WB(B) identification results of PLC-γ1 protein purified by Anti-Flag immunomagnetic beads |
为制备特异性抗原肽,对2只新西兰大白兔进行免疫,使用间接ELISA法检测血清效价,重复试验3次,取平均值(表 2、图 11)。当制备的PLC-γ1多抗稀释比例至1∶12 800时,Rabbit1的OD450 nm值为0.394,Rabbit2的OD450 nm值为0.262,其与阴性对照孔相比仍然都大于2.1倍,因此多抗血清效价为1∶12 800。
|
|
表 2 ELISA初步检测血清效价 Table 2 The preliminary ELISA detection of serum titer |

|
图 11 多抗血清的ELISA效价检测 Fig. 11 ELISA titer detection of polyantiserum |
WB结果显示,在约149 ku区域,PLC-γ1蛋白与制备的多克隆抗体成功结合(图 12),这表明所制备的兔多克隆抗体具有很好的特异性。

|
1、2、4、5. pcDNA3.1-EGFP-P2A-Flag-PLC-γ1转染HEK-293T细胞总蛋白;3、6. pcDNA3.1-EGFP转染293T细胞总蛋白 1, 2, 4, 5. HEK-293T cell total protein transfected with pcDNA3.1-EGFP-P2A-Flag-PLC-γ1; 3, 6. HEK-293T cell total protein transfected with pcDNA3.1-EGFP 图 12 兔1(A)和2(B)所制备的多克隆抗体的WB验证 Fig. 12 WB verification of the polyclonal antibody prepared by rabbit 1(A) and 2(B) |
Ion-6D孤雌激活的卵母细胞在激活后48 h开始卵裂;显微注射pcDNA3.1-EGFP-P2A-Flag-PLC-γ1载体的卵母细胞在注射后48 h开始卵裂,荧光显微镜下观察可成功观测到绿色荧光(图 13);注射空载体组的卵母细胞没有卵裂现象,排除了显微注射过程中机械刺激与pcDNA3.1-EGFP空载激活卵母细胞的可能性。综上所述,说明PLC-γ1重组质粒可在卵母细胞中发挥作用,且具有作为新的卵母细胞激活因子的潜能。
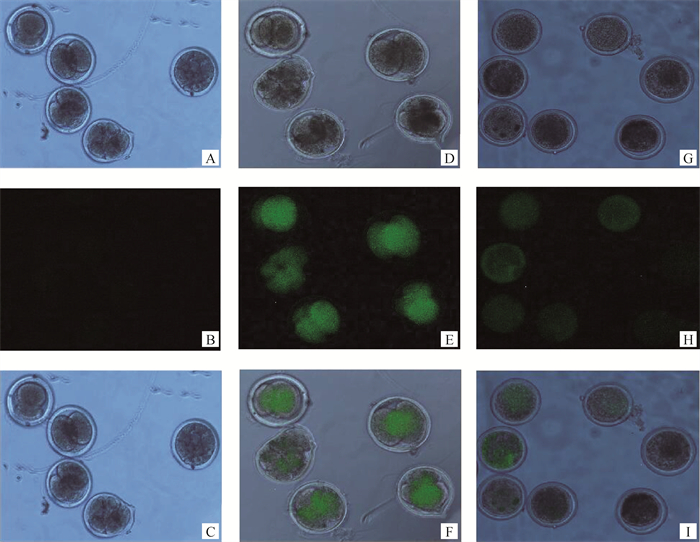
|
A. Ion-6D孤雌激活(明场);B. Ion-6D孤雌激活(暗场);C. Ion-6D孤雌激活Merge图;D. 显微注射pcDNA3.1-EGFP-P2A-Flag-PLC-γ1载体(明场);E. 显微注射pcDNA3.1-EGFP-P2A-Flag-PLC-γ1载体(暗场);F. 显微注射pcDNA3.1-EGFP-P2A-Flag-PLC-γ1载体Merge图;G. 显微注射pcDNA3.1-EGFP载体(明场);H. 显微注射pcDNA3.1-EGFP载体(暗场);I. 显微注射pcDNA3.1-EGFP载体Merge图 A. Ion-6D parthenogenetic activation (bright field); B. Ion-6D parthenogenetic activation (dark field); C. Ion-6D parthenogenetic activation Merge; D. Microinjection of pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 vector (bright field); E. Microinjection of pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 vector (dark field); F. Microinjection of pcDNA3.1-EGFP-P2A-Flag-PLC-γ1 vector Merge; G. Microinjection of pcDNA3.1-EGFP vector (bright field); H. Microinjection of pcDNA3.1-EGFP vector (dark field); I. Microinjection of pcDNA3.1-EGFP vector Merge 图 13 激活后各时期卵母细胞形态(40×) Fig. 13 Oocytes morphology at various stages after activation (40×) |
对Ion-6D激活及显微注射处理后的两组绵羊早期胚胎采用RT-qPCR方法检测其发育过程中各细胞时期的PLC-γ1基因mRNA表达量,试验结果显示,两组早期胚胎在发育过程中PLC-γ1基因mRNA表达量都存在先下降后上升的趋势,且在桑葚胚时期表达量剧增;显微注射组与Ion-6D激活组相比,除2细胞期外,其他时期表达量不断升高,差异显著性不断增强(图 14)。
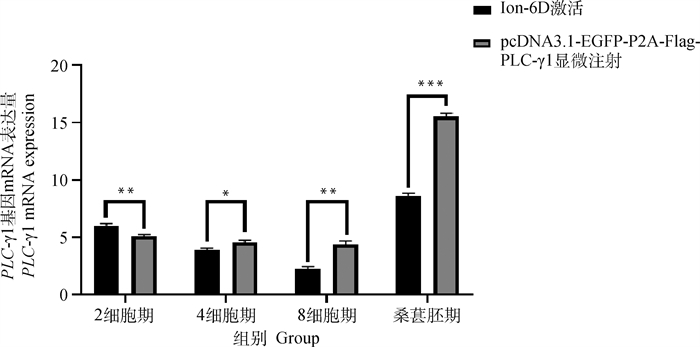
|
图 14 激活后绵羊早期胚胎发育各时期PLC-γ1基因mRNA表达量 Fig. 14 The mRNA expression of PLC-γ1 gene at different stages of early embryo development in sheep after activation |
对孤雌激活后胚胎发育至2细胞期、4细胞期、8细胞期、桑椹胚期的细胞裂解收集总蛋白,进行WB分析。分析结果显示,在149 ku处不同处理方式下不同时期的早期胚胎其蛋白表达量存在差异(图 15、图 16)。

|
1.成熟卵母细胞;2、4、6、8. Ion-6D激活后绵羊早期胚胎发育至2细胞期、4细胞期、8细胞期、桑葚胚期;3、5、7、9. 显微注射后绵羊早期胚胎发育至2细胞期、4细胞期、8细胞期、桑葚胚期 1. Mature oocyte; 2, 4, 6, 8. After Ion-6D activation, the early embryo of sheep developed to 2-cell stage, 4-cell stage, 8-cell stage and morula stage; 3, 5, 7, 9. After microinjection, the early embryo of sheep developed to 2-cell stage, 4-cell stage, 8-cell stage and morula stage 图 15 绵羊早期胚胎发育各时期PLC-γ1蛋白表达 Fig. 15 The expression of PLC-γ1 protein in early embryo development of sheep |
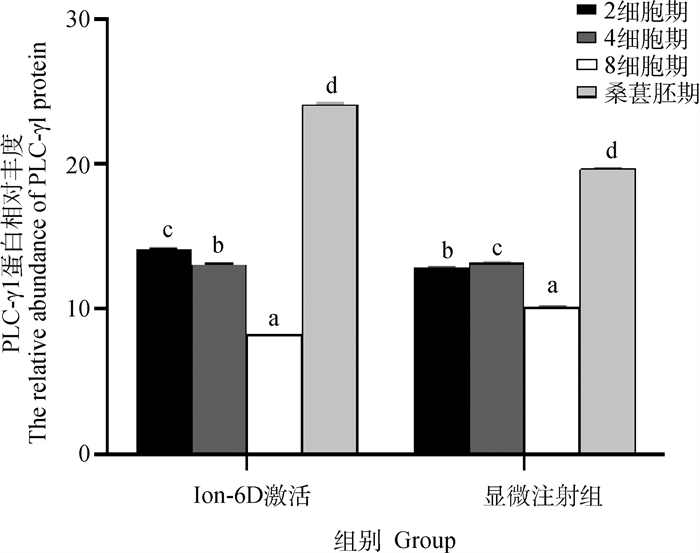
|
图 16 绵羊早期胚胎发育各时期PLC-γ1蛋白相对丰度 Fig. 16 The relative abundance of PLC-γ1 protein at different stages of early embryo development in sheep |
研究表明,PLC-γ1在许多组织中都存在广泛表达的现象,尤其是在神经细胞组织中大量表达[28-29],且对细胞的生长、繁殖,胚胎发育,癌症的发生与凋亡[30-33]等方面起着至关重要的作用。PLC对绵羊卵母细胞胞质钙振荡和早期胚胎发育影响的研究中发现,PLC在卵母细胞激活时启动Ca2+释放,促进胚胎发育,而且在早期胚胎发育过程中也引起Ca2+波动,说明PLC对胚胎发育至关重要,因此PLCγ具有相同的作用,但是PLC不同亚型之间启动不同的调控机制,实现其在信号转导通路中复杂、精密、各异的调控功能。在卵细胞成熟过程中,PLC-γ1对颗粒细胞的发育[34-35]有着重要影响,且在转基因研究上表明其调控小鼠[36]和斑马鱼[37-38]的胚胎发育,说明PLC-γ1在调控早期胚胎发育过程中有着重要作用。但其确切的作用机制仍不清楚,目前,随着生命科学的迅速发展,PLC-γ1在生殖发育中发挥的作用逐渐引起了人们的关注,特别是其对精子的发生发育、卵子受精和胚胎发育影响的研究日益成为生殖发育领域的热点。因此,对于PLC-γ1真核过表达载体的构建以及多克隆抗体的制备,都是上述研究开展的基础。
在现代生物技术的支持下,很难从组织中获取高纯度可溶性、功能性蛋白质,且天然蛋白质来源较少,很难满足生物试验的要求,因此,需要引入基因工程来实现蛋白质的体外过表达。为大量获取重组蛋白,越来越多研究人员选择使用真核和原核系统表达获取目的蛋白。本试验为能够快速灵活的制备高活性、多复杂修饰的纯化绵羊PLC-γ1蛋白,选择带有绿色荧光标记的真核过表达系统pcDNA3.1-EGFP。为减少重组质粒上的荧光蛋白对目的蛋白活性的影响,在目的片段中引入P2A序列,由于绵羊PLC-γ1蛋白没有相对应抗体,为方便鉴定,在目的片段中引入Flag标签。最终构建了pcDNA3.1-EGFP-P2A-Flag-PLC-γ1真核过表达载体。通过转染HEK-293T细胞成功表达PLC-γ1蛋白后使用Anti-Flag免疫磁珠纯化蛋白以减少非特异吸附,将表达的PLC-γ1蛋白混入弗氏佐剂免疫试验兔,ELISA测得血清效价可达1∶12 800。试验所制备的多克隆抗体会对PLC-γ1蛋白产生特异性反应,表明笔者所用的高质量的鼠源IgG1重组抗体与纳米磁珠共价偶联制备的Anti-Flag免疫磁珠所纯化的蛋白质具有良好的免疫原性,可诱导发生良好的体液免疫反应。通过与马忠臣等[39]、杨义[40]的研究结果进行对比发现,抗体产生的速率与多种因素存在直接联系,其与目的蛋白的特性,所混弗氏佐剂的剂量,所免疫试验动物物种的特性都存在着一定的关系。这在一定程度上可为动物免疫试验提供参考数据。本研究在绵羊早期胚胎细胞发育阶段通过荧光显微镜可观察到绿色荧光,表明PLC-γ1重组质粒可在绵羊早期胚胎细胞中发挥作用。且提取绵羊各时期早期胚胎的mRNA及全蛋白进行RT-qPCR及WB检测表明,PLC-γ1在绵羊早期胚胎各时期均有表达。且在绵羊早期胚胎细胞发育过程中PLC-γ1表达量在不同时期呈现出不同的趋势,表明PLC-γ1在绵羊早期胚胎细胞不同的发育阶段发挥着不同的作用。
绵羊是一种常见的家养动物,同时也经常是人类某些疾病研究的动物模型,因此,接下来的研究重点将是以绵羊卵母细胞为研究对象,进一步探索PLC-γ1蛋白对早期胚胎发育的分子机制。笔者后期打算应用基因沉默、流式分选、共聚焦监测钙离子波动等技术和方法,筛选关键的作用因子和信号通路,为探索PLC-γ1在绵羊卵母细胞中蛋白表达的作用机理提供新的理论依据,也为探索PLC-γ1通过信号通路调节卵母细胞成熟的作用机理研究提供新的理论依据,为后续一系列揭示绵羊早期胚胎发育的分子机制试验奠定基础,对动物胚胎过程的发展及提高人类辅助生殖健康具有重要意义。
4 结论本研究成功构建了PLC-γ1真核过表达载体并制备了绵羊PLC-γ1多克隆抗体,通过显微注射技术将重组质粒注入卵母细胞并实现表达,证明PLC-γ1在绵羊早期胚胎发育各时期均有表达,且具有作为新的卵母细胞激活因子的潜能。既为探索绵羊PLC-γ1基因对卵母细胞激活作用及早期胚胎发育的影响提供了科学依据,也为进一步提升绵羊的繁殖性能研究奠定了基础。
| [1] |
REBECCHI M J, PENTYALA S N. Structure, function, and control of phosphoinositide-specific phospholipase C[J]. Physiol Rev, 2000, 80(4): 1291-1335. DOI:10.1152/physrev.2000.80.4.1291 |
| [2] |
潘耀谦, 李瑞珍, 唐海蓉, 等. 家兔脑炎原虫性脑肉芽肿形成与PLCγ/PKC信号转导通路的关系[J]. 中国兽医科学, 2017, 47(12): 1588-1594. PAN Y Q, LI R Z, TANG H R, et al. Relationship between cerebral granulomatous formation caused by Encephalitozoon cuniculi and PLCγ/PKC signal transduction pathway[J]. Chinese Veterinary Science, 2017, 47(12): 1588-1594. DOI:10.16656/j.issn.1673-4696.2017.12.019 (in Chinese) |
| [3] |
刘强, 贺志锐, 王银龙, 等. 中国美利奴绵羊磷脂酶C zeta基因真核表达载体的构建及其表达研究[J]. 畜牧兽医学报, 2014, 45(4): 541-546. LIU Q, HE Z R, WANG Y L, et al. Construction eukaryotic expression vector and its expression of PLCζ gene from Chinese merino sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(4): 541-546. (in Chinese) |
| [4] |
MOCCIA F, LODOLA F, DRAGONI S, et al. Ca2+ signalling in endothelial progenitor cells: a novel means to improve cell-based therapy and impair tumour vascularisation[J]. Curr Vasc Pharmacol, 2014, 12(1): 87-105. DOI:10.2174/157016111201140327162858 |
| [5] |
STITH B J. Phospholipase C and D regulation of src, calcium release and membrane fusion during Xenopus laevis development[J]. Dev Biol, 2015, 401(2): 188-205. DOI:10.1016/j.ydbio.2015.02.020 |
| [6] |
DAI L Z, ZHAUANG L H, ZHANG B C, et al. DAG/PKCδ and IP3/Ca2+/CaMK Ⅱβ operate in parallel to each other in PLC-γ1-driven cell proliferation and migration of human gastric adenocarcinoma cells, through akt/mTOR/S6 pathway[J]. Int J Mol Sci, 2015, 16(12): 28510-28522. DOI:10.3390/ijms161226116 |
| [7] |
柳成荫. 下丘脑PLCγ/Ca2+/GnRH通路在膳食诱导肥胖引起的小鼠雄激素下降中的作用研究[D]. 沈阳: 中国医科大学, 2019. LIU C Y. Study the effect of hypothalamic PLC-γ/Ca2+/GnRH pathway on mouse testosterone decline in diet induced obesity[D]. Shenyang: China Medical University, 2019. (in Chinese) |
| [8] |
MYEONG J, KWAK M, HONG C, et al. Identification of a membrane-targeting domain of the transient receptor potential canonical (TRPC)4 channel unrelated to its formation of a tetrameric structure[J]. J Biol Chem, 2014, 289(50): 34990-35002. DOI:10.1074/jbc.M114.584649 |
| [9] |
YAMADA H, YOSHIDA M, ITO K, et al. Potentiation of glucose-stimulated insulin secretion by the GPR40-PLC-TRPC pathway in pancreatic β-cells[J]. Sci Rep, 2016, 6: 25912. DOI:10.1038/srep25912 |
| [10] |
XU X H, JIN T. The novel functions of the PLC/PKC/PKD signaling axis in G protein-coupled receptor-mediated chemotaxis of neutrophils[J]. J Immunol Res, 2015, 2015: 817604. |
| [11] |
郝肖琼, 贾方毅, 付旭阳. PLC-γ1在小鼠卵母细胞减数分裂恢复中的作用[J]. 中国比较医学杂志, 2019, 29(12): 16-22, 51. HAO X Q, JIA F Y, FU X Y. The role of PLC-γ1 in mouse oocyte meiotic resumption[J]. Chinese Journal of Comparative Medicine, 2019, 29(12): 16-22, 51. (in Chinese) |
| [12] |
陈静. TRPC3调控PLCγ/PKC/CPI-17信号通路在感染性早产中的作用及机制研究[D]. 沈阳: 中国医科大学, 2018. CHEN J. Study on the effect and mechanism of TRPC3 regulation of PLCγ/PKC/CPI-17 signaling pathway in infective premature delivery[D]. Shenyang: China Medical University, 2018. (in Chinese) |
| [13] |
WING M R, BOURDON D M, HARDEN T K. PLC-ε: a shared effector protein in Ras-, Rho-, and Gαβγ-mediated signaling[J]. Mol Interv, 2003, 3(5): 273-280. DOI:10.1124/mi.3.5.273 |
| [14] |
NAKAMURA Y, FUKAMI K. Regulation and physiological functions of mammalian phospholipase C[J]. J Biochem, 2017, 161(4): 315-321. |
| [15] |
汪军梅, 刘宇娟, 薛俊慧, 等. 转录因子HBP1通过负调控磷脂酶C-γ1基因表达抑制宫颈癌细胞的迁移[J]. 中国生物化学与分子生物学报, 2020, 36(12): 1455-1463. WANG J M, LIU Y J, XUE J H, et al. Transcription factor HBP1 inhibits the migration of cervical cancer cells by negatively regulating the expression of PLC-γ1 gene[J]. Chinese Journal of Biochemistry and Molecular Biology, 2020, 36(12): 1455-1463. DOI:10.13865/j.cnki.cjbmb.2020.10.1390 (in Chinese) |
| [16] |
WELLS A, GRANDIS J R. Phospholipase C-γ1 in tumor progression[J]. Clin Exp Metastasis, 2003, 20(4): 285-290. DOI:10.1023/A:1024088922957 |
| [17] |
KELLO M, DRUTOVIC D, CHRIPKOVA M, et al. ROS-dependent antiproliferative effect of Brassinin derivative homobrassinin in human colorectal cancer caco2 cells[J]. Molecules, 2014, 19(8): 10877-10897. DOI:10.3390/molecules190810877 |
| [18] |
MING G L, SONG H J, BERNINGER B, et al. Phospholipase C-γ and phosphoinositide 3-kinase mediate cytoplasmic signaling in nerve growth cone guidance[J]. Neuron, 1999, 23(1): 139-148. DOI:10.1016/S0896-6273(00)80760-6 |
| [19] |
LEW R R, GIBLON R E, LORENTI M S H. The phenotype of a phospholipase C (plc-1) mutant in a filamentous fungus, Neurospora crassa[J]. Fungal Genet Biol, 2015, 82: 158-167. DOI:10.1016/j.fgb.2015.07.007 |
| [20] |
QING W J, GUAN D F, MA R J, et al. Effects of trigonelline inhibition of the Nrf2 transcription factor in vitro on Echinococcus granulosus[J]. Acta Biochim Biophys Sin (Shanghai), 2017, 49(8): 696-705. DOI:10.1093/abbs/gmx067 |
| [21] |
DITTMAR T, HUSEMANN A, SCHEWE Y, et al. Induction of cancer cell migration by epidermal growth factor is initiated by specific phosphorylation of tyrosine 1248 of c-erbB-2 receptor via epidermal growth factor receptor[J]. FASEB J, 2002, 16(13): 1823-1825. |
| [22] |
SMITH M R, COURT D W, KIM H K, et al. Overexpression of phosphoinositide-specific phospholipase Cγ in NIH 3T3 cells promotes transformation and tumorigenicity[J]. Carcinogenesis, 1998, 19(1): 177-185. DOI:10.1093/carcin/19.1.177 |
| [23] |
ZHANG Q Y, YU C H, PENG S, et al. Autocrine VEGF signaling promotes proliferation of neoplastic Barrett's epithelial cells through a PLC-dependent pathway[J]. Gastroenterology, 2014, 146(2): 461-472. DOI:10.1053/j.gastro.2013.10.011 |
| [24] |
袁利明, 胡广东, 刘欣杰, 等. 绵羊磷脂酶C-γ1基因克隆及生物信息学分析[J]. 中国畜牧兽医, 2021, 48(6): 1883-1893. YUAN L M, HU G D, LIU X J, et al. Cloning and bioinformatics analysis of PLC-γ1 gene in sheep[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(6): 1883-1893. (in Chinese) |
| [25] |
LLAVERO F, ARTASO A, LACERDA H M, et al. Lck/PLCγ control migration and proliferation of interleukin (IL)-2-stimulated T cells via the Rac1 GTPase/glycogen phosphorylase pathway[J]. Cell Signal, 2016, 28(11): 1713-1724. DOI:10.1016/j.cellsig.2016.07.014 |
| [26] |
VILARINO M, RASHID S T, SUCHY F P, et al. CRISPR/Cas9 microinjection in oocytes disables pancreas development in sheep[J]. Sci Rep, 2017, 7(1): 17472. DOI:10.1038/s41598-017-17805-0 |
| [27] |
李昊. 绵羊卵母细胞体外成熟与体细胞核移植的研究[D]. 哈尔滨: 东北林业大学, 2011. LI H. The study of oocytes in vitro maturation and somatic cell nuclear transfer in sheep[D]. Harbin: Northeast Forestry University, 2011. (in Chinese) |
| [28] |
MIZUGUCHI M, YAMADA M, KIM S U, et al. Phospholipase C isozymes in neurons and glial cells in culture: an immunocytochemical and immunochemical study[J]. Brain Res, 1991, 548(1-2): 35-40. DOI:10.1016/0006-8993(91)91103-8 |
| [29] |
NUGRAHINI A D, ISHIDA M, NAKAGAWA T, et al. Trigonelline: an alkaloid with anti-degranulation properties[J]. Mol Immunol, 2020, 118: 201-209. DOI:10.1016/j.molimm.2019.12.020 |
| [30] |
JI Q S, ERMINI S, BAULIDA J, et al. Epidermal growth factor signaling and mitogenesis in Plcg1 null mouse embryonic fibroblasts[J]. Mol Biol Cell, 1998, 9(4): 749-757. DOI:10.1091/mbc.9.4.749 |
| [31] |
KASSIS J, LAUFFENBURGER D A, TURNER T, et al. Tumor invasion as dysregulated cell motility[J]. Semin Cancer Biol, 2001, 11(9): 105-117. |
| [32] |
LIAO H J, KUME T, MCKAY C, et al. Absence of erythrogenesis and vasculogenesis in Plcg1-deficient mice[J]. J Biol Chem, 2002, 277(11): 9335-9341. DOI:10.1074/jbc.M109955200 |
| [33] |
木尔扎提·阿勒腾别克. 绵羊磷脂酶C zeta(PLCζ)对绵羊卵母细胞的激活作用及早期胚胎发育的影响[D]. 石河子: 石河子大学, 2015. MUERZHATI A. Activation and influence of early embryonic development of sheep phospholipase C zeta (PLCζ) of sheep oocytes[D]. Shihezi: Shihezi University, 2015. (in Chinese) |
| [34] |
JING C B, CHEN Y, DONG M, et al. Phospholipase C gamma-1 is required for granulocyte maturation in zebrafish[J]. Dev Biol, 2013, 374(1): 24-31. DOI:10.1016/j.ydbio.2012.11.032 |
| [35] |
木尔扎提·阿勒腾别克, 刘强, 黄增文, 等. 绵羊磷脂酶C zeta基因对绵羊卵母细胞孤雌激活的初步研究[J]. 畜牧兽医学报, 2015, 46(3): 402-406. MUERZHATI A, LIU Q, HUANG Z W, et al. Preliminary study parthenogenetic activation of phospholipase C zeta (PLCζ) gene of sheep oocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(3): 402-406. (in Chinese) |
| [36] |
JI Q S, WINNIER G E, NISWENDER K D, et al. Essential Role of the tyrosine kinase substrate phospholipase C-γ 1 in mammalian growth and development[J]. Proc Natl Acad Sci U S A, 1997, 94(7): 2999-3003. |
| [37] |
LAWSON N D, MUGFORD J W, DIAMOND B A, et al. Phospholipase C gamma-1 is required downstream of vascular endothelial growth factor during arterial development[J]. Genes Dev, 2003, 17(11): 1346-1351. |
| [38] |
MA A C H, LIANG R, LEUNG A Y H. The role of phospholipase C gamma 1 in primitive hematopoiesis during zebrafish development[J]. Exp Hematol, 2007, 35(3): 368-373. |
| [39] |
马忠臣, 胡尊楠, 王震, 等. 布鲁氏菌分泌蛋白BspJ多克隆抗体的制备[J]. 中国动物传染病学报, 2020, 28(3): 61-67. MA Z C, HU Z N, WANG Z, et al. Preparation of polyclonal antibodies against Brucella secreting protein BspJ[J]. Chinese Journal of Veterinary Parasitology, 2020, 28(3): 61-67. (in Chinese) |
| [40] |
杨义. 猪JMJD3基因的克隆、表达及其蛋白功能的初步研究[D]. 石河子: 石河子大学, 2019. YANG Y. Cloning, expression of Porcine JMJD3 and preliminary functional analysis of its protein[D]. Shihezi: Shihezi University, 2019. (in Chinese) |
(编辑 郭云雁)



