2. 美国华盛顿州立大学动物科学系, 普耳曼 99164-6310
2. Department of Animal Sciences, Washington State University, Pullman 99164-6310, USA
驴(Equus asinus)是传统的役用家畜,肉质鲜美、营养丰富,其包含亚麻酸在内的多不饱和脂肪酸,种类丰富且含量高,易于被人体吸收利用[1]。广灵驴属大型驴种,其体躯粗壮、产肉性能较好、食用口感与风味俱佳,是中国的优势驴种之一[2-3]。肉的好坏和质量一般可通过嫩度、肌内脂肪(intramuscular fat, IMF) 含量、系水力、肉色、风味等指标进行综合评定,而嫩度则作为重要感官指标用来直接衡量肉品质[4]。嫩度是咀嚼肉的感觉,可以很大程度上影响和决定消费者购买选择与欲望,因此探究驴肉嫩度的调控机制具有极其重要的价值和意义。
肉质的嫩度由肌纤维(如直径、密度、类型、完整性)、结缔组织(如含量、类型及交联状况)、肌原纤维蛋白水解酶特性和肌内脂肪含量的相互交联决定[5]。这种性状同时受机体遗传、年龄、屠宰方式以及饲养手段等的影响,其中遗传对肉质嫩度具有决定性的作用。Lee等[6]分析了钙蛋白酶突变是否影响韩国牛肉嫩度,结果发现CAPN1: c.1589G>A多态性与肉嫩度和多汁性相关。目前评价肉质嫩度的方法主要有华纳-布拉茨勒剪切力(Warner-Bratzler shear force, WBSF)、肌原纤维断裂指数(myofibril fragmentation index, MFI)和纹理轮廓分析(texture profile analysis, TPA)等。Choe等[7]运用WBFS和TPA评估了猪腰肉的嫩度,而MFI基于酶促蛋白水解进行定量,是一种较WBFS更容易获得数据的测量方法,常用于测量牛肉嫩度[8]。加权共表达网络分析(weighted gene co-expression network analysis, WGCNA)是用于找寻高度相关基因模块、确定模块与模块及模块与样本表型之间关联的技术,可用来识别候选生物标记或治疗靶点[9]。Han等[10]运用WGCNA技术研究与新树鼠模型肥胖相关的基因及通路, 发现了3个与肥胖表型相关的模块与相关模块的Hub基因UBA52、AKT1、LRRK2,分析预测核糖体、溶酶体和泛素介导的蛋白水解途径可能参与了肥胖的形成。Novais等[11]利用WGCNA筛选与肉牛饲料效率相关的血清代谢物,发现在正、负离子模式下各检测到1个与剩余采食量相关的模块,功能富集分析发现视黄醇代谢与饲料效率有关。转录组学可以深入探究各种生命活动的内在分子机制,目前已被应用到各个领域[12]。代谢组学也成为了生物学研究中的一个重要组成部分,可鉴定生命体内代谢物之间以及特定基因表达变化之间的关系,探究代谢产物在不同时期与外界环境相互应答中的作用[13]。目前,关于肉质嫩度研究主要集中在鸡、羊、牛等物种上,而关于驴肉嫩度调控机制研究还鲜见报道。
本试验以广灵驴为研究对象,以剪切力和IMF为表型信息,通过WGCNA技术筛选与驴肉嫩度相关的基因及代谢物并进行联合分析,解析相应的驴肉嫩度调控机制,为广灵驴肉质嫩度分子改良和分子育种提供理论依据。
1 材料与方法 1.1 试验动物及数据获取选用广灵驴作为试验对象,选取30头在相同环境与饮食条件下生长、24~36月龄的雌性广灵驴(平均体重236.10 kg),获取途径来源于山西省忻州市繁峙县田源毛驴养殖科技发展有限公司。对动物进行屠宰后于30 min内取第12~13肋骨间的背最长肌组织,立即储存到液氮中供后续处理。本研究运用的前期转录组及代谢组样本是依据剪切力大小与肌内脂肪含量从30头广灵驴中选取的最具差异的14个样本,前期转录组及代谢组数据分析见[14-15]。为了让片段数能真实的反映转录本表达水平,采用FPKM(fragments Per kilobase per million)方法作为衡量基因表达水平的指标,FPKM计算公式如下[16]:
| $ \mathrm{FPKM}_i=\frac{X_i}{\left(\frac{l_i}{10^3}\right)\left(\frac{N}{10^6}\right)}=\frac{X_i}{l_i N} * 10^9 $ |
其中,Xi为唯一比对到基因的片段数;li为基因的长度;N为唯一比对到参考基因组的总片段数。
1.2 试验试剂及仪器石油醚为Merck级别;索氏抽提器SXT-02(上海洪纪仪器设备有限公司);MAQC-12肌肉嫩度仪(南京铭奥仪器设备有限公司);电热恒温水浴锅(上海一恒科学仪器有限公司)。
1.3 剪切力及肌内脂肪含量测定剪切力测定:参照国家标准NY_T 1180-2006《肉嫩度的测定剪切力测定法》测定驴肉剪切力。将驴肉置于80 ℃水浴锅中加热,利用温度计监测肉样中心温度,达到70 ℃后放置室温环境冷却,后用肌肉嫩度仪测定肉样的剪切力大小,设置3个样本重复。
肌内脂肪含量测定:参照国家标准GB5009.6-2016《食品安全国家标准食品中脂肪的测定》要求提取测定广灵驴背最长肌的肌内脂肪含量。利用索氏抽提仪提取驴肉肌内脂肪,溶剂为石油醚,每个样本3个重复。
1.4 基因共表达网络的构建利用R 4.1.0软件中的WGCNA 1.7.0包将14个样本的所有表达数据进行基因共表达网络分析。利用pickSoftThreshold函数计算最佳软阈值,选取无尺度网络拟合指数R2>0.8时power值最小的数为最佳power值。利用WGCNA包中的blockwiseModules函数构建共表达矩阵,相似模块合并阈值设置0.25(mergeCutHeight=0.25),TOM类型为unsigned,deepSplit = 1,每个模块内的最小基因数设置为30(minModuleSize = 30),其他参数按照默认设置。
1.5 目标模块的筛选对模块内的基因进行PCA分析,将主成分1作为模块特征向量(module eigengenes, MEs)。为筛选出与IMF和剪切力密切相关的模块,计算MEs与IMF和剪切力之间的相关系数r以及相应P值。对特异性模块进行筛选,|r|≥0.5且P≤0.05范围的模块可进行后续分析。
1.6 模块基因的GO、KEGG富集分析应用R软件中的topGO 2.40.4包对特异性模块基因进行基因本体(gene ontology, GO)功能富集分析,当P < 0.05时认为该GO条目显著富集。运用Cluster Profiler 3.16.1包进行京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)功能富集分析,当P < 0.05时认为该信号通路的富集具有显著性。
1.7 代谢组WGCNA分析代谢物共表达网络的构建是选取无尺度网络拟合指数R2>0.85时power值最小的数为最佳power值,其余步骤及参数与“1.4”部分相同,目标模块的筛选同“1.5”部分。使用美吉云平台(https://www. http://cloud.majorbio.com/)的自建数据库对目标模块内的代谢物进行人类代谢数据库(human metabolome database, HMDB)化合物分类和KEGG功能富集分析。
1.8 转录组代谢组联合分析利用KEGG数据库对目标基因进行共富集分析,通过Cytoscape 3.7.2软件中的MetScape预测联合通路中基因与代谢物互作网络图。然后用R语言cor运算基因和代谢物的Pearson相关系数,绘制相关性聚类热图并结合相关系数筛选出大于0.5的基因和代谢物,构建转录-代谢物网络。
1.9 统计分析剪切力及肌内脂肪测定数据采用Excel 2019软件进行加权平均值计算,结果以每个样品3个重复计算的平均值表示。以P < 0.05标准筛选GO和KEGG显著富集结果,对各通路中的基因及代谢物进行Pearson相关性分析,以相关性大于0.5为标准,使用R 4.1.0软件对结果进行可视化呈现。
2 结果 2.1 剪切力和肌内脂肪含量测定结果14个广灵驴背最长肌表型数据检测结果如表 1所示。从30头动物中抽取了6头具有高、低肌内脂肪含量显著差异的24月龄广灵驴和8头具有高、低剪切力显著差异的36月龄广灵驴,从表中可以看到,肌内脂肪含量与剪切力大小呈负相关。
|
|
表 1 广灵驴肉用指标相关的描述性统计 Table 1 Descriptive statistics related to indicators for meat in Guangling donkey |
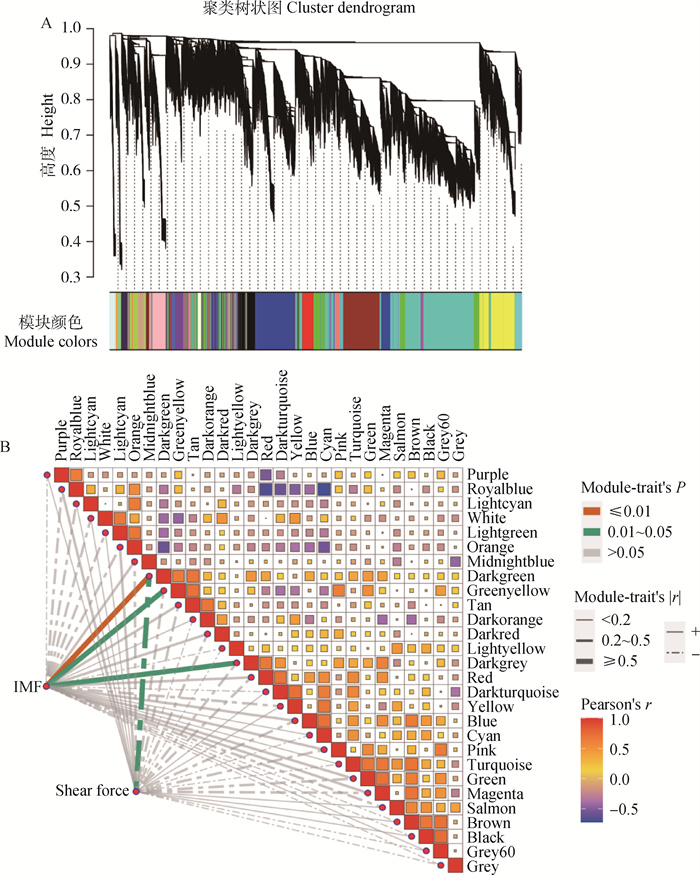
通过软阈值选择最佳β值,当power值等于5,无尺度网络拟合指数R2>0.8(图 1A)。利用TOM值进行层次聚类,通过混合动态剪切来划分模块,构建出了28个模块(图 2A),通过颜色差异区分不同模块。每个模块的详细基因数目见图 1B,其中Turquoise模块内的基因数目最多,共5 362个,White模块内的基因数目最少,为34个,其他模块数目介于43~2 779之间。

|
A.确定最佳软阈值;B.模块基因数量分布 A. Determination of optimal soft threshold; B. Number distribution of genes in modules 图 1 基因共表达网络构建 Fig. 1 Gene co-expression network construction |
|
A.基因聚类模块划分;B.IMF、剪切力与基因模块特征向量的交汇结果 A. Clustering dendrograms of genes and modules division; B. The intersection results of IMF, shear force and module Eigengene of genes 图 2 嫩度关键基因模块筛选 Fig. 2 Screening of key gene modules for tenderness |
模块与IMF和剪切力的相关性如图 2B所示,本研究以|r|≥0.5及P≤0.05为判定标准共筛选出3个关键模块。其中Darkgreen模块(r=0.73,P=0.003)含有NIT2、LST1、SOCS7、GAPT、PAPN2等95个基因;Greenyellow模块(r=0.52,P=0.05)含有LSR、MYOG、AKT1、CD5、ELOVL2等372个基因以及Darkgrey模块(r=0.56,P=0.04)含有CXCL9、CAD1、FADS6、ADH4、TSR1等73个基因,3个模块均与IMF显著正相关,Darkgreen模块(r=-0.64,P=0.01)与剪切力显著负相关。为了验证和解析模块的功能,本研究对这3个模块进行后续分析。
2.3 模块基因GO功能富集分析本研究对Greenyellow、Darkgrey以及Darkgreen三个模块进行GO功能富集分析(图 3)。Greenyellow模块显著富集到262个生物过程、37个细胞组分、53个分子功能,主要在甘油磷脂的生物合成、脂肪酸连接酶活性、脂肪酸β-氧化、脂质氧化、脂肪酸结合等功能上富集。Darkgrey模块显著富集到93个生物过程、20个细胞组分、30个分子功能,主要在羧酸生物合成过程、脂肪酸生物合成过程、G蛋白偶联受体活性、蛋白磷酸酶抑制剂活性、ATP酶调节活性等功能上富集。Darkgreen模块显著富集到105个生物过程、28个细胞组分、21个分子功能,主要在肌管分化、细胞大分子分解代谢过程、肌肉器官发育、横纹肌组织发育、肌肉细胞迁移、钙离子结合、细胞骨架蛋白结合、肌动蛋白丝结合等功能上富集。

|
图 3 Greenyellow(A)、Darkgrey(B)、Darkgreen(C)差异模块基因GO富集结果 Fig. 3 GO enrichment results of Greenyellow(A), Darkgrey(B) and Darkgreen(C) differential module genes |
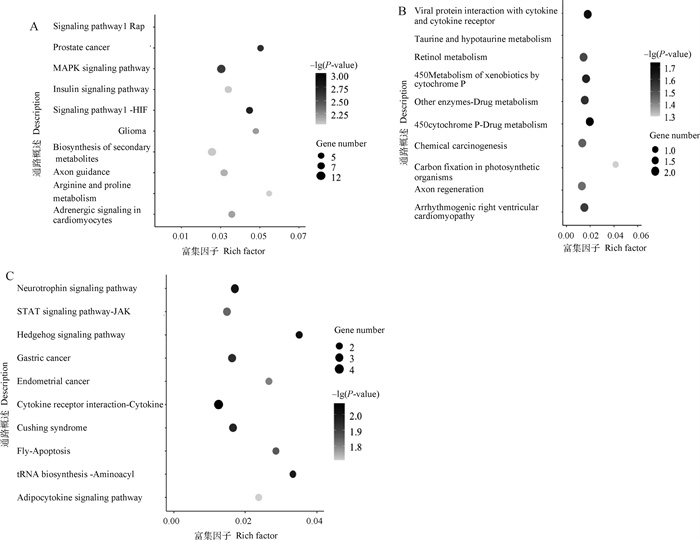
对3个模块进行KEGG功能富集分析,结果见图 4。Greenyellow模块的富集结果显示涉及267条通路,发现有40条通路被显著富集(P < 0.05),主要有HF-1信号通路、脂肪酸代谢、Wnt信号通路、IL-17信号通路以及花生四烯酸代谢等。Darkgrey模块的富集结果显示涉及89条通路,其中有9条通路被显著富集(P < 0.05),即药物代谢-细胞色素P450、病毒蛋白与细胞因子和细胞因子受体的相互作用、细胞色素P450对异生素的代谢、药物代谢-其他酶、致心律失常性右心室心肌病、视黄醇代谢、化学致癌、牛磺酸和亚牛磺酸代谢和轴突再生。Darkgreen模块富集结果显示涉及126条通路,其中有细胞因子-细胞因子受体相互作用、刺猬信号通路、神经营养因子信号通路、氨酰-tRNA生物合成、库欣综合征、胃癌、细胞凋亡、JAK-STAT信号通路、子宫内膜癌、脂肪细胞因子信号通路、甲状腺激素合成、病毒蛋白与细胞因子和细胞因子受体的相互作用、EGFR酪氨酸激酶抑制剂耐药、cAMP信号通路、致心律失常性右心室心肌病、甲状旁腺激素的合成、分泌和作用共16条通路显著富集(P < 0.05)。
|
图 4 Greenyellow(A)、Darkgrey(B)以及Darkgreen(C)模块基因Top10 KEGG富集散点图 Fig. 4 Top10 KEGG enrichment scatter plot of Greenyellow(A), Darkgrey(B) and Darkgreen(C) module genes |
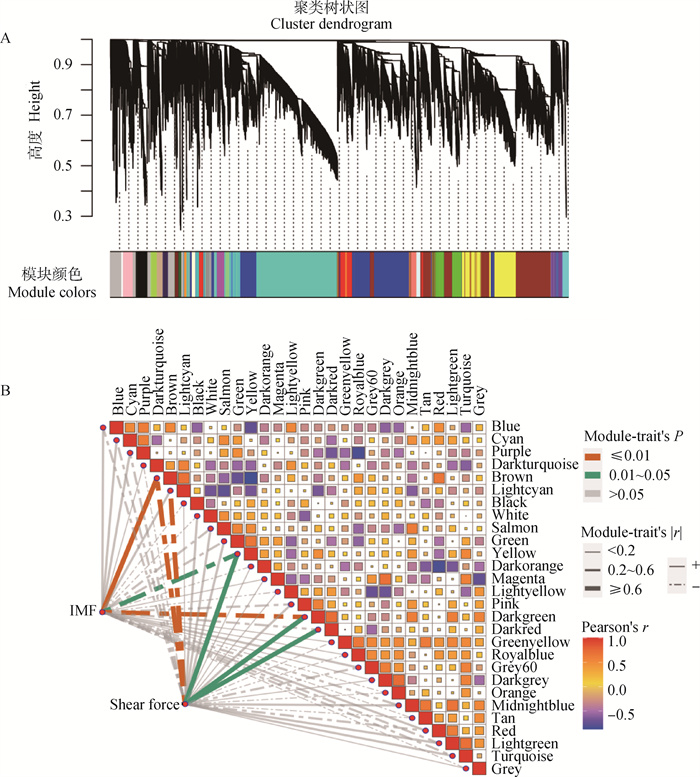
利用pickSoftThreshold函数筛选合适的软阈值,当power值为14时,R2>0.85(图 5A),层次聚类后共构建28个模块(图 6A)。各模块的代谢物数目如图 5B所示,其中Turquoise模块内的代谢物数目最多,共2 238个,White模块内的代谢物最少,为34个,其他模块介于45~1 808之间。

|
A.确定最佳软阈值;B.各模块中的代谢物数目分布 A. Determination of optimal soft threshold; B. Distribution of metabolites number in the module 图 5 代谢物共表达网络构建 Fig. 5 Metabolites co-expression network construction |
|
A.代谢物聚类及模块划分;B.IMF、剪切力与代谢物模块特征向量的交汇结果 A. Clustering dendrograms of metabolites and modules division; B. Intersection results of IMF, shear stress and metabolite module eigenvectors 图 6 代谢物关键模块鉴定 Fig. 6 Metabolites key modules identification |
代谢物模块与IMF和剪切力的相关性如图 6B所示,基于|r|≥0.5及P < 0.05选定关键模块,其中Brown模块(r=0.76,P=0.004)、Yellow模块(r=-0.63,P=0.03)以及Darkgreen模块(r=-0.72,P=0.008)与IMF显著相关。Brown模块(r=-0.79,P=0.002)、Lightcyan模块(r=-0.71,P=0.01)、Yellow模块(r=0.69,P=0.01)、Darkgreen模块(r=0.7,P=0.01)以及Darkred模块(r=0.71,P=0.01)与剪切力显著相关。然而,关键模块中的代谢物大部分无法识别,Brown、Yellow、Darkgreen、Lightcyan以及Darkred模块中代谢物分别有1 645、944、68、98、77个,其中可识别的代谢物分别有171、55、7、11、3个。Brown模块中的代谢物包括丙氨酰-赖氨酸、L-脯氨酰胺、L-酪氨酸、腺嘌呤、丙氨酰-亮氨酸、腺苷酸基琥珀酸等, Yellow模块中的代谢物包括N-乙酰-L-组氨酸、肌肽、尿烷酸、荆芥内酯、黄嘌呤酸8-O-硫酸盐等。由于Darkgreen、Lightcyan以及Darkred模块中可识别代谢物太少,因此本研究主要就Brown以及Yellow模块进行后续分析。
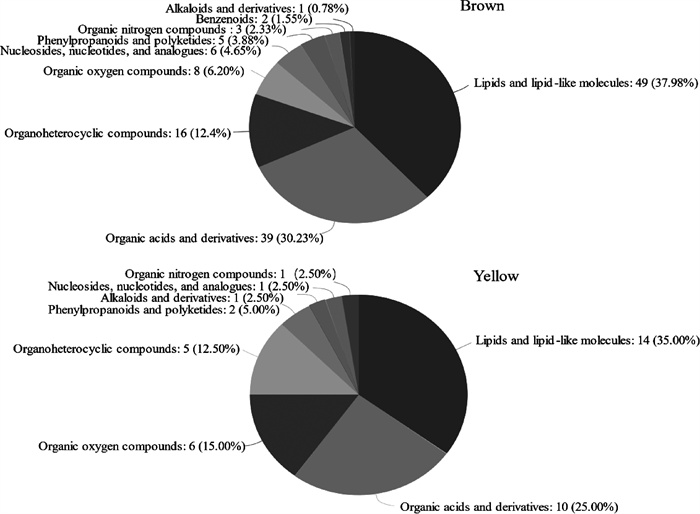
2.6 代谢物模块HMDB化合物分类将Brown和Yellow模块注释到HMDB数据库,结果如图 7所示。Brown和Yellow模块中脂质和类脂质分子占比最多(分别占37.98%和35.00%),其余的有机酸及其衍生物(分别占30.23%和25.00%)、有机杂环化合物(分别占12.40%和12.50%)以及有机氧化合物(分别占6.20%和15.00%)占比比较多。
|
图 7 Brown、Yellow模块代谢物在HMDB数据库中的分类 Fig. 7 Classification of Brown and Yellow modules metabolites in the HMDB database |
对Brown和Yellow模块内的代谢物进行KEGG功能富集分析,图 8展示了各模块富集前10的代谢通路。Brown模块共富集到96条代谢通路,其中37条通路显著富集(P < 0.05),主要有蛋白质消化吸收、谷胱甘肽代谢、FoxO信号通路、柠檬酸循环、精氨酸和脯氨酸代谢、甘油磷脂代谢等。Yellow模块共富集到28条通路,其中仅有甘氨酸、丝氨酸和苏氨酸代谢、嘌呤代谢、β-丙氨酸代谢、甘油磷脂代谢、泛酸和辅酶A生物合成、系统性红斑狼疮、组氨酸代谢、利什曼病和半胱氨酸和蛋氨酸代谢9条通路显著富集(P < 0.05)。

|
图 8 Brown、Yellow模块代谢物Top10 KEGG富集散点图 Fig. 8 Top10 KEGG enrichment scatter plot of Brown and Yellow module metabolites |
本研究对与IMF和剪切力相关模块内的基因及代谢物进行KEGG通路共富集分析,基因模块包括Darkgreen、Greenyellow及Daekgrey,共540个基因,代谢物模块包括Brown、Lightcyan、Yellow、Darkgreen及Darkred,共247个代谢物。结果发现共有81个共富集通路,其中8条(丙氨酸、天冬氨酸和谷氨酸代谢、GABA能突触、谷氨酸能突触、精氨酸和脯氨酸代谢、苯丙胺成瘾、近端小管碳酸氢盐回收、β-丙氨酸代谢以及PPAR信号通路)在KEGG通路中显著富集(P < 0.1),其中丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸和脯氨酸代谢、β-丙氨酸代谢以及PPAR信号通路可能与驴肉的嫩度相关(表 2)。
|
|
表 2 模块基因和代谢物联合KEGG功能富集分析部分通路 Table 2 The KEGG functional enrichment analysis partial pathways of modular genes and metabolites |
对4条KEGG共表达通路(丙氨酸、天冬氨酸和谷氨酸代谢、PPAR信号通路、β-丙氨酸代谢以及氨酸和脯氨酸代谢)中的基因与代谢物进行相关性分析,将Pearson相关系数绝对值大于0.5的基因与代谢物作为研究重点,发现4条共富集通路中均存在相关系数绝对值大于0.5的基因与代谢物,且各通路间具有连接性,图 9展示了共富集通路中基因与代谢物相关网络。在丙氨酸、天冬氨酸和谷氨酸代谢通路中,腺苷酸基琥珀酸与PPAT、GAD1、NIT2基因正相关性强(图 9A)。在精氨酸和脯氨酸代谢通路中,AGMAT基因与代谢物L-脯氨酸、L-谷氨酸以及高肌肽负相关,与肌酸正相关;CARNS1基因与代谢物肌酸正相关,与高肌肽负相关(图 9B)。在β-丙氨酸代谢通路中,代谢物泛酸与基因CARNS1、ACOXL负相关,与GAD1正相关;肌肽与CARNS1、ACOXL正相关,与GAD1负相关(图 9C)。在PPAR信号通路中,代谢物(9S)-羟基十八碳二烯酸与SORBS2、ACOXL基因负相关(图 9D)。

|
椭圆代表代谢物,菱形代基因,实线代表正相关,虚线代表负相关 Ellipses represent metabolites, diamonds represent genes, solid lines represent positive correlation, and dashed lines represent negative correlation 图 9 丙氨酸、天冬氨酸和谷氨酸代谢(A)、精氨酸和脯氨酸代谢(B)、β-丙氨酸代谢(C)以及PPAR信号通路(D)中基因与代谢物相关性网络图 Fig. 9 The correlation network diagram of genes and metabolites in alanine, aspartate and glutamate metabolism(A), arginine and proline metabolism(B), beta-alanine metabolism(C) and PPAR signaling pathway(D) |
嫩度评价指标直接受剪切力的数据结果影响,IMF也是影响嫩度的重要因素。本研究以剪切力和IMF为表型,通过WGCNA技术筛选与嫩度相关的候选基因,共鉴定到3个与IMF和剪切力相关的模块以及各模块中的相关基因。3个模块均与IMF正相关,Darkgreen模块与剪切力负相关,符合IMF与剪切力负相关特性。Greenyellow和Darkgrey模块内的GO和KEGG均是与IMF相关的过程及通路,例如脂质氧化、脂肪酸生物合成过程、花生四烯酸代谢等,而Darkgreen模块在GO功能富集分析上主要涉及肌肉发育及大分子降解、钙离子结合等与肌肉及钙调控相关的过程,KEGG功能富集分析则涉及到脂肪细胞因子信号通路、FoxO信号通路、MAPK信号通路等与IMF相关的信号转导。
通过WGCNA筛选与肉质嫩度相关的代谢物信息和关键模块,鉴定筛选到Brown、Yellow、Darkgreen、Lightcyan以及Darkred 5个关键模块都与剪切力显著相关,其中的Brown、Yellow、Darkgreen模块与IMF显著相关。但由于模块中的大量代谢物无法进行识别,因此只对识别出相对较多代谢物的Brown和Yellow模块进行后续分析。Brown模块内的代谢物主要有丙氨酰-赖氨酸、L-酪氨酸和腺嘌呤等。肉类的嘌呤含量相对较高,肉类摄入量增加与痛风风险增加有关,Huang等[17]在研究中发现,猪肉中的次黄嘌呤和腺嘌呤(AH)的结合含量约占总嘌呤量的90%,AH含量与4种感官特征呈负相关,包括嫩度、多汁性、油性和总体喜好程度,降低肉中两种尿酸嘌呤碱基的水平不仅有利于肉的营养价值,还能提高肉的感官接受度。Yellow模块内的代谢物主要有N-乙酰-L-组氨酸、肌肽以及尿烷酸等。动物死后肉质嫩化的主要原因是由于肉中较大蛋白质结构的蛋白质水解,因此肉中的氨基酸量可能用于指示蛋白质的水解和肉质嫩化的结果。Straadt等[18]在5种不同杂交猪种的代谢组学技术与猪肉感官知觉关系的研究中发现,丙氨酸、肌肽、酪氨酸等7种氨基酸含量与肉嫩度呈正相关。
通过WGCNA筛选的候选基因及代谢物结果与KEGG功能富集分析,发现了81条通路共富集,其中天冬氨酸、丙氨酸和谷氨酸代谢、PPAR信号通路、β-丙氨酸代谢以及精氨酸和脯氨酸代谢显著富集且与广灵驴肉质嫩度相关,进行Pearson相关性分析后发现在4个通路中均有相关的基因及代谢物。Antonelo等[19]研究了与牛肉嫩度相关代谢物及代谢途径,发现高嫩度牛肉代谢物乙酰肉碱、腺嘌呤、β-丙氨酸、缬氨酸水平显著高于低嫩度牛肉且与剪切力负相关,表示这些代谢物可能影响牛肉嫩度。在候选通路中,PPAR信号通路与哺乳动物的肉质显著相关,Fang等[20]在猪PPAR信号通路中挖掘了77个潜在功能性单核苷酸多态性(single nucleotide polymorphism, SNP),其中有13个与猪肉品质显著相关的标记SNPs,它们对脂肪含量、肉色、背膘等性状有显著影响。PPAR是核受体超家族成员,充当配体诱导的转录因子,在葡萄糖和脂质代谢中起着至关重要的作用[21],而肌内脂肪沉积直接影响肉质嫩度,因此可以推测,PPAR信号通路可介导脂肪代谢相关途径从而间接影响肉质剪切力。
在丙氨酸、天冬氨酸和谷氨酸代谢通路中,腺苷酸基琥珀酸(adenylosuccinate, S-AMP)在相关性分子中与基因GAD1、NIT2、PPAT的表达水平正相关。腺苷酸基琥珀酸是嘌呤代谢中合成AMP的前体物质,对β细胞功能障碍的逆转有重要作用[22]。有研究发现,S-AMP与AMPKγ亚基通过形成复合体增强AMPK磷酸化水平,并提高甘油三酯脂肪酶和乙酰辅酶A羧化酶的表达量和磷酸化[23]。谷氨酸脱羧酶(glutamic acid decarboxylase, GAD),是一种可催化谷氨酸脱羧转化成γ-氨基丁酸的脱羧酶,其广泛表达于脊椎动物中枢神经的神经元中,同时GAD还具有刺激胰岛素等激素分泌的作用,可增强动物食欲,提高动物机体的代谢率,促进动物生长[24]。GAD受GAD1和GAD2基因相互调控,现已发现在小鼠中GAD1是胰岛细胞表达占绝对优势的结构形式,这跟γ-氨基丁酸可与神经肽Y相互作用从而刺激食欲有关[25],然而目前还并未发现其对肉质影响的相关研究。同样地,硝化酶样蛋白2(nitrilase-like protein 2, NIT2)属于硝化酶超家族成员之一,Krasnikov等[26]通过研究确定NIT2为ω-酰胺酶,可催化谷氨酰胺和天冬氨酸转氨生成α-酮戊二酸和α-酮琥珀酸,谷氨酰胺转氨可以挽救非特异性转氨酶所产生必需氨基酸的α-酮酸。Wu等[27]利用基因组关联分析研究发现,PPAT基因在肝中的表达水平与鸡腹脂率、腹脂重显著相关。另有研究表明,在牛肉屠宰老化过程中,谷氨酰胺和丙氨酸主要集中在更嫩的牛肉中[28]。在精氨酸和脯氨酸代谢通路中,AGMAT基因与代谢物L-脯氨酸、L-谷氨酸和高肌肽负相关,与肌酸正相关;CARNS1基因结果相反。羟脯氨酸作为胶原蛋白降解的最后一步,被用作判定胶原蛋白分解代谢的特定指标[29]。在鸡屠宰后,肉质老化期间胶原溶解度、游离羟脯氨酸和蛋白水解率均增加,剪切力逐渐降低[30]。脯氨酸和谷氨酸与韩国黄牛肉质嫩度、多汁性和整体可接受性显著正相关[31]。肌酸影响着肌肉的能量代谢,补充肌酸能提升肌肉性能[32]。在此通路中L-脯氨酸、L-谷氨酸、高肌肽和肌酸可能与AGMAT、CARNS1相互作用进而影响驴肉嫩度。
在β-丙氨酸代谢通路中,代谢物泛酸与基因CARNS1、ACOXL负相关,与GAD1正相关;肌肽与CARNS1、ACOXL正相关,与GAD1负相关。肌肽在肌肽合成酶(CARNS)作用下,将β-丙氨酸和L-组氨酸连接起来。β-丙氨酸是形成肌肽的限速因子,给育肥猪喂食β-丙氨酸能提高肌肉肌肽水平和运动能力[33]。肌肽参与调控机体内的抗氧化系统,有效喂食肌肽可提高猪的抗氧化能力和肉质[34]。持续热应激破坏猪背最长肌促氧化/抗氧化平衡,肌肽含量和CARNS1 mRNA表达在30 ℃下3周后显著降低[35]。肌酸和肌肽在安格斯牛中具有中等遗传性,肌肽与牛肉整体嫩度呈负相关,风味研究发现鱼腥味与肌酐和肌肽显著负相关[36]。研究发现,辅酶A前体泛酸可以提高细胞的呼吸强度,推测泛酸可能通过提高线粒体辅酶A的含量进而增加了ATP及谷胱甘肽的含量[37]。ACOXL即酰基辅酶A氧化酶样蛋白,具有酰基辅酶A脱氢酶活性,是过氧化物酶体脂肪酸氧化的主要限速酶。李强[38]通过全基因组关联分析发现,ACOXL c.8C/T与大白猪第十肋骨处背膘厚显著关联。在PPAR信号通路中代谢物(9S)-羟基十八碳二烯酸与基因SORBS2和ACOXL负相关。SORBS2即SH3结构域包含蛋白2,是一种与Abl/Arg非受体酪氨酸激酶途径相关的支架蛋白,已知和肌动蛋白及其他几种不同类型的骨架蛋白相互作用。SORBS2可诱导原代人成纤维细胞衰老[39]。SORBS2可能通过影响细胞连接以及成纤维细胞衰老进而影响肉质嫩度。
4 结论本研究基于WGCNA技术筛选与嫩度相关的候选基因及代谢物,之后进行KEGG功能富集联合分析。发现嫩度候选基因及代谢物共富集在丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸和脯氨酸代谢、β-丙氨酸代谢以及PPAR信号通路上,说明这些通路可能对调控驴肉嫩度有重要作用。各通路上均存在Pearson相关系数大于0.5的基因及代谢物,GAD1、PPAT、NIT2、AGMAT、CARNS1、ACOXL、SORBS2以及腺苷酸基琥珀酸、L-脯氨酸、L-谷氨酸、肌酸、高肌肽、肌肽、泛酸、(9S)-羟基十八碳二烯酸可能是影响驴肉嫩度的候选基因及代谢物。本研究基于WGCNA技术以及KEGG共富集分析筛选了影响嫩度的候选基因及代谢物,为解析驴肉嫩度调控机制奠定了基础,为驴肉分子改良提供了理论依据。
| [1] |
林靖凯, 刘桂芹, 格日乐其木格, 等. 驴肉品质及其影响因素的研究进展[J]. 中国畜牧兽医, 2019, 46(6): 1873-1880. LIN J K, LIU G Q, GERELCHIMEG, et al. Research progress on quality of donkey meat and its influencing factors[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(6): 1873-1880. DOI:10.16431/j.cnki.1671-7236.2019.06.037 (in Chinese) |
| [2] |
闫俊峰. 广灵驴特性和生长规律[J]. 农业技术与装备, 2020(11): 165-166. YAN J F. Characteristics and growth law of Guangling donkey[J]. Agricultural Technology & Equipment, 2020(11): 165-166. DOI:10.3969/j.issn.1673-887X.2020.11.078 (in Chinese) |
| [3] |
曹春红. 简述广灵驴的特性[J]. 中国畜禽种业, 2020, 16(5): 79-80. CAO C H. Briefly describe the characteristics of Guangling donkey[J]. The Chinese Livestock and Poultry Breeding, 2020, 16(5): 79-80. DOI:10.3969/j.issn.1673-4556.2020.05.064 (in Chinese) |
| [4] |
KHALED A Y, PARRISH C A, ADEDEJI A. Emerging nondestructive approaches for meat quality and safety evaluation-a review[J]. Compr Rev Food Sci Food Saf, 2021, 20(4): 3438-3463. DOI:10.1111/1541-4337.12781 |
| [5] |
丰永红. 肌纤维类型影响牛肉成熟过程中蛋白降解的机制研究[D]. 北京: 中国农业科学院, 2020. FENG Y H. Mechanism and effects of muscle fiber types on proteolysis of beef during postmortem process[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020. (in Chinese) |
| [6] |
LEE S H, KIM S C, CHAI H H, et al. Mutations in calpastatin and μ-calpain are associated with meat tenderness, flavor and juiciness in Hanwoo (Korean cattle): molecular modeling of the effects of substitutions in the calpastatin/μ-calpain complex[J]. Meat Sci, 2014, 96(4): 1501-1508. DOI:10.1016/j.meatsci.2013.11.026 |
| [7] |
CHOE J H, CHOI M H, RHEE M S, et al. Estimation of sensory pork loin tenderness using Warner-Bratzler shear force and texture profile analysis measurements[J]. Asian-Australas J Anim Sci, 2016, 29(7): 1029-1036. |
| [8] |
MUNIZ M M M, FONSECA L F S, DOS SANTOS SILVA D B, et al. Identification of novel mRNA isoforms associated with meat tenderness using RNA sequencing data in beef cattle[J]. Meat Sci, 2021, 173: 108378. DOI:10.1016/j.meatsci.2020.108378 |
| [9] |
LANGFELDER P, HORVATH S. WGCNA: an R package for weighted correlation network analysis[J]. BMC Bioinformatics, 2008, 9: 559. DOI:10.1186/1471-2105-9-559 |
| [10] |
HAN Y Y, WANG W G, JIA J, et al. WGCNA analysis of the subcutaneous fat transcriptome in a novel tree shrew model[J]. Exp Biol Med (Maywood), 2020, 245(11): 945-955. DOI:10.1177/1535370220915180 |
| [11] |
NOVAIS F J, PIRES P R L, ALEXANDRE P A, et al. Identification of a metabolomic signature associated with feed efficiency in beef cattle[J]. BMC Genomics, 2019, 20(1): 8. DOI:10.1186/s12864-018-5406-2 |
| [12] |
蒋费涛, 王书平, 祁俊生, 等. 转录组学技术及其在植物系统学上的研究进展[J]. 现代盐化工, 2020, 47(4): 14-17. JIANG F T, WANG S P, QI J S, et al. Research progress of transcriptional technology and its advances in plant phylogeny[J]. Modern Salt and Chemical Industry, 2020, 47(4): 14-17. DOI:10.3969/j.issn.1005-880X.2020.04.007 (in Chinese) |
| [13] |
FIEHN O. Metabolomics-the link between genotypes and phenotypes[J]. Plant Mol Biol, 2002, 48(1-2): 155-171. |
| [14] |
李武峰, 孙瑜彤, 关家伟, 等. 驴肌内脂肪沉积关键调控因子研究[J]. 畜牧兽医学报, 2021, 52(2): 364-375. LI W F, SUN Y T, GUAN J W, et al. Key regulatory factors of intramuscular fat deposition in donkey[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(2): 364-375. (in Chinese) |
| [15] |
李武峰, 关家伟, 邱丽霞, 等. 基于转录组学和代谢组学研究调控驴背最长肌嫩度的分子机制[J]. 畜牧兽医学报, 2022, 53(3): 743-754. LI W F, GUAN J W, QIU L X, et al. Study on the molecular mechanism of regulating tenderness of Longissimus dorsi muscle of donkey based on transcriptomics and metabolomics[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(3): 743-754. (in Chinese) |
| [16] |
MORTAZAVI A, WILLIAMS B A, MCCUE K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq[J]. Nat Methods, 2008, 5(7): 621-628. DOI:10.1038/nmeth.1226 |
| [17] |
HUANG C, ZHENG M, HUANG Y Z, et al. The effect of purine content on sensory quality of pork[J]. Meat Sci, 2021, 172: 108346. DOI:10.1016/j.meatsci.2020.108346 |
| [18] |
STRAADT I K, AASLYNG M D, BERTRAM H C. An NMR-based metabolomics study of pork from different crossbreeds and relation to sensory perception[J]. Meat Sci, 2014, 96(2): 719-728. DOI:10.1016/j.meatsci.2013.10.006 |
| [19] |
ANTONELO D S, CÔNSOLO N R B, GÓMEZ J F M, et al. Metabolite profile and consumer sensory acceptability of meat from lean Nellore and Angus×Nellore crossbreed cattle fed soybean oil[J]. Food Res Int, 2020, 132: 109056. DOI:10.1016/j.foodres.2020.109056 |
| [20] |
FANG C, GUO F, ZHAO X Q, et al. Biological mechanisms of growth performance and meat quality in porcine muscle tissue[J]. Anim Biotechnol, 2021, 11: 1-9. |
| [21] |
MIRZA A Z, ALTHAGAFI I I, SHAMSHAD H. Role of PPAR receptor in different diseases and their ligands: physiological importance and clinical implications[J]. Eur J Med Chem, 2019, 166: 502-513. DOI:10.1016/j.ejmech.2019.01.067 |
| [22] |
GOODING J R, JENSEN M V, DAI X Q, et al. Adenylosuccinate is an insulin secretagogue derived from glucose-induced purine metabolism[J]. Cell Rep, 2015, 13(1): 157-167. DOI:10.1016/j.celrep.2015.08.072 |
| [23] |
王洋, 姜允嘉, 成钟, 等. 腺苷酸基琥珀酸活化AMPK抑制肝细胞内脂质蓄积的作用机制[J]. 中国医药生物技术, 2020, 15(3): 240-248. WANG Y, JIANG Y J, CHENG Z, et al. Adenylosuccinate, a metabolite in purine salvage pathway, binds to AMP-activated protein kinase (AMPK) γ subunit and enhances the metabolic efficiency of lipid[J]. Chinese Medicinal Biotechnology, 2020, 15(3): 240-248. DOI:10.3969/j.issn.1673-713X.2020.03.004 (in Chinese) |
| [24] |
袁仕善, 周智广. 谷氨酸脱羧酶若干研究进展[J]. 生理科学进展, 1998(1): 79-82. YUAN S S, ZHOU Z G. Research progress of glutamic acid decarboxylase[J]. Progress in Physiological Sciences, 1998(1): 79-82. (in Chinese) |
| [25] |
WEI J N, WU J Y. Structural and functional analysis of cysteine residues in human glutamate decarboxylase 65 (GAD65) and GAD67[J]. J Neurochem, 2005, 93(3): 624-633. DOI:10.1111/j.1471-4159.2005.03046.x |
| [26] |
KRASNIKOV B F, CHIEN C H, NOSTRAMO R, et al. Identification of the putative tumor suppressor Nit2 as ω-amidase, an enzyme metabolically linked to glutamine and asparagine transamination[J]. Biochimie, 2009, 91(9): 1072-1080. DOI:10.1016/j.biochi.2009.07.003 |
| [27] |
WU X W, ZHANG Q, XU S S, et al. Differential expression of six chicken genes associated with fatness traits in a divergently selected broiler population[J]. Mol Cell Probes, 2016, 30(1): 1-5. DOI:10.1016/j.mcp.2015.12.003 |
| [28] |
KODANI Y, MIYAKAWA T, KOMATSU T, et al. NMR-based metabolomics for simultaneously evaluating multiple determinants of primary beef quality in Japanese black cattle[J]. Sci Rep, 2017, 7(1): 1297. DOI:10.1038/s41598-017-01272-8 |
| [29] |
WU Z L, HOU Y Q, DAI Z L, et al. Metabolism, nutrition, and redox signaling of hydroxyproline[J]. Antioxid Redox Signal, 2019, 30(4): 674-682. DOI:10.1089/ars.2017.7338 |
| [30] |
VAITHIYANATHAN S, NAVEENA B M, MUTHUKUMAR M, et al. Biochemical and physicochemical changes in spent hen breast meat during postmortem aging[J]. Poult Sci, 2008, 87(1): 180-186. DOI:10.3382/ps.2007-00068 |
| [31] |
PIAO M Y, JO C, KIM H J, et al. Comparison of carcass and sensory traits and free amino acid contents among quality grades in loin and rump of Korean cattle steer[J]. Asian-Australas J Anim Sci, 2015, 28(11): 1629-1640. DOI:10.5713/ajas.15.0128 |
| [32] |
MCKENNA M J, MORTON J, SELIG S E, et al. Creatine supplementation increases muscle total creatine but not maximal intermittent exercise performance[J]. J Appl Physiol (1985), 1999, 87(6): 2244-2252. DOI:10.1152/jappl.1999.87.6.2244 |
| [33] |
ROVERATTI M C, JACINTO J L, OLIVEIRA D B, et al. Effects of beta-alanine supplementation on muscle function during recovery from resistance exercise in young adults[J]. Amino Acids, 2019, 51(4): 589-597. DOI:10.1007/s00726-018-02686-y |
| [34] |
MA X Y, JIANG Z Y, LIN Y C, et al. Dietary supplementation with carnosine improves antioxidant capacity and meat quality of finishing pigs[J]. J Anim physiol Anim Nutr (Berl), 2010, 94(6): e286-e295. DOI:10.1111/j.1439-0396.2010.01009.x |
| [35] |
YANG P G, HAO Y, FENG J H, et al. The expression of carnosine and its effect on the antioxidant capacity of Longissimus dorsi muscle in finishing pigs exposed to constant heat stress[J]. Asian-Australas J Anim Sci, 2014, 27(12): 1763-1772. DOI:10.5713/ajas.2014.14063 |
| [36] |
MATEESCU R G, GARMYN A J, O'NEIL M A, et al. Genetic parameters for carnitine, creatine, creatinine, carnosine, and anserine concentration in longissimus muscle and their association with palatability traits in Angus cattle[J]. J Anim Sci, 2012, 90(12): 4248-4255. DOI:10.2527/jas.2011-5077 |
| [37] |
SLYSHENKOV V S, DYMKOWSKA D, WOJTCZAK L. Pantothenic acid and pantothenol increase biosynthesis of glutathione by boosting cell energetics[J]. FEBS Lett, 2004, 569(1-3): 169-172. DOI:10.1016/j.febslet.2004.05.044 |
| [38] |
李强. 猪生长速度和背膘厚性状候选基因SNP筛查及其关联分析[D]. 武汉: 华中农业大学, 2016. LI Q. SNP detection and association analysis of growth rate and backfat thickness in pigs[D]. Wuhan: Huazhong Agricultural University, 2016. (in Chinese) |
| [39] |
LIESENFELD M, MOSIG S, FUNKE H, et al. SORBS2 and TLR3 induce premature senescence in primary human fibroblasts and keratinocytes[J]. BMC Cancer, 2013, 13: 507. DOI:10.1186/1471-2407-13-507 |
(编辑 郭云雁)



