牦牛是主要生活在高海拔地区的一类珍稀物种,被誉为“高原之舟”[1]。作为青藏高原的唯一大型哺乳动物,牦牛不仅为当地居民提供肉和奶,还被用作贸易运输的工具。牦牛的皮、毛、绒及角也都具有一定的经济价值,为高原牧民提供了生活必需品与经济支撑[2]。然而,牦牛的繁殖率普遍偏低,成年母牦牛的繁殖率多为两年一胎,甚至三年一胎[3]。这种较低的繁殖率除了由于牦牛自身的性成熟较晚、生殖发育缓慢、生长周期较长以外,营养水平、环境因素、科学的管理模式、发情配种和疾病都会直接或间接影响繁殖率[3-4]。近年来,虽然国内外的研究者已经对牦牛繁殖方面进行了深入的研究,但是对于围产期的研究鲜有报道。围产期是经产母畜极为重要的时期,一般界定为妊娠第31周到产后4周,即产前28天至产后28天[5]。在围产期,经产母畜机体的任何异常变化,都会直接或间接地影响其健康状况与繁殖性能[6]。基于前期的研究可知,经产牦牛在围产后期发生了能量负平衡,其酮体含量升高,并且对生殖激素的分泌存在一定的影响[7]。另外也有研究者发现,在围产期对牦牛进行不同程度的补饲,可提高牦牛的繁殖率和犊牛的生长性能[8-9]。但是繁殖率的提高是参差不齐的,而且补饲提高繁殖性能的具体机制是不清楚的。这是由于缺乏牦牛围产期机体代谢的基础资料。
代谢组学作为系统生物学的重要组成部分,能够对比分析不同病理、生理状态下的代谢图谱,从而揭示疾病机制。液相色谱-质谱(liquid chromatography mass spectrometry,LCMS)技术作为代谢组学主要技术平台之一,不仅分离度与灵敏度高、样品预处理简单[10-11],还能够对样本进行灵敏和全面的评估[12]。Liu等[13]应用LCMS技术对牦牛瘤胃菌群和代谢产物之间的关系进行了研究,不仅得到了不同饲料对应的瘤胃菌群类型,还通过分析揭示了饲料类型是如何改变瘤胃代谢的产物和模式的。Yang等[14]也利用LCMS技术对比了包括牦牛在内的几种产奶动物的乳汁差异代谢组学,结果发现了各种动物乳汁中的特有代谢物,以及这些乳汁中独特的代谢机制。LCMS实际上广泛的应用于人类、动物和植物,不仅能够获得有价值的标志物,还能够推测构建网络代谢机制。
本研究应用LCMS技术筛选经产母牦牛围产后期各时期的代谢物表达谱,结合生物信息学分析,旨在阐明经产母牦牛围产后期动态的代谢情况,并通过代谢物的功能挖掘,构建其代谢网络以及其对生殖激素影响的机制。
1 材料与方法 1.1 试验动物的选择和分组试验自4月起在青海省海北藏族自治州海晏县随机选取经产牦牛8头,所选牦牛年龄、胎次和体况均相近,饲养管理方式为自由放牧,且无任何补饲措施。自牦牛分娩之日起,每隔7 d采集1次血液,并根据时间点进行分组,分别为分娩日(A组)、产后7天(B组)、产后14天(C组)、产后21天(D组)和产后28天(E组)。试验母牦牛基本信息见表 1。
|
|
表 1 试验母牦牛基本信息 Table 1 The information of female yaks for test |
采用颈静脉采血的方法,采集全血,不加任何抗凝剂。室温静置3 h后,收集血清。3 000 r·min-1离心5 min,提取上清液,-80 ℃保存。
1.3 样品前处理取100 μL或100 mg样品,液氮研磨,加入3倍体积的lysis buffer(80%甲醇),涡旋混匀,组织破碎仪45 Hz研磨处理4 min,超声5 min(冰水浴)。于-20 ℃静置30 min,14 000 g离心30 min,取上清,用0.45 μm的滤膜过滤,待上机。取上清20 μL于进样瓶中上机检测。所有样品另取等量上清混合成质控(quality control,QC)样品上机检测。
1.4 质谱鉴定样品按仪器要求上高效液相色谱仪(Thermo,系统:Thermo ScientificTM DionexTM ltiMateTM 3000 Rapid Separation LC (RSLC))检测,其中质谱系统为Thermo,型号:Q Exactive。Loading Pump流速0.25 mL·min-1,20 min。流动相参数设置见表 2,离子源参数为喷雾电压2 500 V,毛细管温度320 ℃,离子源为HESI;质谱采用70000 FWHM方法,全扫描目标为3e6,全扫描最大值100 ms,扫描范围为100~1 500 m·z-1;二级质谱采用17500 FWHM方法,目标和最大值分别为1e5和50 ms。
|
|
表 2 流动相参数设置 Table 2 Mobile phase parameters setting |
原始数据经过归一化及降噪处理后,进行数据库检索。数据库包括METLIN数据库(https://metlin.scripps.edu)、Human Metabolome Database数据库(https://metlin.scripps.edu)和ChemSpider数据库(www.chemspider.com)。将质谱检测得到的原始文件(.uep)导入Progenesis QI 2.3 (PQI)软件中,对不同样品根据保留时间偏差0.2 min和质量偏差5 ppm进行数据对齐,CV(coefficient of variance)值30%、信噪比3、最小信号强度100 000、加和离子等信息进行峰提取反褶积,峰值提取。对峰面积进行定量,再整合目标离子,然后通过分子离子峰和碎片离子进行分子式的预测并与数据库进行比对,对定量结果进行归一化和标记矩阵的生产和识别,最后得到数据的鉴定和定量结果。
1.6 差异代谢物的筛选为了更好的显示经产母牦牛围产期代谢的动态变化,试验筛选每2个时间点之间的差异代谢物,旨在构建经产母牦牛在围产后期的代谢情况。试验采用多元统计分析的方法,在最大程度保留原始信息的基础上对采集的多维数据进行降维和回归分析,然后进行差异代谢物的筛选及后续分析。主要包括主成分分析(PCA)、偏最小二乘判别分析(PLS_DA)和正交偏最小二乘判别分析(OPLS-DA)。通过计算第一主成分的变量投影重要度(variable importance in projection,VIP)值以及差异性(P值)和差异倍数进行差异代谢物的筛选。
1.7 差异代谢物的生物信息学分析试验对筛选的差异代谢物进行KEGG(Kyoto Encyclopedia of Genes and Genomes)功能注释、HMDB(Human Metabolome Database)注释和LIPID注释分析。KEGG功能注释主要通过信号通路挖掘代谢物参与的主要生化代谢路径和信号转导途径,数据库网址https://www.genome.jp/kegg/;HMDB注释是与人类相关的小分子代谢物的详细信息,虽然人类与牦牛物种之间有所差异,但是HMDB的注释可以在一定程度上帮助理解代谢物的主要功能,数据库网址https://hmdb.ca/;LIPID注释主要用于挖掘脂质类的差异代谢物的结构和功能;应用的数据库为LIPID MAPS Structure Database(LMSD),网址http://www.lipidmaps.org/data/structure/。3个数据库的结合可以更好的构建经产母牦牛围产后期的动态代谢变化。
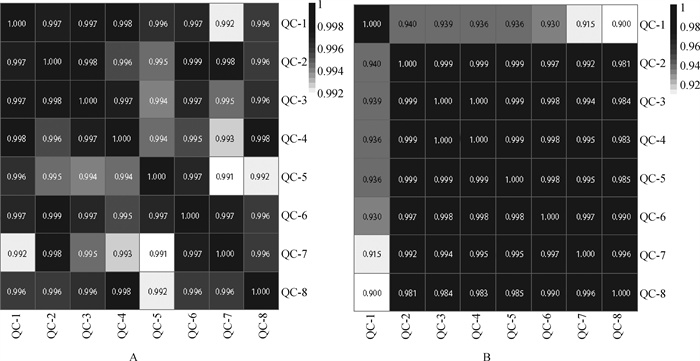
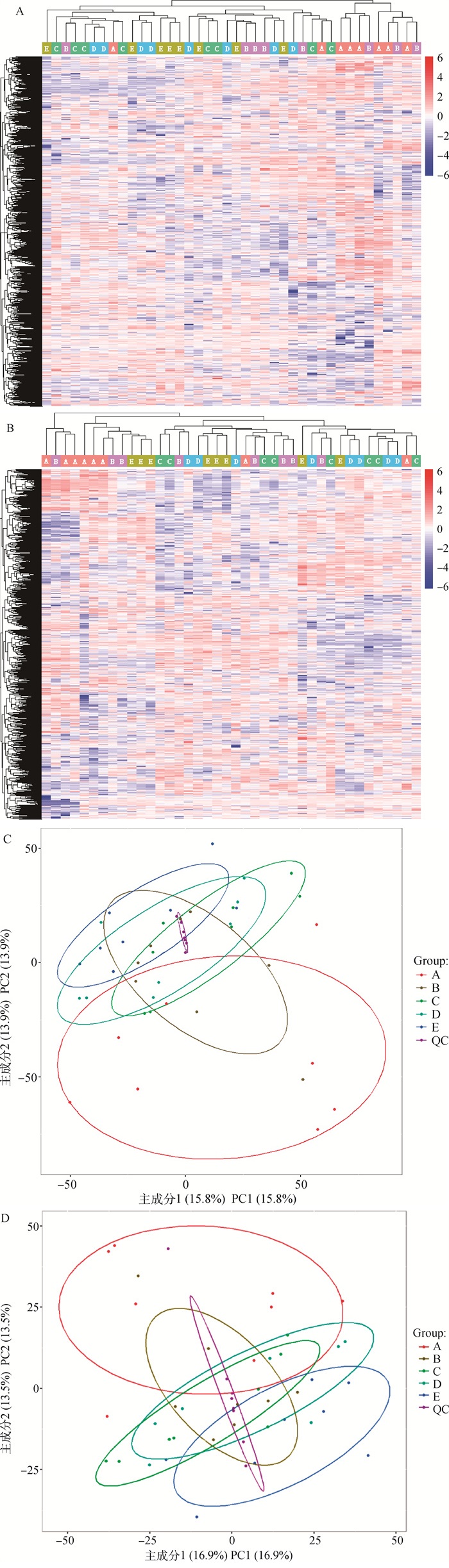
2 结果 2.1 LCMS质谱鉴定结果试验对正、负离子模式下的QC样本进行了相关性分析,结果发现,负离子模式下QC样本之间均无显著性差异,且相关性显著(图 1),正离子模式下QC样本之间虽无完全相关,但相关性均高于0.99。LCMS联用在正离子模式下检测到5 801个代谢物信号,其中2 841种代谢物得到定性分析结果。负离子模式下检测到2 813个代谢物信号,其中1 326种代谢物得到定性分析结果。定性鉴定代谢物的聚类分析和PCA分析结果见图 2。
|
A.正离子模式下QC样品之间的相关性;B.负离子模式下QC样品之间的相关性 A. The correlation between QC samples in positive ion mode; B. The correlation between QC samples in negative ion mode 图 1 QC样品相关性分析 Fig. 1 Correlation analysis of QC samples |
|
A, C.分别为正离子模式下代谢物的聚类分析和PCA分析;B, D. 为负离子模式下代谢物的聚类分析和PCA分析 A, C. Cluster analysis and PCA analysis of metabolites in positive ion mode; B, D. Cluster analysis and PCA analysis of metabolites in negative ion mode 图 2 定性鉴定代谢物的聚类分析和PCA分析结果 Fig. 2 The results of cluster analysis and PCA analysis of metabolites qualitatively identified |
试验对差异代谢物的筛选标准为:1)根据原始数据进行每两个时间点的T-test统计分析,计算P值,P < 0.05为统计学意义的差异;2)差异倍数(Fold change,FC),根据原始数据进行每两个时间点的相对定量均值的比值来计算FC,设定FC>2.0或FC < 0.5为本试验的FC阈值;3)VIP值的计算,根据对原始数据进行多元统计分析计算VIP值,设置阈值为VIP>1.0。
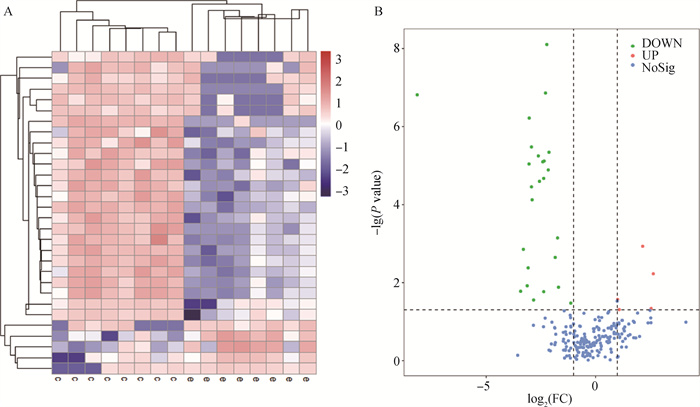
根据设置的阈值进行差异代谢物的筛选,在正离子模式下筛选出差异代谢物共65个,其中4个重复结果,故为61种差异代谢物;负离子模式下筛选的差异代谢物共57个,其中1个重复结果,故为56种差异代谢物。整合结果共筛选出122个差异代谢物,除去重复的结果,共获得117种差异代谢物。图 3是以E组和C组为例的对比分析结果。
|
A. E组和C组的聚类分析;B. E组和C组差异代谢物的筛选 A. Cluster analysis of group E and C; B. Screening of differential metabolites in group E and C 图 3 E组和C组的聚类分析和差异代谢物的筛选 Fig. 3 Cluster analysis of group E and C and screening of differential metabolites |
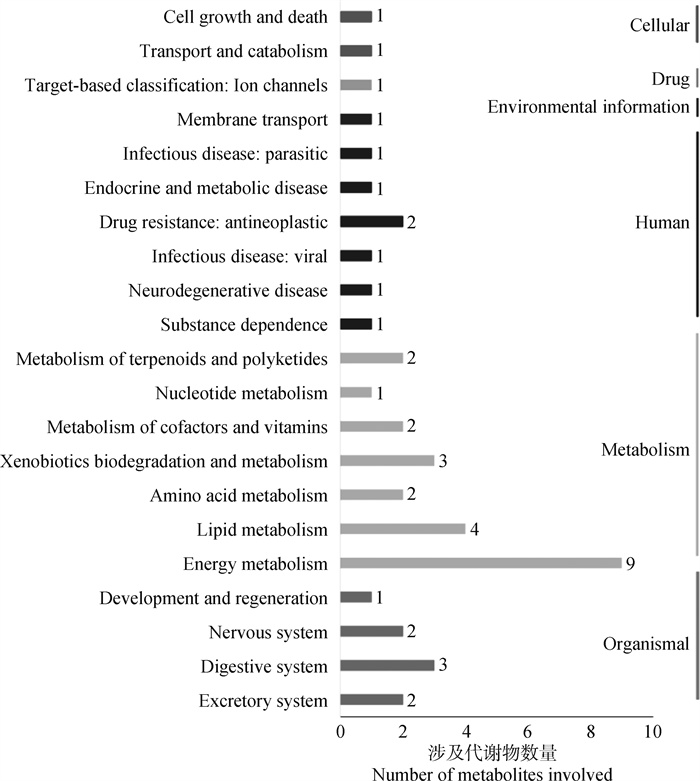
2.3.1 KEGG数据库功能分析 试验对117种差异代谢物进行KEGG数据库检索,结果得到21个信号通路,归属于6个分类,包括细胞过程(cellular process)、药物开发(drug development)、环境信息处理(environmental information processing)、人类疾病(human diseases)、新陈代谢(metabo -lism)和生物系统(organismal systems)(图 4)。
|
图 4 差异代谢物的KEGG功能注释 Fig. 4 KEGG function annotation of differential metabolites |
2.3.2 HMDB数据库分析 试验对117种差异代谢物进行HMDB数据库检索,结果得到11个结果,包括脂质和类脂分子(lipids and lipid-like molecules)、有机杂环化合物(organoheterocyclic compounds)、有机酸及其衍生物(organic acids and derivatives)、苯环型化合物(benzenoids)、有机氧化合物(organic oxygen compounds)、苯丙烷和聚酮(phenylpropanoids and polyketides)、有机氧化合物(organooxygen compounds)、生物碱及其衍生物(alkaloids and derivatives)、核苷、核苷酸和类似物(nucleosides, nucleotides, and analogues)、有机氮化合物(organic nitrogen compounds)和木脂素、新木脂素及相关化合物(lignans, neolignans and related compounds)(图 5)。

|
图 5 差异代谢物的HMDB功能注释 Fig. 5 HMDB functional annotation of differential metabolites |
2.3.3 LMSD脂类注释分析 试验对117种差异代谢物进行LMSD数据库检索,结果得到13个结果,包括类固醇(steroids)、分泌腺(secosteroids)、神经酰胺(ceramides)、黄酮类化合物(flavonoids)、芳香聚酮(aromatic polyketides)、甘油磷酸胆碱(glycerophosphocholines)、甘油磷酸乙醇胺(glycerophosphoethanolamines)、脂肪酸和共轭物(fatty acids and conjugates)、脂肪酯(fatty esters)、脂肪酰胺(fatty amides)、二十烷酸(eicosanoids)、脂肪醇(fatty alcohols)和含氧碳氢化合物(oxygenated hydrocarbons)(图 6)。
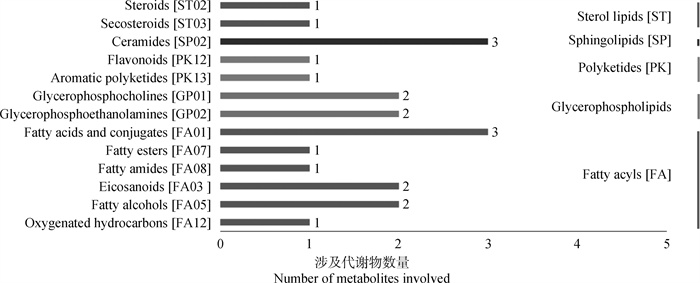
|
图 6 差异代谢物的LMSD功能注释 Fig. 6 LMSD functional annotation of differential metabolites |
根据对差异代谢物的筛选和生物信息学分析结果,筛选出与繁殖、脂类代谢和氨基酸代谢相关的关键差异代谢物30个,通过归类筛选出18种关键代谢物(表 3)。其中,随时间推移表达上调的有9种,表达下调的有6种,表达不规则的有3种。
|
|
表 3 筛选的关键差异代谢物 Table 3 Key differential metabolites screened |
与繁殖性能相关的有3种,包括随时间推移表达上调的β-皮质醇(beta-cortol,Cor)和四氢皮质醇(tetrahydrocortisol,TH-Cor),表达下调的真菌毒素T2(mycotoxin T2,MT2);与脂类代谢相关的有7种,包括随时间推移表达上调的磷脂酰丝氨酸(phosphatidylserine,PS)和甘油三酯(triglyceride,TG),表达下调的丙酸(propanoic acid,Pac)、13S羟基十八碳二烯酸(13S-hydroxyoctadecadienoic acid,13-HODE)和9S羟基十八碳二烯酸(9S-hydroxyoctadecadienoic acid,9-HODE),表达不规则的磷脂酰胆碱(phosphatidylcholine,PC)和磷脂酰乙醇胺(phosphatidylethanolamine,PE);与氨基酸代谢相关的有8种,包括随时间推移表达上调的精氨酰苯丙氨酸(arginyl-Phenylalanine,Arg-Phe)、D-谷氨酸(D-glutamic acid,D-Glu)、γ-谷氨酰半胱氨酸(gamma-glutamylcysteine,Gln-Cys)、甘氨酸(glycylleucine,Gly)和吲哚丙酮酸(indolepyruvate,Ipa),表达下调的5-甲氧基色氨酸(5-methoxytryptophol,Trp)和酪氨酸苯丙氨酸(tyrosyl-phenylalanine,Tyr-Phe),表达不规则的色氨酸谷氨酰胺(tryptophyl-glutamine,Trp-Gln)。
根据筛选的关键代谢物及其生物信息学的功能挖掘,试验构建了经产母牦牛围产期代谢情况,以及对生殖激素的影响(图 7)。根据代谢物随时间变化的趋势,模拟在围产后期相应代谢过程的动态变化(图 8)。
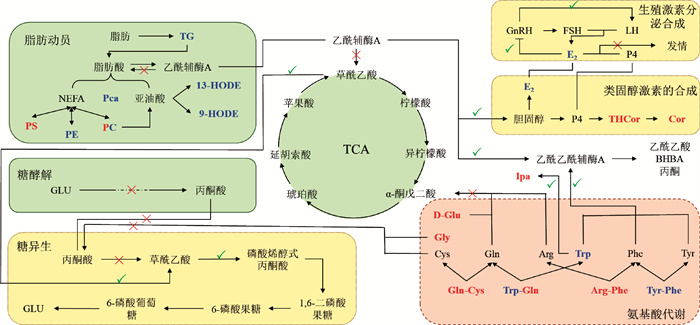
|
图中蓝色字体代谢物表示随着时间的推移表达下调,红色字体代谢物表示表达上调,既存在蓝色字体又存在红色字体的代谢物表示随着时间的推移发生不规则变化;“×”表示通路受阻;“√”表示通路顺畅;“→”表示代谢物的转化和生成;“─┄→”表示通路部分步骤省略;“┤”表示代谢物抑制作用 In the figure, the metabolites in blue font indicate the down-regulation of expression over time, and the metabolites in red font indicate the up-regulation of expression; The metabolites in both blue font and red font indicate irregular changes over time; "×" indicates that the access is blocked; "√" indicates smooth access; "→" indicates the transformation and generation of metabolites; "─┄→" indicates that the steps of the passage are omitted; "┤" indicates metabolite inhibition action 图 7 围产后期动态代谢网络机制 Fig. 7 Mechanism of dynamic metabolic network in late perinatal period |
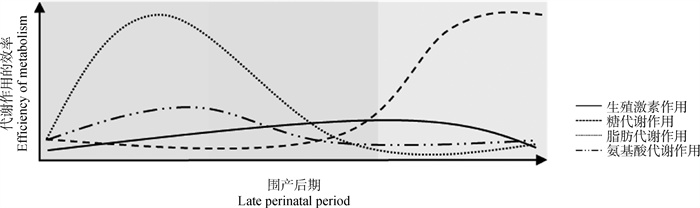
|
图 8 围产后期动态代谢作用 Fig. 8 Mechanism of dynamic metabolic in late perinatal period |
葡萄糖是动物机体主要的能量来源[15],葡萄糖的代谢一般分为无氧条件下的糖酵解过程和有氧条件下的三羧酸循环(tricarboxylic acid cycle;TCA),这两个代谢途径均能分解葡萄糖产生能量,以供给机体的正常生理需要[16]。葡萄糖在糖酵解的作用下产生丙酮酸,丙酮酸的出路主要有两个,其中一个就是进入TCA,进一步分解产生能量供给机体。丙酮酸的另一条出路是糖异生,糖异生是葡萄糖合成的主要机制。母畜在分娩日由于分娩给机体带来的能量消耗而导致血糖含量的降低,这在奶牛中早已被证实[17-18]。当机体血糖含量降低时,糖酵解和TCA过程效率降低,机体就会启动葡萄糖的合成机制,用以提供能量[19]。但是,当糖酵解过程效率降低时,产生的丙酮酸也会随之降低,糖异生过程的主要原料不足,葡萄糖的合成受阻。有研究报道[20],母牛产后因采食量降低和泌乳增加,其体内糖异生过程被抑制,从而引起血糖稳态失衡[21]。随着葡萄糖供能效率的降低,TCA过程中的草酰乙酸发生积累,草酰乙酸是糖异生过程中丙酮酸的下游代谢物,机体的草酰乙酸则会直接进入糖异生,开始合成葡萄糖。而这一过程可能导致母牦牛围产后期葡萄糖呈现先降低后升高的趋势,这与前期的研究结果相一致[7]。
3.2 母牦牛围产后期的脂类代谢试验结果发现,TG,脂肪酸中的Pca,游离脂肪酸的一类甘油磷脂代谢物PS、PE、PC,以及脂肪酸中亚油酸的代谢物13-HODE和9-HODE等7种代谢物,在5个不同的时间点之间表现出了差异性。脂肪是动物主要能量储藏形式,主要以TG的形式存在。随着时间的推移,TG下调,这说明母牦牛在围产后期发生了脂肪动员。当机体主要能量来源受阻时,为了获取更多能量维持自身需求,便会动员脂肪以提供能量[22]。
大量脂肪被动员后,首先被分解为脂肪酸,Pca和亚油酸都属于脂肪酸的一种。Pca是一种三碳短链脂肪酸,能够维持肠道和免疫稳态[23]。作为脂肪酸,它能够直接影响脂肪细胞调节脂肪酸的代谢[24]。亚油酸属于不饱和脂肪酸家族的一员,13-HODE和9-HODE是亚油酸的衍生物[25]。在人类的研究中发现,与健康女性相比,患有多囊卵巢综合症的女性血液中13-HODE和9-HODE水平升高,说明这两种代谢物与生殖机能有关[26]。但是,在牦牛的研究中未见相关的报道。在本研究中,13-HODE和9-HODE随着时间的推移表达下调,说明以其上游代谢物亚油酸和Pca为代表的脂肪酸在围产后期的末期开始降低,推测脂肪动员可能在围产后期的前期作用效率较高,直到中期开始降低,末期恢复糖代谢供能后,脂肪动员恢复正常。另外,发现几种甘油磷脂随着时间的推移表现不同的表达情况。甘油磷脂包含1个极性的磷酸头部基团和1个或2个非极性脂肪酰基尾部基团,是所有活体细胞膜的主要成分[27]。甘油磷脂与脂肪酸之间可以通过水解合成作用相互转化,与此同时,甘油磷脂之间也可以相互转换。本研究中,3类甘油磷脂分别表现上调和下调,PC更是表现为先上调后下调,结果说明脂肪代谢在产后母牦牛机体内发生变化,作为机体能量供给不足时的能量补充机制发挥了作用。
脂肪酸经过反应生成乙酰辅酶A,乙酰辅酶A能够进入TCA进行完全氧化,也可以通过脂肪酸代谢的逆方向合成脂肪酸[28]。然而,在母牦牛围产后期,乙酰辅酶A的这两条出路由于糖代谢的停滞以及脂肪的过度动员都不能进行,为了提供能量,乙酰辅酶A可以转化为乙酰乙酰辅酶A,进而形成酮体,即乙酰乙酸、β-羟丁酸和丙酸[29]。酮体作为奶牛在围产期发生能量负平衡的金标准,在牦牛的前期研究中也报道过。
本研究筛选的与脂类代谢相关的关键代谢物,通过构建网络机制发现,脂类代谢在母牦牛围产后期的前期为了提供能量,启动脂肪动员。过度的脂肪动员产生了乙酰辅酶A,进一步反应产生了酮体,以供给牦牛机体能量需求。说明母牦牛围产后期发生了严重的能量负平衡。
3.3 母牦牛围产后期的氨基酸代谢机体发生能量缺口时,蛋白质代谢也为机体提供能量[30]。氨基酸是蛋白质的基本单位,可以分为生糖氨基酸和生酮氨基酸。
3.3.1 生糖氨基酸 生糖氨基酸主要通过作用于丙酮酸或α-酮戊二酸,本试验结果中发现了Gln-Cys复合体,其中Cys就是作用于丙酮酸的生糖氨基酸。Cys是一种非必需中性氨基酸,为三羧酸循环提供碳源[31]。另外一个作用于丙酮酸的生糖氨基酸是Gly,它在分解过程中经过氨基酸脱氨基、转氨基,再经氧化分解生成二氧化碳和水[32]。Gln-Cys复合体中Gln是作用于α-酮戊二酸的生糖氨基酸,其通过分界代谢和谷氨酸脱氢酶转化为α-酮戊二酸参与TCA [33]。Arg-Phe中的Arg是作用于α-酮戊二酸的生糖氨基酸,Arg通过脱氨基作用转变为糖异生途径的中间产物,从而异生成葡萄糖。D-Glu同样是作用于α-酮戊二酸的生糖氨基酸,它能够被氧化后在转氨基作用下生成α-酮戊二酸进入TCA [34]。
试验发现的生糖氨基酸及氨基酸复合体均表达上调,说明机体在血糖较低的情况下,机体氨基酸代谢效率升高用以补充血糖。但是由于围产后期的起初糖异生和TCA作用效率过低,生糖氨基酸并没有发挥作用发生积累导致的升高。
3.3.2 生酮氨基酸 本试验结果还发现了Trp和Tyr-Phe复合体,它们均为生酮氨基酸,其中Phe和Trp还分别从Arg-Phe和Trp-Gln复合体中被发现了。生酮氨基酸可直接作用于乙酰乙酰辅酶A,进而生成酮体。Trp作为必需氨基酸之一,是机体无法合成的,需要通过食物来获得。Trp经过催化和甲酰化酶等一系列水解作用形成丙酮酸,丙酮酸脱羧生成乙酰乙酸[35];Tyr是一种含有酚羟基的芳香族极性氨基酸[36],Tyr通过各种代谢催化后生成尿黑酸,再通过氧化和水解作用下合成延胡索酸和乙酰乙酸[37-38];Phe是哺乳动物必需的氨基酸,是蛋白质生物合成的底物[39],它能够通过酪氨酸转氨酶催化后生成乙酰乙酸[40]。
本试验发现既存在表达上调的生酮氨基酸及氨基酸复合体,也存在表达下调的生酮氨基酸及氨基酸复合体。Phe与其他生酮氨基酸表达相反可能是由于在产后初期,与Arg结合的复合体利用Arg的生糖功能大量产生,但机体没有启动糖异生所产生的累积导致的。Tyr与Trp表达下调,说明其参与了脂肪动员启动,产生的乙酰辅酶A大量的转化为酮体,以给机体提供能量。
3.4 母牦牛围产后期生殖激素的合成与分泌围产后期生殖激素的分泌与合成不仅能够反映母牦牛的生殖系统恢复情况,也在一定程度上决定了母牦牛下一次妊娠的时间。围产期经产母牦牛由于能量的流失,糖代谢发生障碍,过度的脂肪动员使机体产生酮体供给能量,发生了能量负平衡。与此同时,由于脂肪的过度动员产生的乙酰辅酶A也有部分在循环血液中形成了部分胆固醇。类固醇激素(甾体激素)是由胆固醇经过一系列酶解反应产生的一类环脂肪烃化合物,主要包括糖皮质激素、盐皮质激素和性腺皮质激素[41]。循环血液中的胆固醇主要作用于性腺,对性腺产生配子及分泌激素起着至关重要的作用[42]。有研究证实,胆固醇被催化合成类固醇激素后可进行机体代谢过程,而此时可生成皮质醇和孕酮[43-44]。在小鼠的研究中发现,严重控制饮食后,肾上腺皮质细胞中胆固醇转为类固醇激素的代谢通路活跃,大量合成皮质醇以此适应外界应激[45]。这些也与本研究的结果相一致,代谢组学结果显示作为产生P4的终端产物THCor和Cor在D和E两个时间点分别显著性升高,说明P4在后期开始形成并产生终端产物。另一方面,胆固醇也可以形成E2。E2作为最主要的雌性激素,其合成过程受到多种蛋白的共同调控作用[46]。作为卵巢类固醇激素的E2,在作用于中枢神经系统后,可与P4协同促进子宫发育并诱导母畜发情[47-48]。另外,在差异代谢物的结果中还发现了MT2,有多个研究报告指出,奶牛产奶量和乏情都与MT2有关[49]。但是相关机制尚不清楚。
根据研究结果可以推测,过度脂肪动员后产生的乙酰辅酶A除了大量产生酮体以外,少部分形成了胆固醇,而仅有的胆固醇形成了P4导致最终产物THCor和Cor的上调。但是,胆固醇并没有过多的形成E2,这一推测也与前期的研究结果相一致[7]。母牦牛在围产后期,调节发情的主要生殖激素浓度不对等,这可能是经产母牦牛产后生殖系统恢复困难、产犊间隔过长的主要原因之一,具体的发生机制还需要进一步验证。
4 结论本研究对经产母牦牛围产后期血液代谢谱进行分析,通过关键代谢物的筛选及生物信息学分析发现,经产母牦牛围产后期发生能量负平衡,糖代谢、脂类代谢和氨基酸代谢发生不同程度的代谢障碍,对生殖激素的合成和分泌造成影响,导致产后生殖系统恢复困难,但具体机制需要进一步验证。本研究结果为高原地区母牦牛营养代谢和繁殖性能的研究提供了基础资料和数据,为牦牛产业研究提供了新的方向。
| [1] |
JIA W, ZHANG R, SHI L, et al. Accurate determination of volatile-flavor components in bos grunniens milk by high-throughput dynamic headspace gas chromatographic-mass spectrometry[J]. J Chromatogr A, 2019, 1603: 67-82. DOI:10.1016/j.chroma.2019.06.058 |
| [2] |
REN M, YANG F, GOU J M, et al. First detection and molecular identification of Entamoeba in yaks from China[J]. Acta Parasitol, 2021, 66(1): 264-270. DOI:10.1007/s11686-020-00258-3 |
| [3] |
张君. 不同繁殖类型的牦母牛在发情期和围产期的体况评分[J]. 青海畜牧兽医杂志, 2007, 37(2): 13-14. ZHANG J. Body condition score of different reproductive types of female yak in oestrus and perinatal period[J]. Chinese Qinghai Journal of Animal and Veterinary Sciences, 2007, 37(2): 13-14. DOI:10.3969/j.issn.1003-7950.2007.02.006 (in Chinese) |
| [4] |
ZI X D. Reproduction in female yaks (Bos grunniens) and opportunities for improvement[J]. Theriogenology, 2003, 59(5-6): 1303-1312. DOI:10.1016/S0093-691X(02)01172-X |
| [5] |
张君, 更求久乃. 补饲对青海高原型围产期牦母牛的影响[J]. 中国畜牧杂志, 2007, 43(9): 59-60. ZHANG J, GENG Q J N. Effect of supplementary feeding on Qinghai plateau type perinatal yak cows[J]. Chinese Journal of Animal Science, 2007, 43(9): 59-60. DOI:10.3969/j.issn.0258-7033.2007.09.021 (in Chinese) |
| [6] |
李胜利, 郝阳毅, 王蔚, 等. 围产期奶牛糖脂代谢与健康养殖研究进展[J]. 动物营养学报, 2020, 32(10): 4708-4715. LI S L, HAO Y Y, WANG W, et al. Research progress on glucose-lipid metabolism and healthy feeding in transition dairy cows[J]. Chinese Journal of Animal Nutrition, 2020, 32(10): 4708-4715. DOI:10.3969/j.issn.1006-267x.2020.10.022 (in Chinese) |
| [7] |
马晓玲, 舒适, 黄荣, 等. 牦牛围产期血清酮体消长规律及其对产后生殖激素分泌的影响[J]. 动物营养学报, 2021, 33(6): 3356-3364. MA X L, SHU S, HUANG R, et al. Growth and decline regular pattern of serum ketone body of yak during perinatal period and its effects on secretion of postpartum reproductive hormone[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3356-3364. (in Chinese) |
| [8] |
阿顺贤, 罗增海, 张文颖, 等. 菊苣酸对围产期放牧牦牛生长性能、血清生化指标及抗氧化能力的影响[J]. 中国畜牧兽医, 2019, 46(2): 449-457. A S X, LUO Z H, ZHANG W Y, et al. Effects of chicory acid on growth performance, serum biochemical indices and antioxidant ability of grazing yak in perinatal period[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(2): 449-457. (in Chinese) |
| [9] |
晁文菊, 刘书杰, 吴克选. 围产期补饲对牦牛生产性能及犊牦牛生长发育的影响[J]. 黑龙江畜牧兽医, 2009(5): 111-112. CHAO W J, LIU S J, WU K X. Effect of perinatal supplementary feeding on production performance of yak and growth and development of calves[J]. Heilongjiang Animal Science and Veterinary Medicine, 2009(5): 111-112. DOI:10.3969/j.issn.1004-7034.2009.05.053 (in Chinese) |
| [10] |
莎娜, 康博洋, 张欣昕, 等. 羊肉中多黏菌素A和多黏菌素B液相色谱-串联质谱检测方法的建立[J]. 畜牧与饲料科学, 2021, 42(5): 79-84, 89. SHA N, KANG B Y, ZHANG X X, et al. Development of a liquid chromatography-tandem mass spectrometry (LC-MS/MS) method for detection of Colistin A and Colistin B in mutton[J]. Animal Husbandry and Feed Science, 2021, 42(5): 79-84, 89. (in Chinese) |
| [11] |
刘泽阳, 李明, 吴佩泽, 等. 液相色谱-高分辨串联质谱法检测牛奶中A1和A2 β-酪蛋白[J]. 吉林大学学报: 理学版, 2021, 59(3): 696-702. LIU Z Y, LI M, WU P Z, et al. Determination of A1 and A2 β-Casein in milk by liquid chromatography-high resolution tandem mass spectrometry[J]. Journal of Jilin University: Science Edition, 2021, 59(3): 696-702. (in Chinese) |
| [12] |
WANGCHUK P, ANDERSON D, YESHI K, et al. Identification of small molecules of the infective stage of human hookworm using LCMS-based metabolomics and lipidomics protocols[J]. ACS Infect Dis, 2021, 7(12): 3264-3276. DOI:10.1021/acsinfecdis.1c00428 |
| [13] |
LIU C, WU H, LIU S J, et al. Dynamic alterations in yak rumen bacteria community and metabolome characteristics in response to feed type[J]. Front Microbiol, 2019, 10: 1116. DOI:10.3389/fmicb.2019.01116 |
| [14] |
YANG Y X, ZHENG N, ZHAO X W, et al. Metabolomic biomarkers identify differences in milk produced by Holstein cows and other minor dairy animals[J]. J Proteomics, 2016, 136: 174-182. DOI:10.1016/j.jprot.2015.12.031 |
| [15] |
石朔夕, 王璐晶, 马宁, 等. 1类葡萄糖转运体家族蛋白与2型糖尿病相关的研究进展[J]. 生命的化学, 2021, 41(12): 2641-2647. SHI S X, WANG L J, MA N, et al. Class 1 glucose transporter (GLUT) and their role in type 2 diabetes[J]. Chemistry of Life, 2021, 41(12): 2641-2647. (in Chinese) |
| [16] |
HOPP A K, GRVTER P, HOTTIGER M O. Regulation of glucose metabolism by NAD+ and ADP-ribosylation[J]. Cells, 2019, 8(8): 890. DOI:10.3390/cells8080890 |
| [17] |
严磊, 王家晶, 姚璐连, 等. 围产期奶牛血清糖、脂代谢变化的研究[J]. 畜牧与兽医, 2017, 49(2): 119-120. YAN L, WANG J J, YAO L L, et al. Study on the changes of serum glucose and lipid metabolism in perinatal cows[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(2): 119-120. (in Chinese) |
| [18] |
郭仕辉, 余永涛, 赵清梅, 等. 围产期奶牛主要血液生化指标的监测[J]. 畜牧与兽医, 2020, 52(11): 128-133. GUO S H, YU Y T, ZHAO Q M, et al. Monitoring of major blood biochemical indexes in perinatal cows[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(11): 128-133. (in Chinese) |
| [19] |
宗久榆, 孙蕊心, 于敏. 脂肪组织对糖异生的调控作用[J]. 生命的化学, 2017, 37(5): 842-848. ZONG J Y, SUN R X, YU M. The regulation of adipose tissue on gluconeogenesis[J]. Chemistry of Life, 2017, 37(5): 842-848. (in Chinese) |
| [20] |
BAVA L, RAPETTI L, CROVETTO G M, et al. Effects of a nonforage diet on milk production, energy, and nitrogen metabolism in dairy goats throughout lactation[J]. J Dairy Sci, 2001, 84(11): 2450-2459. DOI:10.3168/jds.S0022-0302(01)74695-4 |
| [21] |
FASSAH D M, JEONG J Y, BAIK M. Hepatic transcriptional changes in critical genes for gluconeogenesis following castration of bulls[J]. Asian-Australas J Anim Sci, 2018, 31(4): 537-547. DOI:10.5713/ajas.17.0875 |
| [22] |
王艳明. 日粮脂肪和能量水平对奶牛氧化应激、生产性能的影响及抗氧化剂添加效果研究[D]. 杭州: 浙江大学, 2010. WANG Y M. Effects of dietary fat and energy density on oxidative stress and lactation performance in dairy cows, in the absence or presence of antioxidant[D]. Hangzhou: Zhejiang University, 2010. (in Chinese) |
| [23] |
HONORÉ A H, THORSEN M, SKOV T. Liquid chromatography-mass spectrometry for metabolic footprinting of co-cultures of lactic and propionic acid bacteria[J]. Anal Bioanal Chem, 2013, 405(25): 8151-8170. |
| [24] |
FRYE R E, ROSE S, CHACKO J, et al. Modulation of mitochondrial function by the microbiome metabolite propionic acid in autism and control cell lines[J]. Transl Psychiatry, 2016, 6(10): e927. |
| [25] |
马宏峰. 亚油酸对高脂小鼠脂质代谢的影响及其机制研究[D]. 合肥: 合肥工业大学, 2007. MA H F. Effect of LA on high fat mouse in lipid metabolism and its mechanisms[D]. Hefei: Hefei University of Technology, 2007. (in Chinese) |
| [26] |
SZCZUKO M, KIKUT J, KOMORNIAK N, et al. The role of Arachidonic and linoleic acid derivatives in pathological pregnancies and the human reproduction process[J]. Int J Mol Sci, 2020, 21(24): 9628. |
| [27] |
马会芳, 魏芳, 董绪燕, 等. 基于衍生化技术的甘油磷脂分析方法研究进展[J]. 分析测试学报, 2018, 37(11): 1396-1404. MA H F, WEI F, DONG X Y, et al. Progress in analysis methods of glycerophospholipid based on chemical derivatization[J]. Journal of Instrumental Analysis, 2018, 37(11): 1396-1404. (in Chinese) |
| [28] |
张翠羽, 杨威, 赵阳, 等. 胆固醇对非酯化脂肪酸介导的犊牛肝细胞脂质沉积影响的GC/MS分析[J]. 中国生物制品学杂志, 2020, 33(1): 33-41. ZHANG C Y, YANG W, ZHAO Y, et al. Analysis of effect of cholesterol on non-esterified fatty acid-mediated calf hepatic lipid deposition by GC/MS[J]. Chinese Journal of Biologicals, 2020, 33(1): 33-41. (in Chinese) |
| [29] |
SUTTON J D, DHANOA M S, MORANT S V, et al. Rates of production of acetate, propionate, and butyrate in the rumen of lactating dairy cows given normal and low-roughage diets[J]. J Dairy Sci, 2003, 86(11): 3620-3633. |
| [30] |
MORAES G, ALTRAN A E, AVILEZ I M, et al. Metabolic adjustments during semi-aestivation of the marble swamp eel (Synbranchus marmoratus, Bloch 1795)-a facultative air breathing fish[J]. Braz J Biol, 2005, 65(2): 305-312. |
| [31] |
解放, 刘楠. 半胱氨酸代谢途径调控与肿瘤治疗新策略[J]. 中国药科大学学报, 2021, 52(5): 522-528. XIE F, LIU N. Regulation of cysteine metabolism and new strategies for cancer treatment[J]. Journal of China Pharmaceutical University, 2021, 52(5): 522-528. (in Chinese) |
| [32] |
张勇. 丙酮酸、肌酸及丙酮酸肌酸对肉鸡氨基酸谱的影响及相关酶活性的研究[D]. 南京: 南京农业大学, 2010. ZHANG Y. Effect of pyruvate, creatine and creatine-pyuvate on profile of amino-acids and relevant enzyme activity in broiler chickens[D]. Nanjing: Nanjing Agricultural University, 2010. (in Chinese) |
| [33] |
CURI R, NEWSHOLME P, PITHON-CURI T C, et al. Metabolic fate of glutamine in lymphocytes, macrophages and neutrophils[J]. Braz J Med Biol Res, 1999, 32(1): 15-21. |
| [34] |
黄博, 胡佳宇, 吴苗苗, 等. 猪胃肠道谷氨酸代谢及其对机体健康的影响[J]. 动物营养学报, 2015, 27(11): 3326-3331. HUANG B, HU J Y, WU M M, et al. Metabolism of glutamic acid in gastrointestinal tract and its effects on health of pigs[J]. Chinese Journal of Animal Nutrition, 2015, 27(11): 3326-3331. (in Chinese) |
| [35] |
PLATTEN M, NOLLEN E A A, RÖHRIG U F, et al. Tryptophan metabolism as a common therapeutic target in cancer, neurodegeneration and beyond[J]. Nat Rev Drug Discov, 2019, 18(5): 379-401. |
| [36] |
唐红萍. 酪氨酸对rCHO细胞培养和单克隆抗体表达的影响及其作用机制[D]. 上海: 华东理工大学, 2019. TANG H P. Effects of tyrosine on rCHO cell culture performance and monoclonal antibody production and its mechanism[D]. Shanghai: East China University of Science and Technology, 2019. (in Chinese) |
| [37] |
ENDO F, TANAKA Y, TOMOEDA K, et al. Animal models reveal pathophysiologies of tyrosinemias[J]. J Nutr, 2003, 133(6 Suppl 1): 2063S-2067S. |
| [38] |
李洁, 赵珂, 孔祥祯, 等. 酪氨酸代谢物对肺癌细胞增殖、周期及化疗药物敏感性的影响[J]. 军事医学, 2017, 41(6): 487-493. LI J, ZHAO K, KONG X Z, et al. Effect of tyrosine metabolites on cell proliferation, cell cycle and chemosensitivity of lung cancer cells[J]. Military Medical Sciences, 2017, 41(6): 487-493. (in Chinese) |
| [39] |
LIU Y F, XU Y R, DING D Q, et al. Genetic engineering of Escherichia coli to improve L-phenylalanine production[J]. BMC Biotechnol, 2018, 18(1): 5. |
| [40] |
赵建存, 宋英杰, 王振圣, 等. 苯丙氨酸/酪氨酸代谢途径及其相关产物与非酒精性脂肪肝的关系[J]. 中国普外基础与临床杂志, 2022, 29(3): 404-409. ZHAO J C, SONG Y J, WANG Z S, et al. Relationship between phenylalanine/tyrosine metabolic pathway and its related products and non-alcoholic fatty liver disease[J]. Chinese Journal of Bases and Clinics in General Surgery, 2022, 29(3): 404-409. (in Chinese) |
| [41] |
傅慧君. 牛奶中类固醇激素快速检测方法研究与应用[D]. 广州: 华南农业大学, 2017. FU H J. The research and application of steroid hormones residue detection in milk[D]. Guangzhou: South China Agricultural University, 2017. (in Chinese) |
| [42] |
宋欢, 叶仪云, 黄飞燕. 类固醇类激素应用于脊髓损伤的研究进展[J]. 现代医药卫生, 2020, 36(15): 2388-2390. SONG H, YE Y Y, HUANG F Y. Progress in the application of steroids in spinal cord injury[J]. Journal of Modern Medicine & Health, 2020, 36(15): 2388-2390. (in Chinese) |
| [43] |
CHIANG J Y L. Bile acid regulation of gene expression: roles of nuclear hormone receptors[J]. Endocr Rev, 2002, 23(4): 443-463. |
| [44] |
张璐通. miR-10a-5p对猪卵巢颗粒细胞类固醇激素合成的作用及机制研究[D]. 杨凌: 西北农林科技大学, 2021. (in Chinese) ZHANG L T. The effect of miR-10a-5p on steroid hormone synthesis in porcine ovarian granulosa cells and the mechanism of action[D]. Yangling: Northwest A & F University, 2021. |
| [45] |
钱宏梁, 潘志强, 王晓敏, 等. 控制摄食对小鼠肝脏及肾上腺胆固醇代谢的影响[J]. 动物营养学报, 2018, 30(6): 2281-2293. QIAN H L, PAN Z Q, WANG X M, et al. Effects of dietary restriction on cholesterol metabolism in liver and adrenal gland of mice[J]. Chinese Journal of Animal Nutrition, 2018, 30(6): 2281-2293. (in Chinese) |
| [46] |
时胜洁. miR-184调控猪卵巢颗粒细胞雌二醇合成、增殖和凋亡的作用研究[D]. 杨凌: 西北农林科技大学, 2021. SHI S J. Effects of miR-184 on regulating estradiol synthesis, proliferation and apoptosis of porcine ovarian granulosa cells[D]. Yangling: Northwest A&F University, 2021. (in Chinese) |
| [47] |
金烨峰. 不同生殖激素对奶牛同期发情的调节效果及应用[D]. 南京: 南京农业大学, 2011. JIN Y F. Different reproductive hormone regulation of the same period on cow estrus effect and application[D]. Nanjing: Nanjing Agricultural University, 2011. (in Chinese) |
| [48] |
任巧玲, 张家庆, 郭红霞, 等. 发情和乏情初产母猪下丘脑-垂体-卵巢轴差异表达基因筛选及分析[J]. 中国畜牧兽医, 2021, 48(8): 2864-2877. REN Q L, ZHANG J Q, GUO H X, et al. Screening and analysis of differentially expressed genes in hypothalamus-pituitary-ovary axis of estrous and anestrous primiparous sows[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(8): 2864-2877. (in Chinese) |
| [49] |
ADHIKARI M, NEGI B, KAUSHIK N, et al. T-2 mycotoxin: toxicological effects and decontamination strategies[J]. Oncotarget, 2017, 8(20): 33933-33952. |
(编辑 郭云雁)



