2. 中国农业科学院北京畜牧兽医研究所, 北京 100193
2. Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
根据世界卫生组织的数据,全世界有超过3.47亿人患有糖尿病。糖尿病已成为仅次于癌症和心脑血管疾病的第三大杀手。1900年,美国登记地区的糖尿病死亡率为10万,1915年则为18万。在波士顿的同一时期,这一数字从14万上升到了26万[1]。胰腺是人体第二大腺体,由内分泌部和外分泌部组成[2]。外分泌胰岛形成一个重要的消化系统,产生消化酶,包括糜蛋白酶、淀粉酶和脂肪酶,用于消化蛋白质、降解碳水化合物和脂肪。内分泌胰岛是几种激素的来源,包括胰岛素和胰高血糖素[3-4]。胰岛素由胰腺中的β细胞分泌,是控制血糖最重要的代谢激素。所有形式的糖尿病其主要原因是胰岛素的丧失,包括胰岛β细胞产生/分泌的胰岛素数量不足[5]。胰岛移植曾被认为是一种很有前途的糖尿病治疗方法。然而,研究表明只有十分之一的受试者在移植后5年内保持胰岛素独立。当诱导慢性免疫抑制以延长胰岛移植物存活时间时,会导致许多疾病的发生。
近年来人们不断探索新的治疗方法,目前发现可以用干细胞移植治疗来改善与胰岛素分泌减少和胰岛素敏感性降低相关的症状[6-7]。在胚胎中, 最早的胰腺来自背侧和腹侧前肠内胚层Pdx1阳性细胞群[8]。随着研究的不断深入,Scharfmann等[9]发现,胎儿胰腺中可能存在多种祖细胞,而在成体中是否存在多能的胰腺干细胞还未明确。近年有研究表明,从羊胚胎中分离得到的胰腺间充质干细胞可分化为β细胞,并改善了1型糖尿病小鼠的血糖[10]。胰腺间充质干细胞比其他间充质干细胞更容易分化为β细胞[11-12],且PMSCs在血管发育、趋化性和伤口愈合过程中高度富集[13]。然而,器官供体的缺乏限制了这些细胞在体外的分离和分化。鉴于此,本试验对西门塔尔牛胰腺间充质干细胞进行分离培养鉴定,并研究其生物学特性及多向诱导分化潜能,为基础兽医和临床糖尿病治疗提供理论参考。
1 材料与方法 1.1 材料1.1.1 试验动物 3月龄健康雄性西门塔尔牛胚胎由中国农业科学院北京畜牧兽医研究所昌平试验基地提供。
1.1.2 试验材料 胰蛋白酶(Tripsin)、胎牛血清(FBS)、DMEM/F12基础培养基、L-DMEM基础培养基、磷酸盐缓冲液(PBS)均购自Gibco公司;胶原酶Ⅳ购自Sigma公司;封闭用山羊血清、FITC标记山羊抗兔二抗购自北京博奥森生物技术有限公司;CD29、CD44、CD73、CD90、CD34、CD45一抗购自美国Abcam公司;RNA逆转录试剂盒购自TaKaRa公司;胰岛素生长因子-1 (IGF-1)、碱性成纤维生长因子(bFGF)、胰岛素转铁蛋白(ITS)均购自英国Perotech公司;吉姆萨染液、油红O染液、阿利新蓝染液、糖原染液、茜素红染液均购自索莱宝公司。激光共聚焦显微镜(Nikon公司),TH4-200倒置显微镜(Olympus公司),CO2培养箱(Heraeus公司),离心机(Eppendorf公司)。
1.2 方法1.2.1 PMSCs的分离培养 在无菌条件下从3月龄西门塔尔牛胚胎中获取胰腺组织,PBS洗涤3遍,切除肠系膜并将胰腺切成小块(1 mm×1 mm× 1 mm),胶原酶消化法:在37 ℃下用0.1%的胶原酶Ⅳ消化10~20 min。可见大量细胞从组织块脱落,再用含10% FBS的DMEM/F12完全培养基中和消化反应。所得悬浮液经100目筛网过滤,并以1 200 r·min-1离心6 min。接种于细胞培养皿,培养2 d后,PBS清洗细胞,以去除非粘附细胞。组织块贴壁法:将1 mm×1 mm×1 mm的小块胰腺组织PBS洗3遍,贴于细胞培养皿,待组织块牢固加DMEM/F12完全培养基(DEME/F12+10% FBS+ 10 ng·mL-1bFGF),在37 ℃,50 mL·L-1CO2的培养箱中培养。接种数天后,可见大量细胞从组织块周围爬出,汇合度达80%时传代,进行后续培养。
1.2.2 PMSCs生长曲线及群体倍增时间检测 将第3代、第9代和第15代细胞以1×104细胞·孔-1接种到24孔板中。自接种时起每24 h随机选取3个孔分别收集细胞悬浮液进行细胞计数,连续计数8 d。根据平均值绘制生长曲线,计算群倍增时间(PDT)。PDT=(t-t0)lg2/(lgNt-lgN0),其中t0是培养开始时间,t是培养终止时间,N0是培养初始细胞数,Nt是培养最终细胞数。
1.2.3 PMSCs克隆形成能力检测 将第3代、第9代、第15代的PMSCs细胞以100细胞·孔-1接种在6孔板中培养,2周后可见单个PMSCs形成较大克隆团,40 g·L-1多聚甲醛固定30 min,PBS洗2次,吉姆萨工作液染色20 min。显微镜下拍照观察克隆形态并计算克隆形成率,克隆形成率=克隆形成数/接种细胞数×100%,试验重复3次以计算平均值。
1.2.4 染色体核型检测 用0.25%的胰蛋白酶消化贴壁细胞,显微镜下观察多数细胞变圆发亮,且大部分细胞单个存在,添加秋水仙素0.2 μg·mL-1,于37 ℃,50 mL·L-1CO2培养箱中继续培养24 h,消化收集细胞,2 000 r·min-1离心10 min,弃上清,37 ℃低渗处理30 min,1 mL固定液轻吹混匀,室温静置30 min,重复固定1次,后吸取细胞悬液在预冷的载玻片上方1.5 m处均匀滴下细胞悬液,室温干燥,吉姆萨工作液染色20 min。自然风干,生物显微镜下观察并拍照。
1.2.5 PMSCs表面标志物检测 将PMSCs接种到六孔板中。在70%汇合时,PBS清洗细胞,40 g·L-1多聚甲醛固定30 min,0.25% Triton X-100通透10 min。山羊血清室温下封闭30 min,分别加入CD29、CD44、CD73、CD90抗体稀释液4 ℃孵育过夜。弃去一抗,PBS洗2次,加入FITC标记二抗,孵育1 h;PBS洗3次,DAPI孵育20 min,PBS清洗后,激光共聚焦显微镜下观察并拍照。
1.2.6 多能性相关基因表达鉴定 使用Trizol法从细胞中提取RNA,PCR试剂盒(Takara)合成cDNA。用Primer Premier 5.0软件进行特异性引物设计(表 1),扩增cDNA。PCR在含有2.0 μL 10× RT缓冲液、13.4 μL蒸馏水、0.2 μL Ex-Taq、1.0 μL正向和反向引物、1.0 μL模板cDNA和1.4 μL dNTP(2.5 mmol·L-1)的20 μL溶液中进行。反应条件严格按照说明书设置。PCR产物通过琼脂糖凝胶电泳在140 V下持续30 min,观察多能性相关基因表达情况。
|
|
表 1 引物信息表 Table 1 Table for primers information |
1.2.7 诱导分化能力鉴定 成骨诱导液由DMEM/F12、10% FBS、0.1 mmol·L-1地塞米松、10 mmol·L-1β-甘油磷酸和50 mg· L-1维生素C组成; 成脂诱导液由DMEM/F-12、10% FBS、10-7mol·L-1地塞米松、8 μg·mL-1胰岛素、70 μmol·L-1吲哚美辛、0.5 mmol·L-1 IBMX组成。成软骨诱导液由L-DMEM、2.5% FBS、1% ITS、50 μg·mL-1脯氨酸、0.1 μmol·L-1地塞米松、0.5 mmol·L-1丙酮酸钠、50 μg·mL-1维生素C、10 ng·mL-1 TGF-β3、10 mg·L-1 IGF-1组成;成肝样诱导液由DMEM/F12、5% FBS、20 ng·mL-1 FGF-4、20 ng·mL-1HGF、1% ITS组成。当细胞生长至60%汇合度时,PBS洗2次,加入诱导液,诱导液每2 d更换1次。连续培养,直到观察到细胞有诱导标志性变化。分别用茜素红、油红O、阿利新兰和糖原染色,并通过RT-PCR分析成骨特异性基因胶原蛋白-Ⅰ(collogen-Ⅰ)和骨桥蛋白(OPN)的表达;成脂特异性基因过氧化物酶体增殖物激活受体-γ(PPAR-γ)和脂蛋白脂肪酶(LPL)的表达;成软骨特异性基因ACAN和SOX9的表达; 成肝样特异性基因白蛋白(ALB)和甲胎蛋白(AFP)的表达。
1.3 数据处理数据处理使用SPSS25.0软件进行单因素方差分析及邓肯氏多重比较,用“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果 2.1 PMSCs的分离培养通过胶原酶消化法和组织块贴壁法均可获得PMSCs,两种方法分离的细胞在传至第3代时,细胞形态均一为长梭形,成漩涡样生长,无明显差异(图 1)。

|
A~D.胶原酶消化法原代、第3代、第9代、第15代(P0、P3、P9、P15)细胞形态;E~H.组织块贴壁法原代、第3代、第9代、第15代(P0、P3、P9、P15)细胞形态 A-D. The primary, 3rd, 9th, and 15th passage (P0, P3, P9, P15)cell morphology treated by collagenase digestion method; E-H. The primary, 3rd, 9th, and 15th passage(P0, P3, P9, P15)cell morphology treated by tissue block adherence method 图 1 西门塔尔牛PMSCs形态 Fig. 1 The morphology of Simmental cattle PMSCs |
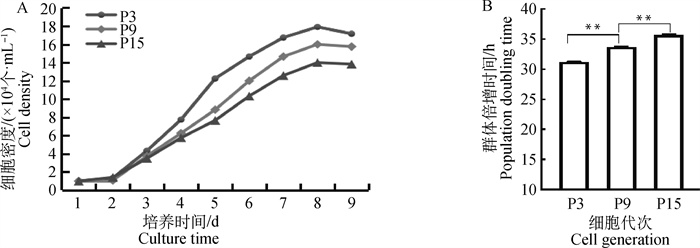
对第3代、第9代、第15代的PMSCs进行细胞计数,绘制细胞生长曲线。三代细胞增殖过程均经历潜伏期、对数生长期、平台期和衰退期,呈典型“S”型(图 2A)。计算得出第3代细胞的群体倍增时间为31.13 h,第9代细胞的群体倍增时间为33.75 h,第15代细胞的群体倍增时间为35.76 h。随着传代次数的增加群体倍增时间也逐渐增加, 并且第9代细胞群体倍增时间显著低于第15代而高于第3代(P<0.01,图 2B)。
|
A.PMSCs第3代、第9代、第15代(P3、P9、P15)的生长曲线;B.PMSCs第3代、第9代、第15代(P3、P9、P15)的群体倍增时间。**.P<0.01 A. Growth curves of the 3rd, 9th, and 15th passages(P3, P9, P15)of PMSCs; B.Population doubling time of the 3rd, 9th and 15th passages (P3, P9, P15) of PMSCs. **. P < 0.01 图 2 西门塔尔牛PMSCs生长曲线和群体倍增时间 Fig. 2 Growth curves and population doubling time of Simmental cattle PMSCs |
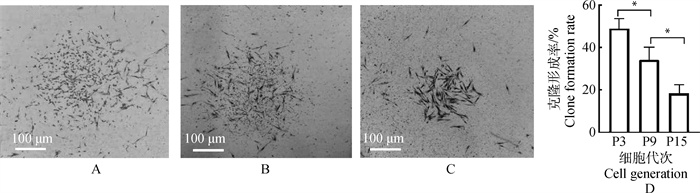
第3代、第9代、第15代的PMSCs均能够在低密度条件下形成单克隆团(图 3A)。克隆形成率分别是(49±4.58)%、(34±6.08)%、(18.33±4.61)%,西门塔尔牛PMSCs随着传代次数的升高,细胞的克隆形成能力逐渐减弱。通过SPSS软件计算表明第3代、第9代、第15代的PMSCs克隆形成率具有显著差异(P<0.05,图 3B)。
|
A~C.西门塔尔牛PMSCs第3代、第9代、第15代(P3、P9、P15)的克隆团形态;D.柱状图显示了不同代次细胞的克隆形成率。*.P<0.05 A-C. The clone group morphology of the 3rd, 9th, and 15th passages (P3, P9, P15) of Simmental cattle PMSCs; D. The bar graph shows the clone formation rate of cells in different passages. *.P < 0.05 图 3 西门塔尔牛PMSCs克隆形成率 Fig. 3 Clonal formation rate of Simmental cattle PMSCs |
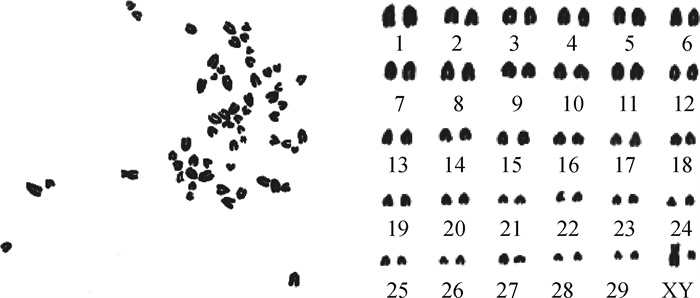
取第9代PMSCs进行核型分析,染色体数目为2n=60,其中包括一对性染色体XY。染色体形态无畸变,表明此次体外培养的PMSCs保持了正常的染色体数目及形态(图 4)。
|
图 4 西门塔尔牛PMSCs染色体核型分析 Fig. 4 Karyotype analysis of PMSCs chromosome in Simmental cattle |
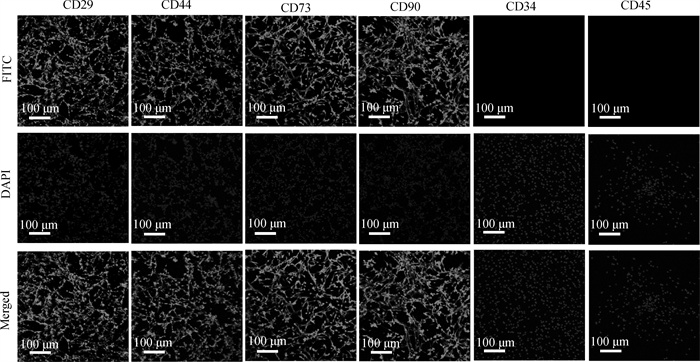
第7代PMSCs细胞做免疫荧光检测结果显示,间充质干细胞表面标志物CD29、CD44、CD73和CD90均呈阳性表达,CD45、CD34呈阴性表达(图 5)。
|
图 5 免疫荧光检测西门塔尔牛PMSCs表面标志物 Fig. 5 Detection of Simmental cattle PMSCs markers by immunofluorescence staining |
Primer Premier 5.0软件设计CD29、CD44、CD73、CD90、CD106、CD166和CD34、CD45标记基因扩增引物,以GAPDH为内参基因,结果显示间充质干细胞特异性标记基因CD29、CD44、CD73、CD90、CD106、CD166呈阳性表达;造血干细胞特异性标记基因CD34、CD45呈阴性表达(图 6)。
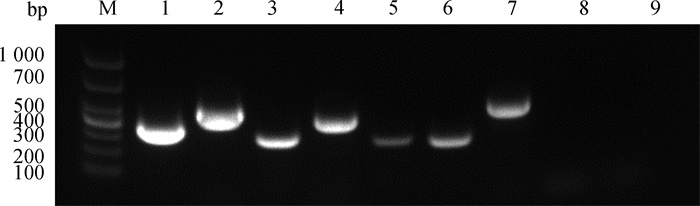
|
M. DL1000 DNA相对分子质量标准;1. GAPDH;2. CD29;3. CD44;4. CD73;5. CD90;6. CD106;7. CD166;8. CD34;9. CD45 M. DL1000 DNA marker; 1. GAPDH; 2. CD29;3. CD44;4. CD73;5. CD90;6. CD106;7. CD166;8. CD34;9. CD45 图 6 RT-PCR检测标记基因的mRNA表达 Fig. 6 RT-PCR detection of marker genes mRNA expression |
2.7.1 成脂诱导分化能力鉴定 成脂诱导6 d后进行油红O染色,诱导后细胞胞浆可见大量橘红色油滴,并进行RT-PCR检测,结果表明成脂诱导后的PMSCs表达脂肪细胞相关基因脂蛋白脂肪酶(LPL)和过氧化物酶体增殖激活受体γ(PPAR-γ), 而对照组LPL和PPAR-γ呈阴性表达(图 7)。
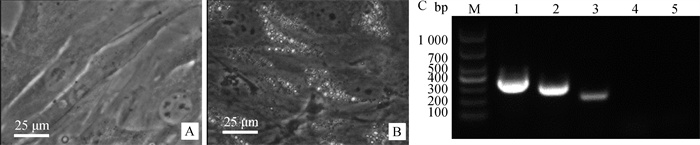
|
A.对照组油红O染色;B.诱导组油红O染色;C: M. DL1000 DNA相对分子质量标准;1. GAPDH;2.诱导组LPL;3.诱导组PPAR-γ;4.对照组LPL;5.对照组PPAR-γ A. Oil red O staining in control group; B. Oil red O staining in induced group; C: M. DL1000 DNA marker; 1. GAPDH; 2. LPL in induced group; 3. PPAR-γ in induced group; 4. LPL in control group; 5. PPAR-γ in control group 图 7 西门塔尔牛PMSCs成脂分化 Fig. 7 Adipogenic differentiation of Simmental cattle PMSCs |
2.7.2 成骨诱导分化能力的鉴定 成骨诱导15 d后进行茜素红染色,诱导后可见沉积的钙盐被染成红色,RT-PCR结果显示成骨诱导后的PMSCs表达Ⅰ型胶原蛋白(Collage typeⅠ)和骨桥蛋白(osteopontin)基因,而对照组未检测到Collage typeⅠ和osteopontin表达(图 8)。

|
A.对照组茜素红染色;B.诱导组茜素红染色;C: M. DL1000 DNA相对分子质量标准;1. GAPDH;2.诱导组collagen type I;3.诱导组osteopontin;4.对照组collagen type I;对照组osteopontin A. Alizarin red staining in control group; B. Alizarin red staining in induced group; C: M. DL1000 DNA marker; 1. GAPDH; 2. collagen type I in induced group; 3. osteopontin in induced group; 4. collagen type I in control group; 5.osteopontin in control group 图 8 西门塔尔牛PMSCs成骨分化 Fig. 8 Osteogenic differentiation of Simmental cattle PMSCs |
2.7.3 成软骨诱导分化能力的鉴定 成软骨诱导15 d后进行阿利新兰染色,诱导组可见含酸性黏多糖的软骨结节被染成蓝色,RT-PCR结果显示成软骨诱导后的PMSCs表达ACAN和SOX9基因,而对照组未检测到ACAN和SOX9基因表达(图 9)。
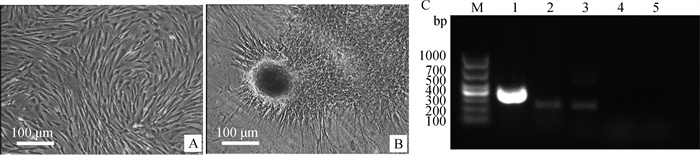
|
A.对照组阿利新兰染色;B.诱导组阿利新蓝染色;C: M. DL1000 DNA相对分子质量标准;1. GAPDH;2.诱导组ACAN;3.诱导组SOX9;4.对照组ACAN;5.对照组SOX9 A. Alcian blue staining in control group; B. Alcian blue staining in induced group; C: M. DL1000 DNA marker; 1. GAPDH; 2. ACAN in induced group; 3. SOX9 in induced group; 4. ACAN in control group; 5. SOX9 in control group 图 9 西门塔尔牛PMSCs成软骨分化 Fig. 9 Chondrogenic differentiation of Simmental cattle PMSCs |
2.7.4 成肝样诱导分化能力的鉴定 成肝样诱导15 d后进行糖原染色,诱导组可见胞质内储存的糖原被染为紫红色,RT-PCR结果显示成肝样诱导后的PMSCs表达白蛋白(ALB)和甲胎蛋白(AFP)基因,而对照组ALB和AFP基因呈阴性表达(图 10)。
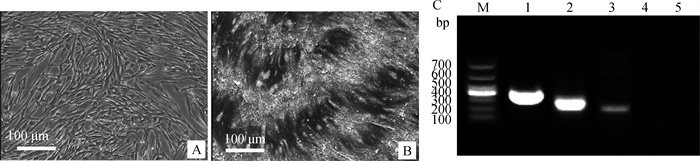
|
A.对照组糖原染色;B.诱导组糖原染色;C: M.DL1000 DNA相对分子质量标准;1.GAPDH;2.诱导组AFP;3.诱导组ALB;4.对照组AFP;5.对照组ALB A. Glycogen staining in control group; B. Glycogen staining in induced group; C: M.DL1000 DNA marker; 1. GAPDH; 2. AFP in induced group; 3. ALB in induced group; 4. AFP in control group; 5. ALB in control group 图 10 西门塔尔牛PMSCs诱导成肝样细胞 Fig. 10 Differentiation of Simmental cattle MSCs into hepatocyte-like cells |
间充质干细胞具有免疫调节作用,有助于从组织损伤中恢复和抑制炎症。许多研究调查了基于MSCs对糖尿病治疗的可行性、安全性和有效性[14-16]。然而,临床使用的最佳来源还没有被证实。因此,相同组织来源或胚胎发育过程中同源区域组织类型来源的干细胞可能提供新的治疗策略[17]。PMSCs除了对糖尿病具有治疗潜力,Thirlwell等[18]通过对PMSCs和骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)分化潜能和免疫调节能力的比较表明PMSCs在治疗移植物抗宿主病方面也具有优势。
通过酶消法和贴壁法均可从西门塔尔牛胚胎中获得生长状态良好的PMSCs,细胞形态为长梭形且传代时间一致。随着传代次数的增加群体倍增时间逐渐增加,克隆形成率逐渐降低。说明随着细胞传代次数的增加细胞逐渐衰老。二倍体核型和稳定的染色体数目、形状和结构是细胞生长和功能的先决条件。核型分析是区分正常细胞和变异细胞的一种简单实用的方法[19-20]。西门塔尔牛有30对染色体,包括性染色体X和Y[21-22]。本研究培养的西门塔尔牛PMSCs均为正常二倍体(2n=60,XY)。这些发现可能对理解染色体融合的分子机制、基因进化具有重要意义。
西门塔尔牛PMSCs的识别通常基于MSCs特异性标记CD29、CD44、CD73、CD90[23]。CD44是一种细胞表面糖蛋白,参与细胞间相互作用、迁移和粘附,参与淋巴细胞激活、再循环和归巢等多种细胞功能[24]。CD73主要分布在细胞表面,并通过糖基磷脂酰肌醇(GPI)与细胞膜结合[25]。血管细胞黏附分子-1(CD106或VCAM-1)是一种细胞因子诱导的细胞表面蛋白,能够介导粘附[26]。目前,间充质干细胞鉴定除了根据细胞形态学、生长特征、多种免疫表型外,另外一项重要的特征是其在体外具有多向分化潜能。细胞在体外必须能够分化成骨细胞、脂肪细胞、软骨细胞等[27]。研究表明,鲁西黄牛PMSCs在体外可分化为中胚层脂肪细胞和骨细胞[27]。本试验将生长状态良好的PMSCs在不同诱导条件下分化为中胚层骨细胞、脂肪细胞、软骨细胞,并跨胚层诱导分化成肝样细胞,进一步验证了西门塔尔牛PMSCs具有良好的体外分化潜能。骨细胞相关标记基因的表达包括Collage typeⅠ和OPN,OPN是成骨分化和成熟的早期标记[28-29],脂肪细胞相关标记基因的表达包括LPL和PPAR-γ,PPAR-γ属于配体激活转录因子的核激素受体超家族,已知可作为脂肪细胞分化的主要转录调节因子,并抑制成骨细胞分化[30]。软骨细胞标记基因包括ACAN和SOX9。由ACAN基因编码的蛋白聚糖是细胞外软骨基质中的主要蛋白多糖成分[31]。SOX9是一种主转录因子,通过阶段特异性调控一系列下游因子参与软骨形成的序列事件[32]。本研究发现,在进行成骨和成软骨诱导时细胞汇合度应选取50%左右,但在成脂诱导时细胞汇合度应选取80%左右为宜。这主要是因为在成脂诱导过程中细胞不再增殖,启动了凋亡程序[33]。西门塔尔牛PMSCs分化为肝样细胞15 d后可表达ALB和AFP,并在胞质储存糖原。由于ALB和AFP是肝细胞存在和代谢活性的特异性标志基因,只有肝细胞才能产生和储存糖原,提示此时PMSCs在体外已经成功向肝样细胞分化[34]。但是由于缺少体内微环境的调节,在体外诱导成的肝样细胞会受到诱导条件影响而产生不同成熟度的肝样细胞,因此本试验中诱导分化获得的肝样细胞尚需更详尽的方案来评价其多方面的肝细胞功能。
4 结论本研究成功从3月龄西门塔尔牛胚胎胰腺组织中分离到PMSCs,细胞形态均一,呈长梭形,并保持了较高的自我更新能力;西门塔尔牛PMSCs表达MSCs相关的表面标记基因CD29、CD44、CD73、CD90、CD106、CD166, 不表达CD34、CD45;西门塔尔牛PMSCs在体外可向成脂、成骨、成软骨、成肝样细胞分化,具有较高的分化潜能。有望在细胞治疗方面发挥潜力,为组织工程学提供新的种子细胞。
| [1] |
The prevention of diabetes mellitus[J]. JAMA, 2021, 325(2): 190.
|
| [2] |
ZHOU Q, MELTON D A. Pancreas regeneration[J]. Nature, 2018, 557(7705): 351-358. DOI:10.1038/s41586-018-0088-0 |
| [3] |
PAN F C, BRISSOVA M. Pancreas development in humans[J]. Curr Opin Endocrinol Diabetes Obes, 2014, 21(2): 77-82. DOI:10.1097/MED.0000000000000047 |
| [4] |
BAKHTI M, BÖTTCHER A, LICKERT H. Modelling the endocrine pancreas in health and disease[J]. Nat Rev Endocrinol, 2019, 15(3): 155-171. DOI:10.1038/s41574-018-0132-z |
| [5] |
RYAN E A, PATY B W, SENIOR P A, et al. Five-year follow-up after clinical islet transplantation[J]. Diabetes, 2005, 54(7): 2060-2069. DOI:10.2337/diabetes.54.7.2060 |
| [6] |
SOLIS M A, VELÁSQUEZ I M, CORREA R, et al. Stem cells as a potential therapy for diabetes mellitus: a call-to-action in Latin America[J]. Diabetol Metab Syndr, 2019, 11: 20. DOI:10.1186/s13098-019-0415-0 |
| [7] |
BHARTIYA D. Stem cells to replace or regenerate the diabetic pancreas: huge potential & existing hurdles[J]. Indian J Med Res, 2016, 143(3): 267-274. DOI:10.4103/0971-5916.182615 |
| [8] |
CHEN B, ZHOU L, WANG L S, et al. Better induction and differentiation strategy for rat pancreatic stem cells: transplant in liver niche[J]. Transplant Proc, 2009, 41(9): 3898-3904. DOI:10.1016/j.transproceed.2009.06.208 |
| [9] |
SCHARFMANN R, XIAO X W, HEIMBERG H, et al. Beta cells within single human islets originate from multiple progenitors[J]. PLoS One, 2008, 3(10): e3559. DOI:10.1371/journal.pone.0003559 |
| [10] |
ZHANG S, YIN J H, JI H B, et al. Functional β-cell differentiation of small-tail Han sheep pancreatic mesenchymal stem cells and the therapeutic potential in type 1 diabetic mice[J]. Pancreas, 2020, 49(7): 947-954. DOI:10.1097/MPA.0000000000001604 |
| [11] |
SEEBERGER K L, DUFOUR J M, SHAPIRO A M J, et al. Expansion of mesenchymal stem cells from human pancreatic ductal epithelium[J]. Lab Invest, 2006, 86(2): 141-153. DOI:10.1038/labinvest.3700377 |
| [12] |
GOPURAPPILLY R, BHAT V, BHONDE R. Pancreatic tissue resident mesenchymal stromal cell (MSC)-like cells as a source of in vitro islet neogenesis[J]. J Cell Biochem, 2013, 114(10): 2240-2247. DOI:10.1002/jcb.24572 |
| [13] |
COOPER T T, SHERMAN S E, BELL G I, et al. Characterization of a Vimentinhigh/Nestinhigh proteome and tissue regenerative secretome generated by human pancreas-derived mesenchymal stromal cells[J]. Stem Cells, 2020, 38(5): 666-682. DOI:10.1002/stem.3143 |
| [14] |
PIXLEY J S. Mesenchymal stem cells to treat type 1 diabetes[J]. Biochim Biophys Acta Mol Basis Dis, 2020, 1866(4): 165315. DOI:10.1016/j.bbadis.2018.10.033 |
| [15] |
THAKKAR U G, TRIVEDI H L, VANIKAR A V, et al. Insulin-secreting adipose-derived mesenchymal stromal cells with bone marrow-derived hematopoietic stem cells from autologous and allogenic sources for type 1 diabetes mellitus[J]. Cytotherapy, 2015, 17(7): 940-947. DOI:10.1016/j.jcyt.2015.03.608 |
| [16] |
PÄTH G, PERAKAKIS N, MANTZOROS C S, et al. Stem cells in the treatment of diabetes mellitus-Focus on mesenchymal stem cells[J]. Metabolism, 2019, 90: 1-15. DOI:10.1016/j.metabol.2018.10.005 |
| [17] |
KHIATAH B, QI M, DU W T, et al. Intra-pancreatic tissue-derived mesenchymal stromal cells: a promising therapeutic potential with anti-inflammatory and pro-angiogenic profiles[J]. Stem Cell Res Ther, 2019, 10(1): 322. DOI:10.1186/s13287-019-1435-2 |
| [18] |
THIRLWELL K L, COLLIGAN D, MOUNTFORD J C, et al. Pancreas-derived mesenchymal stromal cells share immune response-modulating and angiogenic potential with bone marrow mesenchymal stromal cells and can be grown to therapeutic scale under Good Manufacturing Practice conditions[J]. Cytotherapy, 2020, 22(12): 762-771. DOI:10.1016/j.jcyt.2020.07.010 |
| [19] |
LIU Y L, LI F P, CAI Z G, et al. Isolation and characterization of mesenchymal stem cells from umbilical cord of giant panda[J]. Tissue Cell, 2021, 71: 101518. DOI:10.1016/j.tice.2021.101518 |
| [20] |
LUO H N, LI D S, CHEN Z S, et al. Manufacturing and banking canine adipose-derived mesenchymal stem cells for veterinary clinical application[J]. BMC Vet Res, 2021, 17(1): 96. DOI:10.1186/s12917-021-02791-3 |
| [21] |
FROHLICH J, KUBICKOVA S, MUSILOVA P, et al. Karyotype relationships among selected deer species and cattle revealed by bovine FISH probes[J]. PLoS One, 2017, 12(11): e0187559. DOI:10.1371/journal.pone.0187559 |
| [22] |
DE LORENZI L, PLANAS J, ROSSI E, et al. New cryptic karyotypic differences between cattle (Bos taurus) and goat (Capra hircus)[J]. Chromosome Res, 2015, 23(2): 225-235. DOI:10.1007/s10577-014-9462-4 |
| [23] |
DOMINICI M, LE BLANC K, MUELLER I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006, 8(4): 315-317. DOI:10.1080/14653240600855905 |
| [24] |
GOMEZ K E, WU F L, KEYSAR S B, et al. Cancer cell CD44 mediates macrophage/monocyte-driven regulation of head and neck cancer stem cells[J]. Cancer Res, 2020, 80(19): 4185-4198. DOI:10.1158/0008-5472.CAN-20-1079 |
| [25] |
LI Q, HOU H F, LI M, et al. CD73+ mesenchymal stem cells ameliorate myocardial infarction by promoting angiogenesis[J]. Front Cell Dev Biol, 2021, 9: 637239. DOI:10.3389/fcell.2021.637239 |
| [26] |
LU S H, GE M L, ZHENG Y Z, et al. CD106 is a novel mediator of bone marrow mesenchymal stem cells via NF-κB in the bone marrow failure of acquired aplastic anemia[J]. Stem Cell Res Ther, 2017, 8(1): 178. DOI:10.1186/s13287-017-0620-4 |
| [27] |
吴芳春. 牛胰腺间充质干细胞的分离培养及其生物学特性的研究[D]. 北京: 中国农业科学院, 2014. WU F C. Research on isolation, culture and biological characteristics of bovine pancreatic mesenchymal stem cells[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese) |
| [28] |
PARK S, ARAI Y, KIM B J, et al. Suppression of SPRY4 promotes osteogenic differentiation and bone formation of mesenchymal stem cell[J]. Tissue Eng Part A, 2019, 25(23-24): 1646-1657. DOI:10.1089/ten.tea.2019.0056 |
| [29] |
HAN L Z, WANG B, WANG R Y, et al. The shift in the balance between osteoblastogenesis and adipogenesis of mesenchymal stem cells mediated by glucocorticoid receptor[J]. Stem Cell Res Ther, 2019, 10(1): 377. DOI:10.1186/s13287-019-1498-0 |
| [30] |
YUAN Z Y, LI Q, LUO S H, et al. PPARγ and Wnt signaling in adipogenic and osteogenic differentiation of mesenchymal stem cells[J]. Curr Stem Cell Res Ther, 2016, 11(3): 216-225. DOI:10.2174/1574888X10666150519093429 |
| [31] |
LIN L, LI M T, LUO J S, et al. A high proportion of novel ACAN mutations and their prevalence in a large cohort of Chinese short stature children[J]. J Clin Endocrinol Metab, 2021, 106(7): e2711-e2719. DOI:10.1210/clinem/dgab088 |
| [32] |
SONG H, PARK K H. Regulation and function of SOX9 during cartilage development and regeneration[J]. Semin Cancer Biol, 2020, 67: 12-23. DOI:10.1016/j.semcancer.2020.04.008 |
| [33] |
LI S N, WU J F. TGF-β/SMAD signaling regulation of mesenchymal stem cells in adipocyte commitment[J]. Stem Cell Res Ther, 2020, 11(1): 41. DOI:10.1186/s13287-020-1552-y |
| [34] |
梁婷婷, 陈黎, 范明松, 等. 体外诱导人胎盘来源间充质干细胞向肝细胞分化[J]. 中国组织工程研究, 2022, 26(24): 3870-3874. LIANG T T, CHEN L, FAN M S, et al. In vitro differentiation of human placenta-derived mesenchymal stem cells into hepatocytes[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(24): 3870-3874. DOI:10.12307/2022.568 (in Chinese) |
(编辑 郭云雁)



