2. 南京农业大学动物科技学院,南京 210095;
3. 江苏省家禽遗传育种重点实验室,扬州 225125
2. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;
3. Key Laboratory for Poultry Genetics and Breeding of Jiangsu Province, Yangzhou 225125, China
线粒体DNA由于其母系遗传、独立的核外遗传密码以及进化速率快等独有特性,广泛被用于探讨物种遗传结构、系统进化及种质资源鉴定研究[1-3]。线粒体D-loop区又称D-环区,为线粒体DNA中的一段非编码区,它是线粒体基因组序列上变异最大的区域,被作为理想的分子标记用来研究亲缘关系较近群体的遗传起源和种质鉴定[4-7]。迄今为止,在鸡[8]、山鹧鸪[9]、鸽[10]、鸭[11]、猪[12-13]、牛[14-15]、羊[16-17]、马[18-19]、驴[20-21]、鹿[22]和小鼠[23]等诸多物种的遗传多样性和系统发育研究中已被成功应用。在我国,将线粒体D-loop区作为目标位点应用于地方鸡种遗传多样性和母系起源研究已成为科研热点[24-27]。然而其中针对线粒体优势单倍型与鸡生产性能相关性的研究甚少。1985年,Bell等[28]研究显示,由线粒体DNA遗传效应引起的细胞质效应会影响奶牛的生产性能指标,主要包括乳脂率和产奶量等。Toelle等[29]研究发现,细胞质母系效应对杜洛克猪和约克夏猪初生重、断奶重和背膘厚度等均有重要影响。Mannen等[30]研究发现,线粒体16sRNA的2 232 bp处的碱基替换可作为日本黑牛肉质性状的重要候选基因。可见,线粒体遗传效应对动物生产性能具有重要影响。
经研究显示,线粒体D-loop区遗传多样性和单倍型比例在鸡母本和后代个体中严格遵循母系遗传[31]。然而,自达尔文提出家鸡的祖先为红色原鸡以来,家鸡的母系起源问题至今还没有明确定论。1994年,Fumihito等[32]研究显示,家鸡唯一起源于分布于泰国东部及其周边地区的原鸡指名亚种。2008年,Kanginakudru等[33]揭示了分布于印度及其周边地区的原鸡印度亚种和滇南亚种,其在家鸡驯化和选育过程中也发挥了重要的作用。2020年,Wang等[34]基于全基因组测序技术,系统地比较了来自于亚洲和欧洲的大量鸡种、4种原鸡以及红色原鸡5个亚种共计863份样品,分析并提出了家鸡可能的起源地以及驯化要地。作为伴随人类农业文明起源和发展的重要家禽,从源头上查清我国地方鸡的起源驯化和进化关系,对当前品种的保护规划以及开发利用具有现实意义。
本研究拟通过研究不同类型肉鸡生长性能情况和线粒体单倍型特性,分析线粒体优势单倍型与肉鸡生长速度的相关性;同时通过与红色原鸡序列的聚类分析,探讨不同鸡种母系起源,研究结果将为肉鸡配套系选育提供理论指导。
1 材料与方法 1.1 试验材料选择6个不同类型肉鸡品种(配套系)为研究对象(表 1),其中快大型白羽肉鸡品种2个,分别为AA肉鸡和罗斯308;黄羽肉鸡品种4个,根据不同生长速度分类,分为中快速型黄羽肉鸡配套系2个(禽雁麻鸡和裕禾1号肉鸡);慢速型黄羽肉鸡配套系2个(园丰麻鸡2号和港丰瑶黑麻鸡)。其中,中快速型黄羽肉鸡多为我国地方黄羽鸡种(父系)与引进快大型隐性白羽肉鸡(母系)品种杂交选育而成,根据线粒体的母系遗传规律,配套系商品代多含有引进快大型隐性白羽肉鸡的线粒体遗传信息。而慢速型黄羽肉鸡,为保持我国地方鸡品种的优良品质,多不引入快大型肉鸡血统。AA肉鸡和罗斯308受精蛋来源于国家家禽生产性能测定站,其他鸡种受精蛋来源于相关公司(表 1),每个鸡种收集受精蛋300个,在同一条件下孵化出雏。
|
|
表 1 鸡种来源和血液采样数 Table 1 The source and blood sample number of chicken breeds |
1.2.1 生产性能测定 所有鸡种统一饲养于国家家禽生产性能测定站,按照各自公司提供的饲养规程饲养管理,生产性能测定方法参照行业标准《家禽生产性能名词术语和度量计算方法》(NY/T 823-2020)执行。
1.2.2 血样采集和总DNA提取 各鸡种血液采样数见表 1,翅静脉采血,ACD抗凝。参照文献方法提取血样基因组总DNA[35],1.0%琼脂糖(Promega,美国)凝胶电泳检测提取效果。
1.2.3 引物设计和合成 参照红色原鸡线粒体D-loop区全序列(序列号: NC_007235),利用Primer Premier 5.0设计引物,PF:5′- AAACACCCAAA- CTCACTAAC-3′;PR:5′-CACTGGGATGCGGA-TACTTGC-3′,扩增全长为1 586 bp,引物交由生工生物工程(上海)股份有限公司合成。
1.2.4 PCR扩增和测序 采用50 μL扩增体系:其中DNA模板2 μL,2×PCR Master Mix(大连宝生物公司)25 μL,10 μmol·L-1上、下游引物各1.5 μL,灭菌双蒸水20 μL。PCR扩增条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 60 s,72 ℃ 60 s,共32个循环;最后72 ℃ 10 min。采用1.2%琼脂糖(Promega,美国)凝胶电泳检测PCR扩增效果,之后交由生工生物工程(上海)股份有限公司完成测序工作,测序方法采用Sanger法,所有序列均采用双向测序。
1.3 数据处理和分析采用SeqMan程序拼接测序序列,剪去多余片段后通过BioEdit软件与红色原鸡参考序列(NC_007235)逐碱基比对。利用DnaSP 5.10软件统计突变位点总数和单倍型数等遗传多样性信息[36]。利用MEGA 5.05软件构建基于双参数遗传距离的系统发育树[37]。利用Network 10.2软件构建中介网络关系图。利用SPSS 22.0软件进行相关性分析。
2 结果 2.1 不同类型肉鸡群体生长性能测定本研究测定了公母鸡平均体重约1.8 kg时不同鸡种的日龄和饲料转化比(表 2)。结果显示,当群体平均体重约1.8 kg时,白羽肉鸡约为5周龄,饲料转化比为1.60∶1~1.65∶1;中快速型黄羽肉鸡约为8~11周龄,饲料转化比为2.09∶1~2.51∶1;慢速型黄羽肉鸡约为14周龄,饲料转化比为3.13∶1~3.35∶1。
|
|
表 2 不同鸡种初生重及公母平均体重约1.8 kg时的日龄和饲料转化比 Table 2 The birth weight and the days of age, feed conversion ratio of average body weight of male and female about 1.8 kg in different chicken breeds |
6个鸡种线粒体D-loop区突变位点和单倍型分析显示(表 3),314个个体共发现37个突变位点,可划分为40种单倍型。由Network10.2构建的中介网络关系图(图 1)可以看出,40种单倍型明显地分成了A、B、C和E 4个单倍型群(分枝),4个单倍型群分别含有9、17、5和9种单倍型以及34、65、45和170条序列。其中,出现频率最高的为单倍型E1,存在于5个品种89个个体中;其次是单倍型E3,共出现59次;再次是单倍型C2,共出现27次;第四是单倍型B1,共出现18次。
|
|
表 3 6个鸡种线粒体D-loop区突变位点和单倍型分布 Table 3 The variable sites and haplotypes distribution of mtDNA D-loop region in 6 chicken breeds |
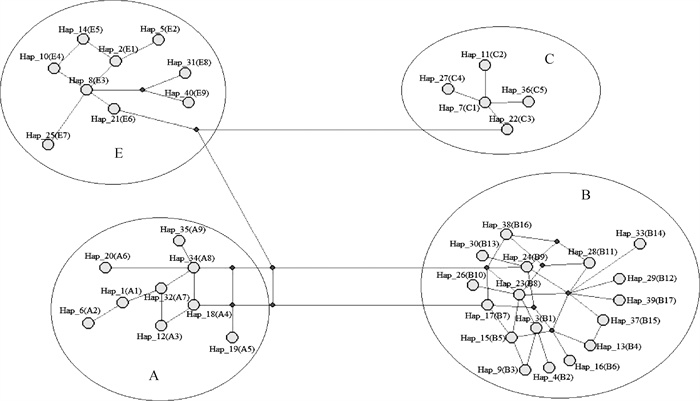
|
图 1 6个鸡种线粒体D-loop区40种单倍型Network图 Fig. 1 Network map of 40 haplotypes in mitochondrial D-loop region of 6 chicken breeds |
进一步分析显示(表 4),白羽肉鸡和中快速型黄羽肉鸡E单倍型比例较高,在AA肉鸡、罗斯308、禽雁麻鸡和裕禾1号肉鸡中占比分别为85.92%、50.00%、100.00%和70.21%;慢速型黄羽肉鸡配套系园丰麻鸡2号和港丰瑶黑麻鸡E单倍型占比相对较低,分别为15.00%和22.39%,园丰麻鸡2号优势单倍型为B单倍型,占比66.67%(40/60);港丰瑶黑麻鸡优势单倍型为C单倍型,占比40.30%(27/67)。
|
|
表 4 不同鸡种线粒体D-Loop区全序列单倍型特征 Table 4 Haplotype characteristics in different chicken breeds based on the complete sequence of D-loop region |
对不同类型肉鸡生长性能和线粒体单倍型比例之间进行相关性分析(表 5)。初生重与E单倍型比例之间呈极显著正相关(P < 0.01),与A、B和C单倍型比例之间均呈负相关,并与B和C单倍型比例之间负相关水平显著(P < 0.05);公母平均体重约1.8 kg时日龄与E单倍型比例之间呈显著负相关(P < 0.05);公母平均体重约1.8 kg时饲料转化比与E单倍型比例之间呈极显著负相关(P < 0.01),而与B和C单倍型比例之间呈显著正相关(P < 0.05)。
|
|
表 5 鸡生长性能与线粒体D-loop区单倍型之间的相关性分析 Table 5 Correlation analysis between growth performance and mitochondrial D-loop haplotype in chicken |
采用NJ法将本研究中所获得的40种单倍型与从GenBank数据库中下载的19条红色原鸡线粒体D-loop区全长序列构建系统发育树(图 2)。下载的红色原鸡序列涵盖滇南亚种(Gallus gallus spadiceus,GGS)、指名亚种(Gallus gallus gallus,GGG)、印度亚种(Gallus gallus murghi,GGM)、海南亚种(Gallus gallus jabouillei,GGJ)和印尼亚种(Gallus gallus bankiva,GGB)的序列。
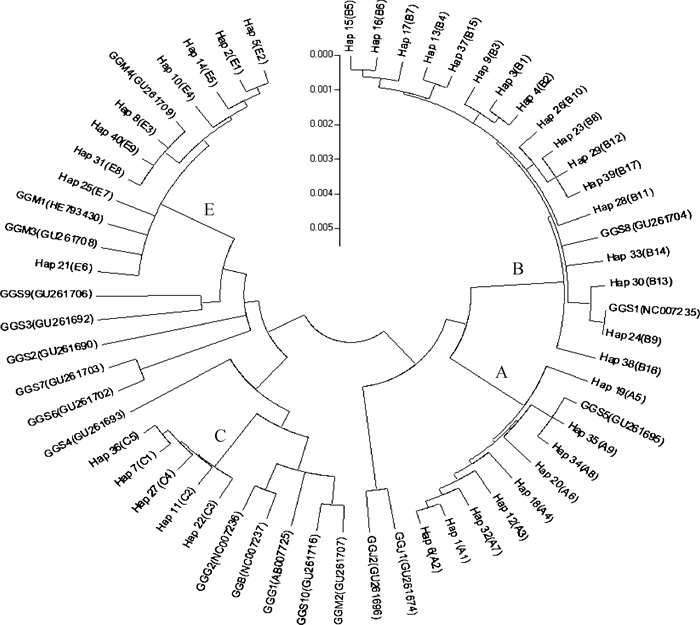
|
图 2 基于线粒体DNA D-loop区采用邻接法构建系统发育树 Fig. 2 Neighbor-joining tree based on mtDNA D-loop region |
由图 2可见,A、B、C和E 4种单倍型在发育树中均单独形成进化枝。其中A分支9种单倍型和B分支17种单倍型均与原鸡滇南亚种(GGS)聚为一枝,A分支所有个体均与GGS5(GU261695)聚为一枝,B分支所有个体与GGS8(GU261704)和GGS1(NC007235)交叉聚为一枝。E分支9种单倍型与原鸡印度亚种(GGM1、GGM3和GGM4)交叉聚为一枝。5种C单倍型聚类形成C分支,并与原鸡印度亚种GGM2、滇南亚种GGS10、指名亚种GGG1和GGG2以及印尼亚种GGB等4种红色原鸡亚种5条序列聚为一类。
3 讨论 3.1 不同类型肉鸡群体mtDNA控制区单倍型特征本研究对6个不同类型肉鸡品种(配套系)314个个体线粒体控制区序列进行研究,共发现37个突变位点和40种单倍型,参照文献规定的单倍型分类通用标准[38],40种单倍型主要分为A、B、C和E共4个单倍型群。白羽肉鸡和中快速型黄羽肉鸡均以E单倍型为优势单倍型,占比均≥50%;而慢速型黄羽肉鸡E单倍型占比均<25%,其中园丰麻鸡2号B单倍型含量较高(66.67%),港丰瑶黑麻鸡C单倍型含量相对较高(40.30%)。有研究显示,中快速型黄羽肉鸡、817杂交肉鸡以及高产蛋鸡E单倍型含量较高,而地方鸡种和慢速型黄羽肉鸡E单倍型含量则相对较低,与本研究结果一致[39]。据文献记载,线粒体E单倍型普遍存在于印度半岛、中东和欧洲地方鸡品种中,为这些地区鸡种的主要单倍型。但是在中国目前还未发现E单倍型占绝对优势的地方品种,且只在少数地方鸡种中被检测到[40]。E单倍型在中快速型黄羽肉鸡中的高比例存在,揭示了欧美商品鸡包括隐性白羽鸡和安卡红鸡等在我国肉鸡配套系的成功培育中贡献突出。
3.2 肉鸡生长速度与线粒体单倍型相关性分析与应用为了满足消费者多元化需求,我国大批黄羽肉鸡配套系被成功培育,按其生长速度可划分为快速型、中速型和慢速型三大类。由于我国地方鸡品种生长速度一般较慢,因此在培育中快速型配套系时,一般引入快大型隐性白羽肉鸡血统来提高生长速度,且在杂交过程中多以快大型隐性白羽肉鸡为母本,因此后代可较完整地遗传母本的线粒体遗传信息。本研究对不同生长速度类型肉鸡群体生产性能与线粒体D-loop区单倍型进行相关性分析,结果显示,所涉及到的肉鸡群体E单倍型与初生重之间呈极显著正相关、与公母平均体重约1.8 kg时日龄和饲料转化比之间分别呈显著和极显著负相关,即E单倍型比例越高,鸡群达到1.8 kg时日龄与快大型白羽肉鸡越接近。在本研究中,两个快大型白羽肉鸡中E单倍型所占比例分别为50.00%和85.92%,远远高于只有地方鸡血统的慢速型黄羽肉鸡的15.00%和22.39%,可见,拥有较高线粒体E单倍型占比的快大型白羽肉鸡在中快速型黄羽肉鸡的育种中贡献较大。有研究显示,利用线粒体标记进行动物辅助选育是可行的[29-31],近年来在植物上也有相关报道。钱明娟等[41]基于线粒体基因组DNA开展了水稻不育系品种细胞质进化和鉴定方法研究,成功研发了一套线粒体分子标记。张跃建等[42]基于甜瓜线粒体基因组富含SSR位点及父系遗传的特性,对328个位点进行了标记开发,有助于甜瓜的育种和种质资源保护。目前,有关线粒体基因组分子标记在鸡配套系选育方面应用的研究还未见相关报道,然而由于线粒体母系遗传的独有特性以及线粒体E单倍型在中快速型肉鸡培育过程中的重要作用,线粒体标记在肉鸡育种工作中应用前景广阔。
3.3 不同类型肉鸡群体系统发生关系和母系起源家鸡不仅品种丰富,而且饲养范围广泛,其驯化过程和母系起源自达尔文时代以来就备受广大学者关注[43-45]。2006年,Liu等[38]基于mtDNA控制区第一高变区对世界家鸡和红色原鸡的世系构成进行研究,发现主要包括A、B、C、D、E、F、G、H和I型等9个母系。2013年,Miao等[46]对世界各地家鸡样本线粒体控制区序列进行了系统研究,揭示了家鸡和红色原鸡的世系构成除了Liu等[38]的研究结果外,还包括W、X、Y和Z型。本研究聚类分析结果发现,拥有A或B单倍型的个体均仅与原鸡滇南亚种交叉聚为一枝。且有研究显示,我国地方鸡品种中绝大多数以A或B单倍型为优势单倍型[24]。由此推测,在我国地方鸡品种长期驯化以及慢速型黄羽肉鸡选育过程中,均保留了原鸡滇南亚种母系血统。本研究中,E单倍型所有个体均仅与红色原鸡印度亚种交叉聚为一枝。据文献记载,E单倍型是南亚和欧美商品鸡的主要单倍型[38]。广大育种者在中快速型肉鸡配套系的选育过程中引入了这些外来鸡种血液,进而加快了育种进程。而拥有C单倍型的个体分别与原鸡指名亚种、滇南亚种、印度亚种以及印尼亚种交叉聚为一枝,可见C分支在长期驯化过程中可能受到多种原鸡亚种血统的影响,母系起源颇为丰富。
4 结论本研究中,6个肉鸡群体314个个体线粒体D-loop区全序列共发现37个突变位点,共组成40种单倍型,并划分为A、B、C和E共4个单倍型群。线粒体单倍型与肉鸡生长速度相关紧密,其中E单倍型与肉鸡生长速度呈现极显著正相关。E单倍型为白羽肉鸡和中快速型黄羽肉鸡的优势单倍型,而在慢速型黄羽肉鸡群体中其比例普遍较低。母系起源分析显示,原鸡滇南亚种为A和B单倍型群的主要起源,印度亚种为E单倍型群的主要起源,而C单倍型群则起源于原鸡指名亚种、滇南亚种、印度亚种和印尼亚种。
| [1] |
PARK Y J, LEE M N, KANG J H, et al. Population genetic structure of Semisulcospira gottschei: simultaneous examination of mtDNA and microsatellite markers[J]. Mol Biol Rep, 2021, 48(1): 97-104. DOI:10.1007/s11033-020-05821-9 |
| [2] |
ARMSTRONG E, IRIARTE A, MARTíNEZ A M, et al. Genetic diversity analysis of the Uruguayan Creole cattle breed using microsatellites and mtDNA markers[J]. Genet Mol Res, 2013, 12(2): 1119-1131. DOI:10.4238/2013.April.10.7 |
| [3] |
KUSZA S, ZAKAR E, BUDAI C, et al. Mitochondrial DNA variability in Gyimesi Racka and Turcana sheep breeds[J]. Acta Biochim Pol, 2015, 62(2): 273-280. DOI:10.18388/abp.2015_978 |
| [4] |
李新建, 薛亚辉, 王明宇, 等. 河南地方猪mtDNA D-loop序列遗传多样性及系统进化分析[J]. 河南农业大学学报, 2020, 54(3): 452-461. LI X J, XUE Y H, WANG M Y, et al. Genetic diversity and phylogenetic relationships of Henan native pig breeds based on the sequence of mtDNA D-loop region[J]. Journal of Henan Agricultural University, 2020, 54(3): 452-461. (in Chinese) |
| [5] |
EFFA K, ROSENBOM S, HAN J L, et al. Genetic diversities and historical dynamics of native Ethiopian horse populations (Equus caballus) inferred from mitochondrial DNA polymorphisms[J]. Genes (Basel), 2021, 12(2): 155. DOI:10.3390/genes12020155 |
| [6] |
NIGUSSIE H, MWACHARO J M, OSAMA S, et al. Genetic diversity and matrilineal genetic origin of fat-rumped sheep in Ethiopia[J]. Trop Anim Health Prod, 2019, 51(6): 1393-1404. DOI:10.1007/s11250-019-01827-z |
| [7] |
COZZI M C, VALIATI P, CHERCHI R, et al. Mitochondrial DNA genetic diversity in six Italian donkey breeds (Equus asinus)[J]. Mitochondrial DNA A, 2018, 29(3): 409-418. DOI:10.1080/24701394.2017.1292505 |
| [8] |
ISLAM M A, OSMAN S A M, NISHIBORI M. Genetic diversity of Bangladeshi native chickens based on complete sequence of mitochondrial DNA D-loop region[J]. Br Poult Sci, 2019, 60(6): 628-637. DOI:10.1080/00071668.2019.1655708 |
| [9] |
李雪娟, 黄原, 雷富民. 山鹧鸪属鸟类线粒体基因组的比较及系统发育研究[J]. 遗传, 2014, 36(9): 912-920. LI X J, HUANG Y, LEI F M. Comparative and phylogenomic analyses on mitochondrial genomes of Arborophila species[J]. Hereditas, 2014, 36(9): 912-920. (in Chinese) |
| [10] |
LEE J C I, TSAI L C, LIAO S P, et al. Evaluation of the polymorphic D-loop of Columba livia in forensic applications[J]. Electrophoresis, 2010, 31(23-24): 3889-3894. DOI:10.1002/elps.201000414 |
| [11] |
DE A K, SAWHNEY S, BHATTACHARYA D, et al. Origin, genetic diversity and evolution of Andaman local duck, a native duck germplasm of an insular region of India[J]. PLoS One, 2021, 16(2): e0245138. DOI:10.1371/journal.pone.0245138 |
| [12] |
李正杰, 周先坤, 王浥尘, 等. 阿坝藏族羌族自治州若尔盖地区藏猪mtDNA D-Loop的遗传多样性分析[J]. 畜牧兽医学报, 2019, 50(12): 2387-2399. LI Z J, ZHOU X K, WANG Y C, et al. Genetic diversity of Tibetan pig mitochondrial DNA D-loop in Ruoergai area of A' ba Tibetan and Qiang autonomous prefecture[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(12): 2387-2399. DOI:10.11843/j.issn.0366-6964.2019.12.003 (in Chinese) |
| [13] |
赵忠海, 周迪, 李辉, 等. 利用mtDNA D-loop区研究贵州猪种的遗传多样性与起源[J]. 农业生物技术学报, 2019, 27(7): 1206-1214. ZHAO Z H, ZHOU D, LI H, et al. Genetic diversity and origin of Guizhou pig (Sus scrofa domesticus) breeds analyzed by mtDNA D-loop region[J]. Journal of Agricultural Biotechnology, 2019, 27(7): 1206-1214. (in Chinese) |
| [14] |
李静, 郭丽君, 王莉, 等. 喀喇昆仑-帕米尔地区牦牛mtDNA D-Loop区遗传多样性及系统发育分析[J]. 中国畜牧兽医, 2020, 47(8): 2481-2492. LI J, GUO L J, WANG L, et al. Analyses of genetic diversity and phylogeny of mtDNA D-loop from yak in Karakoram-Pamir area[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(8): 2481-2492. (in Chinese) |
| [15] |
齐国强, 昝林森, 张桂香, 等. 中国部分地方水牛品种mtDNA D-loop区遗传多样性与起源研究[J]. 畜牧兽医学报, 2008, 39(1): 7-11. QI G Q, ZAN L S, ZHANG G X, et al. Mitochondrial DNA D-loop genetic diversity and origin of some Chinese domestic buffalo breeds[J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(1): 7-11. DOI:10.3321/j.issn:0366-6964.2008.01.002 (in Chinese) |
| [16] |
ALJUBOURI T R S, AL-SHUHAIB M B S. Genotyping of mitochondrial D-loop sequences in three breeds of sheep[J]. Biologia, 2021, 76(1): 203-211. DOI:10.2478/s11756-020-00543-6 |
| [17] |
李芳玉, 黄光云, 王自豪, 等. 都安山羊和隆林山羊mtDNA D-loop区遗传多态性研究[J]. 中国畜牧杂志, 2020, 56(8): 69-72. LI F Y, HUANG G Y, WANG Z H, et al. Genetic polymorphism of mtDNA D-loop region in Du'an goat and Longlin goat[J]. Chinese Journal of Animal Science, 2020, 56(8): 69-72. (in Chinese) |
| [18] |
DELL A C, CURRY M C, YARNELL K M, et al. Mitochondrial D-loop sequence variation and maternal lineage in the endangered Cleveland Bay horse[J]. PLoS One, 2020, 15(12): e0243247. DOI:10.1371/journal.pone.0243247 |
| [19] |
周凡莉, 黄卫平, 金素钰, 等. 建昌马mtDNA D-loop区遗传多样性及系统进化分析[J]. 中国畜牧兽医, 2020, 47(1): 63-73. ZHOU F L, HUANG W P, JIN S Y, et al. Genetic diversity and evolutionary analysis of mtDNA D-loop region in Jianchang horse[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(1): 63-73. (in Chinese) |
| [20] |
李慧锋, 赵婧微, 陈员玉, 等. 晋南驴mtDNA D-loop区部分序列系统进化分析与体型测定[J]. 山西农业大学学报: 自然科学版, 2020, 40(4): 121-128. LI H F, ZHAO J W, CHEN Y Y, et al. Phylogenetic analysis of partial mtDNA D-loop sequence in Jinnan donkey and their body size measurement[J]. Journal of Shanxi Agricultural University: Natural Science Edition, 2020, 40(4): 121-128. (in Chinese) |
| [21] |
XIA X, YU J, ZHAO X, et al. Genetic diversity and maternal origin of Northeast African and South American donkey populations[J]. Anim Genet, 2019, 50(3): 266-270. DOI:10.1111/age.12774 |
| [22] |
JU Y, LIU H M, HE J M, et al. Genetic diversity of Aoluguya Reindeer based on D-loop region of mtDNA and its conservation implications[J]. Gene, 2020, 733: 144271. DOI:10.1016/j.gene.2019.144271 |
| [23] |
MALTSEV A N, STAKHEEV V V, BOGDANOV A S, et al. Phylogenetic relationships of intraspecific forms of the house mouse Mus musculus: analysis of variability of the control region (D-loop) of mitochondrial DNA[J]. Dokl Biol Sci, 2015, 465(1): 285-288. DOI:10.1134/S0012496615060058 |
| [24] |
贾晓旭, 唐修君, 樊艳凤, 等. 华东地区地方鸡品种mtDNA控制区遗传多样性[J]. 生物多样性, 2017, 25(5): 540-548. JIA X X, TANG X J, FAN Y F, et al. Genetic diversity of local chicken breeds in East China based on mitochondrial DNA D-loop region[J]. Biodiversity Science, 2017, 25(5): 540-548. (in Chinese) |
| [25] |
黄勋和, 余哲琪, 翁茁先, 等. 广东省地方鸡线粒体遗传多样性与母系起源[J]. 生物多样性, 2018, 26(3): 238-247. HUANG X H, YU Z Q, WENG Z X, et al. Mitochondrial genetic diversity and maternal origin of Guangdong indigenous chickens[J]. Biodiversity Science, 2018, 26(3): 238-247. (in Chinese) |
| [26] |
李兴才, 潘成勇, 李辉, 等. 香炉山鸡线粒体DNA D-Loop区遗传多样性及系统进化研究[J]. 中国畜牧兽医, 2019, 46(9): 2633-2641. LI X C, PAN C Y, LI H, et al. Study on genetic diversity and system evolution of mtDNA D-loop region in Xianglushan chicken[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(9): 2633-2641. (in Chinese) |
| [27] |
王荣琼, 张自芳, 黄静, 等. 腾冲雪鸡mtDNA D-loop区遗传多样性分析[J]. 云南农业大学学报: 自然科学, 2021, 36(1): 75-81. WANG R Q, ZHANG Z F, HUANG J, et al. Genetic diversity of mtDNA D-loop region in Tengchong white chicken[J]. Journal of Yunnan Agricultural University: Natural Science, 2021, 36(1): 75-81. (in Chinese) |
| [28] |
BELL B R, MCDANIEL B T, ROBISON O W. Effects of cytoplasmic inheritance on production traits of dairy cattle[J]. J Dairy Sci, 1985, 68(8): 2038-2051. |
| [29] |
TOELLE V, MCDANIEL B, ROBISON O. Cytoplasmic effects in swine[J]. J Anim Sci, 1986, 63: 203. |
| [30] |
MANNEN H, MORIMOTO M L, OYAMAT K, et al. Identification of mitochondrial DNA substitutions related to meat quality in Japanese Black cattle[J]. J Anim Sci, 2003, 81(1): 68-73. |
| [31] |
唐修君, 樊艳凤, 贾晓旭, 等. 基于线粒体控制区的鸡不同杂交组合遗传多样性研究[J]. 畜牧兽医学报, 2021, 52(6): 1523-1534. TANG X J, FAN Y F, JIA X X, et al. Study on genetic diversity in different hybrid combinations of chickens based on mitochondrial control region[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(6): 1523-1534. (in Chinese) |
| [32] |
FUMIHITO A, MIYAKE T, SUMI S, et al. One subspecies of the red junglefowl (Gallus gallus gallus) suffices as the matriarchic ancestor of all domestic breeds[J]. Proc Natl Acad Sci U S A, 1994, 91(26): 12505-12509. |
| [33] |
KANGINAKUDRU S, METTA M, JAKATI R D, et al. Genetic evidence from Indian red jungle fowl corroborates multiple domestication of modern day chicken[J]. BMC Evol Biol, 2008, 8: 174. |
| [34] |
WANG M S, THAKUR M, PENG M S, et al. 863 genomes reveal the origin and domestication of chicken[J]. Cell Res, 2020, 30(8): 693-701. |
| [35] |
萨姆布鲁克 J, 拉塞尔 D W. 分子克隆实验指南[M]. 3版. 北京: 科学出版社, 2002: 461-512. SAMBROOK J, RUSSELL D W. Molecular cloning: a laboratory manual[M]. 3rd ed. Beijing: SciencePress, 2002: 461-512. (in Chinese) |
| [36] |
ROZAS J, SÁNCHEZ-DELBARRIO J C, MESSEGUER X, et al. DnaSP, DNA polymorphism analyses by the coalescent and other methods[J]. Bioinformatics, 2003, 19(18): 2496-2497. |
| [37] |
TAMURA K, DUDLEY J, NEI M, et al. MEGA4:molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Mol Biol Evol, 2007, 24(8): 1596-1599. |
| [38] |
LIU Y P, WU G S, YAO Y G, et al. Multiple maternal origins of chickens: out of the Asian jungles[J]. Mol Phylogenet Evol, 2006, 38(1): 12-19. |
| [39] |
唐修君, 樊艳凤, 贾晓旭, 等. 基于线粒体DNA D-loop区的肉鸡品种遗传多样性和起源分析[J]. 中国农业科学, 2021, 54(24): 5302-5315. TANG X J, FAN Y F, JIA X X, et al. Genetic diversity and origin characteristics of chicken species based on mitochondrial DNA D-loop region[J]. Scientia Agricultura Sinica, 2021, 54(24): 5302-5315. (in Chinese) |
| [40] |
OSMAN S A M, YONEZAWA T, NISHIBORI M. Origin and genetic diversity of Egyptian native chickens based on complete sequence of mitochondrial DNA D-loop region[J]. Poult Sci, 2016, 95(6): 1248-1256. |
| [41] |
钱明娟, 谢红卫, 李绍清, 等. 水稻线粒体SCAR分子标记的开发与应用[J]. 分子植物育种, 2016, 14(10): 2671-2679. QIAN M J, XIE H W, LI S Q, et al. Development and application of rice mitochondrial SCAR molecular markers[J]. Molecular Plant Breeding, 2016, 14(10): 2671-2679. (in Chinese) |
| [42] |
张跃建, 寿伟松, 沈佳. 甜瓜(Cucumis melo L. )线粒体基因组标记的开发及应用[J]. 分子植物育种, 2020, 18(12): 3980-3994. ZHANG Y J, SHOU W S, SHEN J. Development and application of mitochondrial SSR markers in Cucumis melo L.[J]. Molecular Plant Breeding, 2020, 18(12): 3980-3994. (in Chinese) |
| [43] |
LAWLER A. Dawn of the chicken revealed in Southeast Asia[J]. Science, 2020, 368(6498): 1411. |
| [44] |
SILVA P, GUAN X, HO-SHING O, et al. Mitochondrial DNA-based analysis of genetic variation and relatedness among Sri Lankan indigenous chickens and the Ceylon junglefowl (Gallus lafayetti)[J]. Anim Genet, 2009, 40(1): 1-9. |
| [45] |
Al-JUMAILI A S, BOUDALI S F, KEBEDE A, et al. The maternal origin of indigenous domestic chicken from the Middle East, the north and the horn of Africa[J]. BMC Genet, 2020, 21(1): 30. |
| [46] |
MIAO Y W, PENG M S, WU G S, et al. Chicken domestication: an updated perspective based on mitochondrial genomes[J]. Heredity (Edinb), 2013, 110(3): 277-282. |
(编辑 郭云雁)



