肝是动物机体最大的实质性器官,也是最大的腺体,具有独特的血流动力学特征和复杂的生理功能[1]。世界小动物兽医协会(WSAVA)将小动物肝疾病划分为4类:血管性疾病、胆道疾病、实质性疾病和肿瘤性肝胆疾病[2]。影像学检查对于肝疾病的诊断和治疗可提供极大的帮助,其中,以增强CT的诊断准确性最高。在医学上,腹部CT对于超过95%的肿块性病变诊断是有用的[3]。CT扫描可以诊断肝肿瘤、肝囊肿、肝结节增生等,并且可以清楚的看到病变部位、形态、数量,并测量其大小,而肝多期增强扫描可以明显提高小病灶的检出率,观察病变的强化特性,对病变进行定性、鉴别诊断,其中肝血管造影是诊断血管性肝疾病的金标准[4-5]。随着兽医领域CT设备的引进,小动物肿瘤性疾病的诊断率大大提高[6],虽然在医学上已经建立了详细的CT多期增强扫描方案,但在小动物上对于肝的多期增强扫描方案的研究却很匮乏。因此本研究以不同体型的犬为研究对象,重点研究了造影剂剂量、注射速率以及扫描延迟时间对多期增强扫描获得肝图像质量的影响,以期建立小动物肝多期增强扫描方案标准。
1 材料与方法 1.1 试验动物9只健康本地杂种犬,小型犬(<10 kg)3只,中型犬(10~20 kg)4只,大型犬(>20 kg)2只。在试验前进行血常规和血液生化检查,未发现各指标异常。试验犬饲养在通风良好、环境整洁的房间。
1.2 主要药品及仪器设备碘海醇100 mL:35 g(I)(湖南金健药业有限公司),舒眠宁Ⅱ(本实验室制备[7]);X射线计算机断层摄影设备supria 32排16层(日立);高压注射泵Zenith-C11(深圳市信冠机电有限公司)。
1.3 试验方法1.3.1 动物准备 试验犬禁食、禁水12 h,麻醉前肌内注射阿托品(0.04 mg·kg-1),舒眠宁Ⅱ肌内注射(0.05 mL·kg-1)麻醉,前肢头静脉埋置22 G留置针。
1.3.2 CT平扫 试验犬麻醉后俯卧于检查床上,将患犬前肢向前牵拉,后肢向后牵拉,腹部贴在检查床上,正中矢状面与检查床垂直,固定患犬后将检查部位送入扫描架,使矢状面激光定位线与棘突重合,基线位于横隔前缘。常用参数:层厚1.25~2.50 mm,管电压120 kV,管电流200 mA,螺距1,窗宽、窗位分别为300、40 HU。扫描范围为横膈前缘至左侧肾门,扫描模式为容积扫描。
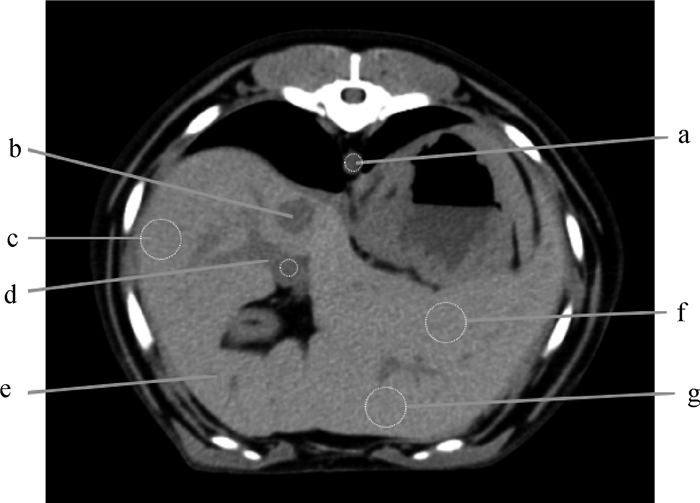
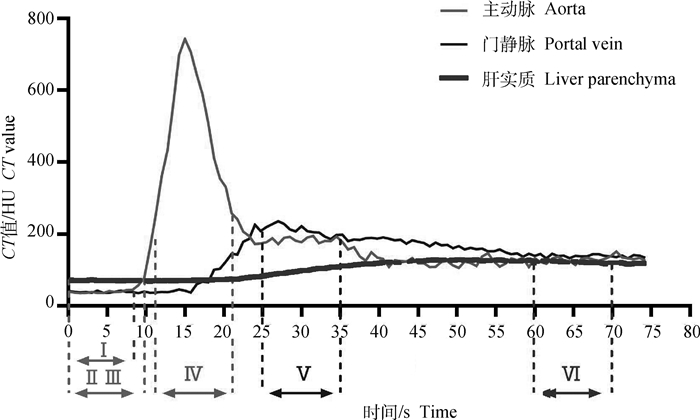
1.3.3 造影剂剂量及速率优化 选择碘海醇(350 mg·mL-1,以I含量计,下同)作为造影剂。采用动态扫描模式优化碘海醇的使用剂量(500、575、650 mg·kg-1),优化造影剂注射速率(2、3 mL·s-1)。首先进行CT平扫,选择适合观察的横断面作为检测层,如图 1所示,该检测层位于门静脉右干分叉处横断面,此断面可同时测量主动脉、门静脉和肝实质CT值。前肢头静脉注射造影剂,然后注射生理盐水(1 mL·kg-1),速率同碘海醇。CT扫描和造影剂推注同时启动,从开始注射造影剂起,每0.75 s扫描一次检测层,扫描模式为动态扫描。连续监测75 s。扫描条件:电压120 kV,电流200 mA,球管旋转时间0.75 s,层厚1.25 mm。所有CT图像采用相同的窗宽(300 HU)和窗位(40 HU)进行评价。在检测层断面上于主动脉中心、门静脉中心和肝左外叶、左内叶、右外叶放置圆形感兴趣区(region of interest,ROI),测量各部位的CT值,肝实质测量需避开肝血管及胆道系统(图 1虚线圆圈所示)。以扫描时间作为横坐标,CT值作为纵坐标,绘制时间-密度曲线。统计造影前后主动脉、门静脉及肝实质CT值。如图 2所示,造影前主动脉CT值:扫描开始后到造影剂未到达主动脉之前所有时间点的CT值的平均值。造影前门静脉CT值:扫描开始后14个时间点的CT值的平均值。造影前肝实质CT值:扫描开始后14个时间点的CT值的平均值。造影后主动脉CT值:主动脉CT峰值附近CT值较高的14个时间点的CT值的平均值。造影后门静脉CT值:门静脉CT峰值附近CT值较高的14个时间点的CT值的平均值。造影后肝实质CT值:肝实质CT峰值附近CT值较高的14个时间点的CT值的平均值。计算主动脉、门静脉、肝实质CT增强值(ΔCTEmax=造影后CT值-造影前CT值)。造影剂剂量和速率选择标准:选择主动脉、门静脉、肝实质ΔCTEmax最大的组别,在ΔCTEmax差异不显著的情况下,考虑到造影剂对肾功能的影响,选择剂量最少的组别作为最佳造影剂剂量和速率标准[6, 8]。
|
a.主动脉;b.后腔静脉;c.肝右外叶;d.门静脉;e.肝右内叶;f.肝左外叶;g.肝左内叶 a. Aorta; b. Posterior vena cava; c. Right outer lobe of liver; d. Portal vein; e. Right inner lobe of liver; f. Left outer lobe of liver; g. Left inner lobe of liver 图 1 检测层 Fig. 1 Detection layer |
|
Ⅰ.造影前主动脉CT值;Ⅱ.造影前门静脉CT值;Ⅲ.造影前肝实质CT值;Ⅳ.造影后主动脉CT值;Ⅴ.造影后门静脉CT值;Ⅵ.造影后肝实质CT值 Ⅰ. CT value of aorta before angiography; Ⅱ. CT value of portal vein before angiography; Ⅲ. CT value of liver parenchyma before angiography; Ⅳ. CT value of aorta after angiography; Ⅴ. CT value of portal vein after angiography; Ⅵ. CT value of liver parenchyma after angiography 图 2 时间-密度曲线 Fig. 2 Time-density curve |
1.3.4 确定最佳扫描延迟时间 使用最佳造影剂剂量、速率对不同体型的犬进行动态扫查,测量主动脉、门静脉、肝实质的CT值,方法同“1.3.3”,以扫描时间作为横坐标,CT值作为纵坐标,绘制时间-密度曲线,统计造影后主动脉、门静脉及肝实质达到CT峰值的时间即达峰时间(tmax)[6]。计算主动脉、门静脉及肝实质达峰时间与注射时间的差值,即ΔtAO/ΔtSP/ΔtL,ΔtAO:主动脉tmax与注射时间的差值,ΔtSP:门静脉tmax与注射时间的差值;ΔtL:肝实质tmax与注射时间的差值。根据上述结果确定扫描延迟时间,延迟时间=注射时间+ΔtAO/ΔtSP/ΔtL-1/2扫描时间,其中, 注射时间为造影剂注射时间与生理盐水注射时间的总和(精确到个位数,四舍五入),具体计算方法为注射时间=体重(kg)×碘剂量/碘浓度/注射速率+体重(kg)×生理盐水剂量(1 mL·kg-1)/注射速率(s),本研究采用碘剂量为575 mg·kg-1,碘浓度为350 mg·mL-1。扫描时间为CT扫描设备根据动物扫描范围系统计算得到。
1.3.5 临床应用 使用最佳造影剂剂量、速率,最佳扫描延迟时间进行临床病例扫查,获取图像,两名兽医放射科医生在不事先了解对比剂注射方案的情况下,使用4分制评分系统(1分:动脉期肝动脉未充盈,门脉期门静脉未充盈,实质期肝实质CT增强值<50 HU;2分:动脉期肝动脉充盈不佳,门脉期门静脉充盈不佳,肝实质CT值增强<50 HU;3分:动脉期肝动脉充盈良好,门脉期门静脉充盈良好,肝实质CT增强值>50 HU;4分:动脉期肝动脉充盈良好,外周分支显现良好,门脉期门静脉充盈良好,外周分支显现良好,实质期肝实质增强>50 HU,图像质量良好)[9]。3分及以上效果良好,可以用于诊断。
2 结果 2.1 最佳造影剂量和注射速率优化采用不同的造影剂剂量和注射速率进行动态扫描,获得主动脉、门静脉、肝实质的CT值,计算主动脉、门静脉、肝实质的ΔCTEmax,结果如表 1所示,相同的注射速率下,随着造影剂剂量的增加,主动脉、门静脉、肝实质ΔCTEmax增加。对于主动脉和门静脉ΔCTEmax,650和575 mg·kg-1碘用量差异不显著,但显著高于500 mg·kg-1。对于肝实质ΔCTEmax,650、575、500 mg·kg-1 3个用量之间没有显著差异。相同造影剂用量,注射速率对主动脉、门静脉、肝实质ΔCTEmax影响不显著。因此研究选择575 mg·kg-1碘海醇用量和3 mL·s-1注射速率进行后续延迟时间的研究。
|
|
表 1 主动脉、门静脉、肝实质区域ΔCTEmax Table 1 ΔCTEmax of aorta, portal vein and liver parenchyma |
采用最佳造影剂剂量(575 mg·kg-1)、速率(3 mL·s-1)进行动态扫描,获得主动脉、门静脉、肝实质的CT值,统计主动脉、门静脉、肝实质的达峰时间(tmax),结果如表 2所示。达峰值时间随体重、注射时间的增加而增加,且随着体重的不断增加,大型犬tmax的增加幅度变小,ΔtROI变小。动物的体重对延迟时间有较明显的影响,将动物分为3种体型,计算得到小、中、大型犬ΔtAO分别为7、9、和4 s,ΔtSP分别为21、23和17 s,ΔtL分别为41、44和34 s。肝各期的扫描延迟时间如表 3所示,不同体型,扫描延迟时间存在差异,扫描时间亦存在差异,各期扫描延迟时间以“注射时间+ΔtAO/ΔtSP/ΔtL-1/2扫描时间”表示。
|
|
表 2 主动脉、门静脉、肝实质tmax Table 2 tmax of aorta, portal vein and liver parenchyma |
|
|
表 3 各期延迟时间 Table 3 Delay time of each period |
采用最佳造影剂剂量(575 mg·kg-1)、速率(3 mL·s-1)及最佳扫描延迟时间应用于100例临床病例,获取图像如图 3所示,可以看到的动脉期主动脉、肝动脉及其远端分支充盈良好,门脉期门静脉及其远端分支充盈良好,实质期肝实质CT值上升>50 HU,各期图像质量良好。两名兽医放射科医生对图像质量评分,100例病例评分结果如表 4所示,两位医生对所有病例的评分均在3分以上,对超过80%的病例评分4分,说明使用本研究所采用的造影剂剂量(575 mg·kg-1)、速率(3 mL·s-1)及最佳扫描延迟时间,绝大多数病例获得的图像质量良好,对于肝疾病的诊断效果良好。

|
A.动脉期;B.门脉期;C.实质期 A. Arterial phase; B. Portal phase; C. Substantive period 图 3 肝多期增强扫描图像 Fig. 3 Multi-phase enhance scanning image of live |
|
|
表 4 图像质量评分结果 Table 4 Image quality score results |
CT平扫可通过对肝实质密度的检测反映肝的病变,而造影检查在平扫的基础上可以更加清楚的显示病变的轮廓,并根据不同病变的造影增强特点进行鉴别诊断[10-11]。因此肝CT多期增强扫描有助于鉴别诊断肝占位性病变,为临床治疗奠定基础。
在肝多期增强扫描中,对于造影剂条件,能改变的因素共有4个,即造影剂剂量、浓度、注射速率和注射时间。剂量、浓度、注射速率均主要影响肝增强时间密度曲线的纵轴,即CT增强值,而注射时间则主要影响时间密度曲线的横轴,即各期在时间上的分布。
在考虑造影剂剂量时,均以mg·kg-1(以I含量计)表示,而不是以mL·kg-1表示,这是因为,碘总量才是影响肝成像能力真正因素[11]。从研究结果来看,相同注射速率下,剂量越高,肝实质增强值越高。医学研究表明,与增强前相比,肝CT值上升50 HU以上将利于肝肿瘤的诊断[12],确定最佳剂量为600 mg·kg-1[11]。而在大多数兽医研究中,基本为800 mg·kg-1的剂量[13],远远高于医学上造影剂剂量。医学研究表明,碘制剂存在引发对比剂肾病、对比剂外渗及其他全身不良反应的风险[14]。也已经有很多兽医研究者在尝试通过增加盐水冲刷来降低造影剂的用量[15]。在本研究中,选取了3个造影剂剂量进行优化,最终选择了575 mg·kg-1的造影剂剂量,此剂量既能达到最佳的造影增强效果(使所有试验动物的肝实质CT增强值>50 HU),且远小于大部分兽医文献造影剂剂量,对于健康动物肾功能无明显影响。
对于造影剂的浓度,研究表明,造影剂浓度对于肝多期增强扫描的影响,远小于造影剂用量及注射速率的影响。当用量能够满足肝实质增强的条件,对比剂注射速率能满足动脉期动脉CT增强值时,使用低浓度的造影剂也可以获得较好的造影效果[11]。所以,本研究在对造影条件进行优化时,并未比较各浓度下造影增强效果,而直接选取市面上最常见的造影剂浓度(100 mL:35 g I)。
注射速率是影响单位时间碘量的最直接也是最重要的因素,而碘流率直接决定了动脉期主动脉的增强和富血供肿瘤的增强。医学研究表明,对富血供肝细胞癌检出能力方面,注射速率最少需要3 mL·s-1以上。在兽医临床上,对于肝多期增强扫描,注射速率从0.5~5 mL·s-1不等[16-18]。由于病例数量有限,目前并未有明确的研究统计注射速率对富血供肝细胞瘤检出率的影响。相比较人的造影增强来说,造影剂对于犬主动脉的增强有所不同。对于体重小的犬,高的注射速率可以形成较大的主动脉峰值,但造成了主动脉时间-密度曲线的高斜率,并不利于16层螺旋CT的扫描。有研究表明,造影剂注射时间越短,动脉期的延迟时间就越难确定[11]。所以对于体重较轻动物的扫描,往往存在难以抓住最佳动脉期延迟时间的问题。在本研究中,设定的两个速率(2、3 mL·s-1)之间并未发现明显的肝实质峰值到达时间差别。最终根据主动脉、门静脉及肝实质CT增强值确定最佳造影剂速率为3 mL·s-1。
本研究并未深入探讨固定注射时间对造影效果的影响,一方面,是由于犬的体重差异过大,导致造影剂剂量差异过大,若固定造影剂注射时间,则小型犬注射速率过低,导致主动脉峰值过低,大型犬造影剂剂量过大,将出现注射速率过高的问题,增加了造影剂的注射风险。在本研究中,注射时间对各期延迟时间的影响可由公式推导而来,也就无需过多担心经验性扫描错过最佳延迟时间的问题了。
在获取最佳造影条件后,如何让造影效果在多期增强扫描中得到最大化的呈现,一个至关重要的因素就是选择合适的扫描时间了,合适的扫描时间直接决定了各期增强扫描的成败。肝相比较其他脏器特殊,为动脉和门静脉双重血供,所以肝的多期增强扫描主要分为3期:①动脉(晚)期:肝动脉浓度达到峰值,门静脉逐渐强化,肝静脉无强化,利于诊断肝富血供肿瘤。②门脉期:门静脉、肝动脉、肝静脉强化良好,利于诊断肝血管瘤和胆道异常等。③肝实质期:肝浓度达到峰值所有血管对比度强化均匀,利于诊断肝单纯囊性病变、乏血供肿瘤等[11, 19]。本研究根据肝增强的时间-密度曲线所反映的增强特点,统计造影后主动脉、门静脉及肝实质达到CT峰值的时间即达峰时间(tmax),计算主动脉、门静脉及肝实质达峰时间与注射时间的差值平均值,即ΔtAO/ΔtSP/ΔtL,根据统计及计算结果确定各期扫描延迟时间公式为“延迟时间=注射时间+ΔtAO/ΔtSP/ΔtL-1/2扫描时间”。有研究表明,延迟时间=达峰时间-1/2扫描时间,而对于CT造影检查中的对比剂注射,达峰时间主要受注射时间影响,并受到一部分团注时间影响[20]。所以在本研究所得到的公式中引入了“注射时间”这个因素,在此公式中,注射时间为造影剂和生理盐水的总注射时间,ΔtROI为达峰时间与注射时间的差值平均值,而扫描时间直接由CT机器的系统决定,低排的CT机器扫描时间长,扫描范围也影响扫描时间。使用本研究所得到的最佳造影剂条件:剂量575 mg·kg-1、生理盐水1 mL·kg-1、速率3 mL·s-1以及最佳各期扫描延迟时间“注射时间+ΔtAO/ΔtSP/ΔtL-1/2扫描时间”(表 3),即使16层螺旋CT在犬的扫描上也可达到一个令人满意的效果,完全可以应用于临床上犬肝疾病的CT造影检查,获得的图像质量良好,对于肝疾病的诊断效果良好。
4 结论本研究建立了犬肝多期增强扫描操作规范,采用碘海醇剂量575 mg·kg-1(I含量)、生理盐水剂量1 mL·kg-1、注射速率3 mL·s-1的条件进行造影。肝动脉期、门脉期、实质期最佳扫描延迟时间可用公式“注射时间+ΔTROI-1/2扫描时间”计算得到,其中,小、中、大3种体型犬的ΔtAO分别为7、9和4 s,ΔtSP分别为21、23、和17 s,ΔtL分别为41、44和34 s。
| [1] |
郭宏彬. 超声在诊断犬肝脏疾病中的应用[D]. 长春: 吉林大学, 2016. GUO H B. Application of ultrasound in the diagnosis of liver disease in dogs[D]. Changchun: Jilin University, 2016. (in Chinese) |
| [2] |
WSAVA Liver Standardization Group. WSAVA standards for clinical and histological diagnosis of canine and feline liver diseases[M]. Amsterdam: Elsevier Ltd, 2006.
|
| [3] |
ITO K, ONO C, KOHNO A, et al. Is intravenous contrast enhancement effective in improving CT diagnosis of hepatic disease?[J]. Nihon Igaku Hoshasen Gakkai Zasshi, 2003, 63(4): 160-170. |
| [4] |
肖恩, 梅晓婷, 杨德吉, 等. 犬肝脏肿块性疾病的CT诊断和鉴别诊断[J]. 畜牧与兽医, 2020, 52(10): 121-126. XIAO E, MEI X T, YANG D J, et al. CT diagnosis and differential diagnosis of canine hepatic mass diseases[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(10): 121-126. (in Chinese) |
| [5] |
KULKARNI N M, FUNG A, KAMBADAKONE A R, et al. Computed tomography techniques, protocols, advancements, and future directions in liver diseases[J]. Magn Reson Imaging Clin North Am, 2021, 29(3): 305-320. DOI:10.1016/j.mric.2021.05.002 |
| [6] |
TATEISHI K, KISHIMOTO M, SHIMIZU J, et al. A comparison between injection speed and iodine delivery rate in contrast-enhanced computed tomography (CT) for normal beagles[J]. J Vet Med Sci, 2008, 70(10): 1027-1030. DOI:10.1292/jvms.70.1027 |
| [7] |
柯肖. 新舒眠宁注射液的研制、麻醉效果及药代动力学研究[D]. 南京: 南京农业大学, 2014. KE X. Development, anesthesia effectiveness and pharmacokinetics of Xinshumianning injection[D]. Nanjing: Nanjing Agricultural University, 2014. (in Chinese) |
| [8] |
GARCIA P, GENIN G, BRET P M, et al. Hepatic CT enhancement: effect of the rate and volume of contrast medium injection in an animal model[J]. Abdom Imaging, 1999, 24(6): 597-603. DOI:10.1007/s002619900572 |
| [9] |
LEE S K, LEE D, KIM D, et al. Effect of catheter size and injection rate of contrast agent on enhancement and image quality for triple-phase helical computed tomography of the liver in small dogs[J]. Vet Radiol Ultrasound, 2017, 58(6): 664-670. DOI:10.1111/vru.12533 |
| [10] |
唐光健, 李松年. 现代全身CT诊断学[M]. 北京: 中国医药科技出版社, 2001. TANG G J, LI S N. Modern whole body CT diagnostics[M]. Beijing: China Medical Science Press, 2001. (in Chinese) |
| [11] |
市川智章. CT造影理论[M]. 付海鸿, 王斌, 译. 北京: 人民卫生出版社, 2019. SHI C Z Z. CT contrast theory[M]. FU H H, WANG B Z, trans. Beijing: People's Medical Publishing House, 2019. (in Chinese) |
| [12] |
ORLANDINI F, BOINI S, IOCHUM-DUCHAMPS S, et al. Assessment of the use of a saline chaser to reduce the volume of contrast medium in abdominal CT[J]. Am J Roentgenol, 2006, 187(2): 511-515. DOI:10.2214/AJR.04.0942 |
| [13] |
SCHWARZ T, SAUNDERS J. Veterinary computed tomography[M]. Oxford: Wiley-Blackwell, 2011.
|
| [14] |
GOIC J B, KOENIGSHOF A M, MCGUIRE L D, et al. A retrospective evaluation of contrast-induced kidney injury in dogs (2006-2012)[J]. J Vet Emerg Crit Care (San Antonio), 2016, 26(5): 713-719. DOI:10.1111/vec.12511 |
| [15] |
KIM H, HONG S, KIM S, et al. Usefulness of a saline chaser to reduce contrast material dose in abdominal CT of normal dogs[J]. J Vet Sci, 2019, 20(4): e38. DOI:10.4142/jvs.2019.20.e38 |
| [16] |
OISHI Y, TANI K, NAKAZAWA H, et al. Anatomical evaluation of hepatic vascular system in healthy beagles using X-ray contrast computed tomography[J]. J Vet Med Sci, 2015, 77(8): 925-929. DOI:10.1292/jvms.14-0469 |
| [17] |
CHAU J, YOUNG A C, DHAND N, et al. Estimation of time to peak contrast enhancement of the aorta and liver for dual-phase computed tomography on the basis of contrast medium arrival time, injection duration, and injection technique in dogs[J]. Am J Vet Res, 2016, 77(10): 1093-1100. DOI:10.2460/ajvr.77.10.1093 |
| [18] |
KORMANO M, DEAN P B. Extravascular contrast material: the major component of contrast enhancement[J]. Radiology, 1976, 121(2): 379-382. DOI:10.1148/121.2.379 |
| [19] |
BAE K T, HEIKEN J P, BRINK J A. Aortic and hepatic peak enhancement at CT: effect of contrast medium injection rate--pharmacokinetic analysis and experimental porcine model[J]. Radiology, 1998, 206(2): 455-464. DOI:10.1148/radiology.206.2.9457200 |
| [20] |
BAE K T. Intravenous contrast medium administration and scan timing at CT: considerations and approaches[J]. Radiology, 2010, 256(1): 32-61. DOI:10.1148/radiol.10090908 |
(编辑 白永平)



