禽致病性大肠杆菌(avian pathogenic Escherichia coli, APEC)属于肠外致病性大肠杆菌(extraintestinal pathogenic Escherichia coli, ExPEC),引起家禽持续感染并引发多系统疾病,常经呼吸道定殖感染,引起家禽的气囊炎、腹膜炎、输卵管炎、蜂窝织炎以及败血症等,严重影响养禽业的养殖成本和产品质量[1-2]。研究发现,APEC与人源ExPEC具有很高的同源性,表明APEC具有潜在的人兽共患病风险[3]。因此,加强对禽致病性大肠杆菌的致病研究,对养殖业和公共卫生安全都具有重大意义。
大肠杆菌Ⅲ型分泌系统2(E. coli Type Ⅲ secretion systems 2, ETT2) 又称ETT2毒力岛[4],与沙门菌Ⅲ型分泌系统SPI-1毒力岛同源,其作为T3SS的主要毒力基因簇,参与多种毒力因子的调控[5-7]。研究表明,尿道致病性大肠杆菌(uropathogenic Escherichia coli,UPEC)中完整的ETT2毒力岛缺失会显著降低细菌运动能力,降低鞭毛蛋白、菌毛和表面蛋白、外膜囊泡(outer membrane vesicles, OMV)的分泌,并影响细菌耐药性以及改变细胞行为[8]。ETT2 ATPase eivC基因的缺失导致APEC运动能力降低,细菌鞭毛受损,表面菌毛增加等[9]。ETT2转录调节因子YqeI及EivF调控APEC运动性、生物被膜形成的能力以及细菌毒力[10-11]。由此可见,ETT2毒力岛在禽致病性大肠杆菌的生物学特性及致病性中发挥着重要作用。
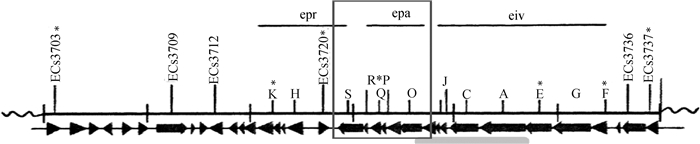
ETT2 epa基因簇由epaS、epaR、epaQ、epaP、epaO基因组成[12](图 1),这5个基因被认为是ETT2注射装置假定的结构基因的重要组成部分,与沙门菌SPI-1注射装置的spa基因簇的基底装置内环的5个组成基因spaS、spaR、spaQ、spaP、spaO具有高度同源性[13]。在肠出血性大肠杆菌O157: H7中,与沙门菌SPI-1中spaP功能相似的escR基因的缺失会阻断效应蛋白NleB1和NleB2易位到宿主细胞中,该基因簇在细菌分泌蛋白的过程中发挥一定的作用并影响细菌致病性[14]。而ETT2 epa基因簇在大肠杆菌生物学特性及致病性中的作用目前尚不清楚。
|
图 1 大肠杆菌毒力岛ETT2模式图 Fig. 1 Physical map of the ETT2 element of Escherichia coli |
本研究通过CRISPR-Cas9基因编辑技术,构建ETT2基底装置基因epaPQR的缺失株和回复株,对其生长性能、运动性、生物被膜形成等生物学特性及致病作用进行评价,探究其对APEC生物学特性及致病性的影响,为进一步了解APEC的致病机制提供理论基础。
1 材料与方法 1.1 材料与引物设计禽致病性大肠杆菌AE81菌株及质粒pCas(卡那霉素抗性)、pTarget(大观霉素抗性)由兽医病理生物学与疫病防控安徽省重点实验室保存。大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司。PrimeScriptTM RT Master Mix (Perfect Real Time) 购自宝日医生物技术(北京)有限公司,PowerUpTM SYBRTM Green Master Mix购自Thermo公司。
利用Primer 5软件设计epaR、epaQ、epaP三个基因共同缺失的epaPQR的检测引物以及CRISPR-Cas9基因编辑技术构建epaPQR基因缺失株和回复株所需要的引物。相关引物序列见表 1。
|
|
表 1 epaPQR基因缺失的引物序列 Table 1 Primer sequence for epaPQR gene knocking out |
通过NCBI将AE81中epa基因簇所包含的5个基因(epaS、epaR、epaQ、epaP、epaO)序列与肠出血性大肠杆菌O157:H7(GenBank: NC_002695.2)中epa基因簇进行同源性分析。利用生物学软件Phyre2进行蛋白质功能预测,筛选置信度较高的疑似结构基因(Phyre2: http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)。
1.3 基因缺失株AE81ΔepaPQR的构建利用CRISPR-Cas9基因编辑技术[15],以pTarget质粒为模板,sgRNA-F/R为引物扩增sgRNA片段。以AE81基因组为模板,epaPQR-up-F/R和epaPQR-down-F/R为引物分别扩增epaPQR的上、下游序列片段。将以上3个片段为模板,以sgRNA-F/epaPQR-down-R为引物,PCR连接成sgRNA特异性的结合靶标序列,引导Cas9蛋白对特异DNA序列切割使DNA双链断裂,利用非同源末端链接(non-homologous end joining,NHEJ)修复机制,随机缺失或插入碱基造成移码突变,以实现目的基因的敲除。将此连接产物与pTarget质粒同时进行双酶切,鉴定正确后进行胶回收,对回收产物进行连接,将连接产物转化入DH5α中培养,验证重组质粒pTarget-epaPQR是否构建成功。
将重组质粒电转入含有pCas质粒的AE81感受态细胞中,涂布至含有卡那霉素抗性的LB培养基上,28 ℃培养24 h。将验证正确的阳性菌株培养至OD600 nm为0.2,按照1∶150比例加入IPTG,37 ℃过夜培养,次日划菌至无抗固体培养基中,42 ℃培养,以消除抗性,用引物pCas-F/R和pTarget-F/R进行PCR验证。
1.4 基因回复株C-AE81ΔepaPQR的构建以AE81基因组为模板,epaPQR-EcoRI-F/epaPQR-BamHI-R为引物,扩增含有酶切位点的epaPQR基因片段,将片段和pSTV28质粒进行酶切并利用T4 DNA连接酶进行连接,化转至DH5α中,构建重组质粒pSTV28-epaPQR,PCR筛选阳性克隆并测序。将pSTV28-epaPQR质粒电转入AE81ΔepaPQR感受态细胞中37 ℃培养。用M13通用引物进行PCR验证并测序。
1.5 生长曲线的测定挑取3株细菌AE81、AE81ΔepaPQR和C-AE81ΔepaPQR的单克隆接种至液体LB培养基中,37 ℃、180 r·min-1过夜培养,次日接种至新的液体LB培养基中,培养到OD600 nm为1.0,然后1∶200转移至新鲜LB肉汤中,每隔1 h用酶标仪测量OD600 nm,直到细菌生长到稳定期。
1.6 运动能力的检测挑取3株细菌AE81、AE81ΔepaPQR和C-AE81ΔepaPQR单克隆培养至OD600 nm为1.0,用灭菌PBS溶液洗涤2次,调整OD600 nm为2.0。然后滴加2 μL菌液点到琼脂粉含量2.5 g·L-1的LB半固体培养基中央,37 ℃静置培养8 h后观察结果,根据运动圈的大小,比较菌株运动能力的差异。
1.7 透射电镜观察鞭毛形态将野生株AE81以及AE81ΔepaPQR和C-AE81ΔepaPQR在LB中于37 ℃静置培养12 h,用PBS洗涤3次后,将细菌置于200目铜镜下,在室温下短暂孵育。然后将细菌用2%醋酸铀酰水溶液染色30 s,待样品干燥后,用透射电子显微镜(日立HT-7700,日本)观察3株细菌鞭毛的形态。
1.8 生物膜形成能力的检测挑取3株细菌AE81、AE81ΔepaPQR和C-AE81ΔepaPQR培养至OD600 nm为1.0,用新LB培养基重悬洗涤两次,并调整OD600 nm为1.0,用LB培养基将菌液稀释50倍,添加到96孔板中,每组重复3次,LB培养基作为阴性对照,分别在25 ℃和37 ℃静置培养48 h。用PBS洗涤并干燥两次,再用0.1%结晶紫染色约20 min,用PBS洗涤并干燥两次。将生物膜溶解在95%酒精中,通过酶标仪测定OD595 nm吸光值,比较3株细菌生物被膜形成能力差异。
1.9 抗血清杀菌能力的检测挑取3株细菌AE81、AE81ΔepaPQR和C-AE81ΔepaPQR培养到OD600 nm为1.0,用无菌PBS洗涤2次,调整细菌数为1×108CFU·mL-1。用PBS将SPF鸡血清稀释至5%、12.5%、25%、50%和100%,将56 ℃水浴30 min的灭活血清做阴性对照。不同梯度的血清与细菌混匀后,37 ℃静置培养30 min,梯度稀释,挂板计数法进行细菌计数。
1.10 组织载菌量测定将野生株AE81和缺失株AE81ΔepaPQR培养到OD600 nm为1.0,用无菌PBS洗涤3次并重悬菌体。每组细菌感染3只罗曼蛋鸡,每只攻毒剂量1×108 CFU·mL-1。感染24 h后无菌条件下分别取心、肝、肺和脾组织,等比例加入无菌PBS,组织研磨仪研磨并倍比稀释,用平板计数法进行细菌计数。
1.11 荧光定量检测鞭毛相关基因的表达为探究epaPQR基因对鞭毛的作用,选择鞭毛结构基因(fliC、fliP、fliQ、fliR)和输出蛋白基因(flgM)及一级调控操纵子(flhD、flhC)进行qRT-PCR检测。将野生株AE81与缺失株AE81ΔepaPQR培养至对数期,利用TRIzol法提取细菌RNA,利用反转录试剂盒说明书进行cDNA的合成。参照PowerUpTM SYBRTM Green Master Mix试剂盒进行荧光定量PCR检测,每个样本重复3次。鞭毛基因荧光引物见表 2,以16S为内参基因。
|
|
表 2 鞭毛基因荧光引物 Table 2 The primers of flagellar genes |
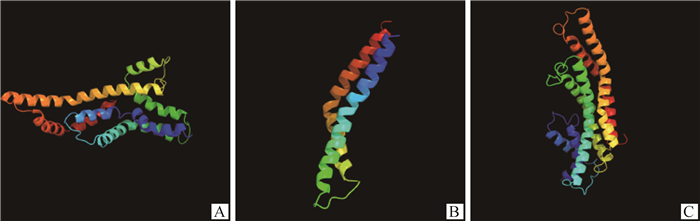
通过Phyre2预测epa基因簇蛋白的结构与功能(图 2A、2B和2C),结果显示,epa基因簇5个基因中的epaP、epaQ和epaR的结构域分别以92%、99%和93%的置信度在其全结构范围内与大肠杆菌鞭毛三型分泌系统核心输出装置的结构域相一致。故选定此3个基因作为整体来探究其功能。
|
图 2 epaP(A)、epaQ(B)和epaR(C)蛋白质功能预测结果及三级结构 Fig. 2 Prediction results and tertiary structure of epaP (A), epaQ (B) and epaR (C) proteins |
通过CRISPR-Cas9基因编辑技术构建重组质粒pTarget,以epaPQR-in-F/R为引物,PCR验证结果显示,重组质粒扩增片段大小为2 101 bp,pTarget原始质粒大小为800 bp(图 3A),条带大小相差1 391 bp,表明重组质粒构建成功。

|
A. 重组质粒验证,M. Marker;1. 重组pTarget质粒,引物pTarget-F/R;2. pTarget质粒,引物pTarget-F/R; 3. 阴性对照。B. 缺失验证,M. Marker;1. AE81菌株,引物epaPQR-in-F/R;2. AE81ΔepaPQR菌株,引物epaPQR-in-F/R;3. 阴性对照;4. AE81菌株,引物epaPQR-out-F/R;5. AE81ΔepaPQR菌株,引物epaPQR-out-F/R;6. 阴性对照 A. Verification of recombinant, M. marker; 1. Recombinant pTarget plasmid, primer pTarget-F/R; 2. pTarget plasmid, primer pTarget-F/R; 3. Negative control. B. Verification of deletion, M. marker; 1. AE81 strain, primer epaPQR-in-F/R; 2. AE81ΔepaPQR strain, primer epaPQR-in-F/R; 3. Negative control; 4. AE81 strain, primer epaPQR-out-F/R; 5. AE81ΔepaPQR strain, primer epaPQR-out-F/R; 6. Negative control 图 3 pTarget重组质粒验证(A)及缺失验证(B) Fig. 3 Verification of pTarget recombinant plasmid (A) and deletion (B) |
通过内、外侧引物验证基因缺失株(图 3B)。PCR检测结果显示,通过内侧引物epaPQR-in-F/R验证,野生株AE81大小为261 bp,缺失株和阴性都无条带(孔道1~3);通过外侧引物epaPQR-out-F/R验证基因缺失株,AE81野生株大小为2 791 bp,缺失株大小为1 400 bp(孔道4~6),缺失株相较于野生株减少了1 391 bp,证明epaPQR基因缺失成功,缺失株命名为AE81ΔepaPQR。
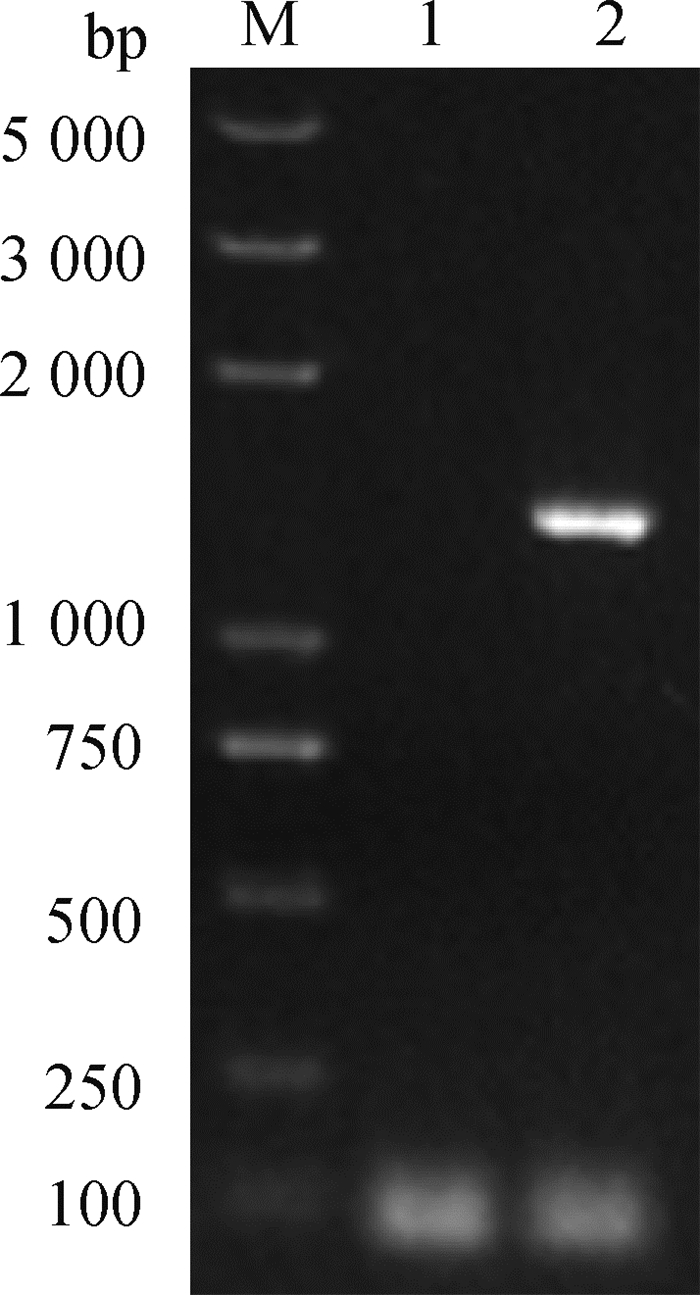
通过pSTV28质粒在AE81ΔepaPQR中构建出回复株,用引物M13-F/R进行PCR验证,结果显示,AE81ΔepaPQR缺失株无条带,而回复株出现1 391 bp条带(图 4),证明回复株构建成功,回复株命名为C-AE81ΔepaPQR。
|
M. Marker;1. AE81ΔepaPQR菌株,引物M13-F/R;2. C-AE81ΔepaPQR菌株,引物M13-F/R M. Marker; 1. AE81ΔepaPQR strain, primer M13-F/R; 2. C-AE81ΔepaPQR strain, primer M13-F/R 图 4 回复株的验证 Fig. 4 Validation of complement strain |
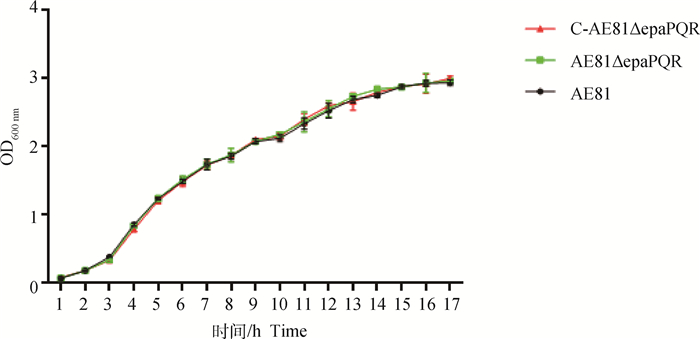
AE81、AE81ΔepaPQR和C-AE81ΔepaPQR 3株菌在17 h内的生长趋势相同(P>0.05,图 5),说明epaPQR基因的缺失不影响其生长特性。
|
图 5 生长曲线测定 Fig. 5 Growth curves determination |
生物膜形成能力的结果表明,与野生株AE81相比,缺失株AE81ΔepaPQR和回复株C-AE81ΔepaPQR的生物膜形成能力的差异不显著(P>0.05,图 6)。
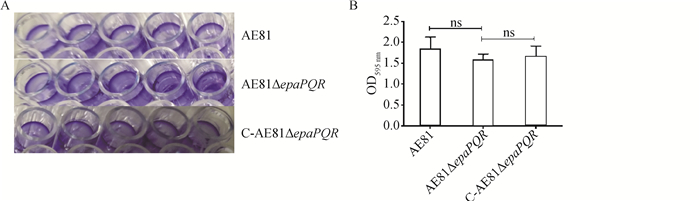
|
A.结晶紫染色法测定APEC生物被膜的形成;B. 酶标仪测定的生物被膜形成的吸光值。ns. 差异不显著(P>0.05) A. Crystal violet staining method was used to determine the formation of APEC biofilm; B. The absorbance value of biofilm formation was determined by enzyme reader. ns. No significant difference (P > 0.05) 图 6 生物被膜形成能力检测 Fig. 6 Biofilm formation ability test |
对3株菌的运动能力(图 7)检测结果表明,野生株AE81、缺失株AE81ΔepaPQR和回复株C-AE81ΔepaPQR的运动圈直径平均值分别为65.40、32.75、54.21 mm,在37 ℃下,缺失株AE81ΔepaPQR的运动圈相较于野生株AE81显著减小;回复株C-AE81ΔepaPQR的运动圈明显回复。因此epaPQR基因的缺失会降低AE81的运动能力。
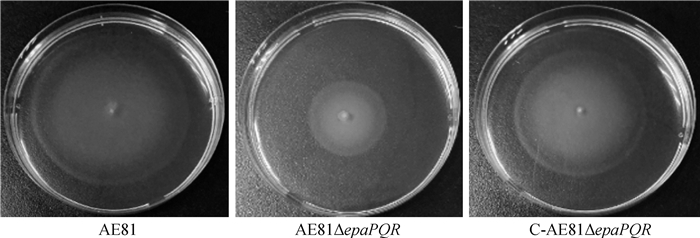
|
图 7 运动能力的比较 Fig. 7 Comparison of motility ability |
通过透射电镜观察3株菌的鞭毛形态(图 8)。结果表明,野生株AE81有数根长而弯曲的鞭毛;相较于野生株AE81,缺失株AE81ΔepaPQR鞭毛的数量明显减少;回复株C-AE81ΔepaPQR鞭毛数量相较于缺失株明显增加,且与野生株AE81鞭毛形态相似。透射电镜对鞭毛形态的观察与“2.5”中运动能力的测定结果趋势一致,进一步证明epaPQR基因影响AE81的运动能力。

|
图 8 透射电子显微镜下的鞭毛形态 Fig. 8 Flagella under the transmission electron microscope |
通过荧光定量PCR验证鞭毛相关基因的表达。结果显示,与野生株AE81相比,缺失epaPQR基因后,缺失株中鞭毛一级调控操纵子flhD和flhC的表达水平显著下调(P<0.05);鞭毛T3SS的结构基因fliC、fliP、fliQ、fliR的表达水平的显著下调(P<0.05),fliN的表达水平下调但差异不显著(P>0.05);鞭毛输出蛋白基因flgM的转录水平显著下调(P<0.05)。回复株C-AE81ΔepaPQR的基因表达水平基本恢复(图 9)。表明epaPQR基因通过影响鞭毛基因的表达,进而影响细菌的运动性。
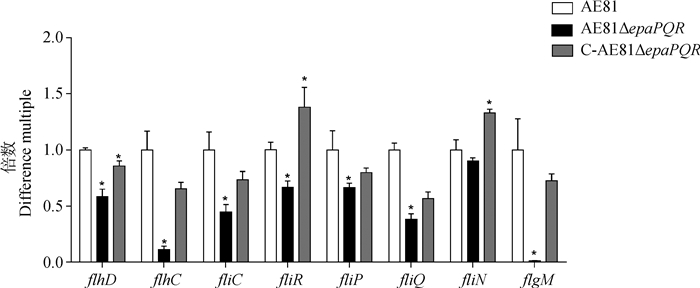
|
*. P<0.05,下同 *. P < 0.05, the same as below 图 9 鞭毛相关基因荧光定量 Fig. 9 Fluorescence quantification of flagellum-related gene |
在不同浓度血清中3株菌的存活能力检测结果表明(图 10),3株菌在PBS和灭活血清中的存活能力无差异(P>0.05),缺失株AE81ΔepaPQR在不同浓度的血清中存活能力相较于野生株都显著增强(P<0.05),且在5%、12.5%、25%浓度中存活能力极显著高于其余2菌株(P<0.01),说明epaPQR基因缺失后其抗血清杀菌能力显著增强(P<0.05)。
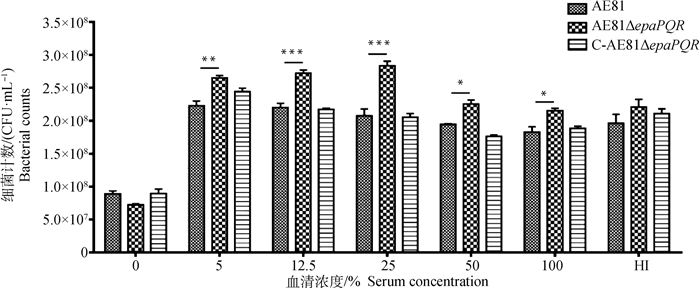
|
***. P<0.001;**. P<0.01。下同 ***. P < 0.001; **. P < 0.01. The same as below 图 10 抗血清杀菌数据图 Fig. 10 Antiserum bactericidal data graph |
通过体内分布试验检测野生株和缺失株菌在雏鸡体内心、肝、脾和肺4个器官的定殖情况(图 11)。结果表明,与野生株AE81相比,epaPQR基因的缺失造成AE81在雏鸡心、肝、脾和肺器官的定殖数量显著减少,尤其在脾中定殖量较少。脾作为免疫器官,会影响细菌在机体内存活能力。
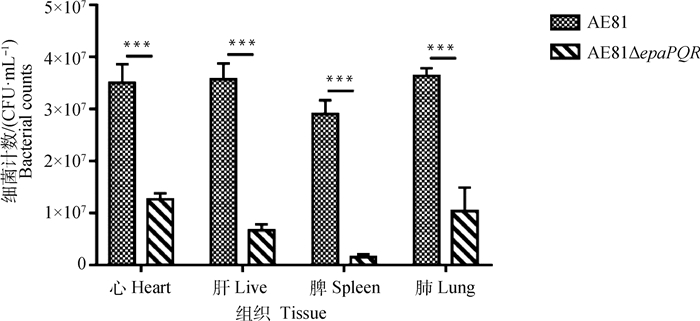
|
图 11 野生株AE81和缺失株AE81ΔepaPQR感染雏鸡的组织载菌量 Fig. 11 Tissue bacteria load after infected with AE81 and AE81ΔepaPQR strains |
ETT2作为T3SS的主要毒力基因簇,编码包括epa(ecs3721-3726)、eiv(ecs3727-3734)、yge(ecs3707-3712)等至少35个开放阅读框[16-18],参与多种毒力因子的调控[19]。研究发现,ETT2毒力岛编码的蛋白影响大肠杆菌毒素和黏附素的分泌或运输[4];在产志贺毒素大肠杆菌中许多毒力基因的表达和分泌受到ETT2毒力岛的影响[20-22]。在肠出血性大肠杆菌中,ETT2毒力岛缺失后导致细菌鞭毛蛋白和菌毛蛋白的分泌减少[5]。可见ETT2对于细菌生物特性及毒力具有重要作用。
生物被膜是一种由胞外多糖、分泌蛋白和DNA组成的表面相关微生物的异质聚集体,可帮助细菌增强自身抵抗力以及抵抗外部环境压力[23]。在本研究中,epaPQR基因的缺失显著降低其运动能力,对其生物被膜形成能力无显著改变。有研究显示,运动性对生物膜的形成并非必不可少,且细菌的运动性不总是促进生物膜形成。ETT2分子伴侣基因ygeG缺失后导致其运动性显著增加,生物被膜形成能力显著下降[24]。因此,运动能力在生物被膜形成过程中起着非常重要的作用,但也受到环二核苷酸和某些代谢调控蛋白等其他因素的影响[25]。
鞭毛是细菌重要的毒力因子,在细菌感染过程中发挥多种作用。细菌可通过旋转鞭毛来运动,使它们能够克服表面环境中的静电斥力和液体阻力,从而增加它们与细胞表面相互作用的机会[26],可促进细菌穿过小肠黏膜黏附于宿主细胞或者非生物表面,并且可以维持和扩散感染。研究表明,UPEC缺失ETT2基因后,导致鞭毛蛋白的分泌显著减少,血清存活能力增强,运动性减弱。ETT2基因簇中etrA的缺失导致APEC运动能力减弱,且鞭毛和运动相关基因flgC, fimI的表达水平显著下调[27]。在本研究中,透射电镜中观察到缺失株鞭毛数量显著减少,可能通过影响鞭毛数量从而调控细菌运动性;qRT-PCR数据显示,缺失epaPQR基因后,鞭毛一级调控操纵子flhD和flhC、结构基因fliC、fliP、fliQ、fliR和鞭毛输出蛋白flgM的转录水平显著下调。其中鞭毛蛋白fliC是鞭毛的主要成分,其表达由鞭毛一级调控子FlhD激活[28]。
APEC主要通过呼吸道感染禽类,然后扩散到全身,导致家禽的菌血症和死亡。研究表明,在E.coli 789中ETT2的缺失导致细菌在1日龄鸡中的毒力显著减弱[7];ETT2 ATPase eivC的缺失在鸭体内毒力和存活率减弱[17]。本研究发现,epaPQR的缺失会降低APEC在鸡体内的定殖,减弱对APEC的致病作用。但在抗血清能力试验中,epaPQR的缺失造成AE81在血清中的存活能力增强。在APEC中,缺失ETT2转录因子eivF基因,增强了细菌在血清中的存活[11]。缺失转录因子yqeI减弱APEC在血清中存活能力[10]。ETT2基因簇的缺失增加了UPEC对血清的敏感性[8]。细菌的许多特性都有助于其血清抗性,包括囊泡、OmpA和LPS等[29],但epaPQR基因是否通过影响这些因素而导致其缺失株血清抗性增强还尚不清楚,还需要进一步深入研究。
4 结论ETT2结构基因epaPQR参与调控APEC的鞭毛形成及其相关基因的转录水平,影响APEC抗血清杀菌能力以及在雏鸡体内不同器官的定殖能力,表明epaPQR在APEC致病过程中发挥重要作用,为深入探究ETT2功能和APEC致病机制提供参考。
| [1] |
EWERS C, JANSSEN T, WIELER L H. Avian pathogenic Escherichia coli (APEC)[J]. Berl Munch Tierarztl Wochenschr, 2003, 116(9-10): 381-395. |
| [2] |
徐引弟, 王治方, 朱文豪, 等. 肠外致病性大肠杆菌的研究进展[J]. 畜牧兽医科技信息, 2011(7): 21-23. XU Y D, WANG Z F, ZHU W H, et al. Advances in the research of Avian Pathogenic Escherichia coli[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2011(7): 21-23. DOI:10.3969/J.ISSN.1671-6027.2011.07.011 (in Chinese) |
| [3] |
JAKOBSEN L, GARNEAU P, BRUANT G, et al. Is Escherichia coli urinary tract infection a zoonosis?Proof of direct link with production animals and meat[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(6): 1121-1129. DOI:10.1007/s10096-011-1417-5 |
| [4] |
HARTLEIB S, PRAGER R, HEDENSTRÖM I, et al. Prevalence of the new, SPI1-like, pathogenicity island ETT2 among Escherichia coli[J]. Int J Med Microbiol, 2003, 292(7-8): 487-493. DOI:10.1078/1438-4221-00224 |
| [5] |
FURNISS R C D, CLEMENTS A. Regulation of the Locus of enterocyte effacement in attaching and effacing pathogens[J]. J Bacteriol, 2017, 200(2): e00336-17. |
| [6] |
SONG M, SUKOVICH D J, CICCARELLI L, et al. Control of type Ⅲ protein secretion using a minimal genetic system[J]. Nat Commun, 2017, 8: 14737. DOI:10.1038/ncomms14737 |
| [7] |
尹磊, 祁克宗, 宋祥军, 等. 大肠杆菌Ⅲ型分泌系统2毒力岛研究进展[J]. 微生物学通报, 2017, 44(12): 3031-3037. YIN L, QI K Z, SONG X J, et al. Type Ⅲ secretion system 2 pathogenicity islands of Escherichia coli[J]. Microbiology China, 2017, 44(12): 3031-3037. DOI:10.13344/j.microbiol.china.170468 (in Chinese) |
| [8] |
SHULMAN A, YAIR Y, BIRAN D, et al. The Escherichia coli type Ⅲ secretion system 2 has a global effect on cell surface[J]. mBio, 2018, 9(4): e01070-18. |
| [9] |
ZHANG L H, CHAUDHURI R R, CONSTANTINIDOU C, et al. Regulators encoded in the Escherichia coli type Ⅲ secretion system 2 gene cluster influence expression of genes within the Locus for enterocyte effacement in enterohemorrhagic E. coli O157:H7[J]. Infect Immun, 2004, 72(12): 7282-7293. DOI:10.1128/IAI.72.12.7282-7293.2004 |
| [10] |
XUE M, XIAO Y T, FU D D, et al. Transcriptional regulator YqeI, locating at ETT2 Locus, affects the pathogenicity of avian pathogenic Escherichia coli[J]. Animals (Basel), 2020, 10(9): 1658. |
| [11] |
傅丹丹, 肖亚婷, 薛媚, 等. 禽致病性大肠杆菌ETT2转录因子eivF缺失株的生物学特性及转录组学分析[J]. 西北农林科技大学学报: 自然科学版, 2020, 48(8): 28-36. FU D D, XIAO Y T, XUE M, et al. Biological characteristics and transcriptomics of avian pathogenic Escherichia coli ETT2 transcription factor eivF deletion strain[J]. Journal of Northwest A&F University: Natural Science Edition, 2020, 48(8): 28-36. (in Chinese) |
| [12] |
宿志瑞. 大肠杆菌ETT2毒力岛的检测与分析[D]. 扬州: 扬州大学, 2011. SU Z R. Detection and analysis on the pathogenicity islands ETT2 among Escherichia coli[D]. Yangzhou: Yangzhou University, 2011. (in Chinese) |
| [13] |
REN C P, CHAUDHURI R R, FIVIAN A, et al. The ETT2 gene cluster, encoding a second type Ⅲ secretion system from Escherichia coli, is present in the majority of strains but has undergone widespread mutational attrition[J]. J Bacteriol, 2004, 186(11): 3547-3560. DOI:10.1128/JB.186.11.3547-3560.2004 |
| [14] |
王玉瑞. 大肠杆菌O157: H7效应分子NleB1和NleB2的初步研究[D]. 合肥: 安徽大学, 2014. WANG Y R. Preliminary study on effector NleB1 and NleB2 from Escherichia coli O157: H7[D]. Hefei: Anhui University, 2014. (in Chinese) |
| [15] |
方锐, 畅飞, 孙照霖, 等. CRISPR/Cas9介导的基因组定点编辑技术[J]. 生物化学与生物物理进展, 2013, 40(8): 691-702. FANG R, CHANG F, SUN Z L, et al. New method of genome editing derived from CRISPR/Cas9[J]. Progress in Biochemistry and Biophysics, 2013, 40(8): 691-702. (in Chinese) |
| [16] |
樊琛, 刘桂芹, 王亚君, 等. Iss蛋白在鸡源大肠杆菌不同毒力菌株中的检测[J]. 畜牧与兽医, 2010, 42(2): 71-73. FAN C, LIU G Q, WANG Y J, et al. Detection of Iss protein in different virulence strains of Chicken Escherichia coli[J]. Animal Husbandry & Veterinary Medicine, 2010, 42(2): 71-73. (in Chinese) |
| [17] |
樊琛, 刘桂芹, 王宇, 等. 鸡源致病性大肠杆菌iss基因原核表达产物的免疫保护作用[J]. 畜牧与兽医, 2010, 42(11): 84-86. FAN C, LIU G Q, WANG Y, et al. Immuno-protective effect of iss gene prokaryotic expression product of pathogenic Escherichia coli from chicken[J]. Animal Husbandry & Veterinary Medicine, 2010, 42(11): 84-86. (in Chinese) |
| [18] |
咸富荣, 温均皓, 樊琛, 等. 鸡源Iss抗血清对鸡大肠埃希菌O2、O78、CVCC1551的抑制作用[J]. 湖北农业科学, 2017, 56(14): 2725-2727. XIAN F R, WEN J H, FAN C, et al. Inhibition of Iss Antiserum to Avian E.coli O2, O78 and CVCC1551[J]. Hubei Agricultural Sciences, 2017, 56(14): 2725-2727. (in Chinese) |
| [19] |
WANG S H, LIU X, XU X, et al. Escherichia coli type Ⅲ secretion system 2 ATPase EivC is involved in the motility and virulence of avian pathogenic Escherichia coli[J]. Front Microbiol, 2016, 7: 1387. |
| [20] |
RIEDE I, ESCHBACH M L. Evidence that TraT interacts with OmpA of Escherichia coli[J]. FEBS Lett, 1986, 205(2): 241-245. |
| [21] |
BOZCAL E, ELDEM V, AYDEMIR S, et al. The relationship between phylogenetic classification, virulence and antibiotic resistance of extraintestinal pathogenic Escherichia coli in zmir province, Turkey[J]. PeerJ, 2018, 6: e5470. |
| [22] |
MIAJLOVIC H, MAC AOGÁIN M, COLLINS C J, et al. Characterization of Escherichia coli bloodstream isolates associated with mortality[J]. J Med Microbiol, 2016, 65(1): 71-79. |
| [23] |
FILLOUX A, VALLET I. Biofilm: Set-up and organization of a bacterial community[J]. Med Sci (Paris), 2003, 19(1): 77-83. |
| [24] |
YIN L, LI Q W, WANG Z P, et al. The role of Escherichia coli type Ⅲ secretion system 2 chaperone protein ygeG in pathogenesis of avian pathogenic Escherichia coli[J]. Res Vet Sci, 2021, 140: 203-211. |
| [25] |
ROY R, TIWARI M, DONELLI G, et al. Strategies for combating bacterial biofilms: A focus on anti-biofilm agents and their mechanisms of action[J]. Virulence, 2018, 9(1): 522-554. |
| [26] |
DONLAN R M. Biofilms: Microbial life on surfaces[J]. Emerg Infect Dis, 2002, 8(9): 881-890. |
| [27] |
王泽平, 李倩文, 尹磊, 等. 大肠杆菌三型分泌系统2转录调节子EtrA对禽致病性大肠杆菌致病性的影响[J]. 微生物学通报, 2020, 47(5): 1515-1523. WANG Z P, LI Q W, YIN L, et al. Effect of ETT2 transcriptional regulator EtrA on the pathogenicity of avian pathogenic Escherichia coli[J]. Microbiology China, 2020, 47(5): 1515-1523. (in Chinese) |
| [28] |
钟华晨, 贺银凤. 群体感应系统调控细菌生物膜的研究进展[J]. 畜牧与饲料科学, 2020, 41(5): 7-12. ZHONG H C, HE Y F. Research advances on regulative role of quorum sensing system in formation of bacterial biofilm[J]. Animal Husbandry and Feed Science, 2020, 41(5): 7-12. (in Chinese) |
| [29] |
MELLATA M, DHO-MOULIN M, DOZOIS C M, et al. Role of virulence factors in resistance of avian pathogenic Escherichia coli to serum and in pathogenicity[J]. Infect Immun, 2003, 71(1): 536-540. |
(编辑 范子娟)



