伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(pseudorabies virus,PRV)引起的可感染多种家畜和哺乳动物的急性传染病,以发热、奇痒(猪除外)及急性脑脊髓炎为主要症状[1]。PRV属于疱疹病毒科α-疱疹病毒亚科[2]。猪是PRV的唯一自然感染宿主以及长期贮存和传播宿主[3]。PRV感染猪后可建立持续性感染,主要潜伏在猪的外周神经组织,在机体免疫低下或受到应激时可被激活,导致机体发病甚至成为传染源[4-5]。PRV特殊的致病方式和感染方式给该病的防控带来较大困难,严重危害全球养猪业的发展[6]。近年来,PRV更是突破了常规疫苗,导致猪伪狂犬病的防控难度极大,成为养猪业防控伪狂犬病所面临的巨大挑战[7]。
在病毒入侵机体过程中,宿主产生各种防御机制来保护机体,先天性免疫应答是抵抗入侵病原体的第一道防线[8]。PRV对宿主细胞的感染力很强,能够引起宿主细胞产生免疫反应,诱导产生Ⅰ型IFN[9],分泌的IFN与其受体结合激活下游信号转导,最终导致数百个干扰素刺激基因(ISGs)的表达[10-11]。其中,ISG15(interferon-stimulated gene15) 作为诱导最强烈、反应最快的ISG蛋白之一,在宿主抵御病毒感染的过程中发挥重要的作用。
近年来,对ISG15抗病毒复制的作用有越来越多的研究。ISG15可以通过作用于病毒入侵的各阶段影响病毒的增殖,也可以作为免疫调节蛋白来调控宿主的反应[12-13]。本实验室前期研究发现PRV感染能显著上调ISG15,过表达ISG15能明显抑制PRV复制。但是ISG15抑制PRV复制的分子机制尚不清楚,有待进一步研究。在前期试验基础上,本研究利用CRISPR/Cas9基因编辑技术,构建ISG15基因敲除PK-15细胞系(PK15-ISG15-/-),利用PRV毒株检测敲除ISG15基因对PRV复制的影响,以期为进一步研究ISG15抑制PRV复制的分子机制提供新思路,同时为有效防控猪伪狂犬病提供新的研究策略。
1 材料与方法 1.1 试验材料猪肾上皮细胞(PK-15)、PRV、ISG15兔多克隆抗体由作者实验室保存;pCompass-LVKO载体购自Addgene;载体质粒pMD2.G和psPAX2购自Sigma;普通琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒均购自天根生化科技有限公司;限制性内切酶BbsⅠ、RNAiso Plus、PrimeScriptTM RT reagent Kit with gDNA Eraser、Primer STARⓇ Max DNA Polymerase购自宝日医生物技术有限公司;MonAmpTM SYBRⓇ Green qPCR Mix试剂购自莫纳生物科技有限公司;PRV鼠源gE单克隆抗体购自普莱柯生物工程股份有限公司;β-actin抗体购自赛维尔生物科技有限公司;Cell Counting Kit-8购自生工生物工程股份有限公司。
1.2 引物设计与合成根据NCBI网站所公布的猪ISG15基因序列(GenBank No.:NM_001128469),在ISG15的单一外显子上找到2个合适的靶位点,将此靶序列与猪的基因组序列进行比对,仅在ISG15基因座上找到完全匹配序列,针对2个位点分别设计sgRNA上游引物与下游引物,同时,在基因组靶序列两侧设计ISG15的验证引物(表 1);通过NCBI数据库查询需要检测的基因mRNA序列,应用Primer-Blast设计RT-qPCR引物(表 1)。
|
|
表 1 引物序列及相关信息 Table 1 Sequences and information of primers used in our study |
1.3.1 敲除载体的构建 将两对sgRNA引物95 ℃ 5 min进行退火杂交,退火后连接至Bbs Ⅰ限制性内切酶线性化的pCompass-LVKO载体中。重组载体送北京擎科生物科技有限公司测序,将测序正确质粒命名为pCompass-LVKO-ISG15-1、pCompass-LVKO-ISG15-2,转化至大肠杆菌DH5α感受态细胞中,挑取单菌落扩大培养,提取质粒后,-20 ℃保存备用。
1.3.2 敲除细胞系的构建 将pCompass-LVKO-ISG15-1、pCompass-LVKO-ISG15-2与psPAX2、pMD2G以2∶1∶1的比例,共转染HEK293T细胞;培养48 h后收集包装病毒上清液,取1 mL感染PK-15细胞,感染48 h后,用2 μg·mL-1嘌呤霉素筛选细胞,使用胰酶消化存活细胞,梯度稀释后,按照每孔1个细胞的比例接种至96孔板,37 ℃,5% CO2培养扩增细胞。取ISG15完全敲除的克隆,抽提基因组DNA后以此为模板,使用验证引物ISG15 VerF和ISG15 VerR进行PCR扩增,20 μL反应体系:PrimerSTAR Max Premix 10 μL, 上、下游引物(0.2 μmol·L-1)各0.4 μL,模板1 μL,ddH2O 8.2 μL。反应条件:98 ℃2 min;98 ℃ 10 s,55 ℃ 5 s,72 ℃ 5 s,共35个循环;72 ℃ 5 min。如果在619 bp处出现一条特异性条带,可初步说明敲除ISG15细胞构建成功,将此条带连接至pEASY-T1 simple载体,随机挑选阳性克隆送公司测序。
1.4 ISG15敲除效率的验证6孔板铺种PK-15和PK15-ISG15-/-细胞,各设3组重复。培养至细胞汇合度70%左右接种病毒,以PRV MOI=2感染细胞,感染24 h收取蛋白,BCA法检测蛋白浓度。取35 μg蛋白样品进行SDS-PAGE电泳后转膜,5%脱脂奶室温封闭1 h后,加入ISG15兔多克隆抗体(1∶5 000)4 ℃摇床孵育过夜,TBST洗膜3次,室温孵育HRP标记的羊抗兔IgG(1∶5 000)1 h,ECL显影。以β-actin作为内参。
1.5 细胞增殖(CCK-8)检测以每孔1×104个细胞在96孔板中铺种PK-15和PK15-ISG15-/-细胞,每个处理设置5个复孔,培养24 h。参照CCK-8试剂盒在不同时间点向指定培养孔中加入10 μL的CCK-8溶液,37 ℃孵育2 h,随后用酶标仪检测在450 nm处的吸光度。试验重复3次。
1.6 间接免疫荧光检测12孔板铺种PK-15和PK15-ISG15-/-细胞,各3个重复,培养至细胞汇合度70%左右进行病毒处理,以PRV MOI=2感染细胞,24 h后取出,PBS洗涤两次,然后使用4%多聚甲醛室温固定15 min,使用破膜液渗透15 min。然后用封闭缓冲液(含5%脱脂奶粉的PBS)封闭细胞1 h后,加入鼠源PRV-gE抗体(1∶1 000)4 ℃孵育过夜。PBS清洗后,室温避光孵育FITC标记的山羊抗小鼠抗体(1∶200),PBS清洗3遍。滴入封片剂平铺覆盖细胞,倒置荧光显微镜下观察。
1.7 实时荧光定量PCR检测6孔板铺种PK-15和PK15-ISG15-/-细胞,各3组重复。培养至细胞汇合度70%左右进行病毒处理,以PRV MOI=2感染细胞,分别在0、6、12、24、36和48 h收取RNA。TRizol法提取RNA并反转录成cDNA,以cDNA为模板,进行RT-qPCR检测。每个样品3个重复。反应体系20 μL:MonAmpTM SYBR Green qPCR Mix 10 μL,上、下游引物(0.2 μmol·L-1)各0.4 μL,cDNA 3 μL,ddH2O 6.2 μL。反应条件:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火和延伸30 s,共40个循环。以β-actin mRNA表达水平为内参值,计算PRV-EP0、PRV-gE、PRV-VP16、IFN-β mRNA水平。
1.8 Western blot检测PRV-gE蛋白的表达6孔板铺种PK-15和PK15-ISG15-/-细胞,各3组重复。培养至细胞汇合度70%左右进行病毒处理,以PRV MOI=2感染细胞,感染0、6、12、24、36和48 h收取蛋白,BCA法测蛋白浓度。取35 μg蛋白样品进行SDS-PAGE电泳后转膜,5%脱脂奶室温封闭1 h后,加入ISG15兔多克隆抗体(1∶5 000)4 ℃摇床孵育过夜,TBST洗膜3次,室温孵育HRP标记的羊抗兔IgG(1∶5 000)1 h后ECL显影。以β-actin作为内参。Image J软件分析条带灰度值比较ISG15敲除对PRV-gE蛋白表达的影响。
1.9 PRV子代病毒滴定测定取对数生长期PK-15和PK15-ISG15-/-细胞接种于6孔板。培养至细胞汇合度70%左右,弃去细胞培养物,PBS洗2遍,将稀释好的PRV病毒液400 μL接种到各孔中,置于37 ℃、5% CO2培养箱1 h,期间每隔15 min摇晃一次,以便病毒吸附;弃去病毒液,加入含1%琼脂糖细胞维持液覆盖各孔,置于37 ℃、5% CO2培养箱培养3 d,取出细胞培养板,10%福尔马林固定30 min,弃去细胞覆盖物,PBS洗2遍,用0.5%结晶紫染色30 min,选择合适的稀释度进行计数。
1.10 ISG15与PRV共孵育试验取对数生长期PK-15细胞稀释接种于6孔板。培养至细胞融合度70%左右,进行分组处理:第1组直接用PRV(MOI=2)感染细胞;第2组将PRV与BSA于37 ℃孵育1 h后加入细胞;第3组将PRV与ISG15蛋白孵育1 h后加入细胞。吸附1 h后,更换成2%维持培养基,24 h后收取细胞总RNA、总蛋白和上清。分别检测PRV-gE的mRNA和蛋白表达,以及子代病毒的增殖。
1.11 统计学分析各试验均平行重复3次,通过GraphPad Prism 8.0软件中T-test检验方法对数据结果进行统计学分析。
2 结果 2.1 Cas9/sgRNA载体的构建为构建ISG15基因敲除PK-15细胞系,针对猪源ISG15的第二外显子,设计了两个特异性的CRISPR-Cas9 sgRNA。利用BbsⅠ末端序列将sgRNA克隆到pCompass-LVKO载体上,挑取单个菌落进行DNA测序,测序结果表明,重组质粒pCompass-LVKO-sgRNA构建成功(图 1),提取质粒用于后续试验。

|
框内序列分别为sgRNA1和sgRNA2序列 The sequences in box are sgRNA1 and sgRNA2 sequence respectively 图 1 pISG15-sgRNA测序结果 Fig. 1 Sequencing results of pISG15-sgRNA |
将构建成功的质粒pCompass-LVKO-sgRNA转染PK-15细胞,并以pCompass-LVKO空载体作为阴性对照。转染24 h后进行嘌呤霉素筛选,通过有限稀释法挑选单克隆。单克隆扩大培养后提取细胞总RNA,反转录为cDNA模板对ISG15进行PCR扩增。结果显示, 在619 bp处有出现一条特异性条带,初步说明该敲除细胞构建成功(图 2A)。将阳性克隆进行测序鉴定,与对照细胞的序列对比分析结果显示,sgRNA1细胞株的ISG15基因外显子打靶区缺失20 bp碱基,sgRNA2细胞株的ISG15基因外显子打靶区缺失8 bp碱基,选取sgRNA2细胞株进行后续功能评价,并命名为PK15-ISG15-/-。

|
A. PCR扩增(M.DL5000 DNA相对分子质量标准;1~3. 阳性克隆细胞PCR结果;4. PK-15细胞为阴性对照);B. PK15-ISG15-/-单克隆细胞测序结果 A. PCR amplification (M. DL5000 DNA marker; 1-3. The ISG15 PCR results of cell colonies; 4. PK-15 cell as a negative control); B. Sequencing results of PK15-ISG15-/- monoclonal cell 图 2 PK15-ISG15-/-单克隆细胞的筛选 Fig. 2 Screen of PK15-ISG15-/-monoclonal cell line |
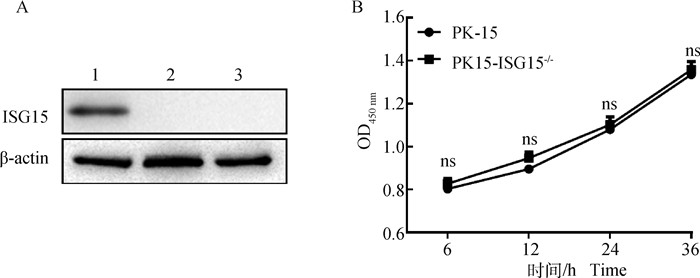
为验证ISG15敲除效率,Western blot检测PK-15和PK15-ISG15-/-细胞中ISG15蛋白的表达水平。结果表明,在PK-15细胞中可见明显的ISG15条带,而PK15-ISG15-/-细胞中没有检测到ISG15的表达,证实PK-15细胞中ISG15基因完全敲除(图 3A)。
|
A. Western blot检测ISG15敲除效率(1.PK-15细胞;2.PK15-ISG15-/- sgRNA1;3.PK15-ISG15-/- sgRNA2);B. 敲除ISG15基因对细胞增殖无影响。ns.差异不显著 A. ISG15 knockout efficiency by Western blot(1. PK-15 cell; 2. PK15-ISG15-/- sgRNA1 polyclonal cell; 3. PK15-ISG15-/- sgRNA2 polyclonal cell); B. ISG15 gene knockout can induce the replication of PK-15. ns. No significant difference 图 3 ISG15基因敲除细胞系的鉴定 Fig. 3 Identification of PK-15 cell line knockout of ISG15 gene |
通过CCK-8检测敲除ISG15基因后是否影响细胞增殖活性。结果显示,敲除ISG15基因后PK15-ISG15-/-细胞与PK-15细胞相比,OD450 nm波长吸光度值差异不显著(P>0.05),结果表明,ISG15基因敲除对PK15细胞的增殖没有显著影响(图 3B)。
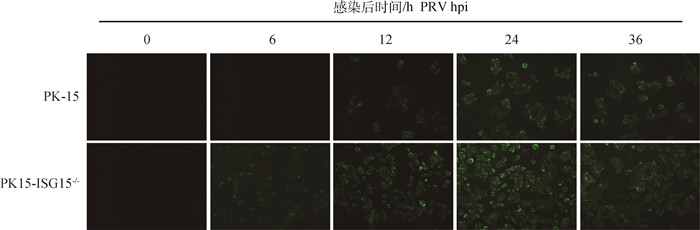
2.4 敲除ISG15基因对PRV病毒复制的影响为了研究ISG15对PRV复制的影响,作者评估了PRV在PK-15和PK15-ISG15-/-细胞中的复制状态。用MOI=2的PRV分别感染PK15细胞和PK15-ISG15-/-细胞,通过间接免疫荧光检测PRV蛋白的表达,发现在感染后的不同时间点,PRV在PK15-ISG15-/-细胞中的表达显著高于PK-15细胞中的表达(图 4)。该结果初步表明,敲除ISG15显著促进PRV复制。
|
荧光显微镜观察PRV感染PK-15及PK15-ISG15-/-细胞对病毒复制的影响(80×) Effect of PRV infecting PK-15 and PK15-ISG15-/- cells on viral replication observed by fluorescence microscopy(80×) 图 4 敲除ISG15基因促进PRV复制 Fig. 4 Knockout of ISG15 gene promotes PRV replication |
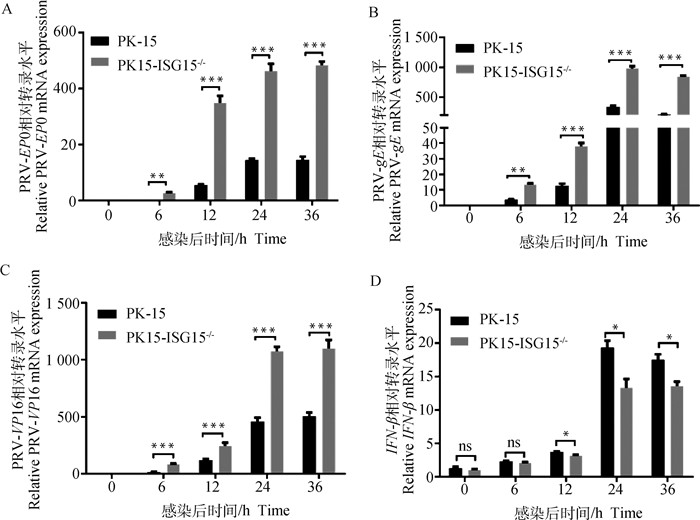
为进一步验证ISG15基因敲除对PRV复制的影响,利用RT-qPCR检测PK15-ISG15-/-细胞在感染PRV后的不同时间点,PRV-EP0、PRV-gE、PRV-VP16的mRNA水平。与对照组PK-15细胞相比,PK15-ISG15-/-细胞中PRV-EP0、PRV-gE、PRV-VP16的mRNA水平极显著升高(P < 0.01;P < 0.001)(图 5A~C),表明ISG15基因的敲除显著促进PRV基因转录。
|
A. RT-qPCR检测感染PRV不同时间PRV-EP0基因mRNA水平;B. RT-qPCR检测感染PRV不同时间PRV-gE mRNA水平;C. RT-qPCR检测感染PRV不同时间PRV-VP16 mRNA水平;D. RT-qPCR检测感染PRV不同时间IFN-β mRNA水平。*.P < 0.05; **. P < 0.01; ***. P < 0.001; ns. P>0.05 A. PRV-EP0 gene mRNA were quantified by RT-qPCR; B. PRV-gE gene mRNA were quantified by RT-qPCR; C. PRV-VP16 gene mRNA were quantified by RT-qPCR; D. PRV-IFN-β gene mRNA were quantified by RT-qPCR. *.P < 0.05; **. P < 0.01; ***. P < 0.001; ns. P>0.05 图 5 敲除ISG15基因促进PRV基因转录、抑制PRV诱导的IFN-β基因转录 Fig. 5 Knockdown of ISG15 promotes PRV transcription and inhibits PRV-induced IFN-β transcription |
同时检测不同时间段IFN-β的mRNA水平,结果显示,PK15-ISG15-/-细胞中IFN-β mRNA水平感染在0~6 h差异不显著;6~36 h时显著低于对照组(P < 0.05)(图 5D),表明ISG15基因敲除可以显著抑制IFN-β的表达。
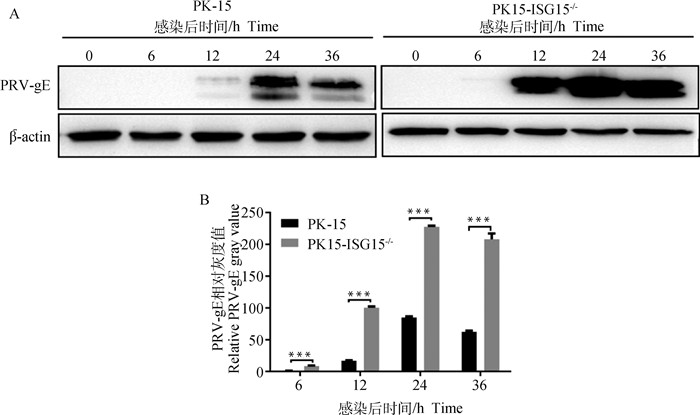
2.6 ISG15基因敲除对PRV蛋白表达的影响相同感染复数(MOI=2)的PRV感染PK-15细胞和PK15-ISG15-/-细胞,并在不同时间点收取细胞总蛋白,Western blot检测结果显示,PRV感染后不同时间PK15-ISG15-/-细胞中PRV-gE蛋白的表达量显著高于对照PK-15细胞(图 6A)。PK-15细胞在感染PRV 12 h时检测到PRV-gE蛋白,而PK15-ISG15-/-细胞在感染PRV 6 h就可以检测到PRV-gE蛋白,并且显示在PRV感染12、24、36 h的PK15-ISG15-/-细胞检测到的PRV-gE蛋白明显高于PK-15细胞。对PRV病毒蛋白的表达进行灰度分析显示,PK15-ISG15-/-中PRV-gE的蛋白表达极显著高于PK-15细胞(P < 0.001)(图 6B)。以上结果表明,ISG15基因敲除促进PRV-gE蛋白表达。
|
PRV gE蛋白Western blot结果(A)及灰度值分析结果(B)。***. P < 0.001 Western blot results of PRV gE protein(A)and gray value analysis results (B). ***. P < 0.001 图 6 敲除ISG15基因促进PRV-gE蛋白表达 Fig. 6 Knockout of ISG15 gene promotes PRV-gE protein expression |
为研究PK-15和PK15-ISG15-/-细胞扩增PRV子代病毒滴度的差异,用相同感染复数(MOI=2)的PRV分别感染这两种细胞,通过病毒噬斑法测定并计算PRV的病毒滴度。结果显示,PK15-ISG15-/-细胞的空斑数多于PK-15细胞,并且每个稀释度的空斑数均高于PK-15细胞(图 7A、B)。如图 7C所示,随着感染时间的增加,PK15-ISG15-/-细胞的病毒滴度显著高于PK-15细胞的病毒滴度(P < 0.05),并且在12 h后PK15-ISG15-/-细胞的病毒滴度极显著高于PK-15细胞(P < 0.001)。结果进一步证实ISG15基因敲除促进PRV的增殖。
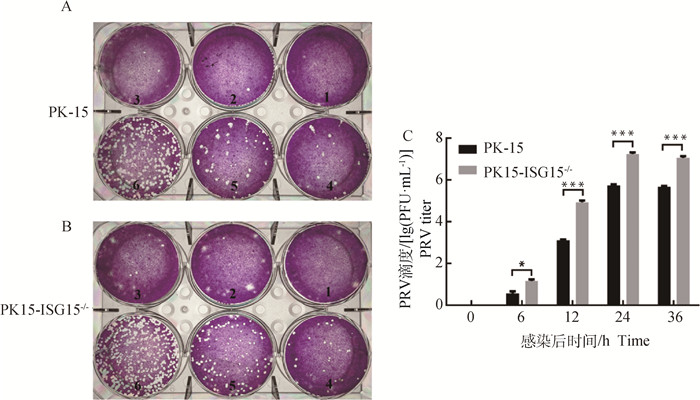
|
A.PRV感染24 h PK-15细胞病毒噬斑(1表示细胞对照;2~6表示病毒4倍梯度稀释,图中按照标号顺序每孔的空斑数量分别为0、1、2、14、40、153个);B.PRV感染24 h PK15-ISG15-/-细胞病毒噬斑(1表示细胞对照;2~6表示病毒4倍梯度稀释,图中按照标号顺序每孔的噬斑数量分别为0、1、7、26、94、190个);C. PK15-ISG15-/-细胞与PK-15细胞的病毒滴度。*P < 0.05; ***.P < 0.001 A. Plaque of PK-15 cell at 24 hpi (1. Cell control; 2-6. Virus 4-fold gradient dilution, the number of plaques in each well according to the labeled order in the figure was 0, 1, 2, 14, 40 and 153, respectively); B. Plaque of PK15-ISG15-/- cell at 24 hpi (1. Cell control; 2-6. Virus 4-fold gradient dilution, the number of plaques in each well according to the labeled order in the figure was 0, 1, 7, 26, 94 and 190, respectively); C. Virus titers of PK-15 and PK15-ISG15-/- cell. *.P < 0.05; ***. P < 0.001 图 7 敲除ISG15基因促进PRV子代病毒的增殖 Fig. 7 Knockout of ISG15 gene promotes proliferation of PRV virus |
为了验证ISG15是否通过抑制病毒入侵抑制PRV的复制,将纯化的ISG15蛋白与PRV于37 ℃孵育1 h后感染细胞,通过Western blot、RT-qPCR和病毒噬斑分别检测PRV的蛋白表达、转录水平以及病毒滴度,BSA与PRV孵育作为阴性对照,说明ISG15与PRV的相互作用是特异性的。Western blot检测和灰度分析结果显示,与对照组相比ISG15抑制PRV-gE蛋白的表达(P < 0.05)(图 8A);RT-qPCR结果显示,PRV-gE的mRNA水平较对照组显著降低(P < 0.05)(图 8B);病毒噬斑结果进一步证实ISG15可以抑制PRV的复制(P < 0.05)(图 8C)。以上结果表明,ISG15蛋白对PRV的抑制作用是通过抑制病毒侵入宿主细胞实现的。
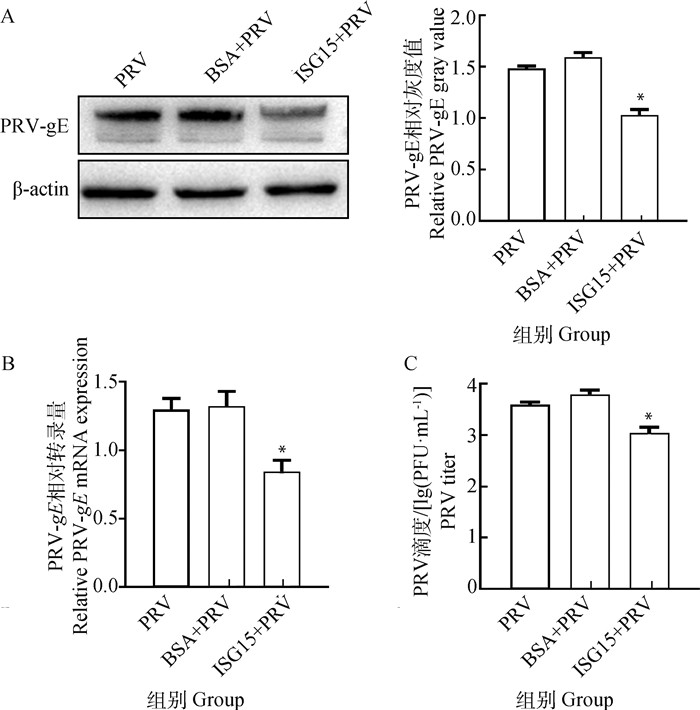
|
A. Western blot检测不同处理PRV感染后PRV-gE蛋白表达(左)及灰度值分析结果(右);B. RT-qPCR检测不同处理PRV感染后PRV-gE基因的mRNA水平;C. 病毒噬斑检测不同处理PRV感染后病毒滴度。*. P < 0.05 A. Expression of PRV-gE protein after infection with different treatments of PRV by Western blot (left) and gray value analysis results (right); B. Expression of PRV-gE protein after infection with different treatments of PRV by RT-qPCR; C. Virus titer after infection with different treatments of PRV by plaque. *. P < 0.05 图 8 ISG15通过抑制病毒入侵抑制PRV的复制 Fig. 8 ISG15 inhibits PRV replication by inhibiting viral invasion |
ISG15是由病原微生物IFN诱导产生的,在宿主防御和清除外源病原感染方面发挥重要作用[14-17]。ISG15已被证明在病毒感染过程中发挥重要作用,既可以通过直接作用影响病毒感染的各阶段,也可以通过间接作用影响病毒感染的宿主信号通路,发挥免疫调节作用[18-21]。由于作用机理的差异,ISG15在不同病原体之间甚至不同宿主物种之间的重要性可能会有所不同。对ISG15的研究有助于抗病毒药物的研发,也能为干预许多疾病的进展提供新的靶标。本试验利用近年来发展迅速的CRISPR/Cas9基因编辑技术成功构建了稳定敲除ISG15基因的PK-15细胞系,选取sgRNA2细胞株进行功能评价,并将该细胞克隆命名为PK15-ISG15-/-,用于研究ISG15对PRV复制的影响及作用机制。
敲低ISG15可促进A型流感病毒(influenza virus,IAV)的复制[22]。Nicholl等[19]研究表明,单纯疱疹病毒Ⅰ型(herpes simplex virus-1,HSV-1)感染可以激活ISG15、MxA等干扰素应答基因,从而抑制HSV-1的复制。Hsiao等[20]研究发现,过表达ISG15可以显著抑制日本脑炎病毒(Japanese encephalitis virus,JEV)的复制。本课题组前期研究发现,PRV感染PK-15细胞后引起ISG15的表达上调,过表达ISG15显著抑制PRV的复制[1]。然而,ISG15抑制PRV复制的分子机制尚不清楚。本研究利用构建的PK15-ISG15-/-细胞系对ISG15基因在PRV感染过程中的作用加以探究。结果表明,ISG15基因的敲除能够显著增加PRV基因的转录、病毒蛋白的翻译以及病毒的增殖,由此确定了ISG15对PRV具有抗病毒作用,敲除ISG15能够促进PK-15细胞中PRV的复制。
病毒入侵机体后,免疫系统可以识别病毒来源的核酸,诱导产生Ⅰ型IFN、促炎性细胞因子等[23-25]。Chen等[26]发现PRV感染过程中,ISG20在PK-15细胞中通过增强IFN-β信号抑制PRV复制。ISG15在抑制PRV复制过程中发挥关键作用,在本研究进一步发现,ISG15敲除能抑制IFN-β的表达,推测ISG15抗PRV复制的作用可能是通过调节Ⅰ型IFN实现,这其中的具体作用机制还需进一步探究和阐明,本文构建的ISG15敲除细胞系可以为该机制的研究提供有力工具。
4 结论从PK-15细胞中敲除ISG15并通过IFA、RT-qPCR、Western blot和病毒噬斑评估了ISG15基因敲除后对PRV复制的影响,确定了ISG15对PRV的抗病毒作用。进一步发现敲除ISG15能够抑制IFN-β的表达,在一定程度上促进PRV的复制。本研究为进一步探讨ISG15抑制PRV复制的分子机制提供良好的生物材料。
| [1] |
LIU H, LI X T, HU B, et al. Outbreak of severe pseudorabies virus infection in pig-offal-fed farmed mink in Liaoning Province, China[J]. Arch Virol, 2017, 162(3): 863-866. DOI:10.1007/s00705-016-3170-7 |
| [2] |
ROIZMANN B, DESROSIERS R C, FLECKENSTEIN B, et al. The family Herpesviridae: an update. The herpesvirus study group of the international committee on taxonomy of viruses[J]. Arch Virol, 1992, 123(3-4): 425-449. DOI:10.1007/BF01317276 |
| [3] |
张元英, 郑和林, 林仕青. 猪伪狂犬病的类症鉴别诊断要点[J]. 当代畜牧, 2009(3): 18-21. ZHANG Y Y, ZHENG H L, LIN S Q. Key points of differential diagnosis of porcine pseudorabies syndrome[J]. Contemporary Animal Husbandry, 2009(3): 18-21. (in Chinese) |
| [4] |
RZIHA H J, METTENLEITER T C, OHLINGER V, et al. Herpesvirus (pseudorabies virus) latency in swine: occurrence and physical state of viral DNA in neural tissues[J]. Virology, 1986, 155(2): 600-613. DOI:10.1016/0042-6822(86)90220-5 |
| [5] |
YANG Q Y, SUN Z, TAN F F, et al. Pathogenicity of a currently circulating Chinese variant pseudorabies virus in pigs[J]. World J Virol, 2016, 5(1): 23-30. DOI:10.5501/wjv.v5.i1.23 |
| [6] |
LUO Y Z, LI N, CONG X, et al. Pathogenicity and genomic characterization of a pseudorabies virus variant isolated from Bartha-K61-vaccinated swine population in China[J]. Vet Microbiol, 2014, 174(1-2): 107-115. DOI:10.1016/j.vetmic.2014.09.003 |
| [7] |
童光志, 陈焕春. 伪狂犬病流行现状及我国应采取的防制措施[J]. 中国兽医学报, 1999, 19(1): 1-2. TONG G Z, CHEN H C. Epidemic present status and prophylactico-therapeutic measures of pseudorabies taken in China[J]. Chinese Journal of Veterinary Science, 1999, 19(1): 1-2. DOI:10.3969/j.issn.1005-4545.1999.01.001 (in Chinese) |
| [8] |
AKIRA S, UEMATSU S, TAKEUCHI O. Pathogen recognition and innate immunity[J]. Cell, 2006, 124(4): 783-801. DOI:10.1016/j.cell.2006.02.015 |
| [9] |
SCHULZ O, PICHLMAIR A, REHWINKEL J, et al. Protein kinase R contributes to immunity against specific viruses by regulating interferon mRNA integrity[J]. Cell Host Microbe, 2010, 7(5): 354-361. DOI:10.1016/j.chom.2010.04.007 |
| [10] |
DER S D, ZHOU A M, WILLIAMS B R G, et al. Identification of genes differentially regulated by interferon α, β, or γ using oligonucleotide arrays[J]. Proc Natl Acad Sci U S A, 1998, 95(26): 15623-15628. DOI:10.1073/pnas.95.26.15623 |
| [11] |
LOEB K R, HAAS A L. The interferon-inducible 15-kDa ubiquitin homolog conjugates to intracellular proteins[J]. J Biol Chem, 1992, 267(11): 7806-7813. DOI:10.1016/S0021-9258(18)42585-9 |
| [12] |
WERNEKE S W, SCHILTE C, ROHATGI A, et al. ISG15 is critical in the control of chikungunya virus infection independent of UbE1L mediated conjugation[J]. PLoS Pathog, 2011, 7(10): e1002322. DOI:10.1371/journal.ppat.1002322 |
| [13] |
PERNG Y C, LENSCHOW D J. ISG15 in antiviral immunity and beyond[J]. Nat Rev Microbiol, 2018, 16(7): 423-439. DOI:10.1038/s41579-018-0020-5 |
| [14] |
FREITAS B T, SCHOLTE F E M, BERGERON É, et al. How ISG15 combats viral infection[J]. Virus Res, 2020, 286: 198036. DOI:10.1016/j.virusres.2020.198036 |
| [15] |
XU L, WANG W S, PEPPELENBOSCH M P, et al. Noncanonical antiviral mechanisms of ISGs: dispensability of inducible interferons[J]. Trends Immunol, 2017, 38(1): 1-2. DOI:10.1016/j.it.2016.11.002 |
| [16] |
SPEER S D, LI Z, BUTA S, et al. ISG15 deficiency and increased viral resistance in humans but not mice[J]. Nat Commun, 2016, 7: 11496. DOI:10.1038/ncomms11496 |
| [17] |
MORALES D J, LENSCHOW D J. The antiviral activities of ISG15[J]. J Mol Biol, 2013, 425(24): 4995-5008. DOI:10.1016/j.jmb.2013.09.041 |
| [18] |
SHI H X, YANG K, LIU X, et al. Positive regulation of interferon regulatory factor 3 activation by Herc5 via ISG15 modification[J]. Mol Cell Biol, 2010, 30(10): 2424-2436. DOI:10.1128/MCB.01466-09 |
| [19] |
NICHOLL M J, ROBINSON L H, PRESTON C M. Activation of cellular interferon-responsive genes after infection of human cells with herpes simplex virus type 1[J]. J Gen Virol, 2000, 81(9): 2215-2218. DOI:10.1099/0022-1317-81-9-2215 |
| [20] |
HSIAO N W, CHEN J W, YANG T C, et al. ISG15 over-expression inhibits replication of the Japanese encephalitis virus in human medulloblastoma cells[J]. Antiviral Res, 2010, 85(3): 504-511. DOI:10.1016/j.antiviral.2009.12.007 |
| [21] |
VILLARROYA-BELTRI C, GUERRA S, SÁNCHEZ-MADRID F. ISGylation-a key to lock the cell gates for preventing the spread of threats[J]. J Cell Sci, 2017, 130(18): 2961-2969. |
| [22] |
TANG Y J, ZHONG G X, ZHU L H, et al. Herc5 attenuates influenza A virus by catalyzing ISGylation of viral NS1 protein[J]. J Immunol, 2010, 184(10): 5777-5790. DOI:10.4049/jimmunol.0903588 |
| [23] |
翟云云, 李佳佳, 张爽, 等. 凋亡相关斑点样蛋白敲除PK-15细胞系的建立及对PRV感染的影响[J]. 畜牧兽医学报, 2021, 52(2): 478-487. ZHAI Y Y, LI J J, ZHANG S, et al. Establishment of apoptosis associated dot like protein knockout PK-15 cell line and its effect on porcine pseudorabies virus infection[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(2): 478-487. (in Chinese) |
| [24] |
KAWAI T, AKIRA S. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity[J]. Immunity, 2011, 34(5): 637-650. DOI:10.1016/j.immuni.2011.05.006 |
| [25] |
CHEN N N, REISS C S. Innate immunity in viral encephalitis: role of C5[J]. Viral Immunol, 2002, 15(2): 365-372. DOI:10.1089/08828240260066288 |
| [26] |
CHEN X Y, SUN D G, DONG S J, et al. Host interferon-stimulated gene 20 inhibits pseudorabies virus proliferation[J]. Virol Sin, 2021, 36(5): 1027-1035. DOI:10.1007/s12250-021-00380-0 |
(编辑 孟培)



