2. 中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,兰州 730046
2. State Key Laboratory of Veterinary Etiological Biology, Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, China
刚地弓形虫(Toxoplasma gondii)是一种分布广泛且危害严重的重要人畜共患病病原,全世界约有三分之一的人感染[1-3]。弓形虫生活史相对复杂,具有多宿主和多阶段的发育周期[4-5]。其生命周期包括有性生殖阶段和无性生殖阶段,但有性生殖阶段仅存在于终末宿主猫科动物的肠道黏膜中,而无性生殖阶段可以发生在人及几乎所有温血动物中[4-7]。弓形虫的传播方式多样,其有性生殖阶段和无性生殖阶段的任一环节均可感染宿主,这也是弓形虫病患者基数庞大的重要原因之一[8-10]。弓形虫可在宿主的脑部、心以及骨骼肌中形成包囊,人和动物摄入未烹饪或烹饪不完全的带有感染力包囊的食物以及被其成熟卵囊污染的水,是感染弓形虫病的重要途径[1, 4, 11-14]。大多数弓形虫病患者为隐性感染,但对于HIV/AIDS患者以及免疫功能低下的个体而言,急性感染是相对常见的,甚至有致死的可能性[4, 15-16]。弓形虫对孕妇和孕畜的危害巨大,速殖子可穿过胎盘,诱发先天性弓形虫病,导致胎儿流产或生理缺陷[4, 17-20]。因此,对弓形虫毒力因子的研究具有深远的公共卫生学意义。
弓形虫入侵宿主细胞的机制复杂,完整的入侵过程需要多种分泌蛋白共同协作[21]。与弓形虫毒力相关的主要调节因子有棒状体蛋白(rhoptry protein, ROP)、致密颗粒(dense granule protein, GRA)、微线体蛋白(microneme protein, MIC)和表面抗原(surface antigen, SAG)等[20-21]。其中,MIC蛋白是微线体分泌的一类在弓形虫入侵早期具有重要功能的蛋白,对于弓形虫识别、黏附及侵入宿主细胞尤为重要,并且还参与肌丝滑动,与弓形虫的运动能力紧密相关[22-25]。MIC蛋白的缺失,很有可能会导致弓形虫失去入侵宿主细胞的能力,进而影响毒力的发挥。MIC蛋白由多种跨膜蛋白和黏附蛋白组成。截至目前,已经发现多种MIC基因,而且这些蛋白具有经典的信号肽序列[24-25]。这些蛋白结构多样且复杂,但是许多蛋白(如TgMIC1-4和TgMIC6-9)含有与高等真核生物蛋白质黏附的结构域或同源结构[24-25]。对于具有黏附结构域的MICs蛋白,其可以与宿主细胞表面的受体和糖类结合,从而形成与宿主细胞相互作用的复合物[26]。二者形成的复合物会分泌到虫体的表面,在弓形虫毒力和致病性方面发挥重要作用[26]。通过蛋白结构和保守位点预测发现,部分MIC蛋白和假定蛋白均含有EGF_3结构域,并且同时还有相似的蛋白结构。通过蛋白结构预测结果和ToxoDB数据库中提供的信息,作者挑选了4个可能与MIC蛋白相关的假定蛋白进行基因功能学研究。此前众多学者已经对大部分MIC蛋白的功能进行解析,但并未对本研究选定的4个MIC相关的假定蛋白进行研究。那么这4个MIC假定蛋白是否也具有与MIC蛋白相似的结构和生物学功能呢?本研究基于CRISPR/Cas9技术,对弓形虫I型RH虫株的4个MIC假定蛋白相关基因进行敲除,以了解这4个基因对弓形虫的生长和对小鼠致病性的影响,为弓形虫疫苗的开发以及相关基因的研究奠定一定的基础。
1 材料与方法 1.1 虫株与实验动物弓形虫RH虫株速殖子由中国农业科学院兰州兽医研究所保存,30只6~8周龄SPF雌性昆明小鼠购自中国农业科学院兰州兽医研究所实验动物中心。
1.2 主要试剂DMEM高糖培养基、胎牛血清(FBS)以及0.25%胰酶均购自美国Gibco公司。质粒小提试剂盒购自北京天根生化有限公司,胶回收试剂盒购自OMEGA公司,乙胺嘧啶粉末购自美国Sigma-Aldrich公司,大肠杆菌DH5α感受态细胞购自南京诺唯赞技术有限公司,其余试剂均为国产分析纯。
1.3 细胞和虫体培养使用添加了10% FBS DMEM培养基培养HFF细胞,待细胞长满,换成添加2% FBS的培养基,用于传代弓形虫I型RH虫株亲本株和基因敲除株的速殖子。待虫体大量逸出时,收集虫体和细胞,用1 mL注射器反复抽吸,裂解宿主细胞,使虫体全部逸出。用孔径为5 μm的Millipore过滤器过滤速殖子,最后将速殖子接入长满HFF的细胞中传代培养[27]。
1.4 目的基因结构特征分析将从ToXoDB下载的目的基因蛋白序列导入蛋白质结构域、家族和功能位点数据库(https://prosite.expasy.org/),获得目的基因活性功能位点。将目的基因蛋白序列导入蛋白3D结构预测网站(https://swissmodel.expasy.org/interactive/),以评分最高的蛋白结构进行3D建模,最后用Discovery Studio 4.5分析蛋白结构[27]。
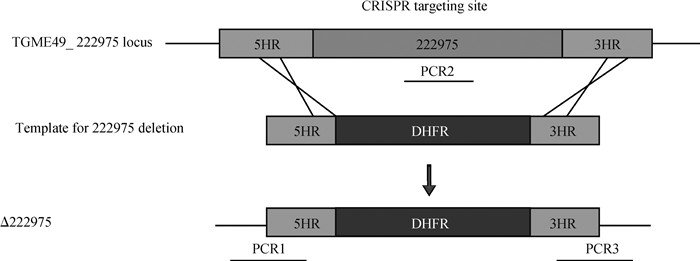
1.5 弓形虫基因敲除株的构建、筛选和鉴定利用CRISPR/Cas9靶点选择网站(http://www.e-crisp.org/E-CRISP/)对弓形虫RH虫株的4个目的基因(TGME49_222975、TGME49_275798、TGME49_238220和TGME49_238210)进行靶点预测,并设计相关引物(表 1)。根据设计的引物,以pSAG1:: CAS9-U6:: sgUPRT为模板,利用Q5定点突变试剂盒将模板质粒中的靶点序列(SgUPRT)替换为目的基因靶点特异的SgRNA序列,酶切环化后得到带有目的基因靶点序列的质粒,转化后测序鉴定获得阳性质粒。用表 2设计的引物,以RH虫株DNA为模板,扩增目的基因的U3、U5同源臂,以DHFR-D质粒为模板扩增抗性片段DHFR-TS,胶回收后,利用同源重组的方法,将目的基因的U3、U5和DHFR-TS连接至PUC19载体,获得带有相关目的基因同源臂以及乙胺嘧啶抗性片段的质粒,转化后测序鉴定获得阳性质粒[27]。最后通过电击转染的方式将带有目的基因靶点序列的质粒与带有目的基因臂以及DHFR的抗性片段导入弓形虫RH速殖子中(图 1),用乙胺嘧啶进行筛选阳性虫株。96孔板单克隆筛选后提取虫体DNA,用之前设计的引物进行PCR验证(表 3)。所有目的基因缺失株构建原理相同。
|
|
表 1 目的基因sgRNA Table 1 sgRNA of target genes |
|
|
表 2 扩增同源片段引物 Table 2 Primers for amplification of homologous fragments |
|
图 1 TGME49_222975基因敲除原理示意图 Fig. 1 Schematic diagram of disrupting TGME49_222975 |
|
|
表 3 验证敲除引物 Table 3 Primers used for identification of the deletion |
将刚逸出的速殖子接种到长满HFF细胞的12孔板中,分别接入300个目的基因缺失株和RH野生株速殖子,细胞培养箱培养7 d后,弃去原培养基,用PBS洗涤3遍,每孔加入1 mL 4%多聚甲醛固定液固定30 min,弃掉固定液,随后每孔加入500 μL 0.5%结晶紫染液, 染色10 min,弃掉结晶紫染液,再用PBS洗涤两边,倒置晾干,观察并拍照记录结果[27]。
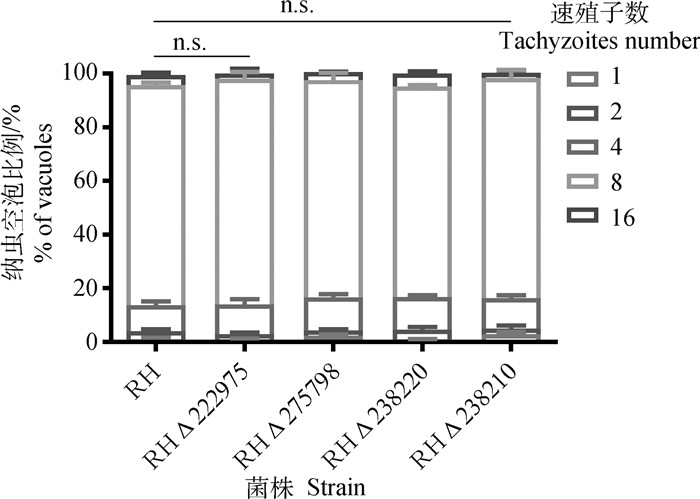
1.7 复制试验长满HFF细胞的12孔板中每孔分别接入1×105个目的基因缺失株和RH野生株速殖子,培养24 h,弃掉原培养基,每孔加入1 mL 4%多聚甲醛固定液,固定30 min,显微镜下分别记录含有16、8、4、2、1个速殖子的纳虫空泡的数目及百分比[27]。
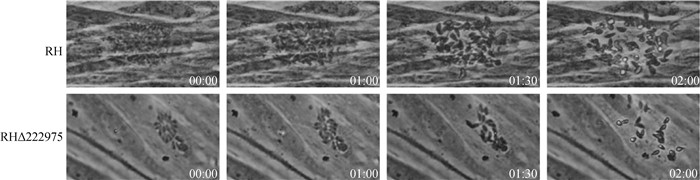
1.8 逸出试验长满单层HFF细胞的12孔板中每孔分别接入2×104个刚逸出的目的基因缺失株和RH野生株速殖子,培养28~32 h,弃去原有培养基,每孔加入1 mL提前37 ℃预热添加了3 μmol·L-1 A23187钙离子的DMEM培养基,立刻用相机记录速殖子实时逸出情况[27]。
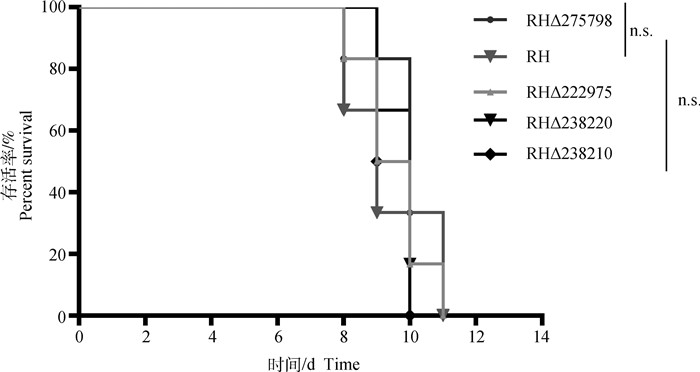
1.9 小鼠毒力试验将30只SPF级6~8周龄昆明雌鼠随机分为5组,每组6只。以腹腔注射的方式接种基因缺失株速殖子和野生株RH速殖子,每只小鼠接种100个速殖子。每天定时观察发病情况,并记录小鼠的死亡情况[27]。
1.10 基于ToXoDB数据库对目的基因进行表达差异分析通过ToxoDB(http://toxodb.org)网站,分别检索4个目的基因在不同基因型弓形虫虫株、不同生活史阶段以及不同分裂周期的表达量数据,并对此数据进行差异化分析[27]。
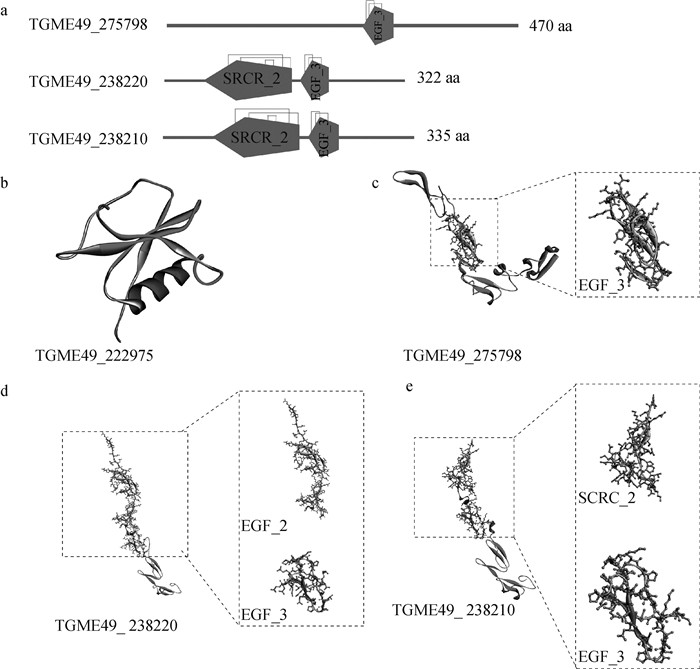
2 结果 2.1 目的基因结构分析用ExPASy分析4个目的基因蛋白序列(图 2)。未在TGME49_222975中检索到保守的结构域,TGME49_275798检索到1个EGF_3结构域,TGME49_238220和TGME49_238210均发现含有1个SRCR_2结构域和1个EGF_3结构域。SRCR_2结构域上有3个二硫键,EGF_3位点上有2个二硫键。SWISS-MODEL蛋白建模结果与ExPASy结果相符,并且发现TGME49_238220和TGME49_ 238210蛋白结构相似,蛋白功能可能比较相似;而TGME49_222975的蛋白结构与其余3个目的基因的蛋白结构差异较大,因此功能可能有较大差异。
|
a.保守结构域预测;b~e. 3D结构预测。扫文章首页OSID码可查看彩图 a. Conservative structure domain prediction; b-e. 3D structure prediction. Scan OSID code for the color pictures 图 2 目的基因保守结构域及蛋白3D结构 Fig. 2 Conserved structural domain of target gene and 3D structure of protein |
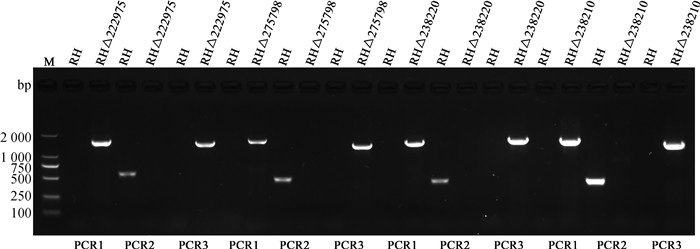
将电转后的速殖子接入25T长满单层HFF细胞,加入乙胺嘧啶进行筛选,待速殖子全部逸出后接入96孔板长满单层HFF细胞中进行单克隆筛选。提取单克隆虫株的DNA,用表 3中引物检验是否成功筛选出目的虫株。如图 3所示,4个目的基因缺失株(RHΔTGME49_222975、RHΔTGME49_275798、RHΔTGME49_238200和RHΔTGME49_238210)均无法扩增出PCR2目的基因片段,而成功扩增出PCR1、PCR3目的基因片段。对于RH野生株,均无法扩增出PCR1、PCR3基因片段,而PCR2可以扩增出目的大小基因片段,这说明成功构建4个目的基因敲除株。
|
图 3 目的基因的敲除验证 Fig. 3 Identification of the knock-out strain |
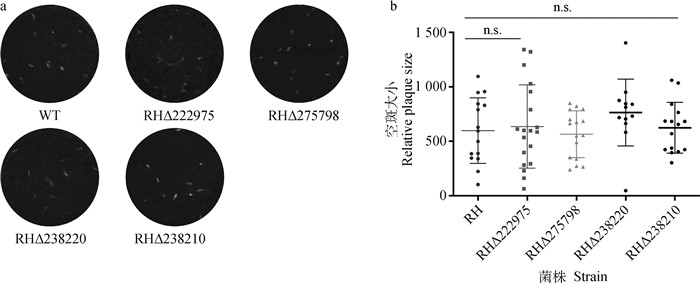
目的基因缺失株和RH野生株的速殖子以相同数量接种至12孔板长满单层HFF细胞培养7 d后,固定染色并拍照记录试验结果。结果表明,4个目的基因敲除株与野生株RH所形成的噬斑数量和大小没有明显差异(P>0.05,图 4)。
|
a.空斑大小及数目;b.空斑大小及数目可视化分析, n.s.P>0.05。扫文章首页OSID码可查看彩图 a.Size and number of plaques; b. Visual analysis of plaques size and number, n.s.P>0.05. The color pictures can be found by scanning the OSID code on the front page 图 4 目的基因缺失株和RH野生株空班形成情况 Fig. 4 Plaques formed by wild-type and the deletion strain |
接种目的基因缺失株和RH野生株1×105个速殖子的12孔板长满单层HFF细胞培养24 h后,弃去原培养基后固定,显微镜下观察包含不同速殖子个数的纳虫空泡数量。结果显示,含有16个速殖子的纳虫空泡数目最多,4个目的基因缺失株和RH野生株包含相同速殖子个数的纳虫空泡数目差别不显著(P>0.05,图 5)。
|
扫文章首页OSID码可查看彩图 The color picture can befound by scanning the OSID code on the front page 图 5 目的基因缺失株和RH野生株体外复制情况 Fig. 5 Comparison of in vitro replication between the deletion strain and wild-type |
接种目的基因敲除株和RH野生株2×104个速殖子12孔板长满单层HFF细胞培养28~32 h, 弃去原培养基,加入一定浓度钙离子,拍照记录速殖子逸出情况。结果显示,目的基因敲除株和RH野生株纳虫空泡内的速殖子2 min内大部分可全部逸出,在1及1.5 min时间点时速殖子逸出情况也大体相似(图 6)。
|
图 6 RHΔTGME49_222975和RH野生株逸出情况 Fig. 6 Comparison of in vitro egress of RHΔTGME49_222975 and wild strain |
5组小鼠(6只·组-1)以腹腔注射的方式接种目的基因缺失株和RH野生株速殖子100个·只-1。结果显示,5组小鼠在8~11 d内全部死亡,4个目的基因缺失株小鼠存活时间较接种野生株小鼠稍有延长,但差异并不明显(P>0.81,图 7)。
|
扫文章首页OSID码可查看彩图 The color picture can be found by scanning the OSID code on the front page 图 7 目的基因缺失株与RH野生株对昆明鼠的毒力情况 Fig. 7 Survival curves of Kunming mice infected with the deletion strain and wild-type strain |
通过ToxoDB数据库检索目的基因在不同弓形虫虫株(图 8a)、不同分裂期表达量(图 8b)和卵囊、速殖子和缓殖子期转录水平(图 8c)的数据,并分析发现,TGME49_222975、TGME49_275798相关数据并不齐全,不适合进行后续分析。TGME49_ 238220、TGME49_238210表达水平低,其中,TGME49_238220、TGME49_238210在RH虫株中的表达量接近,表达量最高的虫株分别为VEG和Pru,但表达量总体低。TGME49_238220不同分裂期表达量没有变化,TGME49_238210表达量在S1分裂期间有一定增加。TGME49_238220、TGME49_238210在弓形虫卵囊、速殖子和缓殖子阶段的转录水平均不高,不同分裂期表达量差异不显著(图 8)。

|
a、b、c分别代表目的基因在弓形虫不同分裂期、不同基因型和不同生命阶段的表达量差异分析 a, b, c represent the differential expression of target genes in different division stages, different genotypes and different life stages of Toxoplasma gondii, respectively 图 8 基于ToxoDB数据库的目的基因表达差异分析 Fig. 8 Differential expression analysis of target genes based on ToxoDB database |
CRISPR/Cas9作为一种操作简便、高效的基因编辑工具,已经广泛用于分子生物学和遗传学研究[28-29]。经过长时间的发展,CRISPR工具已经是弓形虫基因的编辑常用工具之一,众多相关研究成果已相继发表[14, 21, 28]。MIC基因是决定弓形虫毒力的重要基因之一,大多数MIC基因生物学功能已经被相继解析,但对于与MIC相关基因的研究相对有限[12, 14, 21, 28, 30]。本研究基于转录组数据,有针对地挑选4个与MIC基因相关的假定蛋白展开功能学研究,以期找到与重要MIC基因联系紧密的基因,更全面地解析MIC基因功能,为以后开发高效的弓形虫疫苗奠定一定基础。
多种微线体蛋白都含有EGF同源类似的结构域或EGF样结构域,这些结构域对于微线体蛋白间形成复合物,从而提高弓形虫对宿主细胞的黏附能力十分重要。EGF还可以通过与宿主细胞的EGFR结合,激活EGFR和Akt通路,进而阻止由宿主自噬蛋白和溶酶体蛋白启动虫体清除程序[31]。SCRC是一种富含半胱氨酸的保守结构域,其功能不仅与虫体黏附宿主细胞紧密相关,还与虫体调节宿主免疫反应相关[32]。其作为传统意义上的模式识别受体,作为蛋白与蛋白相互作用中的受体是其发挥功能的重要体现[32]。ExPASy检索目的蛋白序列保守结构域发现,TGME49_275798含有1个EGF_3位点,TGME49_238220和TGME49_238210含有1个EGF_3和1个SCRC保守结构域。EGF和SCRC结构对于弓形虫对宿主细胞的黏附、微线体蛋白之间形成复合物、蛋白与宿主蛋白发挥相互作用以及调节宿主的免疫反应有重要作用[32]。以同样方法分析部分MIC蛋白序列(如MIC3和MIC8)的保守结构域和3D结构发现,MIC3和MIC8蛋白也含有EGF_3位点。目的基因TGME49_238220和TGME49_23821与MIC3和MIC8蛋白3D结构也十分相似。
基于此,作者利用CRISPR技术敲除RH野生株4个与MIC相关的假定蛋白基因进行功能研究,成功获得4个目的基因缺失株RHΔTGME49_222975、RHΔTGME49_275798、RHΔTGME49_238200和RHΔTGME49_238210。随后比较基因敲除株与RH野生株在体外复制能力、逸出能力、形成空班的能力以及对昆明鼠的毒力间的差异。结果表明,目的基因缺失株与RH野生株形成的包含相同速殖子个数的纳虫空泡数目大体相当,目的基因缺失株与RH野生株速殖子的逸出能力以及形成空斑的数目和大小,接种相同剂量的目的基因缺失株和RH野生株的昆明鼠从开始死亡时间到全部死亡时间差别并不大,均无统计学差异(P>0.05)。此外,基于定位虫株的构建,间接免疫荧光试验和蛋白免疫印记试验结果均表明目的基因在速殖子阶段并不表达或表达量极低以至于无法检测到。以上结果均说明这4个与MIC相关的目的基因并不是影响弓形虫体外生长能力、逸出能力以及毒力的重要基因。
通过ToxoDB数据库,将目的基因在不同基因型弓形虫虫株、不同细胞周期的表达水平以及不同生活史阶段的转录水平数据进行差异分析。但没有检索到TGME49_222975和TGME49_275798完整的可用于分析的转录组数据。通过比较TGME49_238220和TGME49_238210转录组数据发现,TGME49_238220在Pru中的表达量最高,在RH中表达量最低。TGME49_238210在VEG中表达量最高。但相较于其他功能较强大的基因,TGME49_238220与TGME49_238210在Pru、VEG中的表达水平并不高。这或许解释了目的基因缺失株对弓形虫体外复制能力、逸出能力以及对昆明鼠的毒力并未产生显著影响。TGME49_238220在不同的分裂周期及不同生活史阶段(卵囊、速殖子和缓殖子)转录水平无明显变化,说明其对于弓形虫分裂、卵囊的形成、速殖子缓殖子之间的转化没有影响或所发挥的功能有限。TGME49_238210在弓形虫S1期表达量最高,说明其可能在分裂S1期中有一定作用,但表达量相对较低,也说明其作用有限。TGME49_ 238220和TGME49_238210在不同生活史阶段中表达量有轻微浮动,但幅度较小。数据分析结果表明TGME49_238220和TGME49_238210在RH中的表达量较低,在不同分裂周期表达量、不同生活史阶段(卵囊、速殖子和缓殖子)的转录水平均较低,与基因缺失株表型试验结果相吻合。
本研究结果表明,4个目的基因均不是弓形虫的重要“独立”毒力因子,但可能在其他方面发挥着重要生物学功能。本研究为后续开发弓形虫疫苗、全面解析弓形虫蛋白的功能奠定了基础。
4 结论成功构建4个以弓形虫RH野生株为载体的MIC相关假定蛋白基因缺失株(RHΔTGME49_222975、RHΔTGME49_275798、RHΔTGME49_238200和RHΔTGME49_238210),基因缺失株和野生株RH的噬斑试验、复制试验、逸出试验以及小鼠毒力试验结果均差异不显著,可见4个目的基因均不是弓形虫的重要“独立”毒力因子。
| [1] |
张海生, 梁勤立, 李婷婷, 等. 弓形虫HAD2b基因缺失株的构建及生物学功能研究[J]. 中国兽医科学, 2021, 51(5): 562-568. ZHANG H S, LIANG Q L, LI T T, et al. Generation and functional characterization of HAD2b deletion strain of Toxoplasma gondii[J]. Chinese Veterinary Science, 2021, 51(5): 562-568. (in Chinese) |
| [2] |
WANG Z D, WANG S C, LIU H H, et al. Prevalence and burden of Toxoplasma gondii infection in HIV-infected people: a systematic review and meta-analysis[J]. Lancet HIV, 2017, 4(4): e177-e188. DOI:10.1016/S2352-3018(17)30005-X |
| [3] |
MENDEZ O A, KOSHY A A. Toxoplasma gondii: entry, association, and physiological influence on the central nervous system[J]. PLoS Pathog, 2017, 13(7): e1006351. DOI:10.1371/journal.ppat.1006351 |
| [4] |
SRIVASTAVA S, WHITE M W, SULLIVAN W J JR. Toxoplasma gondii AP2XⅡ-2 contributes to proper progression through s-phase of the cell cycle[J]. mSphere, 2020, 5(5): e00542-20. DOI:10.1128/mSphere.00542-20 |
| [5] |
李威. 弓形虫SRS52蛋白的鉴定及其功能的初步研究[D]. 北京: 中国农业科学院, 2021. LI W. Identification of Toxoplasma gondii SRS52 protein and preliminary study of its function[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021. (in Chinese) |
| [6] |
DUBEY J P, LINDSAY D S, SPEER C A. Structures of Toxoplasma gondii tachyzoites, bradyzoites, and sporozoites and biology and development of tissue cysts[J]. Clin Microbiol Rev, 1998, 11(2): 267-299. DOI:10.1128/CMR.11.2.267 |
| [7] |
RADKE J B, WORTH D, HONG D, et al. Transcriptional repression by ApiAP2 factors is central to chronic toxoplasmosis[J]. PLoS Pathog, 2018, 14(5): e1007035. DOI:10.1371/journal.ppat.1007035 |
| [8] |
杨承杭. 弓形虫UTPG基因的生物学功能研究[D]. 武汉: 华中农业大学, 2021. YANG C H. Biological function study of UTPG gene in Toxoplasma gondii[D]. Wuhan: Huazhong Agricultural University, 2021. (in Chinese) |
| [9] |
HUANG S, HOLMES M J, RADKE J B, et al. Toxoplasma gondii AP2IX-4 regulates gene expression during bradyzoite development[J]. mSphere, 2017, 2(2): e00054-17. DOI:10.1128/mSphere.00054-17 |
| [10] |
SULLIVAN W J JR, JEFFERS V. Mechanisms of Toxoplasma gondii persistence and latency[J]. FEMS Microbiol Rev, 2012, 36(3): 717-733. DOI:10.1111/j.1574-6976.2011.00305.x |
| [11] |
DUBEY J P, HILL D E, JONES J L, et al. Prevalence of viable Toxoplasma gondii in beef, chicken, and pork from retail meat stores in the United States: risk assessment to consumers[J]. J Parasitol, 2005, 91(5): 1082-1093. DOI:10.1645/GE-683.1 |
| [12] |
ELMORE S A, JONES J L, CONRAD P A, et al. Toxoplasma gondii: epidemiology, feline clinical aspects, and prevention[J]. Trends Parasitol, 2010, 26(4): 190-196. DOI:10.1016/j.pt.2010.01.009 |
| [13] |
PAPPAS G, ROUSSOS N, FALAGAS M E. Toxoplasmosis snapshots: global status of Toxoplasma gondii seroprevalence and implications for pregnancy and congenital toxoplasmosis[J]. Int J Parasitol, 2009, 39(12): 1385-1394. DOI:10.1016/j.ijpara.2009.04.003 |
| [14] |
王宁, 薛俊欣, 李健, 等. 弓形虫微线体蛋白4的表达及其应用[J]. 中国兽医学报, 2019, 39(9): 1782-1787. WANG N, XUE J X, LI J, et al. Expression of the microneme protein 4 of Toxoplasma gondii and preliminary study on the application[J]. Chinese Journal of Veterinary Science, 2019, 39(9): 1782-1787. (in Chinese) |
| [15] |
JONES J L, KRUSZON-MORAN D, WILSON M, et al. Toxoplasma gondii infection in the United States: seroprevalence and risk factors[J]. Am J Epidemiol, 2001, 154(4): 357-365. DOI:10.1093/aje/154.4.357 |
| [16] |
MARTÍNEZ A J, SELL M, MITROVICS T, et al. The neuropathology and epidemiology of AIDS: A Berlin experience. A review of 200 cases[J]. Pathol Res Pract, 1995, 191(5): 427-443. DOI:10.1016/S0344-0338(11)80730-2 |
| [17] |
ORTIZ-ALEGRÍA L B, CABALLERO-ORTEGA H, CAÑEDO-SOLARES I, et al. Congenital toxoplasmosis: candidate host immune genes relevant for vertical transmission and pathogenesis[J]. Genes Immun, 2010, 11(5): 363-373. DOI:10.1038/gene.2010.21 |
| [18] |
WANG J L, ZHANG N Z, LI T T, et al. Advances in the development of anti-Toxoplasma gondii vaccines: challenges, opportunities, and perspectives[J]. Trends Parasitol, 2019, 35(3): 239-253. DOI:10.1016/j.pt.2019.01.005 |
| [19] |
WANG J L, HUANG S Y, BEHNKE M S, et al. The past, present, and future of genetic manipulation in Toxoplasma gondii[J]. Trends Parasitol, 2016, 32(7): 542-553. DOI:10.1016/j.pt.2016.04.013 |
| [20] |
TENTER A M, HECKEROTH A R, WEISS L M. Toxoplasma gondii: from animals to humans[J]. Int J Parasitol, 2000, 30(12-13): 1217-1258. DOI:10.1016/S0020-7519(00)00124-7 |
| [21] |
王一凡, 张伟超, 吴颢, 等. CRISPR/Cas9技术在构建弓形虫微线体蛋白mic3敲除株上的应用[J]. 中国兽医学报, 2017, 37(9): 1720-1725. WANG Y F, ZHANG W C, WU H, et al. Knockout of mic3 gene in Toxoplasma gondii using CRISPR/Cas9 technique[J]. Chinese Journal of Veterinary Science, 2017, 37(9): 1720-1725. (in Chinese) |
| [22] |
WANG Y H, YIN H. Research advances in microneme protein 3 of Toxoplasma gondii[J]. Parasit Vectors, 2015, 8: 384. DOI:10.1186/s13071-015-1001-4 |
| [23] |
MEISSNER M, REISS M, VIEBIG N, et al. A family of transmembrane microneme proteins of Toxoplasma gondii contain EGF-like domains and function as escorters[J]. J Cell Sci, 2002, 115(Pt 3): 563-574. |
| [24] |
TOMLEY F M, SOLDATI D S. Mix and match modules: structure and function of microneme proteins in apicomplexan parasites[J]. Trends Parasitol, 2001, 17(2): 81-88. DOI:10.1016/S1471-4922(00)01761-X |
| [25] |
王艳华. 弓形虫抗原主要功能和免疫特性[J]. 中国人兽共患病学报, 2020, 36(4): 330-339. WANG Y H. Main functions and immune characteristics of Toxoplasma gondii antigens[J]. Chinese Journal of Zoonoses, 2020, 36(4): 330-339. (in Chinese) |
| [26] |
柳方远, 李双星, 印春生, 等. 弓形虫主要分泌蛋白及其功能的研究进展[J]. 中国动物传染病学报, 2020, 28(5): 94-102. LIU F Y, LI S X, YIN C S, et al. Research advances on functions of secretory proteins of Toxoplasma gondii[J]. Chinese Journal of Animal Infectious Diseases, 2020, 28(5): 94-102. (in Chinese) |
| [27] |
BAI M J, WANG J L, ELSHEIKHA H M, et al. Functional characterization of dense granule proteins in Toxoplasma gondii RH strain using CRISPR-Cas9 system[J]. Front Cell Infect Microbiol, 2018, 8: 300. DOI:10.3389/fcimb.2018.00300 |
| [28] |
谢素珠, 李继旭, 张煊承, 等. 弓形虫MIC10基因敲除株的构建及鉴定[J]. 中国兽医学报, 2019, 39(10): 2001-2005. XIE S Z, LI J X, ZHANG X C, et al. Construction and identification of Toxoplasma gondii MIC10 gene knockout strain[J]. Chinese Journal of Veterinary Science, 2019, 39(10): 2001-2005. (in Chinese) |
| [29] |
李君, 张毅, 陈坤玲, 等. CRISPR/Cas系统: RNA靶向的基因组定向编辑新技术[J]. 遗传, 2013, 35(11): 1265-1273. LI J, ZHANG Y, CHEN K L, et al. CRISPR/Cas: a novel way of RNA-guided genome editing[J]. Hereditas (Beijing), 2013, 35(11): 1265-1273. (in Chinese) |
| [30] |
江涛, 张东林, 聂浩, 等. 弓形虫MIC3基因真核表达质粒的构建及在IBRS-2细胞内的表达[J]. 畜牧兽医学报, 2007, 38(8): 827-831. JIANG T, ZHANG D L, NIE H, et al. Construction and expression in IBRS-2 cells of the eukaryotic expressed plasmid of MIC3 from Toxoplasma gondii[J]. Acta Veterinaria et Zootechnica Sinica, 2007, 38(8): 827-831. DOI:10.3321/j.issn:0366-6964.2007.08.013 (in Chinese) |
| [31] |
王一凡. 与弓形虫微线体蛋白互作的宿主蛋白的筛选和鉴定[D]. 武汉: 华中农业大学, 2015. WANG Y F. Screening and identification of host proteins that interact with Toxoplasma gondii micronemal proteins[D]. Wuhan: Huazhong Agricultural University, 2015. (in Chinese) |
| [32] |
MARTÍNEZ V G, MOESTRUP S K, HOLMSKOV U, et al. The conserved scavenger receptor cysteine-rich superfamily in therapy and diagnosis[J]. Pharmacol Rev, 2011, 63(4): 967-1000. |
(编辑 白永平)



