产气荚膜梭菌(Clostridium perfringens,CP)是革兰阳性、产芽胞的厌氧性杆菌,普遍存在于鸡料槽、粪便、污水、土壤以及健康鸡的肠道中,是鸡坏死性肠炎(necrotizing enteritis,NE)[1]的主要致病菌。依据CP分泌的四种主要毒素α、β、ε、τ,可将CP分为A~E共5种血清型,大规模流行的为A型[2-3]。NE以肠道严重出血,肠黏膜严重损伤、溃疡和坏死为特征,是家禽养殖业危害最大的疾病之一,每年给养禽业造成巨大经济损失[4]。对于NE的防控,我国养殖业主要通过在饲料或饮水中添加抗生素来预防和治疗CP感染。青霉素、阿维拉霉素、四环素、泰乐菌素、林可霉素、杆菌肽等几种抗生素较常用,且疗效较好。然而抗生素的滥用也使得越来越多的CP产生了耐药性,药效明显降低[5]。近年来,抗生素被禁止作为抗生素促生长剂后,鸡NE的发病率急剧上升。我国已于2020年开始全面实施禁抗措施[6]。目前,全面禁抗后,临床上流行的菌株对常用药物的敏感性有无发生变化还不清楚,常用药物的防治效果需要进一步调查。本文研究了有NE发病史的规模化肉鸡养殖场内CP分离株的毒素型、致病力以及它们对临床上常用3种药物阿维拉霉素、泰乐菌素和林可霉素的敏感性,并根据药敏结果选定阿维拉霉素和磷酸泰乐菌素对NE发病鸡场的无症状鸡群进行预防试验,评价药物效果,从而为规模化养殖场由CP引起的NE防治提供指导。
1 材料与方法 1.1 材料1.1.1 药物 盐酸林可霉素、磷酸泰乐菌素、阿维拉霉素、阿维拉霉素预混剂、磷酸泰乐菌素预混剂,来自中国农业大学动物医学院兽医药理毒理学实验室。
1.1.2 菌株 鸡源A型产气荚膜梭菌(C57-85)CVCC2030、鸡源C型产气荚膜梭菌(C59-2)CVCC60102,购自中国兽医药品监察所中国兽医微生物菌种保藏管理中心;脆弱拟杆菌ATCC25285,购自美国模式菌种收集中心(ATCC)。
1.1.3 主要培养基与耗材 液体硫乙醇酸盐(FTG)培养基、胰胨-亚硫酸盐-环丝氨酸(TSC)琼脂、脑心浸液琼脂(BHA)培养基、无菌脱纤维羊血均购自北京陆桥技术股份有限公司,CHROMagar沙门氏菌显色培养基、MH液体培养基购自北京普纳德科技有限公司,2.5 L厌氧培养包购自日本三菱瓦斯化学株式会社,美蓝染色液购自青岛海博生物技术有限公司。
1.1.4 主要仪器设备 恒温培养箱,上海一恒科技有限公司产品。密封培养罐,美国Thermo公司产品。SPF鸡隔离器,苏州市冯氏实验动物设备有限公司产品。PCR扩增仪,电泳成套设备,凝胶成像系统,美国Bio-rad公司产品。
1.2 方法1.2.1 样品采集、CP的分离、毒素型鉴定 2019、2020年,于山西、河北两地有NE发生的规模化养殖场进行采样,使用微生物采样管采集肉鸡肛门或泄殖腔内新鲜粪便,置于4 ℃低温保存箱中带回实验室。将粪样放入FTG内增菌,吸取增菌液与50 ℃左右的TSC琼脂混匀,凝固后再倒一层TSC,再次凝固后,置于密封培养罐内,放入2袋厌氧培养包,合上盖子密闭,37 ℃培养24 h。挑取CP单菌落在绵羊血琼脂平板上划线置于放有厌氧产气袋的密封培养罐内37 ℃培养24 h。将疑似CP的分离株送去测序公司进行16S rRNA测序,鉴定细菌种属。合成CPA、CPB、ETX、IAP引物,通过多重PCR方法[7]进行毒素型鉴定。
1.2.2 CP的致病力试验 在中国农业大学实验动物平台隔离器中,使用SPF鸡开展试验。购入60只1日龄鸡(记为D1)进行前期饲养,正常雏鸡料饲养至12日龄,在D12将试验鸡随机分配到4组(A、B、C、D组),每组15只,更换为50%鱼粉+50%燕麦粉饲喂[8-10]。培养3株临床分离株(菌株20HB6RK39、20SJ5RX172、20SJ5RX66,分别对应A组、B组和C组),D14日分别对A、B、C组试验鸡进行攻菌,每只鸡经灌胃感染1 mL 1×109 CFU·mL的菌液,连续攻菌5 d[11],分别在DM(攻菌结束次日)、DM+7、DM+14日剖杀5只鸡进行剖检并按Liu等[12]的0~4分评分系统进行肠道病变评分,0分正常,4分最严重。无菌采取回肠内容物,按“1.2.1”的方法检测CP,用接种环蘸取适量回肠内容物,在CHROMagar沙门菌显色培养基平板上划线,37 ℃培养24 h,检测沙门菌,将紫色菌落转接到MH液体培养基中进行纯培养后PCR扩增并测序,鉴定是否为沙门菌[13]。用接种环蘸取回肠内容物在载玻片上涂片,用美蓝进行染色,在显微镜下观查是否有球虫卵囊。在DM~DM+14期间每日观察各组鸡群主要临床症状,对并精神食欲和腹泻症状进行评分。记录死亡鸡数。菌株致病有效性评估主要指标为DM+7日出现明显NE病变[14-15],即各组鸡群有50%的鸡出现死亡或有NE临床症状或有剖检鸡肠道存在NE病变且剖检鸡回肠内容物均检出CP。
1.2.3 最小抑菌浓度(MIC)测定[16]先将阿维拉霉素、林可霉素、泰乐菌素药物贮备液(初始浓度)用FTG培养基进行连续的二倍倍比稀释,将稀释后的药液各取100 μL,按照浓度由高至低依次加到微孔板的第1~11孔,每孔对应浓度分别为256、128、64、32、16、8、4、2、1、0.5、0.25 μg·mL-1。在第12孔加100 μL不含药物的FTG培养基,作为阴性对照孔;在96孔板的第H11孔、H12孔加200 μL不含药物不含菌的FTG培养基,作为阳性对照孔。用FTG增菌至菌液浊度达到0.5麦氏浊度(108CFU·mL-1),再稀释至到5×105CFU·mL-1,作为测试菌液。分别吸取100 μL测试菌液加到微孔板第1~12孔中,微孔板加盖并用胶带固定,37 ℃厌氧培养24 h。第1~11孔对应药液终浓度由高至低分别变为128、64、32、16、8、4、2、1、0.5、0.25、0.125 μg·mL-1。每批药敏试验均用脆弱拟杆菌标准株(ATCC25285)作为质量控制对照。当阴性对照孔没有细菌生长、阳性对照孔有细菌生长,加药无细菌生长孔的最低浓度即为药物对测试菌株的MIC。
1.2.4 预防效果试验 在确诊某肉鸡场正在发生由CP引起NE的鸡群中,遴选132只无NE症状鸡,转入隔离舍开展试验,记为D0日。将132只无NE症状鸡随机分配到3个组(PA、PB和PC)组,每组44只鸡,开展试验。从D1日开始,PA组饲喂含有阿维拉霉素预混剂30 g·t-1(以阿维拉霉素含量计)的饲料,连续21 d;PB组饲喂含有磷酸泰乐菌素预混剂100 g·t-1(以磷酸泰乐菌素含量计)的饲料,连续7 d;PC组饲喂正常饲料。每日观察鸡临床症状并评分[17-18],包括精神食欲(0分:活泼好动,反应敏捷,食欲旺盛;1分:反应变慢,羽毛松乱,离群呆立,食欲减退;2分:精神萎顿,反应迟钝,翅膀下垂,食欲严重下降;3分:趴卧不起,食欲废绝)和腹泻症状(0分:排浅灰绿色柔软柱状粪便,表面有少量白色尿酸盐;1分:排黄白色稀粪,有未消化饲料,肛周有粪污;2分:排黄褐色水样臭粪;3分:排红色、黑褐色粪便,混有血液和肠黏膜组织)。分别在D0、D7、D21、D28每组选11只鸡剖检,对肠道病变进行评分,并收集回肠内容物进行病原检测。试验结束后,按检测时间节点(D0、D7、D21、D28)和试验阶段(D0~D7、D8~D21、D22~D28)收集整理数据,用SPSS对数据进行方差分析。以肠道NE病变发生率、CP检出率为主要指标,以肠道NE病变评分、精神食欲和腹泻症状评分为次要指标,评估用药磷酸泰乐菌素预混剂7 d和阿维拉霉素预混剂21 d对预防肉鸡NE的有效性。
2 结果 2.1 细菌的分离以及鉴定在河北省保定市2个肉鸡养殖场、山西省晋中市1个肉鸡养殖场、山西省晋城市1个肉鸡养殖场共收集753份泄殖腔拭子,分离到91株CP,分离率为12%。CP在TSC平板上为中心黑色的菌落。在绵羊血琼脂平板上生长的菌落为圆形、边缘整齐、凸起、表面光泽、半透明的菌落,周围形成双层溶血环,内层溶血环明显。挑选12株分离的CP进行16S rRNA测序,结果显示分离株与标准菌株C57-85 60102的相似性高达99%,表明分离菌株是CP。多重PCR方法测得,91株CP均只扩增出一条约324 bp的DNA条带,如图 1,结果显示,91株CP均为A型,无其他毒素型。
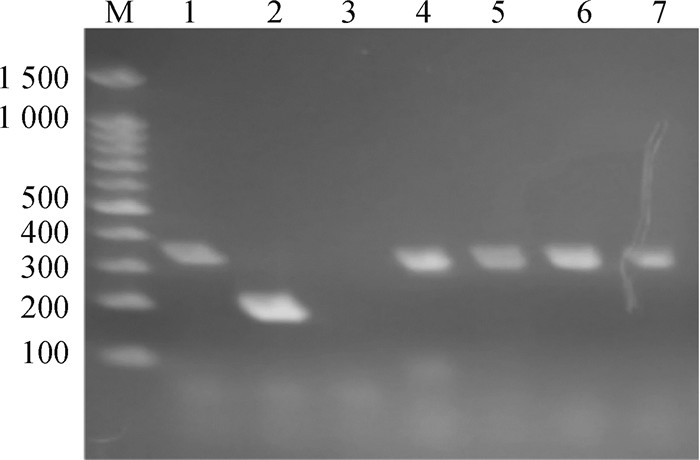
|
M. DNA相对分子质量标准;1. A型菌标准菌株;2. C型菌标准菌株;3. 阴性;4~7. 样品 M. DNA marker; 1. Standard strain of type A bacteria; 2. Standard strain of type C bacteria; 3. Negative; 4-7. Samples 图 1 产气荚膜梭菌毒力基因的多重PCR检测 Fig. 1 Multiplex PCR detection of virulence genes in C. perfringence |
CP经灌胃感染SPF鸡,观察NE病变,从而验证CP致病力。肠道剖检显示,在DM、DM+7和DM+14 d,攻毒组与未攻毒组相比,NE病变评分和NE发生率均有显著上升(P<0.05)。试验期间,各组鸡精神食欲良好,均未出现明显的症状。腹泻症状显示,在DM日,所有组都出现水样便,在DM+7 d,攻毒组排白色稀粪,肛门周围绒毛有粪污,未攻毒组排粪正常,为浅灰绿色柔软柱状,并附有少量白色尿酸盐。DM+14 d,C组有少数鸡排稀粪,存在腹泻现象,其他组正常。试验期间,无病死鸡,存活率为100%。肠道内容物中未检出沙门菌和球虫,所有攻毒组A、B、C组的鸡肠道内容物的CP检出率均为100%;未攻毒组D组未检出CP。
2.3 最小抑菌浓度(MIC)本试验每批次阴性孔均无菌生长,阳性孔均有菌生长。把91株菌的MIC值从小到大排列,第46个菌株的MIC值为MIC50,第82个菌株的MIC值为MIC90。阿维拉霉素对91株鸡源CP的MIC范围为0.25~4 μg·mL-1,MIC50为0.5 μg·mL-1,MIC90为0.5 μg·mL-1。盐酸林可霉素的MIC范围为0.125~128 μg·mL-1,MIC50为4 μg·mL-1,MIC90>128 μg·mL-1。磷酸泰乐菌素的MIC范围为0.25~32 μg·mL-1,MIC50为0.5 μg·mL-1,MIC90为8 μg·mL-1。
2.4 临床预防效果试验在确定菌株对药物敏感性后,选用阿维拉霉素预混剂和磷酸泰乐菌素预混剂进行临床预防效果试验。
2.4.1 NE病变发生率 在D0、D7、D21、D28时,各组选择11只鸡进行剖检,观察肠道NE病变情况。统计剖检鸡的NE病变发生率,结果见表 1,与对照组相比,PA组的NE病变发生率在D21和D28时均显著低于PC组(P<0.05);PB组的NE病变发生率在D7为0,D21、D28逐渐升高至54.5%、63.6%,这与PC组在D7之后的上升趋势一致,但是各时间段差异均不显著(P>0.05)。对照组的NE病变发生率在D0、D7、D21逐渐升高,在D21时到达最高81.2%,并且与D0时相比有显著差异(P<0.05),在D28时仍然维持63.6%的高NE病变发生率。PA与PB组相比,两组的NE病变发生率在D0、D7时相同,在D21和D28时,PB组显著高于PA组(P<0.05)。PA组在整个试验期间都维持较低水平(0或者9.1%),而PB组在D0、D7时维持较低水平,D21、D28时则分别增高至54.5%、63.6%,D21、D28时均显著高于D7日(P<0.05)。
|
|
表 1 各组鸡不同时间点的NE病变发生率 Table 1 Incidence of NE lesions at different time in each group |
结果表明,在连续给药阿维拉霉素21 d,NE病变发生率呈降低趋势,由9.1%降至0,对NE有很好的预防和治疗效果;连续给药磷酸泰乐菌素7 d,与给药阿维拉霉素21 d效果相同。但停药后到试验结束,磷酸泰乐菌素对NE的预防效果逐渐降低明显,NE病变发生率均呈上升趋势。
2.4.2 CP检出率 在D0、D7、D21、D28,采集各组每组11只剖检鸡的回肠内容物检测CP,统计CP检出率,结果见表 2,与对照组相比,PA组的CP检出率在D0、D7、D28时均与PC组无显著差异(P>0.05),在D21时PA组显著低于PC组(P<0.05);PB组与PC组无显著差异(P<0.05)。对照组的CP检出率在D0、D7、D21逐渐升高,从9.1%升高到45.5%,D28日又下降到36.4%,但是对照组各时间段均无显著差异(P>0.05)。PA与PB组相比,两组的CP检出率在D0、D7时相同,在D21和D28日,PB组均高于PA组,但差异不显著(P>0.05)。PA组在整个试验期间都维持较低水平,并且整体呈下降趋势,从18.2%降至9.1%;而PB组在D0、D7、D21时维持较低水平,并且从18.2%降至9.1%,但在D28日又轻微增高至27.3%,组内差异不显著(P>0.05)。
|
|
表 2 各组鸡不同时间点的CP检出率 Table 2 CP detection rate at different time in each group |
在连续给药阿维拉霉素21 d或者连续给药磷酸泰乐菌素7 d后,CP检出率均呈下降趋势,如果不给药,21 d后则鸡群CP的检出率会升高,结果表明,两种药物均可降低CP感染率。阿维拉霉素用药21 d效果显著。
2.4.3 精神食欲和腹泻症状评分 在试验D0~D28日,每日观察每组试验鸡的临床表现。各组鸡在D0、D7、D21、D28均只有个别鸡出现精神食欲下降,组别之间无显著差异(P>0.05)。各组鸡在D0、D7、D21、D28日均只有个别鸡出现腹泻,组别之间无显著差异(P>0.05)。因此,精神食欲和腹泻症状各组之间无显著差异。
2.4.4 NE病变评分 在D0、D7、D21、D28日,各组剖杀11只鸡观察肠道病变,CP对十二指肠、空肠、回肠的损伤最为明显,可形成明显的坏死点。如图 2所示,与对照组相比,PA组在D7日、D21、D28日均未见明显的出血点,PC组可见随着时间延长,小肠内壁的出血点明显增多,甚至出现融合性坏死。PB组小肠在D7日时无明显坏死点,但是D21、D28日也逐渐出现坏死点,但明显不如PC组严重。

|
图 2 D7、D21、D28日各组鸡小肠肠道病变 Fig. 2 Intestinal lesions in each group on D7, D21 and D28 |
统计各组剖检鸡的NE病变评分,见表 3。与对照组相比,PA组的平均NE病变评分在D7、D21和D28时均显著低于PC组(P<0.05);PB组的平均NE病变评分在D7和D21日显著低于PC组(P<0.05),在D28时两组无差异。对照组的平均NE病变评分在D0、D7、D21逐渐升高,在D21日PC组最高平均评分为1.64分,显著高于D0日的0.09分(P<0.05)。PA与PB组相比,两组的平均NE病变评分在D0、D7日相同,在D21和D28日PB组显著高于PA组(P<0.05)。PA组在整个试验期间都维持较低水平,而PB组在D0、D7日维持较低水平,D21、D28日则分别增高至0.73、1.36,显著高于用药期间的0.09和0(P<0.05)
|
|
表 3 各组鸡不同时间点的NE病变评分(x±s) Table 3 The NE lesion scores at different time in each group (x±s) |
连续给药阿维拉霉素21 d或者连续给药磷酸泰乐菌素7 d,能保护鸡肠道不被CP损伤,如果不给鸡群用药,鸡群小肠尤其是十二指肠、空肠会被破坏,发生坏死,结果表明,两种药物均可以保护鸡肠道不出现出血、坏死等症状,抑制NE症状的出现。
3 讨论本研究采集分离的CP均为A型菌株,这与Xu等[19]、Mwangi等[20]和Fancher等[21]结果均为A型一致,致病力试验中腹泻评分和NE病变发生率结果表明:换料对鸡腹泻评分有干扰[22],换料后所有组均出现水样便,当更换回正常饲料未攻毒组粪便恢复正常,攻毒组仍存在腹泻现象,肠道损伤更为严重。可初步得出结论:试验中所选取的3株CP在鱼粉和燕麦改变的肠道环境下,能诱发鸡坏死性肠炎,出现明显的肠道损伤,但不会造成鸡死亡。能引起鸡NE的CP大部分都是A型,但也有少数是C型,由于β毒素的存在,C型CP可能会引起动物感染后致死[23]。
关于药物敏感性,阿维拉霉素对目前我国的鸡源CP仍具有良好的体外抗菌活性,山西、河北两地的鸡源CP对阿维拉霉素的体外敏感性无明显差异性,与中国兽医药品监察所早期分离保存的两株鸡源CP的MIC较一致。2008年,Silva等[24]检测了分离自巴西55株鸡源CP对阿维拉霉素的敏感性,结果MIC范围为0.25~0.5 μg·mL-1;邹君彪等[25]2013年检测了鸡源CP CVCC52标准株对阿维拉霉素的敏感性,结果MIC值为0.25 μg·mL-1;周宇晴[7]2019年检测了分离自中国山西、北京两地60株鸡源CP对阿维拉霉素的敏感性,结果MIC范围为0.06~2 μg·mL-1,MIC90为1 μg·mL-1。本试验检测获得的阿维拉霉素对鸡源CP临床分离株的MIC与上述国内外文献报道一致。由于目前没有CP对阿维拉霉素药物敏感性的折点标准,临床上是否出现了阿维拉霉素耐药株仍不得而知。2009年,Silva等[24]测检了巴西的55株CP的MIC,林可霉素的MIC范围是0.25~64 μg·mL-1,敏感率为89.1%。2013年,邹君彪等[25]测得林可霉素的MIC为100 μg·mL-1;2016年,Fan等[26]测得我国台湾地区MIC50>256 μg·mL-1。2019年,周宇晴[7]检测林可胺类药物克林霉素结果为MIC50为2 μg·mL-1,MIC90>128 μg·mL-1。2019年,方向红等[27]得出CP对林可霉素耐药率为76.42%,2020年,修丽[28]得出耐药率为62.79%。本试验测得盐酸林可霉素的MIC范围为0.125~128 μg·mL-1,MIC50为4 μg·mL-1,MIC90>128 μg·mL-1。由此可见,国内外盐酸林可霉素对CP的敏感性有一定的差异,而随着时间的推移,部分CP对盐酸林可霉素的敏感性也在降低。较高的MIC提示存在鸡源CP对林可霉素耐药问题,具体是否存在耐药还需更多研究证实。本试验测得磷酸泰乐菌素的MIC范围为0.25~32 μg·mL-1,1997年,Watkins等[29]测得美国、比利时、北欧等国家泰乐菌素对CP的MIC50为0.25~8 μg·mL-1。2004年,Martel等[30]测得的MIC范围为0.03~0.5 μg·mL-1,2020年,Wei等[31]测得101株CP的MIC范围为2~16 μg·mL-1。从MIC范围的最大值可以看出,部分CP对磷酸泰乐菌素的体外药物敏感性降低,本次试验检测出MIC50为0.5 μg·mL-1,MIC90为8 μg·mL-1,这与以上结果较为一致。研究表明,分离到的大部分CP仍然对泰乐菌素敏感。
关于药物预防试验,鸡群发生NE,同群的部分无症状鸡已发生CP感染,肠道已存在不同程度的NE病变,若不及时给药预防部分个体也会发生NE而出现精神食欲下降和腹泻症状,且在一定时间内病鸡数将越来越多,CP将在鸡群中传播,造成CP检出率在一定时间内显著上升,越来越多的鸡出现NE病变甚至病情进一步恶化,通过拌料连续21 d给予阿维拉霉素预混剂,给药期间及停药后1周可有效避免无症状鸡出现NE症状,有效阻止无症状鸡的肠道出现NE病变或防止病变恶化,显著降低NE病变发生率和NE病变评分,显著降低CP检出率,这和梁先明与汤树生[32]的结果一致。阿维拉霉素有助于提升肉鸡的生长性能[33]。通过拌料连续7 d给予磷酸泰乐菌素预混剂,给药期间也可有效阻止无症状鸡出现NE症状,效果与阿维拉霉素预混剂相当,但停药后少部分鸡又出现NE症状,推测由未用药NE病鸡传播CP再感染造成。泰乐菌素属生长期快效抑菌剂,通过与细菌核糖体的50S亚基进行可逆性结合,阻断转肽作用和mRNA位移而抑制细菌蛋白质合成。对快速分裂的细菌效果明显,所以用药7 d可以显著降低肠道NE病变,但由于CP是正常菌群的一种,常存在于肠道中,所以一旦停药,可能会引起CP的快速繁殖。阿维拉霉素预混剂、磷酸泰乐菌素预混剂预防由CP引起的鸡NE效果明显[34-35]。
4 结论目前,河北、山西省部分规模化鸡养殖场内临床上流行的CP以A型为主,并且能诱发鸡NE。阿维拉霉素和磷酸泰乐菌素对临床分离的鸡源CP仍具有良好的体外抗菌活性,林可霉素的体外抗菌活性下降。阿维拉霉素和磷酸泰乐菌素预混剂可以有效预防由CP引起的鸡NE。
| [1] |
许文萍. 鸡养殖、屠宰环节中产气荚膜梭菌的流行特点及亲缘关系分析[D]. 泰安: 山东农业大学, 2021. XU W P. Prevalence characteristics and genetic relationship analysis of Clostridium perfringens in chicken rearing and slaughtering stages[D]. Taian: Shandong Agricultural University, 2021. (in Chinese) |
| [2] |
ENGSTRÖM B, FERMÉR C, LINDBERG A, et al. Molecular typing of isolates of Clostridium perfringens from healthy and diseased poultry[J]. Vet Microbiol, 2003, 94(3): 225-235. DOI:10.1016/S0378-1135(03)00106-8 |
| [3] |
王佰魁, 宫莉, 梅小强, 等. 益生菌对肉鸡产气荚膜梭菌攻毒的保护效果研究[C]//中国畜牧兽医学会动物微生态学分会第五届第十三次全国学术研讨会论文集. 广州: 中国畜牧兽医学会, 2018: 205. WANG B Q, GONG L, MEI X Q, et al. Study on the protection effect of probiotics on Clostridium perfringens challenge in broiler[C]//Proceedings of the Fifth 13th National Academic Symposium of Animal Microecology Branch of the Chinese Society of Animal Husbandry and Veterinary Medicine. Guangzhou, 2018: 205. (in Chinese) |
| [4] |
WADE B, KEYBURN A. The true cost of necrotic enteritis[J]. World Poult, 2015, 31(7): 16-17. |
| [5] |
LHERMIE G, GRÖHN Y T, RABOISSON D. Addressing antimicrobial resistance: an overview of priority actions to prevent suboptimal antimicrobial use in food-animal production[J]. Front Microbiol, 2017, 7: 2114. |
| [6] |
张田勘. 饲料禁抗生素大势所趋、配套须跟上[J]. 科学大观园, 2020(2): 62. ZHANG T K. Feed ban antibiotics of the trend of the times, supporting must keep up with[J]. Science Grand View Garden, 2020(2): 62. DOI:10.3969/j.issn.1003-1871.2020.02.027 (in Chinese) |
| [7] |
周宇晴. 北京和山西地区鸡、猪源产气荚膜梭菌抗菌药物敏感性调查[D]. 北京: 中国农业大学, 2019: 13-16. ZHOU Y Q. Antimicrobial susceptibility of Clostriduim perfringens isolated from chickens and pigs in Beijing and Shanxi areas[D]. Beijing: China Agricultural University, 2019: 13-16. (in Chinese) |
| [8] |
STANLEY D, WU S B, RODGERS N, et al. Differential responses of cecal microbiota to fishmeal, Eimeria and Clostridium perfringens in a necrotic enteritis challenge model in chickens[J]. PLoS One, 2014, 9(8): e104739. DOI:10.1371/journal.pone.0104739 |
| [9] |
阚刘刚, 刘艳, 吴媛媛, 等. 鸡坏死性肠炎模型构建和发病机理研究进展[J]. 中国家禽, 2019, 41(13): 41-46. KAN L G, LIU Y, WU Y Y, et al. Advances in model development and pathogenesis mechanisms of avian necrotic enteritis[J]. China Poultry, 2019, 41(13): 41-46. (in Chinese) |
| [10] |
郭维军. 坏死性肠炎对现代肉鸡生产的危害[J]. 畜牧兽医科技信息, 2021(6): 184. GUO W J. The harm of necrotizing enteritis to modern broiler production[J]. Journal of Animal Husbandry and Veterinary Science and Technology, 2021(6): 184. DOI:10.3969/J.ISSN.1671-6027.2021.06.170 (in Chinese) |
| [11] |
乔艺然. A型产气荚膜梭菌感染雏鸡病理形态学研究[D]. 哈尔滨: 东北农业大学, 2015: 13. QIAO Y R. Pathomorphological study of chickens infected with type A Clostridium perfringens[D]. Harbin: Northeast Agricultural University, 2015: 13. (in Chinese) |
| [12] |
LIU D, GUO Y M, WANG Z, et al. Exogenous lysozyme influences Clostridium perfringens colonization and intestinal barrier function in broiler chickens[J]. Avian Pathol, 2010, 39(1): 17-24. DOI:10.1080/03079450903447404 |
| [13] |
许会会, 雷连成, 谢芳, 等. 沙门氏菌PCR检测方法的建立[J]. 中国畜牧兽医, 2010, 37(4): 94-97. XU H H, LEI L C, XIE F, et al. Development of polymerase chain methods for Salmonella[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(4): 94-97. (in Chinese) |
| [14] |
LIU D, GUO S S, GUO Y M. Xylanase supplementation to a wheat-based diet alleviated the intestinal mucosal barrier impairment of broiler chickens challenged by Clostridium perfringens[J]. Avian Pathol, 2012, 41(3): 291-298. DOI:10.1080/03079457.2012.684089 |
| [15] |
SHOJADOOST B, VINCE A R, PRESCOTT J F. The successful experimental induction of necrotic enteritis in chickens by Clostridium perfringens: a critical review[J]. Vet Res, 2012, 43(1): 74. DOI:10.1186/1297-9716-43-74 |
| [16] |
MELVIN P, JAMES Ⅱ S L, APRIL M B, et al. Performance standards for antimicrobial susceptibility testing-30th Edition, CLSI document M100[P]. Clinical and Laboratory Standards Institute, 2020.
|
| [17] |
丁海川. 禽伤寒沙门氏菌自然弱毒活疫苗候选株SG01交叉保护效力及免疫持续期试验评估[D]. 扬州: 扬州大学, 2021: 23. DING H C. Study on cross protection and immune duration test of natural attenuated Salmonella Gallinarum SG01 Strain as live vaccine candidate[D]. Yangzhou: Yangzhou University, 2021: 23. (in Chinese) |
| [18] |
郑晓丽, 宋振银, 倪学勤. 产气荚膜梭菌对家禽业的危害及其预防[J]. 中国家禽, 2008, 30(24): 69-71. ZHENG X L, SONG Z Y, NI X Q. Emerging threat and prevention of Clostridium perfringens in poultry industry[J]. China Poultry, 2008, 30(24): 69-71. (in Chinese) |
| [19] |
XU W P, WANG H R, LIU L X, et al. Prevalence and characterization of Clostridium perfringens isolated from different chicken farms in China[J]. Anaerobe, 2021, 72: 102467. DOI:10.1016/j.anaerobe.2021.102467 |
| [20] |
MWANGI S, TIMMONS J, FITZ-COY S, et al. Characterization of Clostridium perfringens recovered from broiler chicken affected by necrotic enteritis[J]. Poult Sci, 2019, 98(1): 128-135. DOI:10.3382/ps/pey332 |
| [21] |
FANCHER C A, THAMES H T, COLVIN M G, et al. Research Note: Prevalence and molecular characteristics of Clostridium perfringens in "no antibiotics ever" broiler farms[J]. Poult Sci, 2021, 100(11): 101414. DOI:10.1016/j.psj.2021.101414 |
| [22] |
袁伟康, 戚南山, 廖申权, 等. 影响鸡坏死性肠炎病例复制的关键因素[J]. 中国兽医学报, 2021, 41(1): 186-191. YUAN W K, QI N S, LIAO S Q, et al. Major factors influencing the experimental reproduction of necrotic enteritis in chickens[J]. Chinese Journal of Veterinary Science, 2021, 41(1): 186-191. (in Chinese) |
| [23] |
FISHER D J, FERNANDEZ-MIYAKAWA M E, SAYEED S, et al. Dissecting the contributions of Clostridium perfringens type C toxins to lethality in the mouse intravenous injection model[J]. Infect Immun, 2006, 74(9): 5200-5210. DOI:10.1128/IAI.00534-06 |
| [24] |
SILVA R O S, SALVARANI F M, ASSIS R A, et al. Antimicrobial susceptibility of Clostridium perfringens strains isolated from broiler chickens[J]. Braz J Microbiol, 2009, 40(2): 262-264. DOI:10.1590/S1517-83822009000200010 |
| [25] |
邹君彪, 黄苓, 冷董碧. 不同抗生素对产气荚膜梭菌的抑菌效果研究[J]. 国外畜牧学(猪与禽), 2013, 33(6): 103-106. ZOU J B, HUANG L, LENG D B. Antibacterial effect of different antibiotics on Clostridium perfringens[J]. Animal Science Abroad-(Pigs and Poultry), 2013, 33(6): 103-106. (in Chinese) |
| [26] |
FAN Y C, WANG C L, WANG C, et al. Incidence and antimicrobial susceptibility to Clostridium perfringens in premarket broilers in Taiwan[J]. Avian Dis, 2016, 60(2): 444-449. |
| [27] |
方向红, 戴丽红, 颜友荣. 安徽部分地区冷鲜鸡产气荚膜梭菌的污染分析[J]. 现代畜牧兽医, 2019(9): 50-53. FANG X H, DAI L H, YAN Y R. Contamination analysis of clostridium perfringens in chilled chickens in some areas of Anhui province[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2019(9): 50-53. (in Chinese) |
| [28] |
修丽. 山东省部分地区鸭养殖屠宰链中产气荚膜梭菌的分离鉴定及基因分型[D]. 泰安: 山东农业大学, 2020: 23. XIU L. Isolation, identification and genotyping of Clostridium perfringens isolated in duck breeding to slaughtering chains in some areas of Shandong province[D]. Taian: Shandong Agricultural University, 2020: 23. (in Chinese) |
| [29] |
WATKINS K L, SHRYOCK T R, DEARTH R N, et al. In-vitro antimicrobial susceptibility of Clostridium perfringens from commercial turkey and broiler chicken origin[J]. Vet Microbiol, 1997, 54(2): 195-200. |
| [30] |
MARTEL A, DEVRIESE L A, CAUWERTS K, et al. Susceptibility of Clostridium perfringens strains from broiler chickens to antibiotics and anticoccidials[J]. Avian Pathol, 2004, 33(1): 3-7. |
| [31] |
WEI B, CHA S Y, ZHANG J F, et al. Antimicrobial susceptibility and association with toxin determinants in Clostridium perfringens isolates from chickens[J]. Microorganisms, 2020, 8(11): 1825. |
| [32] |
梁先明, 汤树生. 阿维拉霉素预混剂对肉鸡的坏死性肠炎的药效试验[J]. 中国兽医杂志, 2006, 42(12): 17-18. LIANG X M, TANG S S. Efficacy test of Avilamycin premixture on necrotizing enteritis in broiler chickens[J]. Chinese Journal of Veterinary Medicine, 2006, 42(12): 17-18. (in Chinese) |
| [33] |
邹君彪, 和玉丹, 马改彦, 等. 阿维拉霉素对肉鸡生长性能及免疫功能的影响[J]. 畜牧与兽医, 2021, 53(8): 69-73. ZOU J B, HE Y D, MA G Y, et al. Effects of Avilamycin on growth performance and immune function of broilers[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(8): 69-73. (in Chinese) |
| [34] |
黄显会. 抗菌药物在家禽养殖的科学合理使用(四)[J]. 养禽与禽病防治, 2019(11): 20-22. HUANG X H. Scientific and rational use of antimicrobial drugs in poultry breeding (4)[J]. Poultry Husbandry and Disease Control, 2019(11): 20-22. (in Chinese) |
| [35] |
孙宝成, 邹丽娜. 家禽常见肠道疾病诱因与治疗[J]. 畜牧兽医科学(电子版), 2021(10): 108-109. SUN B C, ZOU L N. Inducement and treatment of common intestinal diseases in poultry[J]. Graziery Veterinary Sciences, 2021(10): 108-109. (in Chinese) |
(编辑 白永平)



