猫杯状病毒(feline calicivirus,FCV)属于杯状病毒科、水疱疹病毒属,是一种引起猫科动物口腔与上呼吸道疾病的重要病原[1]。FCV呈世界性分布,在猫科动物中具有高度传染性,猫及老虎、猎豹等野生猫科动物均易感[2]。FCV主要临床症状表现为鼻炎、结膜炎、急性口腔溃、肺炎、慢性胃炎和跛行等。近年来,由于FCV高度的变异性产生的强毒株可引起严重、急性、致死性全身性疾病,死亡率高达50%,症状可表现为溃疡性皮炎、急性关节炎、肠炎、流产以及跛行等全身感染,对猫及猫科动物造成严重威胁[3]。
FCV全基因组由3个开放性阅读框(open reading frame,ORF)组成,其中,ORF2基因编码结构蛋白VP1,按功能域ORF2又可划分为A、B、C、D、E和F 6个区[4]。C和E区变异性较大,特别是E区包含鉴别VS-FCV的特征性氨基酸突变位点,变异最为明显,也是早期疫苗免疫失败的重要原因[5]。为了进一步了解FCV在上海地区流行状况及其遗传变异和演化方向,本研究从2021年1月—3月,从上海地区上呼吸道症状猫的病料中分离鉴定得到13株FCV,对其VP1基因进行遗传演化分析,丰富了国内FCV分离株的基础数据,也为该病毒强毒株的筛选和疫苗研究提供参考依据。
1 材料与方法 1.1 样品采集及处理从上海市中心城区宠物医院收集了17份具有上呼吸道症状患猫的眼结膜、口咽和鼻黏膜拭子样品,记录患猫的年龄、猫三联灭活疫苗免疫情况、主要临床症状(表 1)。将采集的拭子加2 mL PBS缓冲液浸泡后,用0.22 μm微孔滤膜过滤,-20 ℃保存备用。
|
|
表 1 临床样品采集的详细信息 Table 1 Details of the clinical samples |
F81细胞(猫肾传代细胞)由上海市动物疫病预防控制中心兽医实验室保存。猫三联灭活疫苗(猫鼻气管炎、嵌杯病毒病、泛白细胞减少症)(批号:D286389A)购自硕腾(上海)企业管理有限公司;DMEM细胞培养液(批号:2126865)、0.25%浓度胰酶消化液(批号:2042303)均购自GIBCO公司;胎牛血清(批号:2418)购自Sigma公司;核酸提取试剂盒(批号:MDII14-01)购自Magen公司;PrimeScriptTM RT-PCR Kit(批号:AJ62323A)、LA PCRTM Kit Ver.2.1(批号:AK5301)、Prime ScriptTM One Step RT-PCR Kit Ver.2(Dye Plus)(批号:AKE0559A)购自宝生物工程(大连)公司;猫疱疹病毒1型荧光PCR检测试剂盒(批号:FHV20210504)、猫细小病毒荧光PCR检测试剂盒(批号:FPV20210604)购自上海尔创生物科技有限公司。
1.3 病料的RT-PCR鉴定吸取50 μL上述处理的样品,猫三联灭活疫苗作阳性对照,阴性拭子作阴性对照,提取总RNA,依据参照文献[6]合成引物:上游引物FCV-JCF:5′-GCCTCAAACATTAGGAGTGC-3′;下游引物FCV-JCR:5′-CCCTGGGGTTAGGCGCAG-3′,扩增片段为420 bp,引物由上海桑尼生物科技有限公司合成。按照文献[6]的方法进行RT-PCR扩增,1%琼脂糖凝胶电泳分析,将出现预期目的片段的RT-PCR产物送上海桑尼生物科技有限公司进行测序,测序结果用NCBI中的BLAST工具进行比对分析,确认是否为FCV基因序列。同时将FCV阳性的样本接种F81细胞,进行病毒的分离培养。
1.4 病毒分离F81细胞常规消化传代,待长成单层且贴壁率达到90%时,将细胞按照1∶3的比例消化传代,同时将上述病料同步接种到细胞中,37 ℃,5% CO2浓度培养箱中培养,每6 h观察细胞病变1次,70%细胞出现细胞病变、圆缩和脱落时,将培养液冻融3次,收集细胞上清。
1.5 病毒鉴定1.5.1 FCV VP1基因的扩增 依据参考文献[4]合成FCV VP1基因全长扩增引物,FCV-VP1上游引物:5′-ATGTGCTCAACCTGCGC-3′;FCV-VP1下游引物:5′-TCATAATTTAGTCATTGAGCTCCT-3′。FCV VP1基因序列全长2 007~2 010 bp,引物由上海桑尼生物科技有限公司合成。体系总体积为50 μL:PrimeScriptTM RT-PCR Kit buffer 25 μL,Enzyme Mix 2 μL,上、下游引物(浓度均为10 μmol·L-1)各1 μL,RNA模板1 μL,双蒸水补至50 μL。反应条件:50 ℃反转录30 min;94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min;4 ℃保存。取5 μL RT-PCR扩增产物经1%琼脂糖凝胶电泳鉴定,阳性RT-PCR产物送上海桑尼生物科技有限公司进行测序。测序结果用NCBI中的BLAST工具进行比对分析,确认是否为FCV的VP1基因序列。
1.5.2 形态学鉴定 将分离病毒株第3代培养物接种F81细胞,待70%细胞出现CPE后反复冻融3次收毒,将收获的细胞液冻融3次后,10 000 r·min-1离心1 h,除去细胞碎片,随后上清液与终浓度为10%的聚乙二醇8000(PEG8000)混合过夜。在4 ℃下12 000 r·min-1离心2 h后,用Tris缓冲盐溶液(TBS)重悬,经2%磷钨酸负染后进行透射电镜观察。
1.5.3 外源病毒检测 对13株分离株进行猫疱疹病毒1型(FHV-1)和猫细小病毒(FPV)两种外源病毒检测。根据猫疱疹病毒1型荧光PCR检测试剂盒和猫细小病毒荧光PCR检测试剂盒要求,对分离病毒株第3代培养物进行FHV-1和FPV荧光PCR检测。
1.6 构建遗传演化树分别参照国内外FCV强毒株、经典株和疫苗株VP1基因序列(表 2)[7],利用MEGA 6.0和DNAStar v7.1软件构建FCV VP1基因遗传演化分析树,并分析其序列特征。
|
|
表 2 FCV VP1参考序列 Table 2 Reference strains of FCV VP1 gene |
1.7.1 分离株有限稀释纯化 将FCV-SH202101和FCV-SH202113分离病毒株第3代培养物用细胞培养液进行10倍的倍比稀释,共稀释11个稀释度,将稀释液与消化好的细胞悬液按照体积比1∶3加入至6孔板中,第12孔加细胞悬液作阴性对照,每孔体积为2 mL。37 ℃,5% CO2浓度培养箱中培养,每6 h观察细胞病变1次。待70%细胞出现细胞病变、圆缩和脱落时,收获出现细胞病变的最大稀释度孔的上清进行二次有限稀释纯化,共稀释纯化6次,测定纯化后病毒液的TCID50,-80 ℃保存备用。
1.7.2 攻毒试验 将6只健康中华田园猫(3只2~3月龄幼猫,3只2岁左右成年猫,均未免疫过猫三联灭活疫苗)分为A组、B组和对照组,每组均为2只,包括1只幼猫和1只成年猫。A和B组猫均采用滴鼻和口服方式分别接种108.73TCID50·mL-1的FCV-SH202101和1010.26 TCID50·mL-1的FCV-SH202113分离株病毒液,接种剂量为滴鼻和口服各1 mL·只-1;对照组猫接种相同剂量的DMEM细胞培养液。不同感染组隔离饲养,自由采食、饮水,每日监测猫的临床症状和死亡情况,同时采集眼、口、鼻拭子用于排毒情况的检测。
2 结果 2.1 病料的RT-PCR检测17份病料经FCV RT-PCR扩增,其中,编号为BD20210104-2~BD20210104-8、BD20210112-1、BD20210127-1、BD20210804-1、BD20210804-3~BD20210804-5的13份样品扩增产物经凝胶电泳检测显示,在420 bp左右出现与预期目的产物大小一致的目的条带,部分病料样品的扩增结果见图 1。将13份样品的RT-PCR产物进行测序,测序结果在NCBI中进行BLAST比对分析,确认13个序列均为FCV的基因序列,表明13份样品均为FCV阳性。
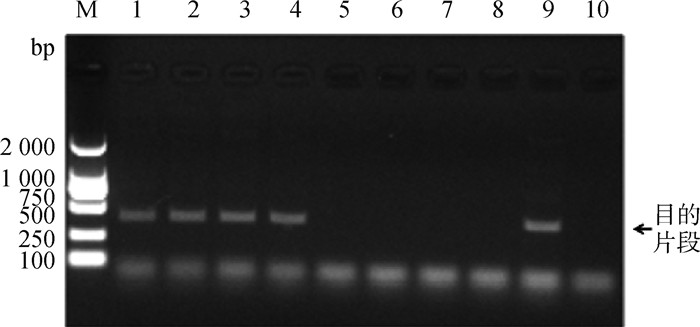
|
M. DL2000 DNA相对分子质量标准;1~4. RT-PCR阳性病料样本;5~8. RT-PCR阴性病料样本;9. 阳性对照;10. 阴性对照 M. DL2000 DNA marker; 1-4. RT-PCR positive samples; 5-8. RT-PCR negative samples; 9. Positive control; 10. Negative control 图 1 部分病料FCV RT-PCR检测结果 Fig. 1 FCV RT-PCR detecting results of part samples |
13份FCV阳性病料接种F81细胞,盲传3代,第3代细胞培养物接种F81细胞24 h,均产生CPE,细胞出现圆缩、拉丝、聚集现象,然后脱落、漂浮在细胞维持液中(图 2)。

|
A.接种BD20210104-2第3代细胞培养物的F81细胞;B.阴性对照 A. F81cells inoculated the 3rd generation cell culture of BD20210104-2; B. Negative control 图 2 接种BD20210104-2第3代细胞培养物24 h后F81细胞病变结果 Fig. 2 CPE of the 3rd generation cell culture of BD20210104-2 in F81 cells at 24 h |
将13份病毒上清液提取RNA,进行FCV VP1 RT-PCR扩增,产物经琼脂糖凝胶电泳检测后得到约2 000 bp大小的条带,与预期2 007 bp大小一致(图 3)。测序结果拼接后,得到13株FCV的VP1全基因序列,将13株病毒VP1基因序列在NCBI中进行BLAST比对分析,确认13株序列均为FCV的VP1基因序列,表明13株分离株为FCV,分别命名为FCV-SH202101~FCV-SH202113。
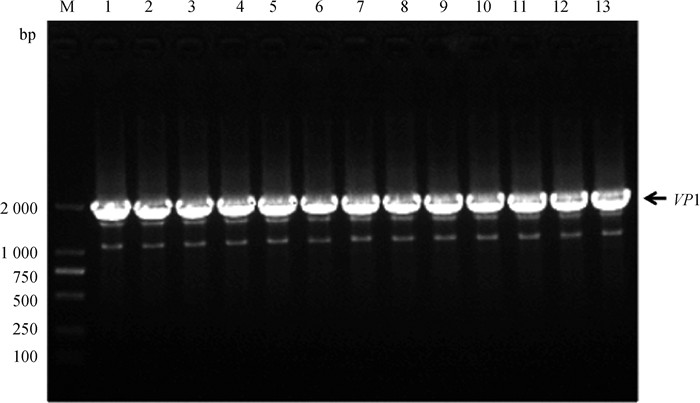
|
M. DL2000 DNA相对分子质量标准;1~13. FCV VP1 RT-PCR阳性产物 M. DL2000 DNA marker; 1-13. FCV VP1 RT-PCR positive products 图 3 FCV VP1 RT-PCR结果 Fig. 3 FCV VP1 RT-PCR detecting results |
FCV-SH202101株F81细胞第4代培养物经电镜负染观察可见无囊膜,呈圆形、椭圆形等形态,直径30~40 nm的病毒粒子(图 4),与杯状病毒粒子形态特征相符,表明分离株病毒为FCV。
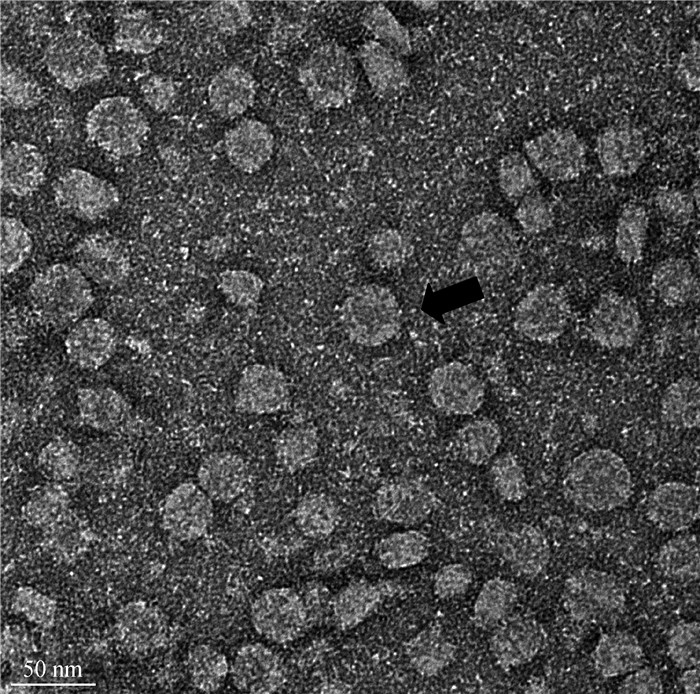
|
图 4 FCV-SH202101病毒粒子电镜图 Fig. 4 Electron microscopy image of isolated FCV-SH202101 strain |
对13株FCV分离株进行FHV-1和FPV两种外源病毒荧光PCR检测,结果均为阴性。
2.6 FCV VP1同源性及遗传演化分析2.6.1 分离株与国内外参考株VP1基因同源性及遗传演化分析 将13株FCV分离株与国内外参考株VP1基因进行同源性分析。结果显示,13株上海分离株之间的核苷酸序列相似性为74.3%~99.8%,其中,FCV-SH202103株与FCV-SH202104株相似性最高,为99.8%;FCV-SH202108株与FCV-SH202111株相似性最低,为74.3%。与国内外强毒株相似性为73.8%~82.9%,其中,FCV-SH202113株与FCV-5株相似性最高,为82.9%;与国内外经典株相似性为73.4%~80.1%,氨基酸序列分析显示,FCV-SH202102株与FCV-YH-16株的相似性高达91.9%,FCV-SH202108株与FB-NJ-13株的相似性最低,为82.1%;与疫苗株相似性为73.2%~79.8%,氨基酸相似性FCV-SH202103株与F4株高达89.4%,FCV-SH202102株与F4株最低,为82.7%。
遗传演化树分析显示,13株分离株分布于3个分支,FCV-SH202108株与上海分离株SH/2014遗传关系较近,FCV-SH202103、FCV-SH202104和FCV-SH202112遗传关系较近,与国外参考株和疫苗株处于同一分支;FCV-SH202113株与强毒株FCV-5遗传关系较近,处于同一分支;其余毒株与国内参考株处于同一分支,且FCV-SH202101、FCV-SH202102、FCV-SH202106、FCV-SH202107、FCV-SH202109和FCV-SH202110遗传关系较近(图 5)。
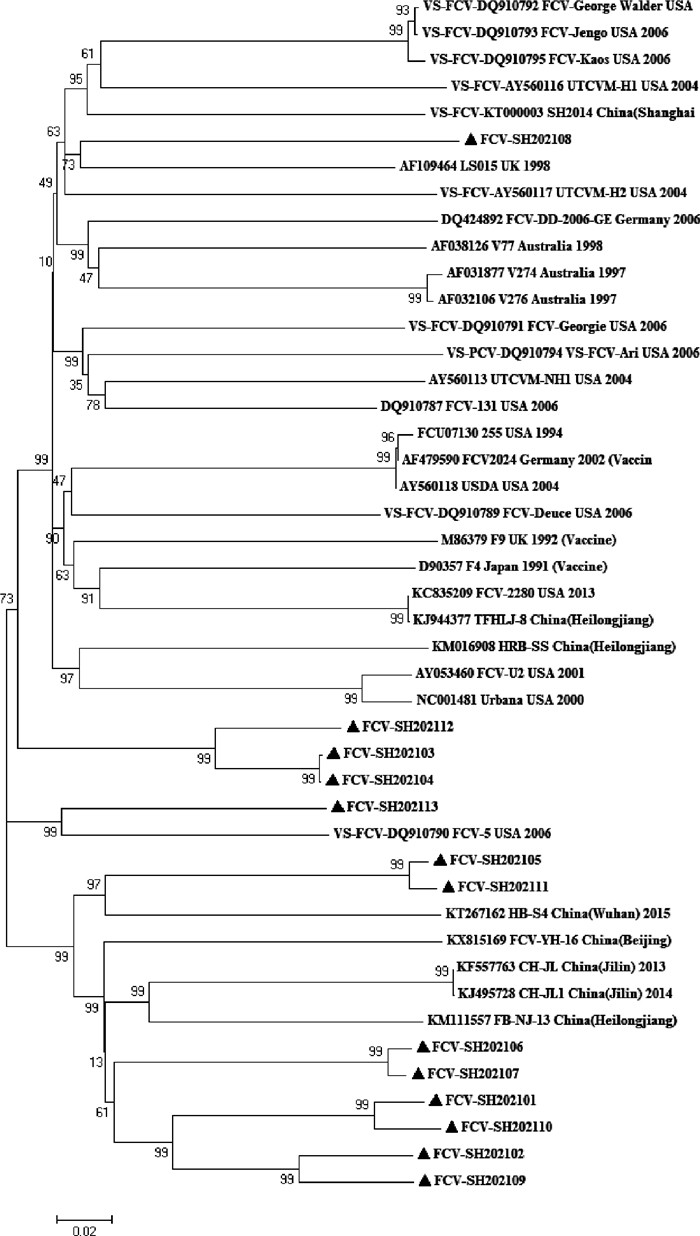
|
▲表示分离毒株 ▲stands for isolated strain 图 5 分离株与参考株VP1基因序列遗传演化树 Fig. 5 Maximum-likelihood tree based on VP1 gene of isolated strains and reference strains |
2.6.2 VS-FCV特征性氨基酸分析 以部分E区(426—461 aa) 分析的具有VS-FCV突变特征氨基酸位点为依据,确定430、438、443、448、452、455和458为VS-FCV特征性氨基酸位点(图 6)。结果表明5株分离株与VS-FCV有6个位点吻合,7株分离株有5个位点吻合,1株分离株有4个位点吻合(表 3)。

|
图 6 VP1蛋白部分E区的氨基酸比较图 Fig. 6 Comparison of amino acid sequences of partical E region in VP1 protein |
|
|
表 3 FCV VP1蛋白部分E区强毒株特征性氨基酸位点分析 Table 3 VS-FCV characteristic amino acid sites analysis of partical E region in VP1 protein |
2.7.1 病毒液TCID50的测定 测定FCV-SH202101株和FCV-SH202113株细胞半数感染量分别为108.73和1010.26 TCID50·mL-1。
2.7.2 感染猫的临床症状 FCV202101株和FCV2021131株感染中华田园猫后,48 h内幼猫陆续出现杯状病毒上呼吸道症状,如眼屎增多、气喘、咳嗽等,体温最高升至39.5 ℃,5 d后幼猫均濒临死亡。A组成年猫1周后出现眼屎增多现象,11 d后猫濒临死亡;B组成年猫1周后无明显的临床症状,2周后出现临床症状,精神沉郁、不食、发烧、眼屎大量增多,18 d后死亡。
2.7.3 感染猫的排毒情况 每日采集不同感染组猫的眼、鼻、口拭子,利用RT-PCR方法检测其排毒情况(表 4),结果表明,FCV202101株和FCV2021131株感染猫3 d后,可持续从眼、鼻、口拭子中检测到FCV。
|
|
表 4 猫感染FCV后排毒情况 Table 4 Virus shedding of cats after FCV infection |
2.7.4 感染猫的发病与死亡情况 FCV202015株和FCV202031株感染猫后,均可导致试验猫的发病和死亡(图 7),对幼猫具有较强的致死性,且病程短、发病急,对成年猫也具有致死性,但病程长短不一。
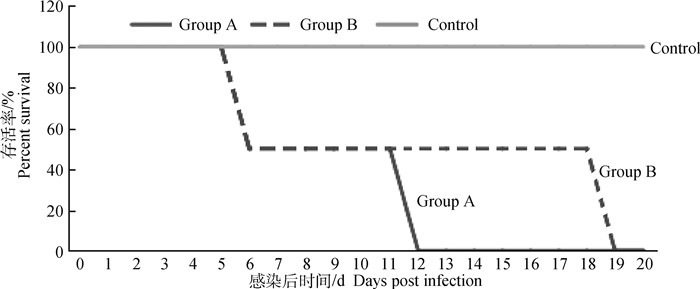
|
图 7 试验组猫感染FCV后存活率 Fig. 7 Survival rate of cats after FCV infection |
近年来,随着国民生活水平的逐步提高,上海市猫宠呈逐年上升趋势,已逐渐成为宠物市场的主流。在猫的传染病病例中,猫杯状病毒感染病例占1/3以上[8]。本研究对17例呼吸道症状的猫病例进行猫杯状病毒的分离,经过细胞病变、VP1测序、病毒电镜观察,13株分离株都鉴定为FCV,阳性率达到76.47%,与周孟云等[4]在杭州宠物猫中调查的结果基本一致,表明上海市具有呼吸道症状的宠物猫杯状病毒感染比较普遍。
由于FCV的RNA聚合酶缺乏校正功能,导致其基因组频繁变异,当出现VS-FCV时,就可能导致疫苗失去保护力[9]。美国的Pedersen等[10]首次报道在1998年采集的样品中发现了VS-FCV,2003年英国及2009年法国也暴发过疫苗免疫的成年猫感染VS-FCV,2013年Velasco等[11]报道了西班牙暴发VS-FCV,2018年郭慧敏等[12]首次报道了VS-FCV在我国流行。上海地区13株FCV分离株之间的VP1核苷酸序列相似性为74.3%~99.8%,与国内外参考株的核苷酸序列相似性为73.2%~80.1%,氨基酸相似性82.7%~91.9%,其中与疫苗株的核苷酸相似性只有73.2%~79.8%,氨基酸的相似性为82.7%~89.4%,分离株VP1核苷酸序列和氨基酸序列相似性均不高,符合FCV易突变的特征。遗传演化树显示,2株分离株与强毒株处于同一分支,8株分离株与国内经典株处于同一分支,3株分离株与国外经典株亲缘关系较近,研究表明,上海市主要流行株可能来自国内北方地区,少数毒株来自国外,与刘春国等[13]研究结果一致,表明上海市FCV起源于不同祖先,其遗传存在生物多样性。虽然Smith等[14]认为FCV-F9疫苗株仍然能够预防FCV的感染,但是遗传演化树显示,本市分离株与疫苗株遗传关系较远,可能是当前疫苗对猫的免疫效果不佳的主要原因。
分离株与国内强毒株SH2014(Shanghai)株相似性为74.7%~77.4%,与国外强毒株相似性为73.8%~82.9%。分离株与强毒株同源性虽然不一致,但是仅从核苷酸和氨基酸序列同源性上并不能将经典FCV与VS-FCV株区分出来[5]。遗传演化树显示,FCV-SH202108株和FCV-SH202113株与强毒株遗传关系较近,其中,FCV-SH202113株与FCV-5处于同一分支,FCV-SH202108株虽然与经典株LS015处于同一分支,但同时与强毒株FCV-George Walder、FCV-Jengo、FCV-Kaos、UTCVM-H1、SH2014(Shanghai)、UTCVM-H2遗传关系较近,表明FCV-SH202108和FCV-SH202113株具有强毒株的可能。FCV VP1衣壳蛋白可分为A、B、C、D、E和F等6个区,其中E为超变区,有研究发现VS-FCV具有特征性氨基酸位点,Foley等[15]对E区具有VS-FCV突变特征的氨基酸位点进行比较分析发现,430位、438位、443位、448位、452位、455位和458位aa可能与其致病性相关。对E区中7个可能的强毒株特征性氨基酸位点分析,发现FCV-SH202101、FCV-SH202102、FCV-SH202107、FCV-SH202109和FCV-SH202110株有6个氨基酸位点与已公开VS-FCV株吻合,而已报道的广西株只有一个吻合位点[16]。因此FCV-SH202101、FCV-SH202102、FCV-SH202107、FCV-SH202109和FCV-SH202110株也具有强毒株的可能。
从采样宿主临床症状、VP1进化树和VS-FCV特征性氨基酸位点进行分析,选择FCV-SH202101株和FCV-SH202113株进行动物感染试验,研究表明,FCV-SH202101株和FCV-SH202113株感染中华田园猫后均可导致发病和死亡,病毒的潜伏期为1~2 d,接种后第3天即可检测出排毒,不同年龄段猫的病程不一致,幼猫5 d后可导致死亡,成年猫病程可持续11~18 d,说明FCV-SH202101株和FCV-SH202113株可能为VS-FCV中国分离株,但VS-FCV的确诊还需要进一步研究病毒复制病例各脏器FCV的分布和滴度、病理变化以及可否造成感染猫的群体性发病与死亡等。
4 结论本研究从临床呼吸道症状猫分离到13株能在F81上形成CPE的病毒,经测序和电镜观察鉴定为FCV,VP1序列分析表明上海地区FCV流行株主要来自国内北方地区,少数毒株来自国外地区,动物感染试验表明2株FCV具有VS-FCV致病性特征,为VS-FCV毒株的筛选提供了有力的证据,也为FCV疫苗的研究提供了技术支持。
| [1] |
王洁, 廖均乐, 钱鹏, 等. 猫杯状病毒的进化与致病性研究进展[J]. 中国兽医杂志, 2021, 57(2): 62-65. WANG J, LIAO J L, QIAN P, et al. Advances on evolution and pathogenicity of feline calicivirus[J]. Chinese Journal of Veterinary Medicine, 2021, 57(2): 62-65. (in Chinese) |
| [2] |
杨清, 刘巧荣, 孙明, 等. 虎源猫杯状病毒的分离及其基因组遗传变异分析[J]. 中国兽医杂志, 2019, 55(9): 7-11. YANG Q, LIU Q R, SUN M, et al. Isolation, identification and genomic characterization of feline calicivirus from tiger[J]. Chinese Journal of Veterinary Medicine, 2019, 55(9): 7-11. (in Chinese) |
| [3] |
BRUNET S, SIGOILLOT-CLAUDE C, PIALOT D, et al. Multiple correspondence analysis on amino acid properties within the variable region of the capsid protein shows differences between classical and virulent systemic feline calicivirus strains[J]. Viruses, 2019, 11(12): 1090. DOI:10.3390/v11121090 |
| [4] |
周孟云, 陈利苹, 宋家升, 等. 杭州地区猫杯状病毒的分离鉴定及VP1基因序列分析[J]. 畜牧与兽医, 2020, 52(4): 103-109. ZHOU M Y, CHEN L P, SONG J S, et al. Isolation and identification of feline calicivirus and analysis of VP1 gene sequences in the Hangzhou area[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(4): 103-109. (in Chinese) |
| [5] |
汤傲星, 刘春草, 王元红, 等. 华东地区猫杯状病毒的分离鉴定及遗传进化分析[J]. 中国预防兽医学报, 2021, 43(6): 667-671. TANG A X, LIU C C, WANG Y H, et al. Isolation, identification and evolutionary genetics of feline calicivirus in East China[J]. Chinese Journal of Preventive Veterinary Medicine, 2021, 43(6): 667-671. (in Chinese) |
| [6] |
王浩, 秦树英, 刘金凤, 等. 猫杯状病毒GX2019的分离鉴定及全基因克隆遗传进化分析[J]. 中国兽医科学, 2020, 50(7): 880-885. WANG H, QIN S Y, LIU J F, et al. Isolation and identification of feline calicivirus GX2019 and genetic evolution analysis of whole gene cloning[J]. Chinese Veterinary Science, 2020, 50(7): 880-885. (in Chinese) |
| [7] |
BATTILANI M, VACCARI F, CARELLE M S, et al. Virulent feline calicivirus disease in a shelter in Italy: a case description[J]. Res Vet Sci, 2013, 95(1): 283-290. DOI:10.1016/j.rvsc.2013.01.025 |
| [8] |
郑思艳, 吕艳丽, 解启宝. 北京地区306例猫上呼吸道感染主要病原调查[J]. 中国兽医杂志, 2018, 54(12): 18-21. ZHENG S Y, LYU Y L, XIE Q B. Investigation of main pathogens of upper respiratory tract infection in 306 cats in Beijing[J]. Chinese Journal of Veterinary Medicine, 2018, 54(12): 18-21. (in Chinese) |
| [9] |
王一鸣, 赵艳丽, 刘秋艳, 等. 猫杯状病毒分子致病机制的研究进展[J]. 中国兽医学报, 2016, 36(2): 362-368. WANG Y M, ZHAO Y L, LIU Q Y, et al. Advances on molecular pathogenesis of feline calicivirus[J]. Chinese Journal of Veterinary Science, 2016, 36(2): 362-368. (in Chinese) |
| [10] |
PEDERSEN N C, ELLIOTT J B, GLASGOW A, et al. An isolated epizootic of hemorrhagic-like fever in cats caused by a novel and highly virulent strain of feline calicivirus[J]. Vet Microbiol, 2000, 73(4): 281-300. |
| [11] |
VELASCO T, HOSIE M, SAMMAN A, et al. Feline calicivirus associated virulent systemic disease (FCV-VSD): report on the first confirmed case in Madrid (Spain)[J]. J Feline Med Surg, 2013, 15: 818-828. |
| [12] |
GUO H M, MIAO Q H, ZHU J, et al. Isolation and molecular characterization of a virulent systemic feline calicivirus isolated in China[J]. Infect Genet Evol, 2018, 65: 425-429. |
| [13] |
刘春国, 刘永相, 刘大飞, 等. 猫杯状病毒的分离鉴定及超变区基因序列分析[J]. 中国预防兽医学报, 2015, 37(11): 885-887. LIU C G, LIU Y X, LIU D F, et al. Isolation, identification and hypervariable region analysis of a feline calicivirus isolated from a cat[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(11): 885-887. (in Chinese) |
| [14] |
SMITH S L, AFONSO M M, PINCHBECK G L, et al. Temporally separated feline calicivirus isolates do not cluster phylogenetically and are similarly neutralised by high-titre vaccine strain FCV-F9 antisera in vitro[J]. J Feline Med Surg, 2020, 22(6): 602-607. |
| [15] |
FOLEY J, HURLEY K, PESAVENTO P, et al. Virulent systemic feline calicivirus infection: local cytokine modulation and contribution of viral mutants[J]. J Feline Med Surg, 2006, 8(1): 55-61. |
| [16] |
丁仰保, 何剑桥, 刘林林, 等. 广西猫杯状病毒全基因组序列测定及其遗传进化分析[J]. 中国动物传染病学报, 2022, 30(2): 67-73. DING Y B, HE J Q, LIU L L, et al. Sequencing of the whole genome and ORF2 phylogenetic analysis of a feline calicivirus isolate from Guangxi[J]. Chinese Journal of Animal Infectious Diseases, 2022, 30(2): 67-73. (in Chinese) |
(编辑 白永平)



