2. 中国农业科学院北京畜牧兽医研究所 农业农村部动物遗传育种与繁殖重点实验室,北京 100193
2. Key Laboratory of Animal Genetics, Breeding and Reproduction of Ministry of Agriculture and Rural Affairs, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
低产羔数是制约肉羊产业发展的重要原因之一,影响产羔数的决定因素是排卵数和卵泡发育[1]。颗粒细胞作为雌性动物卵巢组织的主要功能细胞,在卵泡发育过程中起重要作用[2]。颗粒细胞增殖可以促进卵泡发育,凋亡则引发卵泡闭锁[3]。从原始卵泡的激活开始,直至生长发育成熟为优势卵泡或闭锁的过程中,颗粒细胞通过分泌类固醇激素和生长因子支持卵母细胞的生长发育[4-5]。颗粒细胞的生长发育对这一过程的影响尤为重要[5]。因此,颗粒细胞增殖影响卵泡发育和闭锁的生物学机制一直备受研究人员的关注。近年来,Wnt/β-catenin信号通路在颗粒细胞发育过程中的转录调控作用成为人们研究的热点[6-7]。无翅型MMTV整合位点家族(Wnt family member,WNT蛋白家族)是高度保守的信号分子,在真核生物中均有存在,通过编码分泌的脂蛋白和糖蛋白在Wnt/β-catenin传导途径中起重要作用[8],其广泛参与哺乳动物原始卵泡的形成、卵泡成熟与闭锁过程[9]。无翅型MMTV整合位点家族成员4(Wnt family member 4,WNT4)是研究最广泛的WNT家族原型配体之一,可通过分泌细胞外信号因子在各种器官和细胞的发育中起关键作用。在小鼠中,WNT4参与卵巢发育,雌性小鼠WNT4表达缺失导致XX性腺的雄性化,而雄性过表达WNT4则破坏睾丸血管和睾丸丙酮的合成[10],WNT4过表达可以促进睾丸系统和睾酮合成[11]。在人体中,WNT4调控女性卵巢发育并阻止睾丸的形成,影响性别分化[12]。WNT4在颗粒细胞中高度表达,并通过Wnt/β-catenin传导途径参与卵巢发育、颗粒细胞生长和卵母细胞成熟的过程[13]。此外,WNT4还通过Wnt/β-catenin传导途径参与了肾、肾上腺、乳腺和生殖系统的形成[14],从而影响哺乳动物的器官生长和细胞分化等。卵巢排卵是一个多步骤的过程,排卵数作为影响山羊产羔数的重要指标之一,受多种因素调控影响。颗粒细胞是卵泡发育的主要组成部分,也是卵母细胞提供营养物质和促进卵母细胞成熟的重要影响因素[15]。本课题组在前期的云上黑山羊高、低产羔数卵巢组织转录组测序中发现,WNT4存在两个可变剪接体WNT4-α和WNT4-β,WNT4-α作为调节哺乳动物卵巢组织和控制颗粒细胞生理作用的关键生长因子,在卵巢排卵的过程中发挥作用[12],但可变剪接体WNT4-β对山羊颗粒细胞的影响还未见报道,推测WNT4-β可变剪接体可能通过影响颗粒细胞增殖,进而影响山羊排卵。
本研究以山羊颗粒细胞为试验材料,验证过表达或干扰WNT4-β后WNT信号通路中关键标记因子及颗粒细胞增殖标记基因的表达,并通过鉴定颗粒细胞增殖速率、类固醇激素分泌进一步验证WNT4-β可变剪接体在山羊颗粒细胞中的功能及调控机制。
1 材料与方法 1.1 试验材料与颗粒细胞的分离培养从河北省廊坊市周边屠宰场获得山羊新鲜卵巢组织,置于37 ℃生理盐水(含2%双抗)运回实验室。75%酒精润洗消毒后,预热生理盐水(含1%双抗)清洗3次。10 mL注射器抽取直径2~6 mm卵泡的卵泡液,1 800 r·min-1离心5 min去上清,加入含有10% 胎牛血清的DMEM-F12完全培养基重悬后1 500 r·min-1离心5 min去上清,重复2次。接种在5 cm2培养皿中于CO2培养箱培养(37 ℃、5% CO2、饱和湿度)。颗粒细胞密度达70%后转入10 cm2培养皿相同条件培养。
1.2 仪器与试剂细胞RNA提取试剂盒和反转录试剂盒购自北京天根生化科技有限公司;DMEM基础培养基、DMEM-F12培养基、含EDTA的胰酶、PBS缓冲液、胎牛血清(FBS)、青霉素和链霉素、LipofectamineⓇ 2000转染试剂盒、Opti-MEMⓇ试剂购自Gibco;PrimeScriptTM RTReagent Kit试剂购自TaKaRa;多聚赖氨酸、无水乙醇、氯仿、异丙醇等购自国药集团;Trizol、山羊血清、4%多聚甲醛、全蛋白提取试剂盒、蛋白浓度测定试剂盒(BCA)购自北京索莱宝科技有限公司(中国);SYBR Green qPCR Mix购自Thermo;细胞计数检测试剂盒(CCK8)购自江苏凯基生物技术股份有限公司;荧光IgG购自长春赛信生物公司;山羊雌二醇(E2)检测和山羊孕酮(P4)检测试剂盒购自上海酶联生物科技有限公司;SDS-PAGE电泳液、Western转膜液、Western洗涤液、QuickBlockTM Western封闭液、10%的SDS-PAGE凝胶、QuickBlockTM Western抗体稀释液、PVDF膜和超敏ECL化学发光试剂盒购自北京碧云天生物技术公司;WNT4-β抗体购自Santa;β-catenin抗体购自Abmart;GAPDH、Cyclin-D2、CDK4和IgG抗体均购自Proteintech;其他均为常规化学试剂。
1.3 细胞免疫荧光染色山羊卵泡颗粒细胞以1×106个·孔-1的密度接种于6孔板,每组3个重复。多聚赖氨酸处理爬片,置入6孔板中,36 h后取出。4%多聚甲醛固定20 min,PBS洗涤3次,每次3 min,10%山羊血清孵育30 min,适量WNT4-β抗体4 ℃孵育过夜,PBS洗涤3次,每次5 min,适量荧光IgG,37 ℃孵育1 h,PBS洗涤3次,每次5 min。DAPI避光加入染细胞核5 min,PBS洗涤4次,每次5 min。荧光淬灭剂处理,树脂胶密封载玻片,荧光倒置显微镜(Olympus)(莱卡,德国)观察采集图像。
1.4 表达载体构建根据NCBI数据库提供的山羊WNT4-β CDS区序列,设计相关引物以扩增CDS区序列的基因片段,使用载体为pIRES2-EGFP,同时合成pIRES2-EGFP-WNT4-β、pIRES2-EGFP-WNT4-β NC;si-WNT4-β、si-WNT4-β NC由RNAi软件设计。载体均由上海生工生物科技有限公司(中国)合成。
1.5 细胞转染转染前将山羊卵泡颗粒细胞以1×106个·孔-1的密度接种于6孔板(每组3个重复),每孔2 mL DMEM完全培养基,在37 ℃、5%的CO2饱和湿度条件下培养。取230 μL Opti-MEM与浓度为200 nmol·L-1的pIRES2-EGFP-WNT4-β(过表达组)、pIRES2-EGFP-WNT4-β NC(过表达对照组)、si-WNT4-β(干扰组)、si-WNT4-β NC(干扰对照组)各20 μL低速旋涡混匀。加入244 μL Opti-MEM和6 μL LipofectamineⓇ 2000组成脂质体,形成转染复合体。室温孵育20 min;转染至颗粒细胞,每孔加入1.5 mL Opti-MEM,置于37 ℃,5% CO2饱和湿度条件下培养,6 h后更换为完全培养基培养,48 h后收集细胞与上清。
1.6 RNA提取及RT-qPCR收集转染48 h后的颗粒细胞,根据组织/细胞RNA提取试剂盒说明书提取总RNA,根据反转录试剂盒说明书进行反转录。以cDNA为模板进行RT-qPCR。RT-qPCR在20 μL的体积中进行,包含0.8 μL浓度为10 μmol·μL-1的引物,10 μL SYBR Green qPCR,2.0 μL 50 ng·μL-1的cDNA,其余部分为ddH2O。反应条件:95 ℃预变性5 s;95 ℃ 5 s,60 ℃ 30 s,共计40个循环。山羊RPL19被用作参考基因进行校正。结果采用相对模板量算法(2-ΔΔCT法)处理,基因相对表达量用2-ΔΔCT表示。RT-qPCR引物的序列见表 1,所用引物均由上海生工生物科技有限公司合成。
|
|
表 1 RT-qPCR的引物信息 Table 1 Primer information for RT-qPCR |
使用全蛋白提取试剂盒提取细胞的总蛋白,收集转染pIRES2-EGFP-WNT4-β(过表达组)、pIRES2-EGFP-WNT4-β NC(过表达对照组)、si-WNT4-β(干扰组)、si-WNT4-β NC(干扰对照组)的颗粒细胞,在4 ℃条件下1 500 r·min-1离心5 min,弃上清,加入含有蛋白酶抑制剂的裂解液,匀浆后裂解30 min,每15 min震荡1次,在4 ℃条件下12 000 r·min-1离心30 min,收集上清。根据蛋白浓度测定试剂盒(BCA)说明书测定BCA曲线。按照1∶4加入5×SDS Loading Buffer,混匀后金属水浴锅100 ℃煮10 min,蛋白分装后保存于-80 ℃。
蛋白质变性后,取30 μg蛋白上样于10%的SDS-PAGE凝胶上,电泳,80 V 15 min,120 V 60 min。电泳结束后将10%的凝胶转移至PVDF膜上,150 mA 60 min,抗体(WNT4-β、GAPDH、cyclin-D2和CDK4均按1∶1 000稀释)4 ℃孵育过夜。TBST洗涤5次,每次5 min。二抗(1∶1 000)室温孵育1 h,特超敏ECL化学发光试剂显色,Odyssey CLX成像系统(Li-COR)曝光,拍照并保存。使用Image J软件分析条带灰度值,目的蛋白与GAPDH灰度值的比值即为目的蛋白的相对表达水平。
1.8 颗粒细胞增殖检测以每孔2×104/100 μL的密度将转染pIRES2-EGFP-WNT4-β(过表达组)、pIRES2-EGFP-WNT4-β NC(过表达对照组)、si-WNT4-β(干扰组)、si-WNT4-β NC(干扰对照组)的颗粒细胞接种到96孔板中,每组3个重复,在37 ℃、5% CO2饱和湿度条件下预培养24 h。根据细胞计数试剂盒(CCK-8)说明书,分别在细胞生长0、6、12、24、48和72 h时每孔加入10 μL CCK-8溶液,培养箱孵育1 h,用酶标仪测量450 nm的吸光度,观察颗粒细胞增殖情况。
1.9 激素水平检测按照雌二醇(E2)和孕酮(P4)ELISA试剂盒说明书对转染颗粒细胞后的细胞培养液中雌二醇(E2)和孕酮(P4)浓度进行检测。根据制造商协议,在酶标板上设置标准孔和空白孔各3个。加入40 μL转染pIRES2-EGFP-WNT4-β(过表达组)、pIRES2-EGFP-WNT4-β NC(过表达对照组)、si-WNT4-β(干扰组)、si-WNT4-β NC(干扰对照组)后的细胞上清液,每组3个重复。然后加入10 μL的待测样品。弃去液体,摇干,用洗涤液注入每个孔,静置30 s后弃去,重复5次,拍干。除空白孔外,每孔加入50 μL的酶标试剂。用密封膜密封平板,37 ℃孵育30 min。弃去液体,摇干,向每孔注入洗涤液,静置30 s后弃去,重复5次,拍干。在每孔中加入50 μL显色剂A和50 μL显色剂B,轻轻摇动混合,37 ℃避光显影15 min。向每个孔中加入50 μL终止液以终止反应。在450 nm处依次测量各孔的吸光度(OD值)。
1.10 数据统计分析每个试验3个生物学重复,使用SPSS 18.0 (SPSS INC. Chicago,IL,USA) 软件进行统计分析,数据均用“平均值±标准差”表示。**P < 0.01和*P < 0.05代表组间差异具有统计学意义。
2 结果 2.1 WNT4-β在卵母细胞和颗粒细胞中的表达为了验证WNT4-β的表达位置,对采集到的卵母细胞和颗粒细胞进行免疫荧光染色。结果显示(图 1),在卵母细胞中未检测到WNT4-β的表达(图 1A, B, C);在颗粒细胞中,检测到WNT4-β的表达,且大部分在细胞膜上表达,WNT4-β定位染色包围DAPI细胞核定位染色(图 1D, E, F)。表明WNT4-β的蛋白表达位置在颗粒细胞。所以在之后的研究过程中选择颗粒细胞进行WNT4-β功能的验证。
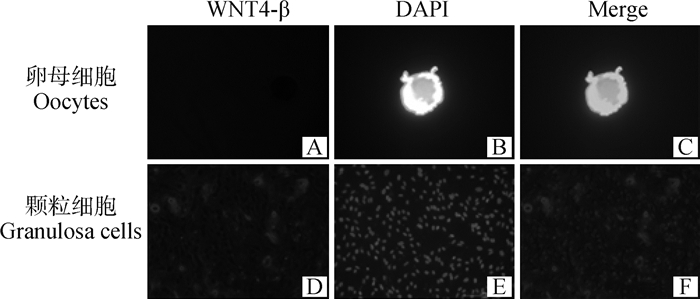
|
图 1 WNT4-β在山羊卵母细胞和颗粒细胞中的定位(200×) Fig. 1 Localization of WNT4-β in goat oocytes and granulosa cells (200×) |
为探究WNT4-β对颗粒细胞增殖的影响,对颗粒细胞转染过表达和干扰WNT4-β载体,检测WNT4-β和颗粒细胞增殖标记基因cyclin-D2与CDK4的mRNA及蛋白表达水平。结果显示,过表达WNT4-β后,WNT4-β和颗粒细胞增殖标记因子cyclin-D2与CDK4基因mRNA表达量与对照组相比极显著上调(P < 0.01,图 2A, C)。WNT4-β、cyclin-D2与CDK4的蛋白水平显著升高(P < 0.05,图 2E, G)。干扰WNT4-β后,WNT4-β和颗粒细胞增殖标记因子cyclin-D2与CDK4基因mRNA表达量与蛋白表达相比均显著降低(P < 0.05,图 2B, D, F, H)。使用CCK-8检测颗粒细胞增殖情况。结果显示,过表达WNT4-β后,颗粒细胞增殖速率显著上调(P < 0.05,图 2I)。干扰WNT4-β后,颗粒细胞增殖速率显著下调(P < 0.05,图 2I)。表明WNT4-β基因能够促进颗粒细胞增殖相关基因的表达,对颗粒细胞增殖起促进作用。
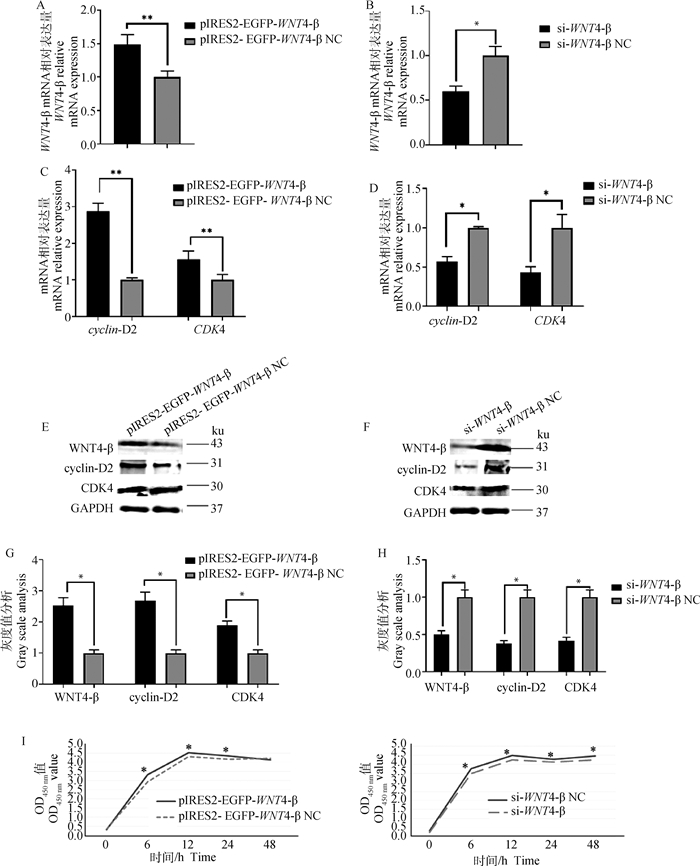
|
A.转染pIRES2-EGFP-WNT4-β后,WNT4-β mRNA表达量;B. 转染si-WNT4-β后,WNT4-β mRNA表达量;C、E、G.转染pIRES2-EGFP-WNT4-β后,cyclin-D2和CDK4 mRNA表达量和蛋白表达水平;D、F、H.转染si-WNT4-β后,cyclin-D2和CDK4 mRNA表达量和蛋白表达水平;I. CCK-8检测颗粒细胞增殖。**.P < 0.01;*.P < 0.05,下同 A. WNT4-β mRNA expression after transfection with pIRES2-EGFP-WNT4-β; B.WNT4-β mRNA expression after transfection with si-WNT4-β; C, E, G. cyclin-D2 and CDK4 mRNA and protein expression levels after transfection with pIRES2-EGFP-WNT4-β; D, F, H.cyclin-D2 and CDK4 mRNA and protein expression levels after transfection with si-WNT4-β; I.CCK-8 assay of granulocyte proliferation. **.P < 0.01; *. P < 0.05, the same as below 图 2 过表达或干扰WNT4-β对颗粒细胞增殖的影响 Fig. 2 Effect of overexpression or interference of WNT4-β on the proliferation of granulosa cells |
通过ELISA检测过表达和干扰WNT4-β后的颗粒细胞中雌二醇(E2)和孕酮(P4)的水平来观察颗粒细胞的类固醇激素分泌。结果表明(图 3),过表达WNT4-β后,与对照组相比,雌二醇(E2)的含量显著升高(P < 0.05,图 3A),孕酮(P4)的含量也升高,但是不显著(图 3C);干扰WNT4-β后,与对照组相比,雌二醇(E2)和孕酮(P4)的水平均显著降低(P < 0.05,图 3B, D)。结果说明,WNT4-β对山羊颗粒细胞激素分泌具有促进作用。
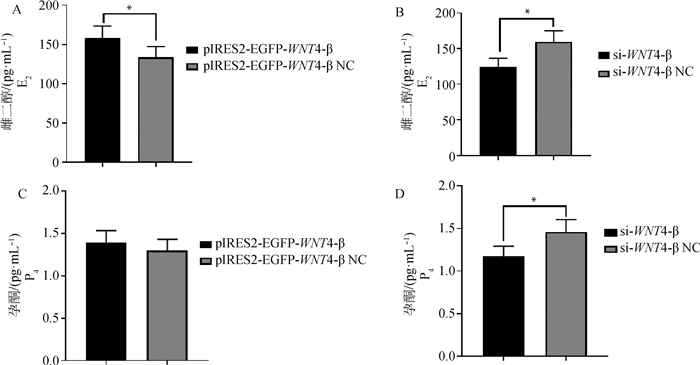
|
A、B.颗粒细胞中雌二醇(E2)水平;C、D.颗粒细胞中孕酮(P4)水平 A, B. Estradiol (E2) level in granulosa cells; C, D. Progesterone (P4) level in granulosa cells 图 3 过表达或干扰WNT4-β对颗粒细胞类固醇激素分泌的影响 Fig. 3 Effect of overexpression or interference of WNT4-β on steroid hormone secretion in granulosa cells |
为探究颗粒细胞增殖过程中WNT4-β对WNT信号通路的影响,在颗粒细胞中转染过表达和干扰WNT4-β载体,检测WNT信号通路标记基因ROA1与RHOA的mRNA表达及关键信号因子β-catenin的蛋白水平。结果显示,过表达WNT4-β后,WNT信号通路相关的ROA1与RHOA基因mRNA相对表达量显著上调(P < 0.05,图 4A)。WNT信号通路关键因子β-catenin蛋白水平显著升高(P < 0.05,图 4C, E)。而干扰WNT4-β后,ROA1与RHOA的mRNA相对表达量及β-catenin的蛋白水平与过表达WNT4-β的颗粒细胞结果完全相反,与对照组相比,均显著下调(P < 0.05,图 4B、D, F)。表明WNT4-β能够影响WNT信号通路的关键信号因子的表达,进而造成WNT信号通路的调控发生改变。并且说明WNT4-β可以通过正向调控WNT信号通路,引起颗粒细胞增殖。
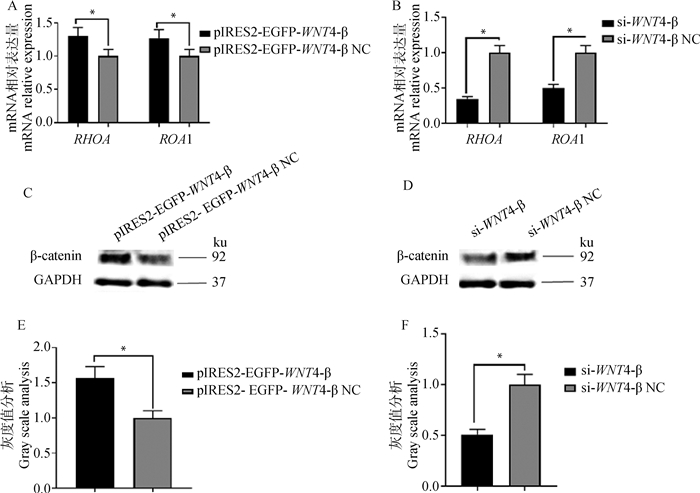
|
A、B. WNT信号通路关键基因ROA1和RHOA mRNA相对表达量;C、D. Western blot检测WNT信号通路关键因子β-catenin的蛋白表达水平;E、F. β-catenin的蛋白表达水平灰度值分析 A, B. Relative expression of ROA1 and RHOA mRNA, key genes in WNT signaling pathway; C, D. Protein expression levels of β-catenin, a key factor in WNT signaling pathway detected by Western blot; E, F. Gray scale analysis of protein expression levels of β-catenin 图 4 过表达或干扰WNT4-β对WNT信号通路的影响 Fig. 4 Effect of overexpression or interference of WNT4-β on WNT signaling pathway |
山羊产羔数是低遗传力繁殖性状,受繁殖周期、排卵、激素分泌、受精等多重因素影响[16]。近年来,WNT信号通路相关基因对哺乳动物繁殖力的调控作用逐渐引起了人们的关注[17]。有研究报道,WNT2a和WNT11在小鼠卵巢中可通过诱导WNT信号促进卵泡发育及颗粒细胞生长[18]。WNT4和G蛋白偶联受体主要在颗粒细胞中结合,在卵巢排卵过程中起重要作用[19]。在子宫内膜异位症女性的颗粒细胞周期研究中,发现WNT4和WNT5a的转录水平严重影响着β-catenin的总量,进而影响卵泡成熟[20]。在小鼠中,发现WNT4在卵泡发育、颗粒细胞增殖和分化中起重要的调节作用[21]。本研究通过前期对高、低产云上黑山羊全转录组数据进行生物学分析发现,WNT4-β可变剪接体可能对山羊卵泡颗粒细胞增殖产生影响,这一结果与其他WNT家族基因在卵巢中作用的研究结果相似,但具体影响机制还值得探究。
颗粒细胞的发育先于卵母细胞,颗粒细胞是影响原始卵泡生长发育的重要因素[22-23]。在卵泡成熟过程中,FSH诱导cyclin-D2,并通过激活CDK4促进卵母细胞G1分裂进程,进而影响颗粒细胞增殖[24]。过量氟化物诱导小鼠应激及细胞凋亡,导致CDK2、CDK4、PCNA和Ki67表达水平显著降低进而抑制卵巢卵泡发育和颗粒细胞生长[25]。本研究中,过表达WNT4-β可以显著上调cyclin-D2与CDK4的表达水平,促进颗粒细胞增殖。干扰WNT4-β则显著下调了cyclin-D2与CDK4的表达水平。推测WNT4-β可能通过促进cyclin-D2与CDK4的表达,进而加快颗粒细胞周期进程,促进颗粒细胞增殖。卵泡作为卵巢的基本单位,由卵母细胞、颗粒细胞、卵泡膜细胞等组成,周围有众多颗粒细胞和卵泡母细胞包裹[26]。在卵泡成熟过程中,卵泡会经历不同的生理变化,这些变化导致颗粒细胞与卵母细胞在营养供给和细胞交流方面联系更加密切[27]。研究表明,雌二醇通过不同的代谢途径进行糖酸基化和甲基化作用[28],哺乳动物产生雌二醇的浓度越高,则体内的卵泡成熟数量则越多[29]。将双酚A注入多囊卵巢综合征的患者体内,会减少颗粒细胞中的芳香化酶表达,从而减少雌二醇分泌,影响卵泡发育[30]。并且敲除雌二醇合成关键酶CYP19后,小鼠的雌二醇分泌量显著下降,从而导致卵泡发育受阻[31]。此外,孕酮也是评价卵泡生长的关键指标之一,其分泌量多少直接影响着排卵及卵子的质量[32]。在单侧去除卵巢的大鼠中发现,卵巢血液中孕酮分泌量减少,排卵数减少[33]。而在少数家养动物中发现,WNT信号通路在卵泡生长和类固醇生成的过程中起重要作用[34]。WNT信号通路利用WNT/β-catenin途径的小分子拮抗作用,影响着类固醇激素的合成[35]。本研究结果表明,过表达WNT4-β提高了颗粒细胞E2和P4的分泌,而干扰WNT4-β则显著抑制了E2和P4的分泌。这表明,WNT4-β可以通过调控颗粒细胞合成类固醇激素,进而影响卵泡细胞的发育。而WNT4-β通过何种途径造成颗粒细胞增殖并影响类固醇激素的合成还不得而知。研究表明,WNT信号通路在调节颗粒细胞增殖、侵袭、转移、凋亡、分化等方面发挥着重要作用[36]。在小鼠中,WT1通过激活Wnt /β-catenin信号通路来维持卵泡中颗粒细胞的早期存活[37];在猪的高通量测序中发现,外泌体miR-31-5p靶向SFRP4卵泡生长,通过Wnt/β-catenin信号传导途径促进颗粒细胞的增殖和孕酮的合成[38]。在颗粒细胞增殖过程中,β-catenin调控多种靶基因的表达[39],与Dvl-ROHA轴和RAC1轴结合进而实现各种功能[40]。本研究证明,过表达WNT4-β提高了ROHA和RAC1的mRNA表达量及β-catenin的蛋白表达水平,这表明WNT4-β通过Wnt/β-catenin信号传导途径促进与Dvl-ROHA轴和RAC1轴结合进而影响颗粒细胞增殖。
4 结论本研究发现,WNT4-β对山羊卵泡颗粒细胞增殖有显著影响。WNT4-β可以通过调控WNT信号通路影响山羊颗粒细胞增殖及类固醇激素的分泌,表明WNT4-β具有调控山羊颗粒细胞增殖的功能,为进一步揭示WNT4调控山羊颗粒细胞增殖的潜在分子机制提供了理论基础。
| [1] |
GUO S H, QUAN S, ZOU S Y. Roles of the notch signaling pathway in ovarian functioning[J]. Reprod Sci, 2021, 28(10): 2770-2778. DOI:10.1007/s43032-021-00610-6 |
| [2] |
SUGIURA K, PENDOLA F L, EPPIG J J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism[J]. Dev Biol, 2005, 279(1): 20-30. DOI:10.1016/j.ydbio.2004.11.027 |
| [3] |
贺小云, 刘秋月, 储明星. miRNA调控哺乳动物卵泡发育和卵母细胞成熟的研究进展[J]. 畜牧兽医学报, 2019, 50(11): 2175-2185. HE X Y, LIU Q Y, CHU M X. Advances in miRNA regulating mammalian follicular development and oocyte maturation[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(11): 2175-2185. DOI:10.11843/j.issn.0366-6964.2019.11.001 (in Chinese) |
| [4] |
ALAM M H, MIYANO T. Interaction between growing oocytes and granulosa cells in vitro[J]. Reprod Med Biol, 2020, 19(1): 13-23. DOI:10.1002/rmb2.12292 |
| [5] |
XU D J, HE H S, JIANG X H, et al. SIRT2 plays a novel role on progesterone, estradiol and testosterone synthesis via PPARs/LXRα pathways in bovine ovarian granular cells[J]. J Steroid Biochem Mol Biol, 2019, 185: 27-38. DOI:10.1016/j.jsbmb.2018.07.005 |
| [6] |
LE ROLLE M, MASSA F, SIGGERS P, et al. Arrest of WNT/β-catenin signaling enables the transition from pluripotent to differentiated germ cells in mouse ovaries[J]. Proc Natl Acad Sci U S A, 2021, 118(30): e2023376118. DOI:10.1073/pnas.2023376118 |
| [7] |
COLOZZA G, KOO B K. Wnt/β-catenin signaling: structure, assembly and endocytosis of the signalosome[J]. Dev Growth Differ, 2021, 63(3): 199-218. DOI:10.1111/dgd.12718 |
| [8] |
TAN Z Y, DING N, LU H M, et al. Wnt signaling in physiological and pathological bone formation[J]. Histol Histopathol, 2019, 34(4): 303-312. |
| [9] |
ZHANG B, WANG M, GONG A H, et al. HucMSC-exosome mediated-Wnt4 signaling is required for cutaneous wound healing[J]. Stem Cells, 2015, 33(7): 2158-2168. DOI:10.1002/stem.1771 |
| [10] |
TANG F R, RICHARDSON N, ALBINA A, et al. Mouse gonad development in the absence of the pro-ovary factor WNT4 and the pro-testis factor SOX9[J]. Cells, 2020, 9(5): 1103. DOI:10.3390/cells9051103 |
| [11] |
JORDAN B K, SHEN J H C, OLASO R, et al. Wnt4 overexpression disrupts normal testicular vasculature and inhibits testosterone synthesis by repressing steroidogenic factor 1/β-catenin synergy[J]. Proc Natl Acad Sci U S A, 2003, 100(19): 10866-10871. DOI:10.1073/pnas.1834480100 |
| [12] |
JÄÄSKELÄINEN M, PRUNSKAITE-HYYRYLÄINEN R, NAILLAT F, et al. WNT4 is expressed in human fetal and adult ovaries and its signaling contributes to ovarian cell survival[J]. Mol Cell Endocrinol, 2010, 317(1-2): 106-111. DOI:10.1016/j.mce.2009.11.013 |
| [13] |
PRUNSKAITE-HYYRYLÄINEN R, SHAN J D, RAILO A, et al. Wnt4, a pleiotropic signal for controlling cell polarity, basement membrane integrity, and antimüllerian hormone expression during oocyte maturation in the female follicle[J]. FASEB J, 2014, 28(4): 1568-1581. DOI:10.1096/fj.13-233247 |
| [14] |
YAO H H C, MATZUK M M, JORGEZ C J, et al. Follistatin operates downstream of WNT4 in mammalian ovary organogenesis[J]. Dev Dyn, 2004, 230(2): 210-215. DOI:10.1002/dvdy.20042 |
| [15] |
POULSEN L C, BØTKJÆR J A, ØSTRUP O, et al. Two waves of transcriptomic changes in periovulatory human granulosa cells[J]. Hum Reprod, 2020, 35(5): 1230-1245. DOI:10.1093/humrep/deaa043 |
| [16] |
DEVENDRA C. Investments on pro-poor development projects on goats: ensuring success for improved livelihoods[J]. Asian-Australas J Anim Sci, 2013, 26(1): 1-18. DOI:10.5713/ajas.2013.r.01 |
| [17] |
STEPHENS S M, MOLEY K H. Follicular origins of modern reproductive endocrinology[J]. Am J Physiol Endocrinol Metab, 2009, 297(6): E1235-E1236. DOI:10.1152/ajpendo.00575.2009 |
| [18] |
LICKERT H, KISPERT A, KUTSCH S, et al. Expression patterns of Wnt genes in mouse gut development[J]. Mech Dev, 2001, 105(1-2): 181-184. DOI:10.1016/S0925-4773(01)00390-2 |
| [19] |
HSIEH M, JOHNSON M A, GREENBERG N M, et al. Regulated expression of Wnts and Frizzleds at specific stages of follicular development in the rodent ovary[J]. Endocrinology, 2002, 143(3): 898-908. DOI:10.1210/endo.143.3.8684 |
| [20] |
SANCHEZ A M, VIGANÒ P, QUATTRONE F, et al. The WNT/β-catenin signaling pathway and expression of survival promoting genes in luteinized granulosa cells: endometriosis as a paradigm for a dysregulated apoptosis pathway[J]. Fertil Steril, 2014, 101(6): 1688-1696. DOI:10.1016/j.fertnstert.2014.02.040 |
| [21] |
HERNANDEZ GIFFORD J A. The role of WNT signaling in adult ovarian folliculogenesis[J]. Reproduction, 2015, 150(4): R137-R148. DOI:10.1530/REP-14-0685 |
| [22] |
TELFER E E, ANDERSEN C Y. In vitro growth and maturation of primordial follicles and immature oocytes[J]. Fertil Steril, 2021, 115(5): 1116-1125. DOI:10.1016/j.fertnstert.2021.03.004 |
| [23] |
刘玉芳, 陈玉林, 周祖阳, 等. miR-221-3p靶向BCL2L11调控小尾寒羊卵泡颗粒细胞凋亡[J]. 中国农业科学, 2022, 55(9): 1868-1876. LIU Y F, CHEN Y L, ZHOU Z Y, et al. miR-221-3p regulates ovarian granulosa cells apoptosis by targeting BCL2L11 in small-tail Han sheep[J]. Scientia Agricultura Sinica, 2022, 55(9): 1868-1876. (in Chinese) |
| [24] |
MOONS D S, JIRAWATNOTAI S, TSUTSUI T, et al. Intact follicular maturation and defective luteal function in mice deficient for cyclin- dependent kinase-4[J]. Endocrinology, 2002, 143(2): 647-654. DOI:10.1210/endo.143.2.8611 |
| [25] |
ZHAO W P, WANG H W, LIU J, et al. JNK/STAT signalling pathway is involved in fluoride-induced follicular developmental dysplasia in female mice[J]. Chemosphere, 2018, 209: 88-95. DOI:10.1016/j.chemosphere.2018.06.086 |
| [26] |
WANG D S, WANG J Q, BAI L Y, et al. Long-term expansion of pancreatic islet organoids from resident procr+ progenitors[J]. Cell, 2020, 180(6): 1198-1211.e19. DOI:10.1016/j.cell.2020.02.048 |
| [27] |
OKUNOMIYA A, HORIE A, TANI H, et al. Figla promotes secondary follicle growth in mature mice[J]. Sci Rep, 2021, 11(1): 9842. DOI:10.1038/s41598-021-89052-3 |
| [28] |
HOSOKAWA K, OTTANDER U, WAHLBERG P, et al. Dominant expression and distribution of oestrogen receptor beta over oestrogen receptor alpha in the human corpus luteum[J]. Mol Hum Reprod, 2001, 7(2): 137-145. DOI:10.1093/molehr/7.2.137 |
| [29] |
NAKANO R, NAKAYAMA T, IWAO M. Inhibition of ovarian follicle growth by a chemical antiestrogen[J]. Horm Res, 1982, 16(4): 230-236. DOI:10.1159/000179506 |
| [30] |
WANG Y, ZHU Q L, DANG X, et al. Local effect of bisphenol A on the estradiol synthesis of ovarian granulosa cells from PCOS[J]. Gynecol Endocrinol, 2017, 33(1): 21-25. DOI:10.1080/09513590.2016.1184641 |
| [31] |
MELVIN E J, LINDSEY B R, QUINTAL-FRANCO J, et al. Circulating concentrations of estradiol, luteinizing hormone, and follicle-stimulating hormone during waves of ovarian follicular development in prepubertal cattle[J]. Biol Reprod, 1999, 60(2): 405-412. DOI:10.1095/biolreprod60.2.405 |
| [32] |
JIANG J L, LIU S Y, QI L N, et al. Activation of Ovarian taste receptors inhibits progesterone production potentially via NO/cGMP and apoptotic signaling[J]. Endocrinology, 2021, 162(3): bqaa240. DOI:10.1210/endocr/bqaa240 |
| [33] |
MEYER G T, BRUCE N W. Rate of ovarian progesterone secretion and peripheral plasma progesterone levels in unilaterally ovariectomized, pregnant rats[J]. J Reprod Fertil, 1982, 66(2): 555-561. DOI:10.1530/jrf.0.0660555 |
| [34] |
ABEDINI A, ZAMBERLAM G, BOERBOOM D, et al. Non-canonical WNT5A is a potential regulator of granulosa cell function in cattle[J]. Mol Cell Endocrinol, 2015, 403: 39-45. DOI:10.1016/j.mce.2015.01.017 |
| [35] |
GUPTA P S P, KAUSHIK K, KRISHNA K, et al. Regulatory role of Wnt signal in the oestradiol synthesis of different size categories of ovarian follicles in buffalo (Bubalus bubalis)[J]. Reprod Domest Anim, 2022, 57(4): 368-380. DOI:10.1111/rda.14075 |
| [36] |
YOKOTA N, NISHIZAWA S, OHTA S, et al. Role of Wnt pathway in medulloblastoma oncogenesis[J]. Int J Cancer, 2002, 101(2): 198-201. DOI:10.1002/ijc.10559 |
| [37] |
WANG J, QIU J P, BO L, et al. WT1 influences apoptosis and proliferation of immature mice granular cells through regulation of the wnt/β-catenin signal pathway[J]. Cell Mol Biol (Noisy-le-grand), 2019, 65(7): 138-145. DOI:10.14715/cmb/2019.65.7.24 |
| [38] |
YUAN C F, LI Z, ZHAO Y, et al. Follicular fluid exosomes: important modulator in proliferation and steroid synthesis of porcine granulosa cells[J]. FASEB J, 2021, 35(5): e21610. |
| [39] |
TEPEKOY F, AKKOYUNLU G, DEMIR R. The role of Wnt signaling members in the uterus and embryo during pre-implantation and implantation[J]. J Assist Reprod Genet, 2015, 32(3): 337-346. DOI:10.1007/s10815-014-0409-7 |
| [40] |
WOLKE C, ANTILEO E, LENDECKEL U. WNT signaling in atrial fibrillation[J]. Exp Biol Med (Maywood), 2021, 246(9): 1112-1120. DOI:10.1177/1535370221994086 |
(编辑 郭云雁)



