2. 瑞鹏宠物医院, 深圳 518000;
3. 中国农业科学院 长春兽医研究所, 长春 130122;
4. 军事医学研究院 微生物流行病研究所, 北京 100071;
5. 牡丹江心血管病医院影像介入诊疗中心, 牡丹江 157001
2. Ruipeng Pet Hospital, Shenzhen 518000, China;
3. Changchun Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Changchun 130122, China;
4. State Key Laboratory of Pathogen and Biosecurity, Beijing Institute of Microbiology and Epidemiology, Beijing 100071, China;
5. Centre of Imaging Diagnosis and Interventional Treatment, Mudanjiang Cardiovascular Disease Hospital of Heilongjiang Province, Mudanjiang 157001, China
猫冠状病毒(feline coronavirus, FCoV)是Alpha冠状病毒属成员之一,可引起家养和野生猫科动物感染,根据刺突(spike)蛋白的氨基酸序列和血清型不同,又可分为猫肠道冠状病毒(feline enteric coronavirus, FECV)和猫传染性腹膜炎病毒(feline infectious peritionitis virus, FIPV)[1-2]。现有研究假说证实FIPV是由FECV在宿主体内病毒基因组发生特定突变衍生而来,可引起体腔内富含蛋白质浆液积液以及脓性肉芽肿,最终使宿主慢性、渐进性全身感染而死亡[3-4]。根据其临床症状有无腹水可分为干性和湿性,患病动物常见食欲废绝、腹泻、被毛混乱、呼吸急促等临床症状,个别严重的病例还有共济失调等神经症状[5]。
FIPV病因复杂,在我国宠物临床上多使用影像学检查、血常规等诊断方法[6-7],配合S蛋白突变位点检测来确诊该病[8],但该法仍存在较高假性结果。而随着高通量测序的发展,宏基因组学技术已经在病原发现、流行病学调查领域发挥作用,在疾病诊断等方面存在巨大潜能,尤其在无症状感染、混合感染检测方面具有特殊优势[9-11]。GS-441524是一类治疗冠状病毒的新型小分子核苷类似物,有研究证明能够在体内和体外具有良好的干扰冠状病毒遗传物质复制,阻止新病毒的产生的药理作用[12-13]。本研究基于高通量测序诊断和血常规、生化分析、fSAA等综合诊疗指标,对FIPV感染的美国短毛猫进行GS-441524治疗,记录从发病到痊愈的诊治过程。经征得病例的主人同意后,愿意将其治疗过程公开,以为其他相似病例的临床治疗提供参考。
1 材料与方法 1.1 患病动物1只1岁雄性美国短毛猫,体重3.58 kg,已绝育,已按完整的免疫程序进行疫苗接种。因连续几日出现精神萎靡不振,食欲降低、毛发凌乱、呼吸困难等现象,由主人送至宠物医院,由兽医师收诊。
1.2 临床症状及检查主诉该猫有腹泻和呕吐等消化道病理症状,猫表征发热,眼鼻分泌物黏稠,胸腹部膨大且触诊有波动感,呼吸困难,呈胸腹式病理性呼吸。腹泻较为严重,其排泄物在肛门处黏连,心率较快,疑似病原感染伴发多脏器并发症所致,病情较重。随后进行血常规、血液生化分析、电解质、血清淀粉样蛋白测定,腹水样本分别送至温州大学病毒学研究所和军事医学科学院进行核酸检测诊断。
1.3 临床治疗过程为缓解症状,采用抽腹水、胸水、抗炎、抗感染等对症治疗方案:静脉注射10%葡萄糖溶液(30 mL·d-1)、重组猫白蛋白注射液(长春西诺,5 mL·d-1)、注射用氨苄西林钠(60 mg·d-1);皮下注射注射用重组猫干扰素ω(北京铁草,75万IU·d-1);肌内注射科特壮复方布他磷注射液(拜尔,1 mL·d-1)。
根据病史调查和临床症状,初步怀疑为FIPV感染,经协商,同时进行抗病毒治疗,主人自行采购小分子核苷类似物GS-441524,以每天2.5~4.0 mg·kg-1进行皮下注射,持续给药10周。
该病例的诊断与治疗过程如图 1所示。
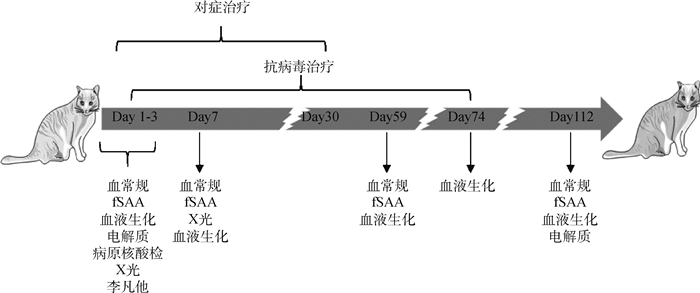
|
图 1 该病例的诊断及治疗过程 Fig. 1 Schematic diagram of the diagnosis and treatment process of this case |
李凡他试验:玻璃试管中,加入适量体积的蒸馏水,其表面以98%的乙酸覆盖,将抽取的腹腔液滴入试管1~2滴,若保持水滴状缓慢沉到试管底部则为阳性,若滴入后混和物迅速消失即为阴性。
高通量测序:取猫腹水400 μL用High Pure Viral RNA Kit(Roche Diagnostics,Germany)试剂盒提取总核酸,利用Ion Total RNA-Seq v2(Life Technologies,USA)试剂盒进行建库,将构建好的文库稀释到终浓度为30 pmol·L-1的工作库,加入到Ion 540芯片,利用Ion S5 Squencing Reagents Kit(Thermo Fisher,Singapore)试剂盒,在Ion S5 plus测序仪上进行测序。原始数据为3.8 Gb。经FASTP 0.21.0 [14]对原始数据筛选Q20以上的数据,该病例-Q20数据为667.1 Mb。将以上过滤后的数据用kraken2-2.0.7-beta软件[15]与minikraken2_v2_8GB_201904_UPDATE数据库比较进行物种分析,本研究在军事医学研究院完成。
RT-PCR验证:将腹水离心取上清液,Trizol法提取RNA并进行反转录获得cDNA。根据测序数据和NCBI数据库中FIPV的N基因保守序列(345 bp)设计引物N-F:TGGTGATAGTGATCTCGTTGCC、N-R:TCAACCTGTGTGTCATCAAACA,在25 μL反应体系中依次加入2×Taq DNA Master 12.5 μL,引物N-F/N-R各1 μL,反转录cDNA 1 μL。PCR扩增程序:95 ℃预变性2 min;95 ℃ 10 s;55 ℃ 30 s;72 ℃ 30 s,35个循环,72 ℃ 5 min,4 ℃保存。最后以1%琼脂糖凝胶电泳进行结果判断。
X光影像学检查:将猫侧位置于摄影平床,根据体厚和摄影距离由仪器自动调整kV和mAs参数。
血常规、血液生化分析、电解质等其他实验室检测参考标准操作步骤进行检测。
2 结果 2.1 实验室检测诊断此病例腹水样本首先经李凡他试验检测,证明腹水为渗出性浆液;血常规结果中,红细胞、血红蛋白及红细胞压积升高,而平均红细胞体积、平均红细胞血红蛋白含量和淋巴细胞百分比明显偏低,结合血清样本在血清淀粉样蛋白(fSAA)试纸检测指标高达161.4 μg·mL-1,远高于参考值5 μg·mL-1,表明该病例有脱水迹象且可能由于病原微生物感染全身呈较高的炎症水平(表 1)。
|
|
表 1 首次实验室诊断结果 Table 1 Results of the first laboratory diagnosis |
生化检测结果显示,总蛋白、球蛋白和谷丙转氨酶三个指标水平均高于参考值,其中谷丙转氨酶比参考值的上限高出近4倍,钾离子、二氧化碳分压和总二氧化碳分压指标异常。综合以上对腹水及血液的多项实验室检查,该病例疑似是由于病原微生物感染导致的腹水系统性炎性渗出,进而引起了多脏器代偿性病理变化。
2.2 高通量测序诊断及RT-PCR验证在送检的腹水样本中,为了减少高通量数据量带来的成本增加,经离心收集上清的基因组提取后,依然可获得大量Unique Reads信息,截取病毒门类注释信息发现,包含FIPV(236条)、RD114逆转录病毒(3 490条)和多种噬菌体病毒等Unique Reads,由于内源性逆转录病毒的存在,作者通过重组拼接获得了覆盖度超过80%的FIPV序列,证明其存在FIPV感染(图 2)。同时,利用RT-PCR方法对FIPV N蛋白编码基因进行扩增,获得特异性目的片段,测序正确(图 2C)。
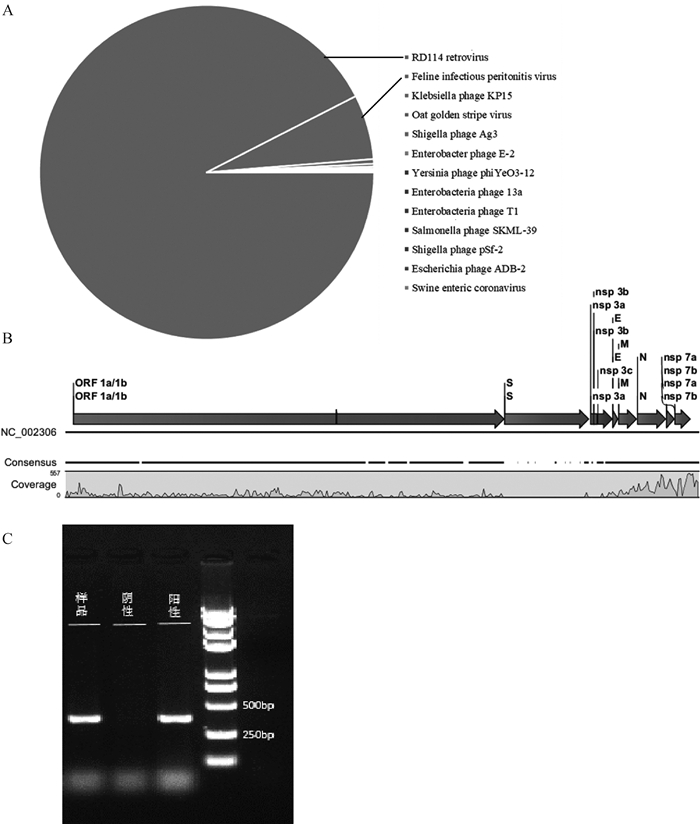
|
A. 腹水中注释为病毒相关的Unique Reads数量所占比例;B. 根据参考基因组NC_002306产生的FIPV拼接结果;C. FIPV N基因RT-PCR验证结果 A. Ascites annotated as the proportion of virus-related Unique Reads; B. The result of FIPV splicing based on the reference genome NC_002306; C. Specific amplification of FIPV N gene based on RT-PCR shown by agarose gel electrophoresis 图 2 宏基因组分析结果 Fig. 2 Results of metagenomic analysis |
收治首日X光影像学检查发现胸腔及腹腔内腹水较多,胸腔和腹腔内各器官边缘界限模糊,已有压迫胸腔和腹腔器官的病理迹象(图 3A),随即为其进行抽胸水、腹水、补液等临床治疗,治疗方案如“1.3”中对症治疗方案所示。在对症治疗的第7天再一次进行X光影像学检查,发现胸水和腹水症状已减轻,肋骨恢复原位,虽还有少量渗出液,但胸腔和腹腔内部各器官形态完整且边缘清晰(图 3B)。

|
A.治疗第1天X光影像;B. 治疗第7天X光影像 A. X-ray image on the first day of treatment; B. X-ray image on the seventh day of treatment 图 3 诊治过程中的影像学检查 Fig. 3 Imaging examination during diagnosis and treatment |
为了评估药物(GS-441524)对该病例的治疗效果,通过用药后血常规、生化、血清淀粉样蛋白等指标的检测,判断治疗效果及预后状态。
2.4.1 血常规检测指标变化趋势 为了解患猫治疗过程中的炎症水平和营养状态,基于血常规、特定生化和fSAA的综合检测方法被应用于整个病程。该病例在治疗第1到7天,其体内红细胞、红细胞压积、血小板和淋巴细胞百分比等指标一直处于不稳定状态,所有指标在治疗第2天均显著降低,第7天显著恢复,第59天的检测中,除红细胞和红细胞压积外,其余各项指标均处于正常水平。
2.4.2 生化检测指标变化趋势 该病例从第1天开展对症结合抗病毒治疗,到第7天时,其血清球蛋白含量明显增高,导致白/球蛋白比降低,但随着治疗的深入,球蛋白含量逐渐恢复正常,白/球蛋白比恢复至0.6以上(图 4A)。谷丙转氨酶和葡萄糖在初次检查时均处于较高水平,经治疗这两项指标恢复正常(图 4B)。提示本研究中使用的治疗方法不会对肝、肾等器官造成药理毒性。
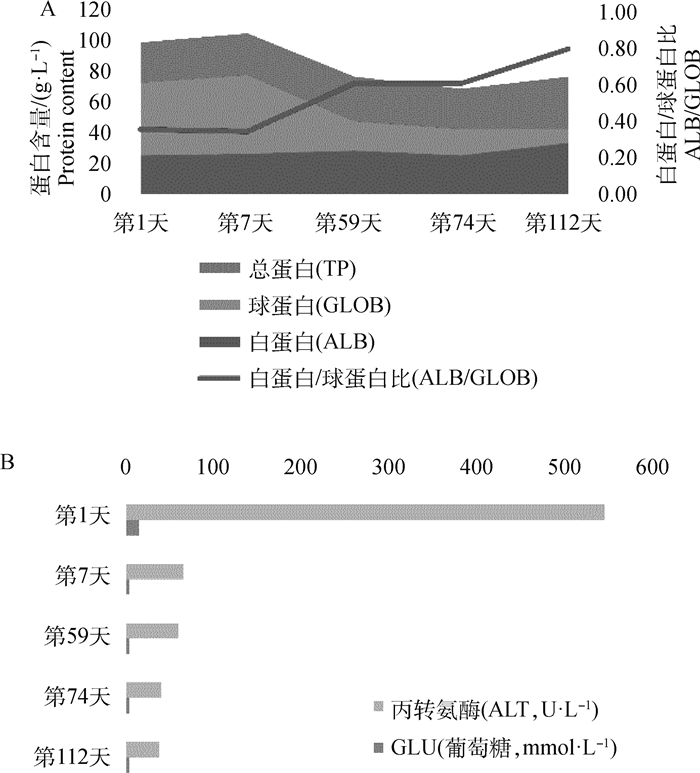
|
A.总蛋白、白蛋白、球蛋白和白蛋白与球蛋白之比的变化趋势;B. 血清中谷丙转氨酶活性及葡萄糖含量的变化趋势 A. The trends of total protein, albumin, globulin and ratio of albumin to globulin; B. The trend of alanine aminotransferase activity and glucose content in serum 图 4 治疗后第1、7、59、74、112天标志性血液生化检测指标变化趋势 Fig. 4 The trend in blood biochemical markers on day 1, 7, 59, 74 and 112 after treatment |
2.4.3 血清淀粉样蛋白检测指标变化趋势 第1天fSAA检测为161.4 μg·mL-1,经过7 d的对症治疗以及6 d的抗病毒治疗,该病例全身炎性水平呈下降趋势,虽然fSAA第7天检测为20.2 μg·mL-1,仍大于参考值上限5 μg·mL-1,但表明这一阶段的治疗已取得成效。在后续治疗过程中的第59天检查中,此项指标处于正常水平,表明此时机体炎症水平已经恢复正常。而在第112天复检中,该指标依然处于正常水平,证明此时体内并无复发迹象。
3 讨论猫作为重要的伴侣动物[16],存在多种疾病传播风险[17-18],可作为冠状病毒的重要宿主之一[19],研究表明FECV可由粪口途径传播,多呈无症状或较轻的腹泻症状,但5%~12%的病例可发生突变而感染FIPV,患猫死亡率可达100%[20],且因存在ADE现象尚无有效疫苗[21]。在我国兽医临床上,FIP的诊断多依赖胶体金、李凡他等临床诊断方法综合判断,而病原学检测方法仅依赖基于荧光定量PCR技术对S蛋白突变位点(M1030L、S1032A、M1058L和S1060A)的检测来验证,但突变频率、序列特异性差异等仍然限制了诊断的准确性[8, 22-23]。随着高通量测序技术的发展,基于宏基因组/转录组的检测方法已经广泛应用于病原、潜在的变异位点及共感染的发现,测序深度的加深可对病原的大部分或全序列实现监控,在兽医临床传染病诊断等方面存在巨大潜能,尤其对于控制猫群感染,进而预警和抵抗人群中的冠状病毒变异、发病具有科学指导意义[9-11]。本试验通过高通量测序技术,以3.8G的测序数据获得了该株病毒80%以上的序列,而且通过RT-PCR验证,证明了测序的真实性和有效性。
|
|
表 2 治疗后第1、2、7、59天血常规标志性指标的变化趋势 Table 2 The trend of blood routine landmark indicators on day 1, 2, 7, and 59 after treatment |
抗病毒小分子化合物是降低病毒滴度,控制病毒重组的有效手段,如3CL蛋白酶抑制剂(GC376)被研发并应用于猫冠状病毒感染治疗,其可与猫冠状病毒3CL蛋白酶催化基因结合,抑制蛋白前体裂解,阻止病毒复制[24-25]。小分子核苷类似物(GS-441524和GS-5734),则能够进入细胞,转化为天然核苷三磷酸的竞争物,抑制RNA依赖RNA聚合酶活性,干扰猫传染性腹膜炎病毒的RNA复制[26]。相较于GC376,GS-441524具有更强的抗病毒活性,不易产生耐药性[27-28]。小分子化合物治疗失败可能存在以下三种原因:①FIPV在长期的药物治疗中易产生耐药性;②较低剂量(2.0 mg·kg-1) 治疗可伴发神经症状;③高龄患病动物对药物作用的耐受能力有差异[28-30]。因此,本研究根据猫龄等影响因素,决定采用高剂量GS-441524连续给药,并持续监控白/球蛋白比、fSAA等临床指标,评估疾病救治效果。由于患猫病情危重,用药后24 h血常规指标并未见明显好转,但可通过进食、饮水等状态判断临床状态。1周后,血常规、血清蛋白、fSAA检测结果均有显著恢复,证明药物选择和剂量有助于改善患猫的身体状态;8周后,均已恢复至正常水平;继续用药2周,各项特征指标白/球蛋白比(0.6)和fSAA(< 5 μg·mL-1)仍在正常水平。停药后6周,各项特征指标依然正常,表明经GS-441524治疗未复发。
4 结论利用高通量测序方法,可拼接获得FIPV的大部分基因组序列,相较于其他检测方法,不仅能准确地诊断FIPV是导致猫疾病的主要病原,还能获得大量的、较为完整的基因组信息。10周高剂量GS-441524注射可有效治疗危重FIP幼猫,未见药物副作用和疾病复发,血清白/球蛋白比(≥0.6)和fSAA(< 5 μg·mL-1)两项指标具有时间一致性,可用于指示疾病变化,评估临床治疗效果。
| [1] |
PEDERSEN N C, ALLEN C E, LYONS L A. Pathogenesis of feline enteric coronavirus infection[J]. J Feline Med Surg, 2008, 10(6): 529-541. DOI:10.1016/j.jfms.2008.02.006 |
| [2] |
VOGEL L, VAN DER LUBBEN M, TE LINTELO E G, et al. Pathogenic characteristics of persistent feline enteric coronavirus infection in cats[J]. Vet Res, 2010, 41(5): 71. DOI:10.1051/vetres/2010043 |
| [3] |
BANK-WOLF B R, STALLKAMP I, WIESE S, et al. Mutations of 3c and spike protein genes correlate with the occurrence of feline infectious peritonitis[J]. Vet Microbiol, 2014, 173(3-4): 177-188. DOI:10.1016/j.vetmic.2014.07.020 |
| [4] |
POLAND A M, VENNEMA H, FOLEY J E, et al. Two related strains of feline infectious peritonitis virus isolated from immunocompromised cats infected with a feline enteric coronavirus[J]. J Clin Microbiol, 1996, 34(12): 3180-3184. DOI:10.1128/jcm.34.12.3180-3184.1996 |
| [5] |
TEKES G, THIEL H J. Chapter six - feline coronaviruses: pathogenesis of feline infectious peritonitis[J]. Adv Virus Res, 2016, 96: 193-218. |
| [6] |
陶军, 殷方芝, 黄忠, 等. 一例猫传染性腹膜炎病例的诊断和治疗[J]. 上海畜牧兽医通讯, 2021(1): 57-58. TAO J, YIN F Z, HUANG Z, et al. Diagnosis and therapy on a cat with feline infectious peritonitis[J]. Journal of Animal Husbandry and Veterinary Communication of Shanghai, 2021(1): 57-58. (in Chinese) |
| [7] |
乔石, 陈银亮, 马玉芳. 一例猫传染性腹膜炎的诊治报告[J]. 中兽医医药杂志, 2019, 38(6): 84-86. QIAO S, CHEN Y L, MA Y F. A case report of feline infectious peritonitis' diagnosis and treatment[J]. Journal of Traditional Chinese Veterinary Medicine, 2019, 38(6): 84-86. (in Chinese) |
| [8] |
CHANG H W, EGBERINK H F, HALPIN R, et al. Spike protein fusion peptide and feline coronavirus virulence[J]. Emerg Infect Dis, 2012, 18(7): 1089-1095. DOI:10.3201/eid1807.120143 |
| [9] |
WANG J H, HAN Y L, FENG J. Metagenomic next-generation sequencing for mixed pulmonary infection diagnosis[J]. BMC Pulm Med, 2019, 19(1): 252. DOI:10.1186/s12890-019-1022-4 |
| [10] |
SINKOV V V, OGARKOV O B, PLOTNIKOV A O, et al. Metagenomic analysis of mycobacterial transrenal DNA in patients with HIV and tuberculosis coinfection[J]. Infect, Genet Evol, 2020, 77: 104057. DOI:10.1016/j.meegid.2019.104057 |
| [11] |
HAN D S, LI Z Y, LI R, et al. mNGS in clinical microbiology laboratories: on the road to maturity[J]. Crit Rev Microbiol, 2019, 45(5-6): 668-685. DOI:10.1080/1040841X.2019.1681933 |
| [12] |
SHEAHAN T P, SIMS A C, GRAHAM R L, et al. Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses[J]. Sci Transl Med, 2017, 9(396): eaal3653. DOI:10.1126/scitranslmed.aal3653 |
| [13] |
WARREN T K, JORDAN R, LO M K, et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys[J]. Nature, 2016, 531(7594): 381-385. DOI:10.1038/nature17180 |
| [14] |
CHEN S F, ZHOU Y Q, CHEN Y R, et al. Fastp: an ultra-fast all-in-one FASTQ preprocessor[J]. Bioinformatics, 2018, 34(17): 884-890. DOI:10.1093/bioinformatics/bty560 |
| [15] |
WOOD D E, LU J, LANGMEAD B. Improved metagenomic analysis with Kraken 2[J]. Genome Biol, 2019, 20(1): 257. DOI:10.1186/s13059-019-1891-0 |
| [16] |
HU Y W, HU S M, WANG W L, et al. Earliest evidence for commensal processes of cat domestication[J]. Proc Nat Acad Sci U S A, 2014, 111(1): 116-120. DOI:10.1073/pnas.1311439110 |
| [17] |
STUETZER B, HARTMANN K. Feline parvovirus infection and associated diseases[J]. Vet J, 2014, 201(2): 150-155. DOI:10.1016/j.tvjl.2014.05.027 |
| [18] |
赵艳丽, 董宏伟, 陈小庆, 等. 猫杯状病毒反向遗传操作系统的建立及其应用的研究进展[J]. 病毒学报, 2015, 31(1): 74-79. ZHAO Y L, DONG H W, CHEN X Q, et al. Progress in establishment and application of feline calicivirus reverse genetics operating system[J]. Chinese Journal of Virology, 2015, 31(1): 74-79. (in Chinese) |
| [19] |
STOUT A E, ANDRÉ N M, JAIMES J A, et al. Coronaviruses in cats and other companion animals: Where does SARS-CoV-2/COVID-19 fit?[J]. Vet Microbiol, 2020, 247: 108777. DOI:10.1016/j.vetmic.2020.108777 |
| [20] |
LEWIS C S, PORTER E, MATTHEWS D, et al. Genotyping coronaviruses associated with feline infectious peritonitis[J]. J Gen Virol, 2015, 96(6): 1358-1368. DOI:10.1099/vir.0.000084 |
| [21] |
SHI J Z, WEN Z Y, ZHONG G X, et al. Susceptibility of ferrets, cats, dogs, and other domesticated animals to SARS-coronavirus 2[J]. Science, 2020, 368(6494): 1016-1020. DOI:10.1126/science.abb7015 |
| [22] |
MCKAY L A, MEACHEM M, SNEAD E, et al. Prevalence and mutation analysis of the spike protein in feline enteric coronavirus and feline infectious peritonitis detected in household and shelter cats in western Canada[J]. Can J Vet Res, 2020, 84(1): 18-23. |
| [23] |
YIN Y Y, LI T, WANG C H, et al. A retrospective study of clinical and laboratory features and treatment on cats highly suspected of feline infectious peritonitis in Wuhan, China[J]. Sci Rep, 2021, 11(1): 5208. DOI:10.1038/s41598-021-84754-0 |
| [24] |
SHI Y J, SHUAI L, WEN Z Y, et al. The preclinical inhibitor GS441524 in combination with GC376 efficaciously inhibited the proliferation of SARS-CoV-2 in the mouse respiratory tract[J]. Emerg Microbes Infect, 2021, 10(1): 481-492. DOI:10.1080/22221751.2021.1899770 |
| [25] |
YE G, WANG X W, TONG X H, et al. Structural basis for inhibiting porcine epidemic diarrhea virus replication with the 3C-like protease inhibitor GC376[J]. Viruses, 2020, 12(2): 240. DOI:10.3390/v12020240 |
| [26] |
CHO A, SAUNDERS O L, BUTLER T, et al. Synthesis and antiviral activity of a series of 1'-substituted 4-aza-7, 9-dideazaadenosine C-nucleosides[J]. Bioorg Med Chem Lett, 2012, 22(8): 2705-2707. DOI:10.1016/j.bmcl.2012.02.105 |
| [27] |
MURPHY B G, PERRON M, MURAKAMI E, et al. The nucleoside analog GS-441524 strongly inhibits feline infectious peritonitis (FIP) virus in tissue culture and experimental cat infection studies[J]. Vet Microbiol, 2018, 219: 226-233. DOI:10.1016/j.vetmic.2018.04.026 |
| [28] |
PEDERSEN N C, PERRON M, BANNASCH M, et al. Efficacy and safety of the nucleoside analog GS-441524 for treatment of cats with naturally occurring feline infectious peritonitis[J]. J Feline Med Surg, 2019, 21(4): 271-281. DOI:10.1177/1098612X19825701 |
| [29] |
PEDERSEN N C, KIM Y, LIU H W, et al. Efficacy of a 3C-like protease inhibitor in treating various forms of acquired feline infectious peritonitis[J]. J Feline Med Surg, 2018, 20(4): 378-392. DOI:10.1177/1098612X17729626 |
| [30] |
PERERA K D, RATHNAYAKE A D, LIU H W, et al. Characterization of amino acid substitutions in feline coronavirus 3C-like protease from a cat with feline infectious peritonitis treated with a protease inhibitor[J]. Vet Microbiol, 2019, 237: 108398. DOI:10.1016/j.vetmic.2019.108398 |
(编辑 白永平)



