2. 贵州大学动物科学学院,贵阳 550025;
3. 贵州省种畜禽种质测定中心,贵阳 550018
2. College of Animal Science, Guizhou University, Guiyang 550025, China;
3. Guizhou Provincial Breeding Animal and Poultry Germplasm Testing Center, Guiyang 550018, China
新城疫病毒(Newcastle disease virus, NDV)属于副黏病毒科、正禽腮腺炎病毒属成员,是一种有囊膜、单股负链不分节段的RNA病毒,其基因组编码6种结构蛋白(NP、P、M、F、HN和L蛋白)和2种非结构蛋白(V、W蛋白)[1]。其中M蛋白主要位于病毒粒子囊膜内表面,构成病毒囊膜和核衣壳连接的支架[2]。研究表明,M蛋白是一种细胞核-细胞质穿梭蛋白:在病毒感染早期,M蛋白通过自身携带的核定位信号(nuclear localization signal, NLS)进入细胞核[3],其主要功能是抑制细胞基因的转录以及调节细胞质中病毒基因组的复制和转录[4];而在病毒感染后期,M蛋白则通过携带的核输出信号(nuclear export signal, NES)进入细胞质[5],在细胞膜内侧参与子代病毒粒子的组装和释放[6]。近年来的研究还发现,M蛋白中存在多处功能性氨基酸基序或位点,能直接影响NDV的毒力和复制能力[7-10]。因此,M蛋白是一种多功能病毒蛋白,在NDV整个生活周期中具有重要作用。
和大多数病毒一样,NDV基因组较小,不能编码病毒复制所需的所有蛋白,为成功感染宿主并在宿主体内进行高效复制和扩散,通常需要与宿主蛋白进行紧密的相互作用,并利用宿主蛋白实现自身的复制。因此,鉴定与NDV病毒蛋白相互作用的宿主蛋白,对阐明NDV的复制和致病机制具有重要意义。目前,国内外已在M蛋白与NDV毒力和复制的关系[7-10],以及以M蛋白为核心的病毒样颗粒(virus-like particles, VLPs)形成和利用方面的研究上取得了较大的进展[11-13],而对M蛋白与宿主蛋白相互作用调控NDV复制和致病性等方面的研究进展相对缓慢。鉴于M蛋白在NDV生活周期中的重要作用,本文主要从M蛋白的结构特征和细胞内定位特征,以及M蛋白与宿主蛋白相互作用的功能研究方面进行综述,以期为更好地认识和研究M蛋白在NDV复制和致病性中的作用提供参考。
1 NDV M蛋白及其结构特征Class Ⅰ和Class Ⅱ分支的NDV毒株M基因全长均为1 241 bp,开放阅读框长度为1 095 bp,共编码364个氨基酸,蛋白质分子量约为40 ku。M蛋白在NDV进化过程中是一个相对保守的病毒蛋白,从GenBank下载100株NDV M蛋白氨基酸序列进行比对分析,发现M蛋白之间的相似性可达95.3%~99.5%。对NDV M蛋白[以ZJ1毒株M蛋白(GenBank No. AAL18934.2)为例]氨基酸组成分析发现,M蛋白含有46个强碱性氨基酸、31个强酸性氨基酸、138个疏水性氨基酸和3 102个极性氨基酸。因此,M蛋白整体呈高度碱性且高度疏水性[14]。同时,M蛋白中也含有丰富的泛素化位点和磷酸化位点,其中K119和K260[15]以及K247[16]被证实存在泛素化修饰,这对M蛋白在细胞内完成细胞核-细胞质穿梭以及NDV VLPs的出芽与释放有重要作用,但是M蛋白磷酸化位点及其功能的研究尚未见报道。另外,M蛋白中也含有较多的B细胞表位,其中,aa 42—56多肽序列可作为制备M蛋白单克隆抗体的良好免疫抗原[17],而M蛋白aa 77—82和aa 354—363则可用于LaSota疫苗株与其他基因型重组NDV疫苗的血清学鉴别诊断[18]。
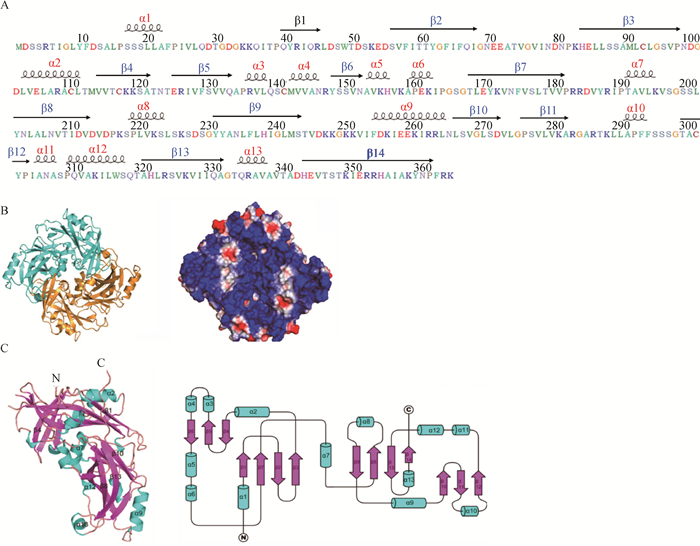
对NDV M蛋白二级结构分析发现,M蛋白含有13个α-螺旋(α1-α13)和14个β-折叠(β1-β14)(图 1A)。近年来,已有多个单股负链RNA病毒M蛋白的晶体结构被解析。对NDV M蛋白的X-射线晶体衍射(PDB登录号:4G1L)分析发现,M蛋白主要以同源二聚体形式存在,形状近似正方形(图 1B,左);利用空间结构模型展示M蛋白表面电荷,可以发现M蛋白表面主要带正电荷(蓝色表示正电荷,红色表示负电荷)(图 1B,右)[2]。对M蛋白单体进行分析发现,每个M蛋白单体包含大量的α-螺旋和β-折叠,并且均有两个相似的折叠结构域,其氨基端和羧基端均包含一个β-三明治样结构,并且各种α-螺旋位于这些β-三明治样结构表面(图 1C)[2]。研究表明,NDV M蛋白羧基端aa 266—280能形成特异的折叠结构与细胞脂质双分子膜结合[19],该折叠结构主要由2个α-螺旋(α12和α13)包裹2个反向平行的β-折叠(β13和β14)形成。最近Shtykova等[20]利用X-射线小角散射方法研究M蛋白在中性和酸性pH条件下的晶体结构,结果发现中性pH条件下的M蛋白二聚体可以形成四聚体,类似于丝状NDV病毒粒子大小的蛋白螺旋寡聚体,从而允许在没有其他病毒蛋白存在时,M蛋白形成膜面曲率完成VLPs的出芽;而在酸性pH下的M蛋白寡聚化趋势减少,这一发现解释了NDV通过内吞途径进入宿主细胞时,可能是通过加速M蛋白的支架解体来促进病毒核衣壳释放到细胞质[21-22]。
|
A. NDV M蛋白二级结构示意图,其包含的α-螺旋和β-折叠分别用红色和蓝色字体表示;B. NDV M蛋白两个单体(蓝色和金色)用带状图表示(左图),其表面正电荷和负电荷分别用蓝色和红色标出(右图);C. NDV M蛋白单体结构带状图的立体结构示意图,单体包含两个相似的β-三明治样结构域(洋红色),两侧有许多α-螺旋(蓝绿色)(左图);M蛋白单体二级结构示意图(右图) A. The secondary structure diagram of NDV M protein, with the α-helices and β-folds shown in red and blue fonts. B. The two monomers (blue and gold) of NDV M protein are shown as a ribbon diagram (Left). The surface charge is represented on a space-filling model (Right), with the positively charged regions shown in blue and the negatively charged regions in red. C. The ribbon drawing of the monomeric structure of NDV M protein shown as a stereo diagram. The M protein monomer contains two similarly folded β-sandwich domains (magenta) that are flanked by several α-helices (cyan) (Left). A schematic diagram representing the secondary structure elements of the M protein monomer (Right) 图 1 NDV M蛋白二级和三级结构示意图[2] Fig. 1 The schematic diagram of secondary and tertiary structures of NDV M protein[2] |
早在1988年,研究人员利用单克隆抗体检测NDV M蛋白在细胞内的分布时,发现M蛋白具有细胞核定位特征[23]。随后Peeples等[24]研究发现,虽然不同毒力NDV感染细胞后的M蛋白分布有所差异,但是在病毒感染早期M蛋白均定位在细胞核和核仁,并且这种定位不依赖于其他病毒蛋白的参与。近年来,研究人员利用绿色荧光蛋白标记的方法研究发现,M蛋白在早期定位在细胞核和核仁,而在后期则分布在细胞质和细胞膜[25]。另外,研究证实M蛋白在细胞膜内侧通过与HN、F和NP蛋白发生相互作用,来完成VLPs的组装和出芽[6]。因此,NDV M蛋白在细胞内具有细胞核-细胞质穿梭特征。
有研究表明,分子量小于50 ku的蛋白质可以通过自由扩散的方式穿过核孔复合体。然而研究发现,虽然猿猴空泡病毒40(Simian virus 40, SV40)的大T抗原分子量小于50 ku,但它却能通过由多个碱性氨基酸组成的NLS(126PKKKRKV132)进入细胞核[26],并且这一现象也在非洲爪蟾核质蛋白的细胞核定位研究中得到证实[27]。随后,研究人员还发现许多小分子量的蛋白质还可以通过由疏水性氨基酸(如亮氨酸L、异亮氨酸I和缬氨酸V等)组成的NES进入细胞质[28]。因此,由NLS和NES介导的蛋白质完成细胞核-细胞质穿梭受到越来越多的关注。NDV M蛋白的分子量为40 ku,但是研究人员通过多序列比对分析和氨基酸点突变试验证实,M蛋白(ZJ1株)中存在1个由两簇碱性氨基酸组成的NLS[3]和3个由疏水性氨基酸组成的NES[5](表 1),分别介导M蛋白的细胞核-细胞质穿梭。另外,M蛋白还具有核仁定位特征,其中aa 30—60可能是M蛋白的假定核仁定位信号(putative nucleolar localization signal, pNoLS)[29](表 1)。
|
|
表 1 NDV M蛋白携带的定位信号 Table 1 Localization signals carried by NDV M protein |
NDV具有溶瘤特性且不感染人,能刺激肿瘤细胞产生抗肿瘤免疫应答,因而在抗肿瘤治疗方面具有良好的研究价值和应用前景[30]。有研究证实,NDV在细胞中的快速复制会激活ATM依赖的双链DNA断裂(DNA double-strand break, DSB)反应,并且NDV强毒株F和HN蛋白在协同诱导细胞膜融合过程中激活ATM依赖的DSB反应,进而促进NDV靶向杀伤肿瘤细胞[31-32]。另外,NDV NP和P蛋白引起的细胞自噬和内质网应激在抑制肿瘤细胞增殖方面也发挥了重要作用[33]。在病毒M蛋白诱导细胞凋亡研究方面,研究人员发现水泡性口炎病毒(vesicular stomatitis virus, VSV)M蛋白第51位氨基酸介导的线粒体途径可以诱导肿瘤细胞凋亡[34],而狂犬病病毒(rabies virus, RABV)M蛋白第95位氨基酸能通过caspase依赖和非依赖的两种途径诱导肿瘤细胞凋亡[35]。对NDV M蛋白的研究发现,在肿瘤细胞中表达M蛋白可以诱导肿瘤细胞凋亡,并且使促凋亡蛋白Bax重新分布在线粒体;进一步的分析发现M蛋白氨基端区域(aa 23—37)存在一个Bcl-2同源域3(Bcl-2 homology 3, BH3)类似结构域,该结构域的缺失导致M蛋白诱导肿瘤细胞凋亡能力下降[36]。另外,免疫共沉淀试验结果表明M蛋白通过BH3结构域与Bax蛋白发生相互作用[36],因而证实NDV M蛋白与Bax蛋白相互作用可以促进肿瘤细胞的凋亡。
3.2 M蛋白与宿主蛋白互作促进病毒基因组的复制和转录多种副黏病毒如尼帕病毒(Nipah virus, NiV)、亨德拉病毒(Hendra virus, HeV)、仙台病毒(Sendai virus, SeV)、麻疹病毒(measles virus, MeV)和NDV,以及单股负链RNA病毒如VSV和呼吸道合胞体病毒(respiratory syncytial virus, RSV)的M蛋白在病毒感染期间均能定位在细胞核,其主要功能是抑制宿主细胞基因的转录以及调节病毒基因组在细胞质中的复制和转录[4, 37-41]。目前,对于副黏病毒M蛋白与何种宿主蛋白相互作用调节病毒基因组的复制和转录报道较少。溴结构域包含蛋白2(bromodomain-containing protein 2, BRD2)是含溴结构域和额外终端结构域(bromodomain and extra-terminal domain, BET)家族蛋白成员之一,主要位于细胞核,在细胞周期调控、基因转录调节、抗病毒免疫应答等方面具有重要作用[42-44]。本课题组近期研究发现NDV M蛋白与鸡BRD2蛋白在细胞核中存在相互作用,这种互作主要是通过M蛋白C-端区域(aa 264—313)结合鸡BRD2蛋白C-端ET结构域(aa 619—683)进行的;进一步研究发现M蛋白能以剂量依赖的方式降低鸡胚成纤维细胞(DF-1)内BRD2基因的转录,并且干扰DF-1细胞中BRD2蛋白的表达,能显著上调NDV基因组的复制和转录水平,而在细胞内过表达BRD2基因则得到相反的结果[45]。因此,M蛋白与鸡BRD2蛋白相互作用通过降低BRD2基因的表达和促进NDV基因组的复制和转录,进而增强NDV的复制能力和致病性,这也增加了对BRD2蛋白功能的认识。
3.3 M蛋白与宿主蛋白互作促进M蛋白的细胞核和核仁定位蛋白质进行细胞核-细胞质穿梭除了需要自身携带的NLS和NES,还需要与细胞内的核转运受体蛋白(如importin α、importin β、CRM1、exportin-t等)发生相互作用[46-47]。本课题组利用酵母双杂交系统从DF-1细胞cDNA文库中筛选到importin β1与NDV M蛋白存在相互作用,进一步的试验证实M蛋白通过其NLS与importin β1发生相互作用,并且在RanGTP的帮助下进入细胞核[48]。另外,研究还发现importin α5可以与importin β1相互作用形成importin α5/importin β1/M三元复合物,降低M蛋白的入核效率,进而影响NDV的复制和致病性[48]。CRM1是一种核输出受体蛋白,能与大多数NES相互作用,使蛋白质由细胞核进入细胞质[49]。有研究发现NDV M蛋白携带3个NES,但是CRM1抑制剂并不能降低NES的核输出能力,也不影响NDV的复制和致病性,说明M蛋白进入细胞质不依赖于CRM1[5]。因此,M蛋白的核输出受体蛋白还有待于进一步研究。
研究表明,核仁是真核生物细胞核中最为明显的结构,大多数病毒蛋白能够定位在核仁来促进病毒的复制[50-51],其中核磷蛋白B23、核仁素蛋白C23和核仁纤维蛋白是核仁蛋白中最为丰富的三个蛋白,它们在病毒蛋白进入核仁中发挥着重要作用[52-54]。NDV M蛋白具有明显的核仁定位特征[24-25],研究人员利用酵母双杂交技术发现M蛋白与核磷蛋白B23存在相互作用,并且M蛋白aa 30—60与核磷蛋白B23 aa 188—245是相互作用区域;干扰DF-1细胞内核磷蛋白B23的表达不仅减少了M蛋白的核仁定位,而且显著减弱了NDV的复制效率和致病性[29]。另外,荧光共定位试验结果表明,在NDV感染早期M蛋白与核磷蛋白B23具有明显的核仁定位,但是在NDV感染后期M蛋白表现为细胞核和细胞质定位,而核磷蛋白B23却由核仁定位转变为核质定位[29]。因此,NDV M蛋白通过与核磷蛋白B23相互作用进入核仁,但是M蛋白在核仁中可能会破坏核磷蛋白B23的结构和功能来影响细胞蛋白的翻译,以此促进NDV的复制和致病性[55]。
3.4 M蛋白与宿主蛋白互作促进病毒粒子的组装和出芽研究人员在SeV和MeV病毒粒子中发现有细胞骨架蛋白存在,推测细胞骨架蛋白参与了副黏病毒的组装和出芽[38]。早期有研究发现,NDV M蛋白与细胞骨架蛋白actin存在直接的相互作用[56],但是两者互作在NDV组装和出芽中的作用却未见报道。后来Ren等[57]对鸡胚尿囊液中的NDV纯化后进行蛋白质组学分析,发现NDV病毒粒子中有大量的细胞骨架蛋白存在,如actin、ARP2、ARP3、tubulin、ANXA2等。最近,Koga等[58]报道了同为副黏病毒成员的MeV,其M蛋白与细胞骨架蛋白ANXA2存在相互作用;干扰ANXA2的表达不仅减少M蛋白在细胞膜内侧的分布,而且降低了病毒的出芽效率,结果说明M蛋白与ANXA2的相互作用有助于MeV的组装和出芽。本课题组近期利用免疫共沉淀方法发现NDV M蛋白与ANXA2存在相互作用,并且干扰ANXA2的表达降低了NDV的复制能力和出芽效率(结果待发表),暗示了M蛋白与ANXA2的相互作用可能在NDV组装和出芽过程中具有重要作用。
对囊膜病毒的出芽机制进行研究发现,囊膜病毒蛋白中存在晚期结构域,并且通过招募宿主细胞空泡蛋白分选(vacuolar protein sorting, VPS)系统形成内体分选转运蛋白复合体(endosomal sorting complex required for transport, ESCRT)实现病毒的出芽[59-60]。NDV M蛋白具有与副流感病毒5型(parainfluenza virus 5, PIV5)和腮腺炎病毒(mumps virus, MuV)M蛋白相似的FPIV晚期结构域,这对M蛋白的出芽和病毒的复制至关重要,并且M蛋白的出芽还需要宿主细胞ESCRT的参与[61],但是M蛋白与宿主蛋白的相互作用参与NDV的出芽报道较少。带电的多泡体蛋白(charged multivesicular body proteins, CHMPs)是ESCRT-Ⅲ的主要成分,主要参与表面受体蛋白的降解和内吞多泡体的形成[62]。Li等[63]研究证实CHMP4B与M蛋白在细胞质存在相互作用,在细胞中干扰CHMP4B的表达或过表达CHMP4B/C蛋白均能显著抑制NDV的复制,表明M蛋白与CHMP4B蛋白相互作用调节NDV的出芽过程。因此,研究M蛋白与宿主蛋白的相互作用,对深入认识宿主蛋白调控病毒的组装和出芽机制具有重要意义。
3.5 M蛋白与宿主蛋白互作参与NDV的免疫逃避M蛋白抑制宿主免疫应答已在多种RNA病毒中被报道,如RABV M蛋白能通过结合RelAp43蛋白来抑制NF-κB信号通路产生炎性细胞因子[64];VSV M蛋白在小鼠L929细胞中能分别抑制NF-κB活性和干扰素应答反应[65];最近研究人员发现新型严重急性呼吸综合征冠状病毒2型M蛋白能指引细胞自噬标志物LC3转位到线粒体显著削弱Ⅰ型干扰素的产生,而无法与LC3互作的M蛋白突变体则表现出较弱的干扰素拮抗效应,表明M蛋白能通过促进线粒体自噬拮抗宿主固有免疫反应[66]。王蕾等[67]最早报道了NDV M蛋白能抑制宿主细胞表达促炎性细胞因子,进而抑制宿主免疫应答来促进NDV的复制。本课题组最新的研究发现NDV M蛋白在细胞质中能以剂量依赖的方式降低具有叉头相关结构域的TRAF相互作用蛋白[TNF receptor associated factor (TRAF)-interacting protein with a Forkhead-associated (FHA) domain, TIFA]的表达,并且通过抑制TIFA/TRAF6/NF-κB信号通路产生炎性细胞因子促进NDV的复制[68],因而首次揭示了M蛋白参与了NDV的免疫逃避。
Viperin是一种干扰素诱导蛋白,从低等脊椎动物到高等哺乳动物均表现出高度的保守性,主要参与宿主抗病毒的先天性免疫应答,对许多病毒都具有抗病毒作用[69-70]。Shah等[71]研究发现鸡viperin蛋白具有抵抗NDV感染的作用,利用反向遗传操作技术在NDV基因组中表达鸡viperin蛋白,能明显降低NDV的复制和致病性;进一步通过生物信息学分析和免疫共沉淀试验证实NDV M蛋白与鸡viperin蛋白存在相互作用。该研究结果表明,M蛋白通过与viperin蛋白发生相互作用,降低宿主对NDV的抗病毒免疫应答,这有利于NDV在宿主体内的复制。另外,有研究表明,酸性亮氨酸核磷酸蛋白32B(acidic leucine-rich nuclear phosphoprotein 32B, ANP32B)可作为免疫调节器参与宿主免疫应答,在抗病毒感染方面发挥着一定的作用[72]。最近,Günther等[73]研究报道了ANP32B蛋白可以与多种副黏病毒(包括NiV、HeV、SeV、NDV和犬瘟热病毒)M蛋白发生相互作用,其中NiV和HeV M蛋白均以ANP32B蛋白依赖的方式进入细胞核,但是ANP32B蛋白与M蛋白相互作用在NDV以及其他副黏病毒复制中的作用还有待进一步研究。因此,以上研究结果表明NDV M蛋白在参与病毒免疫逃避和促进病毒复制方面具有重要作用。
4 展望NDV M蛋白与其他副黏病毒(如SeV、MeV、NiV和HeV)和单股负链RNA病毒(如VSV和RSV)M蛋白均具有相同的细胞内定位特征和功能[4, 37-41],这就决定了M蛋白需要与多种宿主蛋白相互作用来发挥其功能。目前,虽然对NDV M蛋白与宿主蛋白相互作用的功能有了一定的认识,但相比其他副黏病毒和单股负链RNA病毒M蛋白的研究仍不够深入。近些年来的研究表明,VSV M蛋白在细胞核中与宿主蛋白Rae1和Nup98相互作用形成复合物,能有效地抑制细胞基因转录和阻止细胞mRNA的核输出[74-75];而M蛋白在细胞质中能与LMP2相互作用干扰细胞免疫蛋白酶体的形成,进而使VSV逃避宿主免疫系统的监视[76],同时M蛋白也可以与真核细胞翻译起始因子3i相互作用促进VSV基因组的转录,并通过抑制细胞干扰素刺激基因的表达来促进VSV的复制[77]。另外,研究发现PIV5 M蛋白与血管抑素结合蛋白1(angiomotin-like 1, AmotL1)相互作用能促进病毒的感染和病毒粒子的释放[78];进一步的研究发现AmotL1蛋白可将M蛋白连接到NEDD4泛素连接酶家族成员上,这对促进PIV5子代病毒粒子的释放具有重要作用[79]。因此,上述相关研究结果为深入研究NDV M蛋白与宿主蛋白相互作用的功能提供了借鉴和参考。
目前,基于免疫共沉淀结合蛋白质谱鉴定的方法已经筛选到多种与NDV M蛋白相互作用的宿主蛋白[15, 80],主要涉及细胞骨架蛋白、核转运受体蛋白、核孔复合物蛋白、蛋白质合成相关蛋白、E3泛素连接酶相关蛋白、细胞凋亡相关蛋白和免疫相关蛋白等。这些宿主蛋白与已经报道的NDV M蛋白功能有关,但是还需要进一步的相互作用验证和功能研究。另外,除了已报道的宿主蛋白importin β1和BRD2与NDV M蛋白相互作用能促进M蛋白的细胞核定位和病毒基因组复制与转录以外[45, 48],本课题组前期利用酵母双杂交系统还筛选到3种与NDV M蛋白相互作用的宿主蛋白(包括真核细胞翻译延伸因子2、丝氨酸和精氨酸剪接因子3和核基质蛋白3)[48],其中核基质蛋白3和BRD2均参与了细胞基因的转录,并且两者还存在相互作用[43],暗示M蛋白与核基质蛋白3和BRD2可以形成复合物,因此三者之间的相互作用对NDV复制和致病性的影响及其作用机制也值得深入研究。总之,开展与NDV M蛋白相互作用宿主蛋白的鉴定和功能研究不仅有助于拓展M蛋白的功能,而且对深入认识M蛋白在NDV复制和致病性中的作用具有重要意义。
| [1] |
AMARASINGHE G K, AYLLÓN M A, BÀO Y, et al. Taxonomy of the order Mononegavirales: update 2019[J]. Arch Virol, 2019, 164(7): 1967-1980. DOI:10.1007/s00705-019-04247-4 |
| [2] |
BATTISTI A J, MENG G, WINKLER D C, et al. Structure and assembly of a paramyxovirus matrix protein[J]. Proc Natl Acad Sci U S A, 2012, 109(35): 13996-14000. DOI:10.1073/pnas.1210275109 |
| [3] |
COLEMAN N A, PEEPLES M E. The matrix protein of Newcastle disease virus localizes to the nucleus via a bipartite nuclear localization signal[J]. Virology, 1993, 195(2): 596-607. DOI:10.1006/viro.1993.1411 |
| [4] |
DUAN Z Q, DENG S S, JI X Q, et al. Nuclear localization of Newcastle disease virus matrix protein promotes virus replication by affecting viral RNA synthesis and transcription and inhibiting host cell transcription[J]. Vet Res, 2019, 50(1): 22. DOI:10.1186/s13567-019-0640-4 |
| [5] |
DUAN Z Q, SONG Q Q, WANG Y Y, et al. Characterization of signal sequences determining the nuclear export of Newcastle disease virus matrix protein[J]. Arch Virol, 2013, 158(12): 2589-2595. DOI:10.1007/s00705-013-1769-5 |
| [6] |
PANTUA H D, MCGINNES L W, PEEPLES M E, et al. Requirements for the assembly and release of Newcastle disease virus-like particles[J]. J Virol, 2006, 80(22): 11062-11073. DOI:10.1128/JVI.00726-06 |
| [7] |
DUAN Z Q, LI J, ZHU J, et al. A single amino acid mutation, R42A, in the Newcastle disease virus matrix protein abrogates its nuclear localization and attenuates viral replication and pathogenicity[J]. J Gen Virol, 2014, 95(5): 1067-1073. DOI:10.1099/vir.0.062992-0 |
| [8] |
XU H X, SONG Q Q, ZHU J, et al. A single R36Q mutation in the matrix protein of pigeon paramyxovirus type 1 reduces virus replication and shedding in pigeons[J]. Arch Virol, 2016, 161(7): 1949-1955. DOI:10.1007/s00705-016-2847-2 |
| [9] |
XU H X, DUAN Z Q, CHEN Y, et al. Simultaneous mutation of G275A and P276A in the matrix protein of Newcastle disease virus decreases virus replication and budding[J]. Arch Virol, 2016, 161(12): 3527-3533. DOI:10.1007/s00705-016-3046-x |
| [10] |
段志强, 嵇辛勤, 邓珊珊, 等. 鸭源新城疫病毒M蛋白核定位信号突变影响病毒的毒力和复制能力[J]. 微生物学报, 2018, 58(10): 1786-1797. DUAN Z Q, JI X Q, DENG S S, et al. Nuclear localization signal mutation in the M protein attenuates the virulence and replication of duck-origin Newcastle disease virus[J]. Acta Microbiologica Sinica, 2018, 58(10): 1786-1797. (in Chinese) |
| [11] |
XU X H, DING Z, LI J D, et al. Newcastle disease virus-like particles containing the Brucella BCSP31 protein induce dendritic cell activation and protect mice against virulent Brucella challenge[J]. Vet Microbiol, 2019, 229: 39-47. DOI:10.1016/j.vetmic.2018.12.007 |
| [12] |
XU X H, QIAN J, QIN L S, et al. Chimeric Newcastle disease virus-like particles containing DC-binding peptide-fused haemagglutinin protect chickens from virulent Newcastle disease virus and H9 N2 avian influenza virus challenge[J]. Virol Sin, 2020, 35(4): 455-467. DOI:10.1007/s12250-020-00199-1 |
| [13] |
YANG Y P, SHI W, ABIONA O M, et al. Newcastle disease virus-like particles displaying prefusion-stabilized SARS-CoV-2 spikes elicit potent neutralizing responses[J]. Vaccines (Basel), 2021, 9(2): 73. DOI:10.3390/vaccines9020073 |
| [14] |
CHAMBERS P, MILLAR N S, PLATT S G, et al. Nucleotide sequence of the gene encoding the matrix protein of Newcastle disease virus[J]. Nucl Acids Res, 1986, 14(22): 9051-9061. DOI:10.1093/nar/14.22.9051 |
| [15] |
姜维雨. 新城疫病毒M蛋白K119和K260泛素化修饰有助于病毒样颗粒的形成[D]. 上海: 中国农业科学院, 2019. JIANG W Y. K119 and K260 ubiquitination of Newcastle disease virus M protein is essential for efficient virus-like particle formation[D]. Shanghai: Chinese Academy of Agricultural Sciences, 2019. (in Chinese) |
| [16] |
彭听雨, 杨冰欢, 谭磊, 等. 新城疫病毒M蛋白247位赖氨酸对其功能的影响[J/OL]. 中国动物传染病学报, 2021: 1-10. (2021-04-27). http://kns.cnki.net/kcms/detail/31.2031.S.20210427.1012.010.html. PENG T Y, YANG B H, TAN L, et al. Effect of 247 lysine in Newcastle disease virus matrix protein on its functions[J/OL]. Chinese Journal of Animal Infectious Diseases, 2021: 1-10. (2021-04-27). http://kns.cnki.net/kcms/detail/31.2031.S.20210427.1012.010.html. (in Chinese) |
| [17] |
董靖. 新城疫病毒M蛋白单克隆抗体制备及核定位研究[D]. 合肥: 安徽农业大学, 2020. DONG J. Establishment of monoclonal antibodies against Newcastle disease virus matrix protein and its nuclear localization[D]. Hefei: Anhui Agricultural University. (in Chinese) |
| [18] |
BI Y K, JIN Z Y, WANG Y H, et al. Identification of two distinct linear B cell epitopes of the matrix protein of the Newcastle disease virus vaccine strain LaSota[J]. Viral Immunol, 2019, 32(5): 221-229. DOI:10.1089/vim.2019.0007 |
| [19] |
EL NAJJAR F, SCHMITT A P, DUTCH R E. Paramyxovirus glycoprotein incorporation, assembly and budding: a three way dance for infectious particle production[J]. Viruses, 2014, 6(8): 3019-3054. DOI:10.3390/v6083019 |
| [20] |
SHTYKOVA E V, PETOUKHOV M V, DADINOVA L A, et al. Solution structure, self-assembly, and membrane interactions of the matrix protein from Newcastle disease virus at neutral and acidic pH[J]. J Virol, 2019, 93(6): e01450-18. |
| [21] |
SÁNCHEZ-FELIPE L, VILLAR E, MUOZ-BARROSO I. Entry of Newcastle disease virus into the host cell: role of acidic pH and endocytosis[J]. Biochim Biophys Acta, 2014, 1838(1): 300-309. DOI:10.1016/j.bbamem.2013.08.008 |
| [22] |
ZHAO R, SHI Q K, HAN Z X, et al. Newcastle disease virus entry into chicken macrophages via a pH-dependent, dynamin and caveola-mediated endocytic pathway that requires Rab5[J]. J Virol, 2021, 95(13): e0228820. DOI:10.1128/JVI.02288-20 |
| [23] |
FAABERG K S, PEEPLES M E. Strain variation and nuclear association of Newcastle disease virus matrix protein[J]. J Virol, 1988, 62(2): 586-593. DOI:10.1128/jvi.62.2.586-593.1988 |
| [24] |
PEEPLES M E, WANG C, GUPTA K C, et al. Nuclear entry and nucleolar localization of the Newcastle disease virus (NDV) matrix protein occur early in infection and do not require other NDV proteins[J]. J Virol, 1992, 66(5): 3263-3269. DOI:10.1128/jvi.66.5.3263-3269.1992 |
| [25] |
DUAN Z Q, LI Q H, HE L, et al. Application of green fluorescent protein-labeled assay for the study of subcellular localization of Newcastle disease virus matrix protein[J]. J Virol Methods, 2013, 194(1-2): 118-122. DOI:10.1016/j.jviromet.2013.08.014 |
| [26] |
WOLFF B, PARK M K, KLIMA E, et al. Antibodies against the SV40 large T antigen nuclear localization sequence[J]. Arch Biochem Biophys, 1991, 288(1): 131-140. DOI:10.1016/0003-9861(91)90174-H |
| [27] |
PAINE P L, YASSIN R, PAINE T M, et al. Intranuclear binding on nucleoplasmin[J]. J Cell Biochem, 1995, 58(1): 105-114. DOI:10.1002/jcb.240580113 |
| [28] |
FUNG H Y J, NIESMAN A, CHOOK Y M. An update to the CRM1 cargo/NES database NESdb[J]. Mol Biol Cell, 2021, 32(6): 467-469. DOI:10.1091/mbc.E20-11-0694 |
| [29] |
DUAN Z Q, CHEN J, XU H X, et al. The nucleolar phosphoprotein B23 targets Newcastle disease virus matrix protein to the nucleoli and facilitates viral replication[J]. Virology, 2014, 452-453: 212-222. DOI:10.1016/j.virol.2014.01.011 |
| [30] |
BURMAN B, PESCI G, ZAMARIN D. Newcastle disease virus at the forefront of cancer immunotherapy[J]. Cancers (Basel), 2020, 12(12): 3552. DOI:10.3390/cancers12123552 |
| [31] |
REN S H, REHMAN Z U, SHI M Y, et al. Hemagglutinin-neuraminidase and fusion proteins of virulent Newcastle disease virus cooperatively disturb fusion-fission homeostasis to enhance mitochondrial function by activating the unfolded protein response of endoplasmic reticulum and mitochondrial stress[J]. Vet Res, 2019, 50(1): 37. DOI:10.1186/s13567-019-0654-y |
| [32] |
REN S H, UR REHMAN Z, GAO B, et al. ATM-mediated DNA double-strand break response facilitated oncolytic Newcastle disease virus replication and promoted syncytium formation in tumor cells[J]. PLoS Pathog, 2020, 16(6): e1008514. DOI:10.1371/journal.ppat.1008514 |
| [33] |
CHENG J H, SUN Y J, ZHANG F Q, et al. Newcastle disease virus NP and P proteins induce autophagy via the endoplasmic reticulum stress-related unfolded protein response[J]. Sci Rep, 2016, 6: 24721. DOI:10.1038/srep24721 |
| [34] |
GRAY Z, TABARRAEI A, MORADI A, et al. M51R and Delta-M51 matrix protein of the vesicular stomatitis virus induce apoptosis in colorectal cancer cells[J]. Mol Biol Rep, 2019, 46(3): 3371-3379. DOI:10.1007/s11033-019-04799-3 |
| [35] |
KOJIMA I, IZUMI F, OZAWA M, et al. Analyses of cell death mechanisms related to amino acid substitution at position 95 in the rabies virus matrix protein[J]. J Gen Virol, 2021, 102(4): 001594. DOI:10.1099/jgv.0.001594 |
| [36] |
MOLOUKI A, HSU Y T, JAHANSHIRI F, et al. The matrix (M) protein of Newcastle disease virus binds to human bax through its BH3 domain[J]. Virol J, 2011, 8: 385. DOI:10.1186/1743-422X-8-385 |
| [37] |
GHILDYAL R, HO A, JANS D A. Central role of the respiratory syncytial virus matrix protein in infection[J]. FEMS Microbiol Rev, 2006, 30(5): 692-705. DOI:10.1111/j.1574-6976.2006.00025.x |
| [38] |
HARRISON M S, SAKAGUCHI T, SCHMITT A P. Paramyxovirus assembly and budding: building particles that transmit infections[J]. Int J Biochem Cell Biol, 2010, 42(9): 1416-1429. DOI:10.1016/j.biocel.2010.04.005 |
| [39] |
PENTECOST M, VASHISHT A A, LESTER T, et al. Evidence for ubiquitin-regulated nuclear and subnuclear trafficking among Paramyxovirinae matrix proteins[J]. PLoS Pathog, 2015, 11(3): e1004739. DOI:10.1371/journal.ppat.1004739 |
| [40] |
YU X L, SHAHRIARI S, LI H M, et al. Measles virus matrix protein inhibits host cell transcription[J]. PLoS One, 2016, 11(8): e0161360. DOI:10.1371/journal.pone.0161360 |
| [41] |
DONNELLY C M, ROBY J A, SCOTT C J, et al. The structural features of Henipavirus matrix protein driving intracellular trafficking[J]. Viral Immunol, 2021, 34(1): 27-40. DOI:10.1089/vim.2020.0056 |
| [42] |
DENIS G V, MCCOMB M E, FALLER D V, et al. Identification of transcription complexes that contain the double bromodomain protein Brd2 and chromatin remodeling machines[J]. J Proteome Res, 2006, 5(3): 502-511. DOI:10.1021/pr050430u |
| [43] |
ZHOU L, HAN Y F, YUAN C, et al. Screening and bioinformatics analysis of cellular proteins interacting with chicken bromodomain-containing protein 2 in DF-1 cells[J]. Br Poult Sci, 2021, 1-10. DOI:10.1080/00071668.2021.1943311 |
| [44] |
周磊, 韩一帆, 段志强. 含溴结构域蛋白2结构与功能的研究进展[J]. 中国细胞生物学学报, 2021, 43(4): 856-865. ZHOU L, HAN Y F, DUAN Z Q. Advances in the structure and function of bromodomain-containing protein 2[J]. Chinese Journal of Cell Biology, 2021, 43(4): 856-865. (in Chinese) |
| [45] |
DUAN Z Q, HAN Y F, ZHOU L, et al. Chicken bromodomain-containing protein 2 interacts with the Newcastle disease virus matrix protein and promotes viral replication[J]. Vet Res, 2020, 51(1): 120. DOI:10.1186/s13567-020-00846-1 |
| [46] |
FU X K, LIANG C, LI F F, et al. The rules and functions of nucleocytoplasmic shuttling proteins[J]. Int J Mol Sci, 2018, 19(5): 1445. DOI:10.3390/ijms19051445 |
| [47] |
PACI G, ZHENG T T, CARIA J, et al. Molecular determinants of large cargo transport into the nucleus[J]. Elife, 2020, 9: e55963. DOI:10.7554/eLife.55963 |
| [48] |
DUAN Z Q, XU H X, JI X Q, et al. Importin α5 negatively regulates importin β1-mediated nuclear import of Newcastle disease virus matrix protein and viral replication and pathogenicity in chicken fibroblasts[J]. Virulence, 2018, 9(1): 783-803. DOI:10.1080/21505594.2018.1449507 |
| [49] |
WANG A Y, LIU H T. The past, present, and future of CRM1/XPO1 inhibitors[J]. Stem Cell Investig, 2019, 6: 6. DOI:10.21037/sci.2019.02.03 |
| [50] |
SALVETTI A, GRECO A. Viruses and the nucleolus: the fatal attraction[J]. Biochim Biophys Acta Mol Basis Dis, 2014, 1842(6): 840-847. DOI:10.1016/j.bbadis.2013.12.010 |
| [51] |
RAWLINSON S M, MOSELEY G W. The nucleolar interface of RNA viruses[J]. Cell Microbiol, 2015, 17(8): 1108-1120. DOI:10.1111/cmi.12465 |
| [52] |
ZHOU J W, DAI Y D, LIN C, et al. Nucleolar protein NPM1 is essential for circovirus replication by binding to viral capsid[J]. Virulence, 2020, 11(1): 1379-1393. DOI:10.1080/21505594.2020.1832366 |
| [53] |
DONG D D, ZHU S Q, MIAO Q H, et al. Nucleolin (NCL) inhibits the growth of peste des petits ruminants virus[J]. J Gen Virol, 2020, 101(1): 33-43. DOI:10.1099/jgv.0.001358 |
| [54] |
CHEN G Q, YAN Q, WANG H R, et al. Identification and characterization of the nucleolar localization signal of Autographa Californica multiple nucleopolyhedrovirus LEF5[J]. J Virol, 2020, 94(4): e01891-19. |
| [55] |
段志强, 谢玲玲, 周迪, 等. 新城疫病毒M蛋白细胞核定位的机制与功能研究进展[J]. 畜牧兽医学报, 2021, 52(4): 891-898. DUAN Z Q, XIE L L, ZHOU D, et al. Research progress on the mechanism and function of nuclear localization of Newcastle disease virus M protein[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(4): 891-898. (in Chinese) |
| [56] |
GIUFFRE R M, TOVELL D R, KAY C M, et al. Evidence for an interaction between the membrane protein of a paramyxovirus and actin[J]. J Virol, 1982, 42(3): 963-968. DOI:10.1128/jvi.42.3.963-968.1982 |
| [57] |
REN X P, XUE C Y, KONG Q M, et al. Proteomic analysis of purified Newcastle disease virus particles[J]. Proteome Sci, 2012, 10(1): 32. DOI:10.1186/1477-5956-10-32 |
| [58] |
KOGA R, KUBOTA M, HASHIGUCHI T, et al. Annexin A2 mediates the localization of measles virus matrix protein at the plasma membrane[J]. J Virol, 2018, 92(10): e00181-18. |
| [59] |
VIETRI M, RADULOVIC M, STENMARK H. The many functions of ESCRTs[J]. Nat Rev Mol Cell Biol, 2020, 21(1): 25-42. DOI:10.1038/s41580-019-0177-4 |
| [60] |
MENG B, LEVER A M L. The interplay between ESCRT and viral factors in the enveloped virus life cycle[J]. Viruses, 2021, 13(2): 324. DOI:10.3390/v13020324 |
| [61] |
DUAN Z Q, HU Z L, ZHU J, et al. Mutations in the FPIV motif of Newcastle disease virus matrix protein attenuate virus replication and reduce virus budding[J]. Arch Virol, 2014, 159(7): 1813-1819. DOI:10.1007/s00705-014-1998-2 |
| [62] |
LATA S, SCHOEHN G, SOLOMONS J, et al. Structure and function of ESCRT-Ⅲ[J]. Biochem Soc Trans, 2009, 37(1): 156-160. DOI:10.1042/BST0370156 |
| [63] |
LI X, LI X Q, CAO H, et al. Engagement of new castle disease virus (NDV) matrix (M) protein with charged multivesicular body protein (CHMP) 4 facilitates viral replication[J]. Virus Res, 2013, 171(1): 80-88. DOI:10.1016/j.virusres.2012.10.033 |
| [64] |
BEN KHALIFA Y, LUCO S, BESSON B, et al. The matrix protein of rabies virus binds to RelAp43 to modulate NF-κB-dependent gene expression related to innate immunity[J]. Sci Rep, 2016, 6: 39420. DOI:10.1038/srep39420 |
| [65] |
MARQUIS K A, BECKER R L, WEISS A N, et al. The VSV matrix protein inhibits NF-κB and the interferon response independently in mouse L929 cells[J]. Virology, 2020, 548: 117-123. DOI:10.1016/j.virol.2020.06.013 |
| [66] |
HUI X F, ZHANG L L, CAO L, et al. SARS-CoV-2 promote autophagy to suppress type Ⅰ interferon response[J]. Sig Transduct Target Ther, 2021, 6(1): 180. DOI:10.1038/s41392-021-00574-8 |
| [67] |
王蕾, 陈福勇, 郑世军, 等. 新城疫病毒(NDV)基质(M)蛋白在体外对炎症因子诱导的作用[J]. 中国兽医杂志, 2008, 44(4): 14-15. WANG L, CHEN F Y, ZHENG S J, et al. Induction effect of Newcastle disease virus (NDV) matrix (M) protein on the production of inflammatory factors in vitro[J]. Chinese Journal of Veterinary Medicine, 2008, 44(4): 14-15. DOI:10.3969/j.issn.0529-6005.2008.04.006 (in Chinese) |
| [68] |
DUAN Z Q, YUAN C, HAN Y F, et al. TMT-based quantitative proteomics analysis reveals the attenuated replication mechanism of Newcastle disease virus caused by nuclear localization signal mutation in viral matrix protein[J]. Virulence, 2020, 11(1): 607-635. DOI:10.1080/21505594.2020.1770482 |
| [69] |
NG L F P, HISCOX J A. Viperin poisons viral replication[J]. Cell Host & Microbe, 2018, 24(2): 181-183. |
| [70] |
YUAN Y K, MIAO Y, QIAN L P, et al. Targeting UBE4A revives viperin protein in epithelium to enhance host antiviral defense[J]. Mol Cell, 2020, 77(4): 734-747. DOI:10.1016/j.molcel.2019.11.003 |
| [71] |
SHAH M, BHARADWAJ M S K, GUPTA A, et al. Chicken viperin inhibits Newcastle disease virus infection in vitro: A possible interaction with the viral matrix protein[J]. Cytokine, 2019, 120: 28-40. DOI:10.1016/j.cyto.2019.04.007 |
| [72] |
BECK S, ZICKLER M, PINHO DOS REIS V, et al. ANP32B deficiency protects mice from lethal influenza A virus challenge by dampening the host immune response[J]. Front Immunol, 2020, 11: 450. DOI:10.3389/fimmu.2020.00450 |
| [73] |
GVNTHER M, BAUER A, MVLLER M, et al. Interaction of host cellular factor ANP32B with matrix proteins of different paramyxoviruses[J]. J Gen Virol, 2020, 101(1): 44-58. |
| [74] |
RAJANI K R, KNELLER E L P, MCKENZIE M O, et al. Complexes of vesicular stomatitis virus matrix protein with host Rae1 and Nup98 involved in inhibition of host transcription[J]. PLoS Pathog, 2012, 8(9): e1002929. DOI:10.1371/journal.ppat.1002929 |
| [75] |
QUAN B L, SEO H S, BLOBEL G, et al. Vesiculoviral matrix (M) protein occupies nucleic acid binding site at nucleoporin pair (Rae1·Nup98)[J]. Proc Natl Acad Sci U S A, 2014, 111(25): 9127-9132. DOI:10.1073/pnas.1409076111 |
| [76] |
BEILSTEIN F, OBIANG L, RAUX H, et al. Characterization of the interaction between the matrix protein of vesicular stomatitis virus and the immunoproteasome subunit LMP2[J]. J Virol, 2015, 89(21): 11019-11029. DOI:10.1128/JVI.01753-15 |
| [77] |
PAN W, SONG D G, HE W Q, et al. EIF3i affects vesicular stomatitis virus growth by interacting with matrix protein[J]. Vet Microbiol, 2017, 212: 59-66. DOI:10.1016/j.vetmic.2017.10.021 |
| [78] |
PEI Z F, BAI Y T, SCHMITT A P. PIV5 M protein interaction with host protein angiomotin-like 1[J]. Virology, 2010, 397(1): 155-166. DOI:10.1016/j.virol.2009.11.002 |
| [79] |
RAY G, SCHMITT P T, SCHMITT A P. Angiomotin-like 1 links paramyxovirus M proteins to NEDD4 family ubiquitin ligases[J]. Viruses, 2019, 11(2): 128. DOI:10.3390/v11020128 |
| [80] |
段云兵. 新城疫病毒基质(M)蛋白生物学功能的初步研究[D]. 南京: 南京农业大学, 2014. DUAN Y B. Preliminary study on biological functions of Newcastle disease virus matrix protein[D]. Nanjing: Nanjing Agricultural University, 2014. |
(编辑 白永平)



