2. 河北北方学院动物科技学院 预防兽医学重点实验室, 张家口 075131;
3. 内蒙古骆驼研究院, 阿拉善 750300
2. Department of Veterinary Medicine, College of Animal Science and Technology, Hebei North University, Zhangjiakou 075131, China.;
3. Inner Mongolia Institute of Camel Research, Alashan 750300, China
随着全球气温升高和现代畜牧业的飞速发展,热应激(heat stress, HS)对动物的影响几乎不可避免,已给养殖业造成了严重的经济损失[1-2]。当机体产生的热量超过其将热量散发到周围环境的能力时,可导致HS的发生,进而促使动物体核温度升高,造成采食量、生产性能和繁殖能力降低,亦会影响肉类和乳制品的产量[3]。研究表明,肝损伤是HS病例中最致命的并发症,也是导致患病动物死亡的直接原因[4-6]。因此,数十年来,HS诱导的肝损伤一直是国内外学者和畜牧业关注的焦点。虽然HS导致肝损伤的机制尚未被完全阐明,但有证据表明其涉及氧化应激(oxidative stress, OS),且提高机体抗氧化能力可缓解HS所致组织损伤[1, 7-8]。因此,增强肝组织的抗氧化能力可能是预防HS所致肝损伤的有效策略。
如上所述,OS参与HS所致肝损伤的机制已被诸多研究证实。当HS引起的体温升高和代谢过度时可引起组织/细胞内活性氧(ROS)的产生增加。在正常生理条件下,ROS水平可被抗氧化防御机制有效控制,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)和谷胱甘肽(GSH)等。抗氧化防御系统可通过限制氧化的速度和进程来保护细胞免受氧化应激[8]。然而,当过量产生的ROS超过机体抗氧化系统处理能力时,就会导致OS。反过来,OS通过破坏细胞成分,如蛋白质、脂质和核酸(DNA和RNA)等,引起细胞内蛋白质羰基化(PCO)、脂质过氧化和DNA突变等不良反应,从而导致氧化损伤[9]。如果OS得不到有效控制,这种反应可进而引起广泛的组织损伤[1]。最近的研究亦证实,ROS的过量产生在HS诱导的肝氧化应激、肝细胞凋亡和坏死过程中发挥了重要作用[4, 8]。因此,应用抗氧化剂干预,已成为应对这一严重并发症的重要策略。
目前,已在HS动物模型中证实,抗氧剂对肝具有保护作用[10-12]。天然抗氧化剂因具有安全、有效和廉价等特性已被用于多种疾病的辅助治疗。骆驼乳清蛋白(camel whey protein, CWP)是一种强大的天然抗氧化剂,可降低ROS生成、提高GSH含量、缓解氧化应激,且其抗氧化活性显著高于牛和其它动物源乳清蛋白[13-15]。此外,CWP虽然和牛乳清蛋白成分相似,均由α-乳白蛋白(α-LA)、乳铁蛋白(LF)、血清白蛋白(SA)、乳过氧化物酶(LPO)、肽聚糖识别蛋白(PGRP)、溶菌酶(LZM)和各种免疫球蛋白(Ig)等组成,但缺乏易引起幼龄动物和婴幼儿过敏反应的β-乳球蛋白(β-LG)[16]。CWP可通过诱导GSH和抗氧化酶的表达降低HS所致氧化应激和组织损伤[7, 16-17]。近年来,关于CWP的研究大多集中在其独特的抗糖尿病作用,且证实CWP可调节氧化应激反应是其治疗糖尿病的重要因素[13]。Ebaid等[18]研究亦表明,CWP可通过激活谷胱甘肽-S-转移酶(GST)缓解肝脂质过氧化,并可通过增加GSH水平抑制肝氧化应激。本课题组前期在体外试验中也证实,经过模拟胃肠消化的CWP可通过激活抗氧化信号通路缓解HS诱导的大鼠肝细胞凋亡和损伤[19]。由此可见,CWP的强抗氧化应激作用使其具有潜在的抗HS所致肝损伤的医用价值。然而,迄今为止还没有研究报道在动物模型中CWP对HS所致肝损伤的影响。因此,本研究侧重于阐明CWP对HS诱导的肝氧化应激和损伤的保护作用,为其临床应用提供科学依据。
1 材料与方法 1.1 药品和试剂CWP由本实验室按先前报道的方法制备并保存[19];组织活性氧(ROS)检测试剂盒(DHE)购自北京百奥莱博科技有限公司;总SOD活性检测试剂盒(WST-8法)、Western blot及IP细胞裂解液、苏木素伊红(HE)染色试剂盒购自上海碧云天生物技术公司;丙二醛(MDA)含量及过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、谷丙转氨酶(ALT)、谷草转氨酶(AST)活性检测试剂盒购自南京建成生物工程研究所;还原型谷胱甘肽(GSH)含量检测试剂盒购自北京索莱宝生物科技有限公司;蛋白定量用Pierce BCA Protein Assay Kit,购自赛默飞世尔科技(中国)有限公司;大鼠维持饲料购自斯贝福(北京)生物技术有限公司。
1.2 试验动物分组及处理36只6周龄SPF级雄性Sprague-Dawley(SD)大鼠购自内蒙古医科大学实验动物中心,实验动物生产许可证编号为SCXK(蒙)2015-0001,实验动物使用许可证编号为SYXK(蒙)2015-0001。SD大鼠试验期间给予标准的实验室饲料及清洁的饮水,于(21±1) ℃,相对湿度60%~75%环境中隔离饲养,室内灯光于每天08:00开启,20:00关闭。将所有大鼠适应性饲养2周后随机分为6组,每组6只。即HS致肝损伤组(HS)、CWP低剂量干预组(L组)、CWP中剂量干预组(M组)、CWP高剂量干预组(H组)、正常对照组(Control)和CWP对照组(CWP)。L、M和H组灌服CWP(CWP溶于1 mL生理盐水,剂量分别为100、200和400 mg·kg-1),Control组和HS组每天灌服1 mL生理盐水,CWP组每天灌服400 mg·kg-1的CWP,连续2周。之后,除Control组和CWP组外,其余各组大鼠均按本实验室前期确定的程序建立HS致大鼠肝损伤模型:将大鼠置于人工气候箱内(温度为(40±0.2) ℃,相对湿度为60%~65%)HS处理2 h(上午10:00~ 12:00),连续处理8 d。每次HS处理结束后,立即将大鼠移出人工气候箱并于初始环境饲养22 h。HS期间,于每次HS处理前1 h灌服上述剂量CWP或生理盐水。
1.3 肝功能生物标志物AST和ALT检测试验结束后采集各组大鼠血液,1 000×g离心15 min分离血清。按试剂盒说明书操作,用Curve Expert 1.4软件绘制标准曲线并计算血清样本中AST和ALT含量。
1.4 HE染色观察肝组织病理学变化试验结束后,将各组大鼠麻醉后处死并采集肝组织。将各大鼠肝组织一部分固定于4%多聚甲醛固定过夜。按常规方法,组织块经石蜡包埋并制成4 μm切片后进行HE染色,观察肝组织病理学变化。剩余大鼠肝组织用预冷PBS冲洗除去血污,于液氮冷冻后置-80 ℃保存,备用。
1.5 检测肝组织ROS及MDA含量按试剂盒说明书操作,采用DHE探针检测ROS含量。取大鼠肝组织50 mg,加入1 mL匀浆缓冲液,充分匀浆后于4 ℃ 1 000×g离心10 min,取上清;采用微量法,于96孔板中依次加入匀浆后的上清190 μL和DHE探针10 μL,混匀;将96孔板于37 ℃避光孵育30 min后用酶标仪检测荧光强度(Synergy H4, BioTek, USA,激发波长488 nm,发射波长610 nm);另取匀浆上清50 μL,采用BCA法测定样品蛋白含量,以每毫克蛋白荧光强度(RFU·mg-1prot)表示ROS含量。按试剂盒说明书操作,检测组织匀浆中MDA含量。
1.6 检测肝组织SOD、CAT及GSH-Px活性取50 mg肝组织,剪碎后加入200 μL Western blot及IP细胞裂解液,充分匀浆后于4 ℃ 12 000×g离心5 min,取上清用BCA法进行蛋白定量,剩余部分进行后续检测。按试剂盒说明书操作,检测组织匀浆中SOD、CAT、GSH及GSH-Px活性。
1.7 数据统计分析所有试验数据均以(Mean±SE)表示,用SPSS 25.0软件的单因素方差分析(one-way ANOVA)和LSD进行组间比较,结果以P < 0.05表示差异显著,P < 0.01表示差异极显著,P < 0.001表示差异极其显著。
2 结果 2.1 CWP对HS大鼠血清肝功能生物标志物的影响HS诱导的肝氧化应激可诱发肝细胞损伤,进而导致肝功能障碍[4]。因此,本研究检测了大鼠血清中肝功能生物标志物ALT和AST水平,以探讨CWP对HS大鼠肝功能的影响。结果显示,HS组大鼠血清ALT(图 1A)和AST(图 1B)水平和Control组相比极显著升高(P < 0.001),表明HS处理对大鼠肝有明显的损伤作用。CWP组大鼠ALT和AST水平和Control组相比差异不显著(P>0.05),表明本研究所用CWP剂量无肝毒性。同时可见,CWP以剂量依赖性方式降低了HS大鼠血清ALT和AST水平,其中H组和HS组相比差异极显著(P < 0.01)。本研究在体内试验中证实,CWP可缓解HS所致肝损伤。
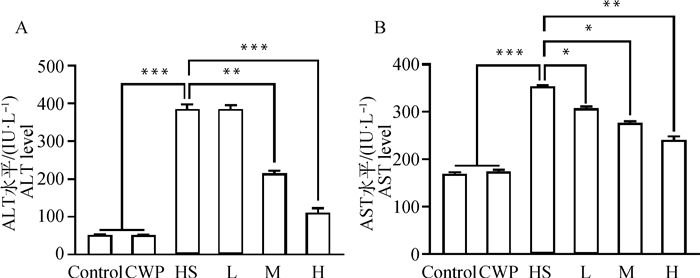
|
A. ALT水平;B. AST水平;*表示P < 0.05,**表示P < 0.01,***表示P < 0.001。Control.正常对照组;CWP.CWP对照组;HS.HS致肝损伤组;L.CWP低剂量干预组;M.CWP中剂量干预组;H.CWP高剂量干预组。下同 A. ALT level; B. AST level; * means P < 0.05, ** means P < 0.01, *** means P < 0.001. Control. control group; CWP. CWP control group; HS. HS-induced liver injury group; L. CWP low-dose intervention group; M. CWP medium-dose intervention group; H. CWP high-dose intervention group. The same as below 图 1 CWP对HS大鼠血清肝功能生物标志物水平的影响 Fig. 1 Effects of CWP on the serum levels of biomarkers for liver function in HS rats |
由图 2可见,Control组和CWP组大鼠肝细胞核圆润位于细胞中央;肝细胞排列呈索状,肝细胞索以中央静脉为中心呈放射状排列;肝血窦间隙大小均匀,未见扩张或萎缩;组织中未见水肿、坏死、炎性细胞浸润等病理变化,组织形态结构正常,表明CWP无肝细胞毒性。HS组大鼠肝组织部分肝小叶中央静脉周围和肝血窦内可见以淋巴细胞为主的炎性细胞弥散性或小灶性浸润(如黑色箭头所示);大量肝细胞水肿和空泡变性,细胞显著肿胀、胞浆淡染,细胞核固缩、深染(如橙色箭头所示)、碎裂(如灰色箭头所示);大量肝细胞脂肪变性,细胞内可见形态规则的圆形空泡(如蓝色箭头所示);部分中央静脉和大量肝血窦内可见充满大量红细胞(如紫色箭头所示)。结合“2.1”数据分析,HS可导致大鼠肝组织发生损伤。然而,重要的是,CWP可以剂量依赖性方式缓解HS诱导的大鼠肝损伤,高剂量组除部分肝小叶汇管区和肝血窦内炎性细胞浸润外,肝组织病理学形态基本恢复正常,表明CWP对HS诱导的大鼠肝损伤有明显的缓解作用。
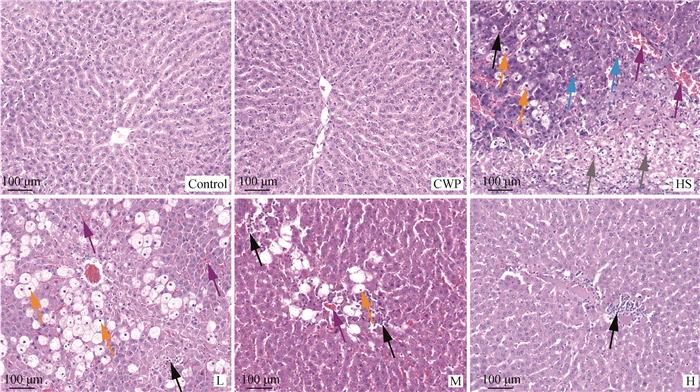
|
黑色箭头.炎性细胞浸润;橙色箭头.肝细胞肿胀和空泡变性;灰色箭头.肝细胞核碎裂;蓝色箭头.肝细胞脂肪变性;紫色箭头.肝小叶中央静脉及肝血窦充满大量红细胞 Black arrow. inflammatory cell infiltration. Orange arrow. hepatocyte swelling and ballooning degeneration. Gray arrow. fragmentation of hepatocyte nuclei. Blue arrow. hepatocyte steatosis. Purple arrow. portal vein dilatation and sinusoidal congestion 图 2 CWP对HS大鼠肝的组织病理学影响 Fig. 2 Effects of CWP treatment on histopathology changes of liver in HS rats |
本研究通过检测肝中ROS和MDA水平,评价了CWP对HS大鼠肝氧化应激的保护作用。结果显示,HS可诱导大鼠肝组织内ROS(图 3A)及脂质过氧化产物MDA水平(图 3B)极显著升高(P < 0.001)。然而,在HS处理前灌服CWP的大鼠肝中ROS和MDA水平显著下降(P < 0.05),且呈剂量依赖性。同时,CWP对正常大鼠肝中ROS和MDA水平无影响(P>0.05)。这些结果表明,CWP可在不引起正常机体氧化应激前提下对HS诱导的大鼠肝氧化应激有明显缓解作用。
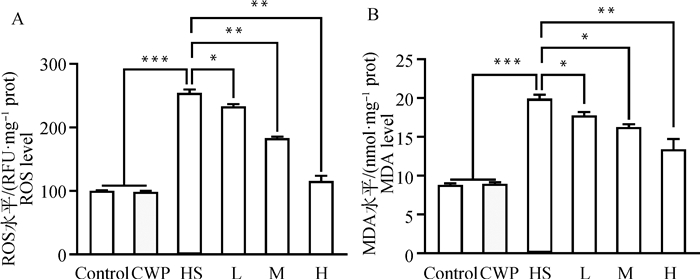
|
图 3 CWP对HS大鼠肝中ROS产生(A)及MDA水平(B)的影响 Fig. 3 Effects of CWP on the production of ROS (A) and the levels of MDA (B) in HS rats |
HS可引起组织中抗氧化酶活性和GSH水平降低,从而导致ROS清除障碍和氧化应激[7]。因此,本研究检测了HS大鼠肝中SOD、CAT、GSH-Px活性及GSH水平。结果显示,HS降低了大鼠肝中SOD(图 4A)、CAT(图 4B)和GSH-Px(图 4C)活性及GSH(图 4D)水平,与对照组相比差异极显著(P < 0.01)。然而,HS处理前灌服CWP的大鼠肝中SOD、CAT、GSH-Px活性及GSH水平均有不同程度升高,且呈剂量依赖性。同时可见,CWP亦可明显增强正常大鼠肝中CAT(P < 0.05)及GSH-Px(P < 0.05)活性。以上结果表明,CWP可通过上调抗氧化剂水平及抗氧化酶活性提高大鼠肝的抗氧化防御能力,从而保护肝组织免受HS引起的氧化损伤。

|
图 4 CWP对HS大鼠肝抗氧化防御系统的影响 Fig. 4 Effects of CWP on hepatic antioxidant defense system in HS rats |
随着全球气温升高和集约化养殖业的发展,热应激(HS)对动物养殖业的危害已不可避免。据报道,肝损伤及肝功能障碍几乎是所有HS病例中最常见且致命的病理变化[4]。虽然HS致肝损伤的机制尚未完全阐明,但有证据表明其涉及氧化应激(oxidative stress, OS)[1, 3, 7, 16]。氧化反应在机体的信号转导中发挥着非常重要的作用,然而,当该反应产生的ROS超过机体抗氧化防御系统处理能力时就会引起组织发生氧化损伤[20]。HS引起的肝损伤和功能障碍也是由OS所介导的[11]。因此,应用抗氧化剂,尤其是安全有效的天然抗氧化剂增强机体抗氧化能力,进而缓解HS所致肝损伤已成为研究热点。乳蛋白通常是通过胃肠消化后释放的各种生物活性肽的前体,越来越受到国内外学者关注。天然蛋白源的生物活性肽作为营养添加剂或治疗药物最大的优点是在体内几乎没有毒副作用[13]。CWP已被证实是一种强大的天然抗氧化剂,且其抗氧化活性优于牛和其他动物源乳清蛋白,这可能是因为它的抗氧化氨基酸含量较高[13]。本课题组前期的体外研究亦表明,水解的CWP可通过增强大鼠肝细胞抗氧化能力缓解HS所致细胞损伤[19]。在此基础上,本研究进一步在体内试验中证实了CWP对HS大鼠肝损伤的保护作用,其机制可能是通过增强肝组织抗氧化防御能力实现的。
本研究观察到, HS大鼠血清ALT和AST水平升高,表明HS可导致大鼠肝功能障碍。ALT主要存在于肝细胞胞浆中,血清中其水平升高提示肝细胞膜受损,膜通透性增加。AST主要分布在肝细胞的胞浆和线粒体中,血清中其水平升高表明这些细胞器受损[21]。先前有报道称,驼乳可通过降低这些肝功能生物标志物水平改善酒精性肝损伤,但没有明确CWP的作用[22],本研究发现,HS大鼠肝功能生物标志物水平显著升高,表明肝细胞及肝功能已明显受损,而CWP可显著降低ALT和AST水平。另外,本研究发现,HS大鼠肝组织病理学变化与肝功能生物标志物水平一致,说明,暴露于HS环境可显著破坏大鼠肝组织结构,表现为大量肝细胞水肿和空泡变性,核固缩、碎裂及溶解,炎性细胞浸润,中央静脉及肝血窦充满大量红细胞等,这些病理改变与近期的另一项研究一致,在该研究中,暴露于HS的大鼠肝组织显示肝细胞肿胀、空泡变性、坏死、炎性浸润及出血[4]。而本研究发现,HS前用CWP进行干预的大鼠,肝损伤程度明显降低。总之,本研究首次提供了进一步证据,证明驼乳的主要成分CWP具有潜在的抗HS所致肝功能障碍及损伤作用。
如前所述,HS诱导的OS,尤其是过量的自由基,如ROS,可通过靶向各种大分子,包括蛋白质、脂质和DNA,诱导肝细胞损伤并导致肝功能障碍[23]。MDA是多不饱和脂肪酸脂质过氧化的产物,也是衡量机体氧化应激水平的常用生物标志物[24]。本研究中观察到,HS显著增加了大鼠肝细胞ROS和MDA水平,而CWP降低了ROS及MDA水平,且呈剂量依赖性,这也是最终缓解了HS所致肝损伤及功能障碍的重要原因。先前的报道表明,水解的CWP含有可有效清除自由基的生物活性肽,因此可作为治疗氧化应激相关疾病的营养品或治疗肽[25]。针对氧化应激疾病,机体组织/细胞已经进化出防御系统,包括GSH、SOD、CAT、GSH-Px等,从而控制OS的进程,保护组织细胞免受氧化损伤。其中,GSH是抗线粒体功能障碍和凋亡的关键抗氧化剂,其水平失衡可能会破坏氧化还原稳态。SOD、CAT、GSH-Px是控制ROS水平重要的抗氧化酶,通过清除自由基参与抗氧化防御,从而限制氧化的速度和进程,最终保护细胞免受氧化损伤[9]。各种应激因素会降低抗氧化防御系统功能,本研究中亦显示,HS显著降低了SOD、CAT、GSH-Px活性及GSH水平,这是HS导致肝发生氧化应激的重要因素。本研究发现,HS前补充CWP的大鼠肝中GSH水平及SOD、CAT、GSH-Px活性均明显恢复。之前的研究表明,与单独喂食被黄曲霉毒素污染饲料的动物相比,日粮补充CWP可恢复肝及睾丸中的抗氧化酶活性和GSH水平[13]。另一项研究表明,CWP可通过激活GSH-S-转移酶减少肝脂质过氧化并增加GSH水平来控制氧化应激[18]。本课题组前期研究亦显示,水解的CWP可通过增强抗氧化酶活性降低HS诱导的大鼠肝细胞损伤[19]。这些数据表明,增强肝的抗氧化能力可改善各种应激因素引起的肝损伤。另外,本研究显示,CWP可明显增强正常大鼠肝中CAT及GSH-Px活性,表明了其可作为营养性添加剂的潜力。总之,这些结果提示,膳食补充CWP可以提高大鼠肝的抗氧化能力,从而缓解HS诱导的氧化损伤。
4 结论综上所述,补充CWP可缓解HS所致大鼠肝损伤,其机制可能是提高了肝中GSH水平及SOD、CAT、GSH-Px等抗氧化酶活性,进而有效地缓解了ROS介导的氧化应激,也为CWP作为一种营养性添加剂抵御高温环境引起的肝氧化损伤提供了科学依据。
| [1] |
AKBARIAN A, MICHIELS J, DEGROOTE J, et al. Association between heat stress and oxidative stress in poultry; mitochondrial dysfunction and dietary interventions with phytochemicals[J]. J Anim Sci Biotechnol, 2016, 7: 37. DOI:10.1186/s40104-016-0097-5 |
| [2] |
LARA L J, ROSTAGNO M H, et al. Impact of heat stress on poultry production[J]. Animals (Basel), 2013, 3(2): 356-369. |
| [3] |
RAMADAN N K, BADR G, ABDEL-TAWAB H S, et al. Camel whey protein enhances lymphocyte survival by modulating the expression of survivin, bim/bax, and cytochrome C and restores heat stress-mediated pathological alteration in lymphoid organs[J]. Iran J Basic Med Sci, 2018, 21(9): 896-904. |
| [4] |
GENG Y, MA Q, LIU Y N, et al. Heatstroke induces liver injury via IL-1β and HMGB1-induced pyroptosis[J]. J Hepatol, 2015, 63(3): 622-633. DOI:10.1016/j.jhep.2015.04.010 |
| [5] |
WEIGAND K, RIEDIGER C, STREMMEL W, et al. Are heat stroke and physical exhaustion underestimated causes of acute hepatic failure?[J]. World J Gastroenterol, 2007, 13(2): 306-309. DOI:10.3748/wjg.v13.i2.306 |
| [6] |
HASSANEIN T, RAZACK A, GAVALER J S, et al. Heatstroke: its clinical and pathological presentation, with particular attention to the liver[J]. Am J Gastroenterol, 1992, 87(10): 1382-1389. |
| [7] |
BADR G, ABDEL-TAWAB H S, RAMADAN N K, et al. Protective effects of camel whey protein against scrotal heat-mediated damage and infertility in the mouse testis through YAP/Nrf2 and PPAR-gamma signaling pathways[J]. Mol Reprod Dev, 2018, 85(6): 505-518. |
| [8] |
SLIMEN I B, NAJAR T, GHRAM A, et al. Reactive oxygen species, heat stress and oxidative-induced mitochondrial damage[J]. Int J Hyperthermia, 2014, 30(7): 513-523. DOI:10.3109/02656736.2014.971446 |
| [9] |
CORROCHANO A R, BUCKIN V, KELLY P M, et al. Invited review: Whey proteins as antioxidants and promoters of cellular antioxidant pathways[J]. J Dairy Sci, 2018, 101(6): 4747-4761. DOI:10.3168/jds.2017-13618 |
| [10] |
WILL J S, SNYDER C J, WESTERFIELD K L, et al. N-acetylcysteine (NAC) for the prevention of liver failure in heat injury-mediated ischemic hepatitis[J]. Mil Med, 2019, 184(9-10): 565-567. DOI:10.1093/milmed/usz022 |
| [11] |
SONG J H, KIM K J, CHEI S, et al. Korean red ginseng and Korean black ginseng extracts, JP5 and BG1, prevent hepatic oxidative stress and inflammation induced by environmental heat stress[J]. J Ginseng Res, 2020, 44(2): 267-273. DOI:10.1016/j.jgr.2018.12.005 |
| [12] |
SAHIN K, ORHAN C, AKDEMIR F, et al. Resveratrol protects quail hepatocytes against heat stress: modulation of the Nrf2 transcription factor and heat shock proteins[J]. J Anim Physiol Anim Nutr (Berl), 2012, 96(1): 66-74. DOI:10.1111/j.1439-0396.2010.01123.x |
| [13] |
BADR G, RAMADAN N K, SAYED L H, et al. Why whey?Camel whey protein as a new dietary approach to the management of free radicals and for the treatment of different health disorders[J]. Iran J Basic Med Sci, 2017, 20(4): 338-349. |
| [14] |
ELAGAMY E I. Effect of heat treatment on camel milk proteins with respect to antimicrobial factors: a comparison with cows' and buffalo milk proteins[J]. Food Chem, 2000, 68(2): 227-232. DOI:10.1016/S0308-8146(99)00199-5 |
| [15] |
MIHIC T, RAINKIE D, WILBY K J, et al. The therapeutic effects of camel milk: a systematic review of animal and human trials[J]. J Evid Based Complementary Altern Med, 2016, 21(4): NP110-NP126. DOI:10.1177/2156587216658846 |
| [16] |
BADR G, RAMADAN N K, ABDEL-TAWAB H S, et al. Camel whey protein protects lymphocytes from apoptosis via the PI3K-AKT, NF-κB, ATF-3, and HSP-70 signaling pathways in heat-stressed male mice[J]. Biochem Cell Biol, 2018, 96(4): 407-416. DOI:10.1139/bcb-2017-0217 |
| [17] |
ABDEL-AZIEM S H, HASSAN A M, ABDEL-WAHHAB M A, et al. Dietary supplementation with whey protein and ginseng extract counteracts oxidative stress and DNA damage in rats fed an aflatoxin-contaminated diet[J]. Mutat Res, 2011, 723(1): 65-71. DOI:10.1016/j.mrgentox.2011.04.007 |
| [18] |
EBAID H, AHMED O M, MAHMOUD A M, et al. Limiting prolonged inflammation during proliferation and remodeling phases of wound healing in streptozotocin-induced diabetic rats supplemented with camel undenatured whey protein[J]. BMC Immunol, 2013, 14(1): 31. DOI:10.1186/1471-2172-14-31 |
| [19] |
DU D H, LV W T, SU R N, et al. Hydrolyzed camel whey protein alleviated heat stress-induced hepatocyte damage by activated Nrf2/HO-1 signaling pathway and inhibited NF-κB/NLRP3 axis[J]. Cell Stress Chaperones, 2021, 26(2): 387-401. DOI:10.1007/s12192-020-01184-z |
| [20] |
COSENTINO-GOMES D, ROCCO-MACHADO N, MEYER-FERNANDES J R, et al. Cell signaling through protein kinase C oxidation and activation[J]. Int J Mol Sci, 2012, 13(9): 10697-10721. DOI:10.3390/ijms130910697 |
| [21] |
LI C N, LAN M, LV J W, et al. Screening of the hepatotoxic components in Fructus gardeniae and their effects on rat liver BRL-3A Cells[J]. Molecules, 2019, 24(21): 3920. DOI:10.3390/molecules24213920 |
| [22] |
KORISH A A, ARAFAH M M, et al. Camel milk ameliorates steatohepatitis, insulin resistance and lipid peroxidation in experimental non-alcoholic fatty liver disease[J]. BMC Complement Altern Med, 2013, 13(1): 264. DOI:10.1186/1472-6882-13-264 |
| [23] |
XU D W, XU M, JEONG S, et al. The role of Nrf2 in liver disease: novel molecular mechanisms and therapeutic approaches[J]. Front Pharmacol, 2018, 9: 1428. |
| [24] |
HE S S, GUO Y H, ZHAO J X, et al. Ferulic acid protects against heat stress-induced intestinal epithelial barrier dysfunction in IEC-6 cells via the PI3K/Akt-mediated Nrf2/HO-1 signaling pathway[J]. Int J Hyperthermia, 2018, 35(1): 112-121. DOI:10.1080/02656736.2018.1483534 |
| [25] |
IBRAHIM H R, ISONO H, MIYATA T, et al. Potential antioxidant bioactive peptides from camel milk proteins[J]. Anim Nutr, 2018, 4(3): 273-280. DOI:10.1016/j.aninu.2018.05.004 |
编辑 范子娟



