2. 中国农业科学院饲料研究所 农业农村部饲料生物技术重点实验室, 北京 100081
2. Key Laboratory of Feed Biotechnology of Ministry of Agriculture and Rural Affairs, Feed Research Institue, Chinese Academy of Agricultural Sciences, Beijing 100081, China
乳酸链球菌素(nisin)是一种主要抑制革兰阳性菌的小分子多肽类羊毛硫细菌素,由34个氨基酸组成,分子量为3.5 ku。早在1969年,nisin就被联合国粮食及农业组织(FAO)和世卫组织(WHO)批准作为食品添加剂。截至目前,nisin仍在防控食品微生物污染中作为常用添加剂,是现在研究较为透彻且最为商业化的细菌素[1],但此前有报道称,将其替代抗生素应用于肉鸡生产中也取得了良好效果[2-3]。本课题组前期体外研究结果表明,适宜浓度的nisin和莫能菌素处理均可以改变瘤胃发酵类型,增加丙酸摩尔浓度,但与莫能菌素处理相比,nisin能在显著抑制甲烷生成的同时而不影响饲料消化率[4]。通过进一步微生物组学分析发现,造成莫能菌素处理组中瘤胃干物质消化率显著降低而nisin处理组没有显著影响的原因与瘤胃功能菌群数量及多样性的变化密切相关[5]。然而,体外模拟瘤胃发酵的底物含量及微生物数量比实际瘤胃内环境低很多[6],考虑到体内外试验条件的差异,还需进一步开展体内的动物饲养试验来对nisin通过调控瘤胃微生物改善瘤胃发酵的有效性进行验证。
近年来, 随着畜牧业不断发展,家畜与人类对食物的竞争不断加大,降低饲料中人类可食用成分的比例有助于缓解我国人畜争粮的矛盾,而非常规饲料的应用则一定程度上缓解了这种压力,De Evan等[7]使用干玉米酒精糟及其可溶物(DDGS)等非常规饲料代替羔羊饲料中44%的精料,发现饲料中人类可直接食用成份下降了27.7%。DDGS是玉米等谷物经酵母和酶发酵生产乙醇后的工业副产品,具有高蛋白、高脂肪、高能量及低成本的特点[8],且随着近十年来我国DDGS产量稳步增多(增幅达108.8%[9]),其作为豆粕(soybean meal,SBM)替代物来缓解我国饲料蛋白资源紧缺也是一种潜在手段。本课题组前期饲养试验结果表明,DDGS替代全部豆粕和部分玉米并未对育肥期湖羊的生长性能产生不利影响[10]。然而,此前关于DDGS对瘤胃微生物影响的研究主要集中于奶牛和肉牛[11-13],对育肥期湖羊瘤胃微生物的研究鲜有报道。日粮变化影响瘤胃微生物菌群结构[14-15],而微生物对宿主代谢稳态也起到关键作用[16]。因此,了解营养调控措施对微生物的影响以及微生物与宿主之间的互作关系,对于提高动物生产性能具有重要意义。本研究假定,不同蛋白源日粮添加nisin对育肥湖羊瘤胃发酵及微生物菌群结构会产生影响,并应用Illumina Miseq测序及Real-time qPCR等技术对其进行探究,旨在为DDGS替代豆粕作为日粮蛋白源以及nisin替代抗生素在反刍动物生产中的应用提供更多的理论依据。
1 材料与方法 1.1 试验材料试验所用nisin(浙江某生物工程公司)标准品组成:2.5% nisin、77.5% NaCl和20%脱脂奶粉;活性:≥1×106 IU·g-1;产品批号:150514。Nisin在本试验中的添加量是基于申军士等[4]体外研究结果而定,添加30.5 mg·kg-1DM(假定试验动物干物质采食量(dry matter intake, DMI)=1 150 g·d-1,且瘤胃容积约为5 L)nisin在湖羊瘤胃中浓度约为2 μmol·L-1。
1.2 试验设计及日粮配方试验采用2×2因子设计,两因子分别为蛋白源[豆粕、DDGS]和nisin(添加水平为0或30.5 mg·kg-1 DM),两两组合,配制4种等氮等能日粮:豆粕日粮(豆粕=12% DM日粮)、豆粕日粮中添加30.5 mg·kg-1DM nisin、DDGS日粮(DDGS=20% DM日粮)、DDGS日粮中添加30.5 mg·kg-1DM nisin。豆粕与DDGS的粗蛋白、中性洗涤纤维、酸性洗涤纤维和粗脂肪含量(干物质基础百分比)分别为:50.1%和30.9%,17.3%和37.5%,9.0%和18.3%,3.1%和12.7%[10]。参照中华人民共和国农业部发部的肉羊饲养标准(2004)营养需要配制各组日粮,DDGS替代了日粮中所有的豆粕和部分玉米粉料,具体日粮配方及营养水平与本课题组此前同批动物饲养试验一致[10]。
32只体重为(23±2.0)kg的湖羊公羔采取2×2析因随机区组试验设计,根据体重分为2个区组(低体重组,16只;高体重组,16只),每个区组的湖羊随机分配到4个组,单栏饲养。每组随机分配到4种不同日粮处理,整个试验期共10周(包括1周适应期和9周正式试验期),每日7:00和19:00饲喂全混合日粮(TMR),保证剩料率在5%~10%,自由饮水。在正式试验期结束时,从各处理组中随机选取6只(低体重组,3只;高体重组,3只)湖羊(共24只)进行屠宰取样。
1.3 样本采集在正式试验开始及第9周时连续3 d于晨饲前准确称量每只羊的体重,数据用于试验湖羊平均日增重(ADG)的计算。ADG=(末期平均体重-初始平均体重)/时间间隔。
在试验期结束前2 h,各试验组湖羊于晨饲后4~6 h进行屠宰。屠宰后,将瘤胃沿底部中线剪开并立即把内容物取出分装。一份瘤胃内容物样品直接置于10 mL离心管中,然后置于-20 ℃保存,用于瘤胃内容物DNA提取。一份内容物样品参照申军士等[4]的方法经四层纱布过滤,滤液立即用便携式pH计(Ecoscan pH 5, Eutech Instruments, 新加坡)测量瘤胃液pH,剩余内容物再分装两份,-20 ℃保存。参照申军士等[4]的方法处理样品后使用气相色谱仪(7890A,安捷伦,英国)测定挥发性脂肪酸(volatile fatty acid, VFA);参照Chaney和Marbach[17]的比色法测定氨态氮浓度。
取出瘤胃,移除瘤胃内容物后用生理盐水将瘤胃壁冲洗干净称重并记录(瘤胃重),最后称量湖羊胴体重并计算屠宰率。屠宰率=胴体重/屠体重×100%。
1.4 瘤胃内容物DNA提取瘤胃内容物样品解冻后,参照Dai等[18]的方法,经十六烷基三甲基溴化铵(CTAB)、bead-beating和DNA提取液(酚-氯仿-异戊醇)处理后,提取瘤胃内容物中微生物的总DNA。DNA提取物首先采用1.2%(w/v)琼脂糖凝胶电泳并经GoldviewTM(SaiBaiSheng,上海)染色后直观检测DNA质量,再经NanoDrop 2000c分光光度计(Thermo Fisher Scientific,美国)测定DNA浓度(ng·μL-1)以及260 nm与280 nm OD比值(1.8~2.0)。DNA样品-20 ℃保存。
1.5 瘤胃内容物Real-time PCR定量参照申军士等[4]的方法构建20 μL反应体系(10 μL SYBR GREEN、0.4 μL ROX、0.4 μL引物F、0.4 μL引物R、6.8 μL双蒸水、2 μL DNA模板),使用ABI7500 Real-time PCR仪对瘤胃内容物中的总菌[19]、真菌[19]、原虫[20]、甲烷菌[21]、斯氏梭菌[22](Clostridium sticklandii)和Clostridium aminophilum[22]进行定量分析。分别以总菌、C. sticklandii和C. aminophilum的16S rRNA基因,以真菌和原虫的18S rRNA基因,以甲烷菌的甲基辅酶M还原酶(mcrA)基因构建质粒并以此作为模板制作各目标菌定量的标准曲线。
1.6 瘤胃细菌Illumina-MiSeq测序选取细菌通用V3-V4可变区域为目的片段,对瘤胃内容物细菌DNA进行PCR扩增。在扩增过程中引入不同样本的接头Barcode(8 bp碱基序列)和测序引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。扩增完成后,采用2%琼脂糖凝胶电泳检测PCR产物,检验合格后使用AxyPrepDNA凝胶提取试剂盒(Axygen Biosciences,美国)提取和纯化预期条带,随后使用QuantiFluor®dsDNA试剂盒(Promega, 美国)对DNA纯化物进行质量检测。在Illumina-MiSeq平台上,按要求将不同样本的扩增产物按等比例混合并测序。测序完成后,所有数据按如下过程处理:原始fastq数据去除barcode和引物序列,使用QIIME 1.9.1软件进行质量过滤及片段拼接。使用UPARSE(版本7.1)以97% 的序列相似性截断对操作分类单元(OTUs)进行重新聚类,并运用UCHIME算法识别和删除可能嵌合的序列。选定每个OTU中最丰富的序列为代表序列,然后基于SILVA数据库(版本128)进行分类比对,并使用FastTree软件构建系统发育树。采用QIIME1.9.1软件计算覆盖度、丰富度及多样性指数。
1.7 数据分析使用相似性分析(ANOSIM)对不同主因素间瘤胃细菌PCoA分析差异显著性进行统计;对瘤胃功能菌群实时定量PCR数据进行对数转换以提高其正态性;使用SAS软件(Vsrsion 9.4)进行残差分析用于确定不同统计数据是否需要转换,然后使用SAS混合模型(Mixed)对湖羊屠宰性能指标、瘤胃发酵参数、瘤胃功能菌群数量、瘤胃细菌α多样性以及瘤胃细菌门和属水平的相对丰度等进行统计分析,其中蛋白源、nisin、蛋白源×nisin(Pro×Nis)为模型固定效应,区组、羊(Pro×Nis)为随机效应。使用Kenward Roger选项计算自由度,P < 0.05表示差异显著。
2 结果 2.1 屠宰性能变化由表 1可知,日粮蛋白源与nisin对湖羊屠宰性能指标(平均日增重、胴体重、屠宰率及瘤胃重量)没有交互作用(P≥0.24)。DDGS替代豆粕作为蛋白源(P≥0.18)以及日粮添加nisin(P≥0.08)均不影响湖羊屠宰性能。
|
|
表 1 不同日粮蛋白源添加nisin对育肥湖羊屠宰性能的影响 Table 1 Effect of different dietary protein sources and nisin on slaughter performance in fattening Hu sheep |
由表 2可知,日粮蛋白源与nisin添加对育肥湖羊瘤胃发酵参数没有交互作用(P≥0.27);使用DDGS替代豆粕作为蛋白源会显著降低湖羊瘤胃中氨态氮(P < 0.05)、乙酸(P < 0.05)及总支链脂肪酸(Branch-chain VFA, BCVFA)(P < 0.05)的浓度;日粮添加nisin对湖羊瘤胃发酵参数无显著影响(P≥0.11)。
|
|
表 2 不同日粮蛋白源添加nisin对育肥湖羊瘤胃发酵参数的影响 Table 2 Effect of different dietary protein sources and nisin on rumen fermentation characteristics in fattening Hu sheep |
由表 3可知,日粮蛋白源与nisin对育肥湖羊瘤胃功能菌群数量不存在交互作用(P≥0.42);使用DDGS替代豆粕会显著降低育肥湖羊瘤胃中原虫及C. aminophilum数量(P < 0.05),而瘤胃总菌、真菌及甲烷菌的数量无显著差异(P≥0.053);日粮添加nisin对瘤胃功能菌群的数量并无显著影响(P≥0.09)。各处理组中并未检测到有C. sticklandii的存在。
|
|
表 3 不同日粮蛋白源添加nisin对育肥湖羊瘤胃功能菌群数量的影响 Table 3 Effect of different dietary protein sources and nisin on ruminal microbial populations in fattening Hu sheep |
由表 4可知,在育肥湖羊瘤胃细菌α多样性各指标中,日粮蛋白源与nisin没有交互作用(P≥0.08);日粮使用DDGS替代豆粕作为蛋白源的ACE和Chao1指数显著升高(P < 0.05),而对Shannon指数无显著影响(P=0.41);日粮添加nisin不显著影响瘤胃细菌的α多样性(P≥0.06)。
|
|
表 4 不同日粮蛋白源添加nisin对育肥湖羊瘤胃细菌菌群α多样性的影响 Table 4 Effect of different dietary protein sources and nisin on rumen bacterial α diversity in fattening Hu sheep |
基于Bary-Curtis距离算法的主坐标分析(PCoA)结果见图 1。结果表明,不同日粮蛋白源对育肥湖羊瘤胃细菌组成并未有显著影响(P=0.16),而日粮添加乳酸链球菌素具有改变瘤胃细菌群β多样性的趋势(P=0.055)。
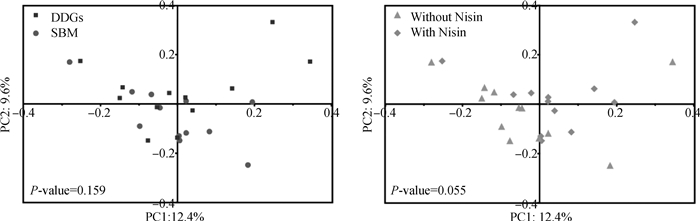
|
图 1 不同日粮蛋白源以及nisin对育肥湖羊瘤胃细菌菌群影响的PCoA分析 Fig. 1 PCoA analysis of fattening Hu sheep rumen bacterial diversity affected by different dietary protein sources and nisin |
不同处理组瘤胃细菌门水平相对丰度见表 5。瘤胃内容物中的细菌主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、螺旋菌门(Spirochaetae)、放线菌门(Actinobacteria)、纤维菌门(Fibrobacteres)、变形菌门(Proteobacteria)组成。各处理组优势菌门均为Bacteroidetes(45.58%~50.61%)和Firmicutes(45.37%~48.89%),二者相对丰度占瘤胃菌群的94.47%及以上;日粮蛋白源与nisin对育肥湖羊瘤胃细菌门水平相对丰度没有交互作用(P≥0.17);日粮蛋白源与添加nisin均不影响瘤胃细菌门水平相对丰度(P≥0.14)。
|
|
表 5 不同日粮蛋白源添加nisin对育肥湖羊瘤胃细菌门水平相对丰度(至少一个处理相对丰度>0.5%)的影响 Table 5 Effect of different dietary protein sources and nisin on relative abundance of rumen bacteria at phylum level (each with a relative abundance > 0.5% in at least one treatment) in fattening Hu sheep |
不同处理组瘤胃细菌属水平相对丰度见图 2。各处理组的主要优势菌属均为Prevotella 1:(23.78%~33.33%)、Christensenellaceae R-7 group(12.14~13.93%)和Ruminococcaceae NK4A214 group(5.73~7.84%)。试验结果表明,对于瘤胃Ruminococcaceae NK4A214 group和Unclassified Bacteroidetes相对丰度来说,日粮蛋白源与nisin存在交互作用(P < 0.05), Unclassified Bacteroidetes的相对丰度在SBM-nisin组中最高;日粮使用DDGS替代豆粕作为蛋白源Butyrivibrio 2和Ruminococcaceae UCG-005的相对丰度显著降低(P < 0.05),而Pseudobutyrivibrio和Roseburia的相对丰度显著增加(P < 0.05);日粮添加nisin对育肥湖羊瘤胃细菌属水平相对丰度没有显著影响(P≥0.06)。
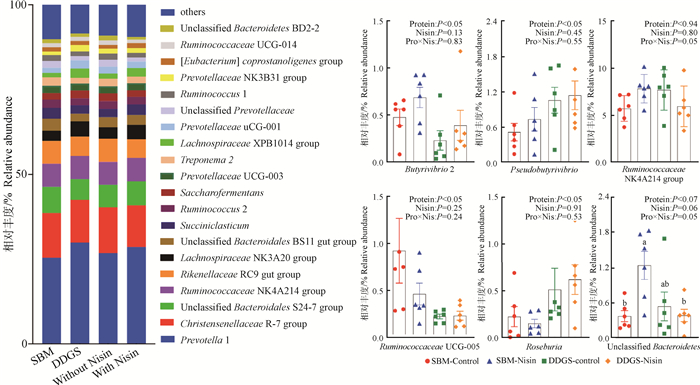
|
左图为瘤胃细菌属水平相对丰度柱状图(至少有一组相对丰度>1%);右图柱状图为瘤胃细菌属水平在蛋白源、nisin或二者交互作用具有显著差异的所有菌属(至少有一组相对丰度>0.5%);Pro×Nis表示蛋白源与乳酸链球菌素的交互作用 The figure on the left shows the of relative abundance of rumen bacteria at genus level in the rumen (each with a relative abundance >1% in at least one treatment). The right figure shows all rumen bacteria at genus level with significant differences in protein source, nisin, or interaction between the two (each with a relative abundance >0.5% in at least one treatment). Pro×Nis is the interaction of protein and nisin 图 2 不同日粮蛋白源添加nisin对育肥湖羊瘤胃细菌属水平的影响 Fig. 2 Effect of different dietary protein sources and nisin on relative abundance of rumen bacteria at genus level in fattening Hu sheep |
Nisin在反刍动物瘤胃调控中的体内试验研究报道较少,但是对单胃动物(主要集中在肉鸡上)肠道菌群及发酵参数的影响研究已有诸多报道[2-3, 23]。Kierończyk等[3]对400只雌鸡回肠内容物进行qPCR分析,结果表明,日粮补充nisin的肉鸡回肠内拟杆菌属——普雷沃氏菌属蔟(Bacteroides-Prevotella cluster)以及肠杆菌科(Enterobacteriaceae)等潜在致病菌的数量显著降低,引起了消化道菌群的显著变化。Józefiak等[23]发现,nisin可以显著降低肉鸡回肠中短链脂肪酸(SCFA)的浓度,以及拟杆菌属(Bacteroides)和肠杆菌科(Enterobacteriacae)的数量。本课题组前期体外模拟瘤胃发酵的研究成果表明,nisin的添加显著影响了瘤胃发酵参数,通过选择性抑制瘤胃中甲烷菌的方式来减少甲烷的生成,莫能菌素的添加会降低DM消失率但nisin不影响[4-5]。通过进一步微生物组学分析发现nisin对瘤胃DM消化率没有影响的原因与瘤胃功能菌群数量与多样性的变化密切相关[5]。在本研究中,日粮添加30.5 mg·kg-1DM nisin不影响育肥湖羊屠宰性能及瘤胃发酵参数,并且对瘤胃微生物区系影响很小,与先前体外研究成果不一致[4-5]。此前有研究报道,体外模拟瘤胃试验中底物含量以及微生物的数量(包括细菌、真菌、原虫等)远低于实际瘤胃内环境[6, 24],这说明体外试验的结果不能简单的推导到体内。因此推测,本研究中nisin未达到预期效果可能是添加剂量不足导致。除剂量问题外,乳酸链球菌素作为一种肽类物质其活性在复杂的瘤胃内环境中是否能保持稳定也值得思考,有研究报道称,乳酸链球菌素的稳定性取决于其所处环境和环境中酶的性质[25]。瘤胃是一个复杂的动态生态系统,其中栖息的种类繁多的微生物可以分泌多种活性酶,如淀粉酶、纤维素酶、蛋白酶等,从而协助宿主降解日粮中营养物质,据此推测,乳酸链球菌素的活性可能在复杂瘤胃代谢过程中受到限制,因此,并未对湖羊瘤胃中微生物区系造成预期的影响。此外,nisin对育肥湖羊瘤胃发酵及菌群结构的影响也可能与试验动物品种、试验周期的长短等不同有关,后续还需更多体内试验对nisin的有效性进行验证。
3.2 不同日粮蛋白源对育肥湖羊屠宰性能及瘤胃发酵参数的影响本研究发现,使用DDGS替代豆粕作为日粮蛋白源对育肥湖羊的屠宰性能没有显著影响,与前期饲养试验生长性能结果相一致[10]。Huls等[26]报道称,使用与本研究相同剂量的DDGS(20%)替代豆粕饲喂育肥绵羊也未对动物生长性能产生影响。Felix等[27]此前的一项研究表明,日粮添加20% DDGS并不会影响羔羊的生长性能,但是当添加剂量达到40%和60%时,羔羊的生长性能降低。据上述结果推测,DDGS的添加水平可能是导致DDGS对育肥绵羊生长性能产生差异的主要原因。
本研究发现,DDGS替代豆粕作为日粮蛋白源导致育肥期湖羊瘤胃中乙酸浓度显著降低,但丙酸浓度基本不变,此结果与本课题组之前所报道的结果相似[10]。淀粉会在瘤胃嗜淀粉拟杆菌(Bacteroides amylophilus)、栖瘤胃杆菌(Bacteroides ruminicola)等细菌的作用下迅速水解为麦芽糖和葡萄糖,进而发酵转化为丙酮酸,随后丙酮酸再分别转化为宿主可吸收利用的乙酸、丙酸、丁酸等短链脂肪酸[7],但是DDGS中的淀粉大多数在工业生产过程中被转化为了酒精。本研究中,DDGS基础日粮中玉米粉料含量低于豆粕基础日粮,这可能是导致饲喂DDGS的湖羊瘤胃中VFA浓度降低的主要原因。此前,Benchaar等[28]也发现,当DDGS的饲喂量从DM的0%增加到30%时,奶牛瘤胃中总VFA含量从99.3 mmol·L-1线性下降到91.1 mmol·L-1。本研究还发现,饲喂DDGS的湖羊瘤胃中氨态氮浓度显著低于饲喂豆粕湖羊,这可能归因于豆粕中蛋白质比DDGS中蛋白质更易消化。DDGS与豆粕相比含有较高的过瘤胃蛋白,更低的瘤胃可降解性会导致肽降解以及氨基酸脱氨基作用减少,进而减少氨态氮在瘤胃内的生成[28]。BCVFA主要来源于氨基酸的脱氨基作用[22],本研究中BCVFA浓度降低也证实了这一观点。
3.3 不同日粮蛋白源对育肥湖羊瘤胃微生物的影响本研究发现,DDGS替代豆粕作为日粮蛋白源后导致瘤胃中原虫以及C. aminophilum的数量显著降低。原虫是瘤胃中重要的脱氨基产氨微生物,主要通过吞噬细菌以获得氮源进而合成自身氨基酸[29]。有研究发现,瘤胃中原虫被去除后氨态氮浓度下降了26%,这可能归因于缺少原虫的情况下菌体蛋白以及饲料蛋白在瘤胃中可降解性降低[29]。瘤胃中高效产氨菌是一类具有极强氨基酸脱氨基活性和特异性的细菌,其数量虽少却占瘤胃总产氨能力的35%~50%[30]。C. aminophilum与C. sticklandii是由Paster等[31]于1988年从奶牛瘤胃中首先分离出的革兰阳性高效产氨菌。在本研究中,C. aminophilum的数量显著降低,其与原虫数量的降低可能是导致饲喂DDGS的湖羊瘤胃中氨态氮浓度降低的主要原因。有研究者在去除瘤胃原虫的反刍动物中观察到瘤胃VFA浓度降低,证明原虫在瘤胃内饲料降解以及VFA生成中发挥重要作用[29],这也与本研究中饲喂DDGS的湖羊瘤胃中原虫数量降低且总VFA浓度下降的结果相符合。
前人研究发现,使用19.5%或20%的DDGS替代豆粕作为肉牛日粮蛋白源并不会显著影响瘤胃细菌多样性及组成[11-12],与本课题组前期在湖羊上的研究结果相一致。而Ramirez等[13, 32]发现,当日粮中DDGS的添加比例增加到DM基础的30%和50%时,瘤胃细菌的结构发生了显著变化,这说明日粮添加过高剂量的DDGS对瘤胃细菌可能会产生较大影响。本研究中各处理组优势菌门均为Bacteroidetes和Firmicutes,二者占总瘤胃细菌菌群的94.47%~96.13%,DDGS替代豆粕作为日粮蛋白源并未改变湖羊瘤胃细菌菌群门水平相对丰度。本研究发现使用DDGS替代豆粕作为蛋白源在湖羊瘤胃细菌属水平上对Ruminococcaceae UCG-005、Butyrivibrio、Pseudobutyrivibrio和Roseburia产生了显著影响。此前,本课题组的饲养试验发现, DDGS替代豆粕后增加了日粮中的粗脂肪含量[10],而玉米DDGS原料粗脂肪中不饱和脂肪酸比例高,易氧化变质,对动物健康及畜产品品质造成不利影响[33]。前人研究表明,不饱和脂肪酸浓度升高会对瘤胃内微生物造成更大压力[34],因此推测,Butyrivibrio 2和Ruminococcaceae UCG-005可能对瘤胃中不饱和脂肪酸更为敏感,导致其相对丰度显著降低。此外,有报道称,Roseburia是一种可净利用乙酸的糖酵解菌[35],本研究中,其相对丰度显著升高可能与饲喂DDGS的湖羊瘤胃中的乙酸浓度变化相关。此外,DDGS由于其本身营养物质丰富,储存过程中如果受潮容易滋生霉菌,产生多种霉菌毒素(如脱氧雪腐镰刀菌烯醇,烟曲霉毒素及玉米赤霉烯酮等)[36],本研究中瘤胃细菌相对丰度的变化也可能与DDGS原料中霉菌毒素的含量相关。虽然不同日粮蛋白源如何影响瘤胃微生物代谢的机制尚不明确,但随着宏基因组、宏转录组及代谢组等技术的发展,也为未来这种代谢机制的揭示提供了有效手段。
4 结论使用DDGS作为日粮蛋白源改变了湖羊瘤胃发酵参数及微生物菌群结构,瘤胃中原虫以及高效产氨菌数量的降低可能是导致瘤胃内氨态氮浓度降低的主要原因。日粮添加30.5 mg·kg-1DM的nisin对育肥湖羊瘤胃发酵参数及微生物菌群结构均无显著影响。
| [1] |
ROSS R P, MORGAN S, HILL C. Preservation and fermentation: past, present and future[J]. Int J Food Microbiol, 2002, 79(1-2): 3-16. DOI:10.1016/S0168-1605(02)00174-5 |
| [2] |
KIERONCZYK B, RAWSKI M, MIKOŁAJCZAK Z, et al. Nisin as a novel feed additive: the effects on gut microbial modulation and activity, histological parameters, and growth performance of broiler chickens[J]. Animals, 2020, 10(1): 101. DOI:10.3390/ani10010101 |
| [3] |
KIEROŃCZYK B, PRUSZYŃSKA-OSZMAŁEK E, ŚWIĄTKIEWICZ S, et al. The nisin improves broiler chicken growth performance and interacts with salinomycin in terms of gastrointestinal tract microbiota composition[J]. J Anim Feed Sci, 2016, 25(4): 309-316. DOI:10.22358/jafs/67802/2016 |
| [4] |
申军士, 刘壮, 陈亚迎, 等. 乳酸链球菌素对瘤胃体外发酵、甲烷生成及功能菌群数量的影响[J]. 微生物学报, 2016, 56(8): 1348-1357. SHEN J S, LIU Z, CHEN Y Y, et al. Effects of nisin on in vitro fermentation, methanogenesis and functional microbial populations of the rumen[J]. Acta Microbiologica Sinica, 2016, 56(8): 1348-1357. (in Chinese) |
| [5] |
SHEN J S, LIU Z, YU Z T, et al. Monensin and nisin affect rumen fermentation and microbiota differently in vitro[J]. Front Microbiol, 2017, 8: 1111. DOI:10.3389/fmicb.2017.01111 |
| [6] |
PATRA A K, YU Z T. Essential oils affect populations of some rumen bacteria in vitro as revealed by microarray (RumenBactArray) analysis[J]. Front Microbiol, 2015, 6: 297. |
| [7] |
DE EVAN T, CABEZAS A, DE LA FUENTE J, et al. Feeding agroindustrial byproducts to light lambs: influence on growth performance, diet digestibility, nitrogen balance, ruminal fermentation, and plasma metabolites[J]. Animals, 2020, 10(4): 600. DOI:10.3390/ani10040600 |
| [8] |
VALENTIM J K, LIMA H J D A, BITTENCOURT T M, et al. Quality of broilers fed diets containing dry distillery grains[J]. Journal of Agricultural Studies, 2020, 8(1): 357-370. DOI:10.5296/jas.v8i1.16115 |
| [9] |
天下粮仓. 中国DDGS供需平衡表(2020年12月)[EB/OL]. [2020-12-25]. http://www.cofeed.com/ddgs/20124742140.html. Tianxialiangchang. Supply and demand balance of DDGS in China[EB/OL]. [2020-12-25]. http://www.cofeed.com/ddgs/20124742140.html. (in Chinese) |
| [10] |
SHEN J S, CHEN Y Y, MORAES L E, et al. Effects of dietary protein sources and nisin on rumen fermentation, nutrient digestion, plasma metabolites, nitrogen utilization, and growth performance in growing lambs[J]. J Anim Sci, 2018, 96(5): 1929-1938. DOI:10.1093/jas/sky086 |
| [11] |
CASTILLO-LOPEZ E, JENKINS C J R, ALUTHGE N D, et al. The effect of regular or reduced-fat distillers grains with solubles on rumen methanogenesis and the rumen bacterial community[J]. J Appl Microbiol, 2017, 123(6): 1381-1395. DOI:10.1111/jam.13583 |
| [12] |
CASTILLO-LOPEZ E, RAMIREZ H A R, KLOPFENSTEIN T J, et al. Effect of feeding dried distillers grains with solubles on ruminal biohydrogenation, intestinal fatty acid profile, and gut microbial diversity evaluated through DNA pyro-sequencing[J]. J Anim Sci, 2014, 92(2): 733-743. DOI:10.2527/jas.2013-7223 |
| [13] |
RAMIREZ H A R, NESTOR K, TEDESCHI L O, et al. The effect of brown midrib corn silage and dried distillers' grains with solubles on milk production, nitrogen utilization and microbial community structure in dairy cows[J]. Can J Anim Sci, 2012, 92(3): 365-380. DOI:10.4141/cjas2011-133 |
| [14] |
WOLFF S M, ELLISON M J, HAO Y, et al. Diet shifts provoke complex and variable changes in the metabolic networks of the ruminal microbiome[J]. Microbiome, 2017, 5(1): 60. DOI:10.1186/s40168-017-0274-6 |
| [15] |
LOOR J J, ELOLIMY A A, MCCANN J C. Dietary impacts on rumen microbiota in beef and dairy production[J]. Anim Front, 2016, 6(3): 22-29. DOI:10.2527/af.2016-0030 |
| [16] |
CAMMACK K M, AUSTIN K J, LAMBERSON W R, et al. RUMINANT NUTRITION SYMPOSIUM: Tiny but mighty: the role of the rumen microbes in livestock production[J]. J Anim Sci, 2018, 96(10): 4481. DOI:10.1093/jas/sky331 |
| [17] |
CHANEY A L, MARBACH E P S. Modified reagents for determination of urea and ammonia[J]. Clin Chem, 1962, 8(2): 130-132. DOI:10.1093/clinchem/8.2.130 |
| [18] |
DAI Z L, ZHANG J, WU G Y, et al. Utilization of amino acids by bacteria from the pig small intestine[J]. Amino Acids, 2010, 39(5): 1201-1215. DOI:10.1007/s00726-010-0556-9 |
| [19] |
DENMAN S E, MCSWEENEY C S. Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J]. FEMS Microbiol Ecol, 2006, 58(3): 572-582. DOI:10.1111/j.1574-6941.2006.00190.x |
| [20] |
SYLVESTER J T, KARNATI S K R, YU Z T, et al. Development of an assay to quantify rumen ciliate protozoal biomass in cows using real-time PCR[J]. J Nutr, 2004, 134(12): 3378-3384. DOI:10.1093/jn/134.12.3378 |
| [21] |
DENMAN S E, TOMKINS N W, MCSWEENEY C S. Quantitation and diversity analysis of ruminal methanogenic populations in response to the antimethanogenic compound bromochloromethane[J]. FEMS Microbiol Ecol, 2007, 62(3): 313-322. DOI:10.1111/j.1574-6941.2007.00394.x |
| [22] |
PATRA A K, YU Z T. Effects of vanillin, quillaja saponin, and essential oils on in vitro fermentation and protein-degrading microorganisms of the rumen[J]. Appl Microbiol Biotechnol, 2014, 98(2): 897-905. DOI:10.1007/s00253-013-4930-x |
| [23] |
JÓZEFIAK D, KIEROŃCZYK B, JUŚKIEWICZ J, et al. Dietary nisin modulates the gastrointestinal microbial ecology and enhances growth performance of the broiler chickens[J]. PLoS One, 2013, 8(12): e85347. DOI:10.1371/journal.pone.0085347 |
| [24] |
SOTO E C, YÁÑEZ-RUIZ D R, CANTALAPIEDRA-HIJAR G, et al. Changes in ruminal microbiota due to rumen content processing and incubation in single-flow continuous-culture fermenters[J]. Anim Prod Sci, 2012, 52(9): 813-822. DOI:10.1071/AN11312 |
| [25] |
CHOLLET E, SEBTI I, MARTIAL-GROS A, et al. Nisin preliminary study as a potential preservative for sliced ripened cheese: NaCl, fat and enzymes influence on nisin concentration and its antimicrobial activity[J]. Food Control, 2008, 19(10): 982-989. DOI:10.1016/j.foodcont.2007.10.005 |
| [26] |
HULS T J, BARTOSH A J, DANIEL J A, et al. Efficacy of dried distiller's grains with solubles as a replacement for soybean meal and a portion of the corn in a finishing lamb diet[J]. Sheep Goat Res J, 2006, 21: 30-34. |
| [27] |
FELIX T L, ZERBY H N, MOELLER S J, et al. Effects of increasing dried distillers grains with solubles on performance, carcass characteristics, and digestibility of feedlot lambs[J]. J Anim Sci, 2012, 90(4): 1356-1363. DOI:10.2527/jas.2011-4373 |
| [28] |
BENCHAAR C, HASSANAT F, GERVAIS R, et al. Effects of increasing amounts of corn dried distillers grains with solubles in dairy cow diets on methane production, ruminal fermentation, digestion, N balance, and milk production[J]. J Dairy Sci, 2013, 96(4): 2413-2427. DOI:10.3168/jds.2012-6037 |
| [29] |
NEWBOLD C J, DE LA FUENTE G, BELANCHE A, et al. The role of ciliate protozoa in the rumen[J]. Front Microbiol, 2015, 6: 1313. |
| [30] |
申军士, 毛胜勇, 朱伟云. 反刍动物瘤胃高效产氨菌菌群结构、功能及其调控[J]. 动物营养学报, 2015, 27(8): 2323-2327. SHEN J S, MAO S Y, ZHU W Y. Ruminal hyper ammonia producing bacteria in ruminants: community structure, function and its manipulation[J]. Chinese Journal of Animal Nutrition, 2015, 27(8): 2323-2327. DOI:10.3969/j.issn.1006-267x.2015.08.002 (in Chinese) |
| [31] |
PASTER B J, RUSSELL J B, YANG C M, et al. Phylogeny of the ammonia-producing ruminal bacteria Peptostreptococcus anaerobius, Clostridium sticklandii, and Clostridium aminophilum sp. nov.[J]. Int J Syst Evol Microbiol, 1993, 43(1): 107-110. |
| [32] |
CALLAWAY T R, DOWD S E, EDRINGTON T S, et al. Evaluation of bacterial diversity in the rumen and feces of cattle fed different levels of dried distillers grains plus solubles using bacterial tag-encoded FLX amplicon pyrosequencing[J]. J Anim Sci, 2010, 88(12): 3977-3983. DOI:10.2527/jas.2010-2900 |
| [33] |
伍璋健. 美国DDGS对生长猪生长性能和血液生化指标的影响[D]. 长沙: 湖南农业大学, 2013. WU Z J. Effects of DDGS on performance and blood biochemical indexes of growing pigs[D]. Changsha: Hunan Agricultural University, 2013. (in Chinese) |
| [34] |
SCHINGOETHE D J, KALSCHEUR K F, HIPPEN A R, et al. Invited review: the use of distillers products in dairy cattle diets[J]. J Dairy Sci, 2009, 92(12): 5802-5813. DOI:10.3168/jds.2009-2549 |
| [35] |
DUNCAN S H, HOLD G L, BARCENILLA A, et al. Roseburia intestinalis sp. nov., a novel saccharolytic, butyrate-producing bacterium from human faeces[J]. Int J Syst Evol Microbiol, 2002, 52(5): 1615-1620. |
| [36] |
郭福存, 江南. DDGS的营养价值及限制因素[J]. 中国家禽, 2007, 29(10): 43-44. GUO F C, JIANG N. Nutrition Value and Limiting Factors of DDGS[J]. China Poultry, 2007, 29(10): 43-44. DOI:10.3969/j.issn.1004-6364.2007.10.020 (in Chinese) |
(编辑 范子娟)



