2. 华南农业大学动物科学学院, 广州 510642
2. College of Animal Science, South China Agricultural University, Guangzhou 510642, China
在养猪业中,种公猪精液质量是衡量其繁殖性能的重要指标之一[1],氧化应激(oxidative stress, OS)是体外引起公猪精液质量下降的主要原因,精子在成熟阶段以及保存过程中极易受到活性氧(reactive oxygen species, ROS)攻击[2-3],导致精子脂质过氧化和正常生理被损害,引起精子的OS。目前,通过向精液稀释液中添加外源性抗氧化剂改善解冻后精子的抗氧化防御系统,清除部分自由基和ROS[4],从而保护精子免受氧化损伤[5]。谷胱甘肽过氧化物酶家族在氧化应激中起着保护作用,本课题组前期研究发现,GPx6蛋白在公猪的附睾和精清高表达,其附着在精子头部,通过影响抗氧化途径的组成部分,阻止精子过早获能[6],但机制仍然不明确。GPx6最先在人嗅觉系统的上皮细胞[7]和胚胎组织被分离出来[8],在之后的研究中发现,组成GPx6催化位点硒代半胱氨酸V的mRNA在睾丸中表达,在妊娠早期母猪血液中也能检测到GPx6的表达[9],它的生物学功能仍然不确定。目前,种公猪繁殖力衰退和氧化应激是引起公猪精液质量下降的主要原因,精液蛋白与公猪精子功能相关,对于精液蛋白GPx6在种猪繁育方面的研究还处于初级阶段,相关报道寥寥无几。本研究以大白猪公猪和母猪为研究对象,通过蛋白免疫印迹和免疫组化方法检测大白猪生殖组织中GPx6蛋白的表达水平,对其在附睾细胞中进行定位;通过ELISA方法检测精液中GPx6的表达量,统计公猪的繁殖性能指标,分析GPx6的表达量与繁殖性能的相关性;为深入挖掘GPx6蛋白与公猪受精能力的相关性研究奠定基础,为精液稀释液的添加剂研究提供参考。
1 材料与方法 1.1 试验材料1.1.1 试验样品 大白公猪和种猪精液来自广东某种猪场;生殖组织(睾丸、附睾头、附睾体、附睾尾、前列腺、尿道球腺、精囊腺、卵巢和输卵管)来自15月龄大白公猪和大白母猪(各3头),屠宰程序参照中华人民共和国国家标准(GB 50317—2000)。
1.1.2 试验动物 试验于广东某种猪场进行,按照公猪配种胎次≥20胎、3次配种公猪为同一头的标准,选取20头大白公猪为研究对象,统计相对应的1 279头母猪生产数据(2014年5月—2017年12月)。采集公猪精液,每份精液样品做3个重复,试验重复3次。
1.2 主要试剂及材料PBS购自Thermo公司;丙酮、福尔马林、多聚甲醛和苏木素购自北京雷根生物技术有限公司;正常兔血清和羊血清购自鼎国公司;Lysis buffer和BCA蛋白含量检测试剂盒购自凯基生物有限公司;GPx6 ELISA检测试剂盒购自TSZ公司;蛋白免疫印迹检测中用到的试剂均购自广州佳研生物科技有限公司;GPx6兔多克隆抗体购自Cloud-Clone公司,GAPDH鼠单克隆抗兔购自Sigma公司,HRP标记羊抗鼠IgG抗体和HRP标记羊抗IgG抗体购自Earthox公司。
高速冷冻离心机购自Eppendorf公司;酶标仪购自Thermo公司;超微量分光光度计购自Thermo公司;凝胶成像系统购自上海天能公司;洗板机购自南昌普朗医用设备有限公司;电泳仪购自Bio-Rad公司;实验室专用超纯水机购自四川沃特尔水处理有限公司;切片机购自徕卡显微系统上海贸易有限公司。
1.3 试验方法1.3.1 蛋白免疫印迹检测 取10~20 mg组织加500 μL裂解液,匀浆研磨处理,使用Lysis buffer提取组织蛋白,根据BCA蛋白含量检测试剂盒说明书检测总蛋白含量。蛋白样品变性,在12% SDS-PAGE凝胶上上样20 μg·孔-1,80 V电泳3 h;将蛋白转至NC膜,90 V转膜1 h,脱脂奶粉室温封闭1 h,GPx6一抗(1∶1 000稀释)孵育,4 ℃过夜,TBST洗膜2次,TBS洗膜1次;二抗(1∶3 000稀释)孵育,37 ℃孵育2 h,洗膜同上;ECL超敏发光液显色,曝光显影。以内参GAPDH进行目的蛋白表达量校正。
1.3.2 免疫组化检测 获得新鲜的组织样本,立即固定在10%的福尔马林中,常规石蜡包埋,切片,厚度为4 μm。二甲苯脱蜡,梯度乙醇脱水,抗原修复。3%兔血清封闭(TBS溶液稀释),室温孵育30 min。PBS冲洗3次。添加兔源GPx6一抗(1∶500稀释),阴性对照为兔血清,4 ℃过夜。PBS冲洗3次,加HRP标记的羊抗兔IgG二抗(1∶1 000稀释),37 ℃孵育30 min,PBS洗涤,DAB显色,终止。苏木精复染,酒精脱水,树胶封片,荧光显微镜检查玻片,图像采集分析,阳性细胞(GPx6蛋白表达的细胞)的着色为棕褐色,没有表达的均为紫蓝色,即细胞核的颜色。
1.3.3 精液蛋白提取 取2 mL精液,4 ℃,2 000 r·min-1离心15 min分离精子和精清,取上清液,12 000 r·min-1,4 ℃离心10 min,取上清按体积比1∶2加入预冷丙酮,-20 ℃放置4 h。取2 mL析出液,12 000 r·min-1,4 ℃离心20 min,得到精清蛋白。精液离心后的沉淀即为精子沉淀,用PBS清洗3次,每次2 000 r·min-1,4 ℃离心10 min。加入0.5 mL的Lysis buffer溶液,提取精子蛋白,冰上操作。最后,根据BCA蛋白浓度检测试剂盒说明书检测总蛋白含量,根据GPx6 ELISA试剂盒检测GPx6蛋白含量,GPx6蛋白相对含量= GPx6 ELISA含量/总蛋白含量。
1.3.4 测定指标及统计方法 根据评定大白公猪受精能力的数学模型对大白公猪进行高低繁殖力分组[10],通过筛选和统计,选取20头公猪配种的合格母猪1 279头,统计和计算生产数据,进而得到繁殖性能数据;母猪生产指标包括总仔数、活仔数、死胎数、木乃伊数和畸形数,公猪繁殖性能指标包括窝产活仔数(NBA)、窝产总仔数(TNB)、配种母猪数、分娩母猪数、分娩率(FR)和繁殖力。其中,FR=分娩母猪数/配种母猪数×100%,繁殖力=FR×NBA。统计种公猪的繁殖指标数据和GPx6蛋白的相对含量数据,进行显著相关性检验;将GPx6蛋白相对含量按从高到低排序,选取排名前30%为高含量组,后30%的为低含量组,检测不同的繁殖指标与精子和精清中GPx6蛋白含量的关系。精子中GPx6蛋白按含量分组后,高含量组5头公猪对应的配种母猪头数为401头,低含量组5头公猪对应的配种母猪头数为237头;精清中GPx6蛋白按含量分组后,高含量组5头公猪对应的配种母猪头数为452头,低含量组5头公猪对应的配种母猪头数为343头。
1.4 统计与分析筛选并采集20头大白种公猪精液,统计分析公猪繁殖性能指标(窝产总仔数、窝产活仔数、分娩率和繁殖力)。使用IBM SPSS Statistics 21软件的独立样本t检验及单因素方差分析(one way ANOVA),进行差异显著性分析;用双变量Pearson相关分析,P<0.05表示差异或相关显著,结果用“平均值±标准误”表示。
2 结果 2.1 GPx6在大白猪生殖组织中的表达通过蛋白免疫印迹(Western blot)方法检测GPx6蛋白在大白猪生殖组织中的表达,结果显示,GPx6在附睾头、附睾体和附睾尾中高表达(图 1)。

|
1. 睾丸;2~4. 附睾头、附睾体、附睾尾;5. 尿道球腺;6. 前列腺;7. 精囊腺;8. 卵巢;9. 输卵管 1. Testis; 2-4. Caput, corpus, cauda epididymidis; 5. Urethral bulb gland; 6. Prostate; 7. Seminal vesicle gland; 8. Ovary; 9. Fallopian tube 图 1 GPx6在猪生殖组织中的表达 Fig. 1 Expression of GPx6 in the reproductive tissues of pigs |
运用免疫组化(immunohistochemistry, IHC) 方法检测GPx6在大白公猪附睾细胞中表达。公猪附睾组织IHC结果显示,相对于阴性对照(图 2A、C),GPx6在附睾组织的顶细胞、基底细胞、晕细胞、主细胞和精子中表达,在肌样细胞中不表达(图 2)。
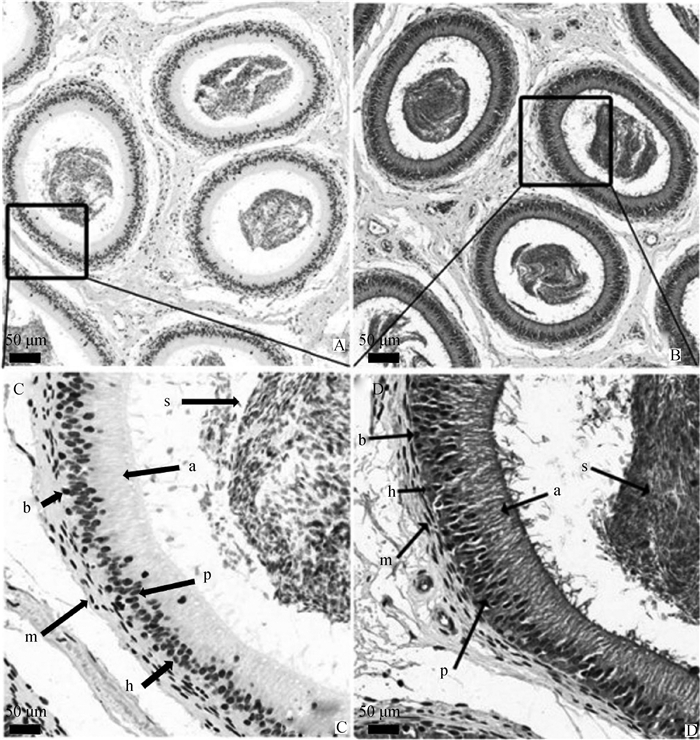
|
A、C. 阴性对照;B、D.GPx6组. a. 顶细胞;b. 基底细胞;h. 晕细胞;m. 肌样细胞;p. 主细胞;s.精子 A, C. Negative control; B, D. GPx6 group. a. Apical cell; b. Basal cell; h. Halo cell; m. Myoid cell; p. Principal cell; S. Sperm 图 2 GPx6蛋白在公猪附睾细胞中的定位 Fig. 2 Localization of GPx6 in boar epididymal cells |
2.3.1 大白公猪精子和精清中GPx6含量的检测 采集20头大白种公猪精液,提取精子蛋白和精清蛋白,通过BCA方法检测总蛋白含量,通过GPx6 ELISA试剂盒检测精子和精清中GPx6蛋白的含量,计算出GPx6相对含量。结果发现,精子和精清中均含有GPx6蛋白,精清中GPx6蛋白含量是精子中的7倍,差异显著(P<0.05,表 1)。
|
|
表 1 精子和精清中GPx6蛋白的含量比较 Table 1 Comparison of GPx6 protein content in sperm and seminal plasma |
2.3.2 精液中GPx6蛋白含量与繁殖性能的相关性 统计母猪的生产成绩,计算分析公猪的繁殖性能,使用SPSS软件分析GPx6蛋白含量和繁殖性能的关系。结果表明,大白公猪精子的GPx6蛋白含量与所有繁殖参数呈负相关,精清中的GPx6蛋白含量与窝产总仔数、窝产活仔数和繁殖力呈负相关,与分娩率无显著相关(表 2)。
|
|
表 2 精子GPx6蛋白含量与大白公猪繁殖性能的相关性分析 Table 2 Correlation analysis between concentration of GPx6 in sperm and reproductive performance of Large White boars |
2.3.3 GPx6蛋白影响公猪繁殖性能的初步验证 使用SPSS软件分析精子和精清中的不同GPx6蛋白含量与繁殖指标的关系。结果表明,除了精清高、低含量组的分娩率和繁殖力外,精子和精清高含量组的窝产活仔数和窝产总仔数均低于低含量组,但差异不显著;大白公猪中精子中的GPx6蛋白含量与窝产总仔数、窝产活仔数和繁殖力负相关,精清中的GPx6蛋白含量与窝总产仔数和窝产活仔数负相关(表 3)。
|
|
表 3 大白公猪精液中的不同GPx6蛋白含量与繁殖性能的相关性分析 Table 3 Correlation analysis between different concentration of GPx6 protein in semen and reproductive performance of Large White boars |
GPxs作为一种有效的抗氧化保护剂,在植物中研究的比较多。据报道,它能清除磷脂氢过氧化物,并在氧化脱氢酶的消耗和胁迫信号传导中发挥重要作用,可防止包括重金属在内的多种污染物产生过量的活性氧[11-14],特别是铜和铅离子[15-16]。研究发现,通过检测拟南芥中GPx6的含量可以预测酯类对植物的不良影响[17]。在动物中,由活性氧产引起的听力损失,与耳蜗听觉部分GPx6基因的表达显著相关[18]。同时,研究表明,小鼠胚胎线粒体GPx6 mRNA的表达水平与ROS过量引起的线粒体功能障碍有关[19]。总之,无论在植物还是动物中,GPx6的作用与ROS息息相关。
GPx蛋白家族在进化过程中形成了两个亚类,一类包括GPx1和GPx2,另一类包括GPx3、GPx5和GPx6,各蛋白成员均有高度保守的GPx蛋白家族基序和硒代半胱氨酸或半胱氨酸[20]。GPx6与GPx5属于同一亚类,在对山羊各组织的GPx家族基因进行荧光定量分析发现,GPx6和GPx5在山羊的睾丸和附睾中都有表达[21]。研究进一步发现,GPx5在附睾中特异性表达,且与精子功能有关,是精子质量的生物标记[22],它可以保护细胞免受氧化应激诱导的脂质过氧化和DNA突变的影响[23]。GPx6与GPx5是同源蛋白,在蛋白结构和功能上存在相似性,GPx6可能与精子质量和氧化应激有关。同时,GPx6蛋白在精液中的表达量与公猪繁殖性能负相关,而不能像GPx5蛋白一样被作为抗氧化酶和精子质量的标志物,这表明,即使是同源蛋白,功能上也存在一定的差异[24],可能是因为GPx6是硒依赖性蛋白,而GPx5是半胱氨酸GPx蛋白,具体的原因和机制还需进一步探索。
GPx6首次在嗅觉系统的鲍曼氏腺中被发现,鲍曼氏腺是上皮细胞中的一种巨形多细胞体[7]。早期已有研究发现,嗅觉受体GRK3 / BARK2在哺乳动物的精子中被鉴定出来,可能与精子的趋化性有关[25]。在人精子细胞中对嗅觉受体OR1D2活性进行鉴定,发现其活性在可育和亚可育的雄性之间有所不同[26]。Souto等[27]在研究两个适应性亚热带气候的牛品种精清蛋白的季节性表达时,发现牛精清中GPx6蛋白的丰度在夏季比冬季要高,是影响精子特异性最关键的蛋白之一。由此可见,精液蛋白GPx6的表达与精子的受精力必定存在关联性。
本研究通过IHC试验发现,GPx6在附睾的顶细胞、基底细胞、晕细胞、主细胞和精子中表达,由于精子需要两周才能到达储存精子的附睾尾[28],推测GPx6在附睾中可能以外泌体的形式通过与精子头部表面结合附着在精子上[29]。该假设得到以下研究的支持,即精液蛋白GPx5在附睾中的特异性表达,已证明它与可以转移到精子头部、覆盖顶体的外泌体相关,防止精子过早发生顶体反应,保护精子膜免受损伤[30]。总之,GPx6在附睾的顶细胞、基底细胞、晕细胞、主细胞和精子中表达,影响公猪的繁殖性能相关,其作用可能与保持精子功能和精子质量的提高有关,该研究为后期GPx6蛋白在公猪精子受精力和精液稀释液方面的研究奠定基础。
4 结论综上所述,GPx6在公猪和母猪生殖组织中差异性表达,在附睾头、附睾体和附睾尾高表达,且定位在附睾的顶细胞、基底细胞、晕细胞、主细胞和精子中;GPx6蛋白在精清中的表达是精子中的7倍,且在精液中的表达量与窝产活仔数和窝产总仔数呈负相关关系。
| [1] |
甄林青, 王立蕊, 付杰丽, 等. 家畜精液质量相关生物标记的研究进展[J]. 畜牧兽医学报, 2016, 47(4): 645-651. ZHEN L Q, WANG L R, FU J L, et al. The research progress in semen quality related biomarker in livestock[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(4): 645-651. (in Chinese) |
| [2] |
ZHU Z D, LI R N, FAN X T, et al. Resveratrol improves boar sperm quality via 5'AMP-activated protein kinase activation during cryopreservation[J]. Oxid Med Cell Longev, 2019, 2019: 5921503. |
| [3] |
吕松洁, 付丽, 范文华, 等. 线粒体靶向抗氧化剂Mitoquinone对湖羊冻精损伤的保护作用[J]. 畜牧兽医学报, 2019, 50(12): 2554-2559. LV S J, FU L, FAN W H, et al. Protective effect of mitochondria-targeted antioxidant Mitoquinone on the damage of Hu sheep frozen sperm[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(12): 2554-2559. DOI:10.11843/j.issn.0366-6964.2019.12.020 (in Chinese) |
| [4] |
ZHAO F F, WHITING S, LAMBOURNE S, et al. Melatonin alleviates heat stress-induced oxidative stress and apoptosis in human spermatozoa[J]. Free Radic Biol Med, 2021, 164: 410-416. DOI:10.1016/j.freeradbiomed.2021.01.014 |
| [5] |
FRIESEN C R, NOBLE D W A, OLSSON M. The role of oxidative stress in postcopulatory selection[J]. Philos Trans R Soc B Biol Sci, 2020, 375(1813): 20200065. DOI:10.1098/rstb.2020.0065 |
| [6] |
CHEN Y, WANG K, ZHANG D L, et al. GPx6 is involved in the in vitro induced capacitation and acrosome reaction in porcine sperm[J]. Theriogenology, 2020, 156: 107-115. DOI:10.1016/j.theriogenology.2020.06.020 |
| [7] |
ARTHUR J R. The glutathione peroxidases[J]. Cell Mol Life Sci, 2000, 57(13-14): 1825-1835. |
| [8] |
DEAR T N, CAMPBELL K, RABBITTS T H. Molecular cloning of putative odorant-binding and odorant-metabolizing proteins[J]. Biochemistry, 1991, 30(43): 10376-10382. DOI:10.1021/bi00107a003 |
| [9] |
SHEN J Y, ZHOU C L, ZHU S E, et al. Comparative transcriptome analysis reveals early pregnancy-specific genes expressed in peripheral blood of pregnant sows[J]. PLoS One, 2014, 9(12): e114036. DOI:10.1371/journal.pone.0114036 |
| [10] |
张守全, 陈志林, 冯美莹, 等. 一种评定大白公猪受精能力的数学模型及其建立方法: 中国, 201510431755.1[P]. 2015-11-11. ZHANG S Q, CHEN Z L, FENG M Y, et al. Mathematic model for evaluating fertility of the Large White, and establishment method thereof: CN, 201510431755.1[P]. 2015-11-11. (in Chinese) |
| [11] |
BELA K, HORVÁTH E, GALLÉ A, et al. Plant glutathione peroxidases: emerging role of the antioxidant enzymes in plant development and stress responses[J]. J Plant Physiol, 2015, 176: 192-201. DOI:10.1016/j.jplph.2014.12.014 |
| [12] |
MORTAZAVI S M J, MORTAZAVI S A R, PAKNAHAD M. Arabidopsis plants exposed to gamma radiation in two successive generations show a different oxidative stress response[J]. J Environ Radioact, 2017, 171: 253-254. DOI:10.1016/j.jenvrad.2016.12.009 |
| [13] |
PASSAIA G, QUEVAL G, BAI J, et al. The effects of redox controls mediated by glutathione peroxidases on root architecture in Arabidopsis thaliana[J]. J Exp Bot, 2014, 65(5): 1403-1413. DOI:10.1093/jxb/ert486 |
| [14] |
RODRIGUEZ MILLA M A, MAURER A, HUERE A R, et al. Glutathione peroxidase genes in Arabidopsis are ubiquitous and regulated by abiotic stresses through diverse signaling pathways[J]. Plant J, 2003, 36(5): 602-615. DOI:10.1046/j.1365-313X.2003.01901.x |
| [15] |
TAN L L, XUE X G, DU J, et al. Probing the molecular toxic mechanism of lead (Ⅱ) ions with glutathione peroxidase 6 from Arabidopsis thaliana[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2020, 226: 117597. DOI:10.1016/j.saa.2019.117597 |
| [16] |
WANG K, TANG S F, HOU X M. Molecular mechanism investigation on the interactions of copper (Ⅱ) ions with glutathione peroxidase 6 from Arabidopsis thaliana[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2018, 203: 428-433. DOI:10.1016/j.saa.2018.05.085 |
| [17] |
WANG Z, TANG S F, HOU X M. Glutathione peroxidase 6 from Arabidopsis thaliana as potential biomarker for plants exposure assessment to di-(2-ethylhexyl) phthalate[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2020, 229: 117955. DOI:10.1016/j.saa.2019.117955 |
| [18] |
TADROS S F, D'SOUZA M, ZHU X X, et al. Gene expression changes for antioxidants pathways in the mouse cochlea: relations to age-related hearing deficits[J]. PLoS One, 2014, 9(2): e90279. DOI:10.1371/journal.pone.0090279 |
| [19] |
XU X C, HE L Y, ZHANG A M, et al. Toxoplasma gondii isolate with genotype Chinese 1 triggers trophoblast apoptosis through oxidative stress and mitochondrial dysfunction in mice[J]. Exp Parasitol, 2015, 154: 51-61. DOI:10.1016/j.exppara.2015.04.008 |
| [20] |
BRIGELIUS-FLOHÉ R, MAIORINO M. Glutathione peroxidases[J]. Biochim Biophys Acta, 2013, 1830(5): 3289-3303. DOI:10.1016/j.bbagen.2012.11.020 |
| [21] |
张建新, 王茜, 荀文娟, 等. GPxs家族基因在山羊不同组织和睾丸不同发育时期的表达特性研究[J]. 畜牧兽医学报, 2011, 42(5): 650-657. ZHANG J X, WANG Q, XUN W J, et al. The expression of glutathione peroxidases family genes in different tissues and testes at different stages of male goats[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(5): 650-657. (in Chinese) |
| [22] |
VLAGRAN I, CASTILLO-MARTÍN M, PRIETO-MARTÍNEZ N, et al. Triosephosphate isomerase (TPI) and epididymal secretory glutathione peroxidase (GPX5) are markers for boar sperm quality[J]. Anim Reprod Sci, 2016, 165: 22-30. DOI:10.1016/j.anireprosci.2015.12.001 |
| [23] |
TATENO H, KRAPF D, HINO T, et al. Ca2+ ionophore A23187 can make mouse spermatozoa capable of fertilizing in vitro without activation of cAMP-dependent phosphorylation pathways[J]. Proc Natl Acad Sci U S A, 2013, 110(46): 18543-18548. DOI:10.1073/pnas.1317113110 |
| [24] |
MUDGAL R, SRINIVASAN N, CHANDRA N. Resolving protein structure-function-binding site relationships from a binding site similarity network perspective[J]. Proteins, 2017, 85(7): 1319-1335. DOI:10.1002/prot.25293 |
| [25] |
WALENSKY L D, ROSKAMS A J, LEFKOWITZ R J, et al. Odorant receptors and desensitization proteins colocalize in mammalian sperm[J]. Mol Med, 1995, 1(2): 130-141. DOI:10.1007/BF03401561 |
| [26] |
OTTAVIANO G, ZUCCARELLO D, MENEGAZZO M, et al. Human olfactory sensitivity for bourgeonal and male infertility: a preliminary investigation[J]. Eur Arch Otorhinolaryngol, 2013, 270(12): 3079-3086. DOI:10.1007/s00405-013-2441-0 |
| [27] |
SOUTO P L, CARMOUY L S T, SANTOS C, et al. Seasonal differences in seminal plasma proteins from two bovine breeds adapted to a subtropical climate[J]. Trop Anim Health Prod, 2021, 53(1): 61. DOI:10.1007/s11250-020-02536-8 |
| [28] |
DACHEUX J L, DACHEUX F. New insights into epididymal function in relation to sperm maturation[J]. Reproduction, 2014, 147(2): R27-R42. DOI:10.1530/REP-13-0420 |
| [29] |
SAMANTA L, PARIDA R, DIAS T R, et al. The enigmatic seminal plasma: a proteomics insight from ejaculation to fertilization[J]. Reprod Biol Endocrinol, 2018, 16(1): 41. DOI:10.1186/s12958-018-0358-6 |
| [30] |
栾兆进, 张家新. 哺乳动物附睾特异GPx5功能及其调节机制的研究进展[J]. 中国畜牧兽医, 2018, 45(9): 2500-2506. |
(编辑 范子娟)



