2. 安徽农业大学 地方畜禽遗传资源保护与生物育种安徽省重点实验室, 合肥 230036
2. Anhui Province Key Laboratory of Local Livestock and Poultry Genetic Resource Conservation and Bio-breeding, Anhui Agricultural University, Hefei 230036, China
番鸭为优良瘦肉型鸭,具有肉质好、蛋白质含量高、耐粗饲、生长快和体型大等特点。因其产蛋量低,且在个体间存在显著差异,所以,番鸭产蛋等繁殖性状成为了当前研究的焦点[1-3]。研究普遍认为,禽类产蛋主要受体内激素水平的影响,肝在雌激素刺激下合成大量脂质物质释放入血液中[4-6]。番鸭肝非靶向代谢组学研究表明,产蛋期差异代谢物主要由脂类和有机酸类代谢物组成[3]。Li等[7]通过转录组学揭示鸡产蛋前后肝转录组谱差异,发现差异表达基因主要富集于胆固醇合成、过氧化物酶体增殖物激活受体(PPAR)信号通路和不饱和脂肪酸合成等脂质代谢通路。可见,产蛋性状是家禽生产中的重要经济性状之一,受到脂肪沉积调控[8]。
脂肪酸在肝中通过肝细胞从血浆吸收和从头生物合成而积累,与甘油组装成甘油三酯[9]。甘油三酯为脂肪酸在细胞和血浆中储存和运输的主要形式,在极低密度脂蛋白(VLDL)形成早期和末期与其结合[9],形成富含甘油三酯的VLDL,并分泌至血液,以脂滴形式储存于腹部脂肪、皮下脂肪、颈部脂肪和肠系膜脂肪[10]。不同于哺乳动物,禽类约90%脂质于肝中合成。肝作为家禽机体重要代谢器官,在脂质合成、转运和代谢过程中发挥关键作用[11-13]。在产蛋期,肝合成蛋黄靶向型VLDL(VLDLy)通过血液转运至卵巢组织并沉积于卵黄中,促进各等级卵泡生长发育[4]。家禽肝在产蛋期间体积增大以合成大量卵黄脂质,来满足产蛋期间卵黄脂质沉积需求,肝颜色因脂质积累也逐渐变为黄色[14]。腺苷酸活化蛋白激酶(AMPK)为脂质合成代谢主开关,在胆固醇合成、脂肪酸氧化、脂肪酸合成和VLDL合成等脂质代谢中发挥重要调控作用。活化AMPK可导致乙酰辅酶A羧化酶(ACC)、HMG-CoA还原酶(HMGR)和脂肪酸合成酶(FSH)磷酸化,从而抑制肝中脂肪酸和胆固醇的生物合成[15-16]。因此,探究肝脂肪酸组成及AMPK信号通路对解释肝在产蛋各期脂质代谢具有重要意义。
本研究旨在了解番鸭产蛋各期血脂水平、肝组织学结构、肝AMPK信号通路基因表达和其脂肪酸组成,为番鸭肝脂质代谢应答产蛋提供机理研究。同时,为产蛋期番鸭合理的饲粮营养水平监控、合理的脂肪贮存与营养调控提供借鉴,以期提高番鸭产蛋量。
1 材料与方法 1.1 试验材料与样品采集白羽母番鸭饲养于安徽安庆永强农业开发股份有限公司,22周龄种鸭光照时间为11 h·d-1,采食量为103 g·d-1;30、40和60周龄种鸭光照时间为17 h·d-1,采食量为160 g·d-1,各饲养阶段营养水平均按国家研究委员会(NRC)标准进行[17]。分别于产蛋前期(22周龄,(2 152±73) g)、产蛋初期(30周龄,(2 735±92) g)、产蛋中期(40周龄,(2 760±94) g) 和产蛋末期(60周龄,(3 100±105) g) 随机选取健康母番鸭各15羽,禁食12 h后翅静脉采血并分离血清。屠宰后,收集肝右叶样本于脂肪固定液中保存。快速收集肝右叶样本于液氮中保存,后转移至超低温冰箱中储存备用。
1.2 血脂指标浓度测定总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)等血脂指标浓度由北京北方生物技术研究所有限公司测定。极低密度脂蛋白胆固醇(VLDL-C)浓度测定参照ELISA试剂盒说明书进行(H249,南京建成生物工程研究所)。
1.3 肝HE和油红O染色肝标本固定后,进行脱水、石蜡包埋、切片、染色等处理。切片制作由武汉赛维尔生物科技有限公司(中国武汉)完成。使用光学显微镜(IX73, Olympus, Japan)观察切片。ImageJ(V1.58,USA)用于测定切片中脂滴所占比例。
1.4 总RNA提取和cDNA合成肝组织总RNA提取参照总RNA提取试剂盒说明书进行(10606ES60,上海翊圣生物科技有限公司)。琼脂糖凝胶电泳和NanoDrop 2000(Thermo Fisher公司,USA)用于检测提取总RNA的完整性和浓度。cDNA合成试剂盒(11123ES60,上海翊圣生物科技有限公司)逆转录2 μg RNA为cDNA后,-80 ℃保存,直至qRT-PCR分析。
1.5 实时定量PCR(qRT-PCR)分析根据GenBank中绿头鸭LKB1、AMPKα1、HMGR、ACC1、SREBP1c、HNF4α、CPT1、FAS和内参β-actin序列设计荧光定量PCR引物。引物序列及目的片段长度见表 1。引物序列由通用生物公司合成。荧光定量采用HieffⓇ qPCR SYBR Green Master Mix试剂盒(11202ES08,上海翊圣生物科技有限公司)在ABI-7500仪器(Thermo Fisher公司,USA)进行。qRT-PCR反应体系(10 μL):5 μL HieffⓇ qPCR SYBR Green Master Mix,上游和下游引物各0.2 μL,0.6 μL cDNA,4 μL ddH2O。反应程序:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,重复40个循环。熔解曲线阶段按照仪器默认设置进行。采用2-△△CT法计算mRNA相对表达量。
|
|
表 1 荧光定量PCR引物信息 Table 1 Primers used for quantitative real-time PCR |
脂肪酸测定参照国标GB5009.168—2016[18]方法进行,并做适当修改。准确称取1.5 g肝组织转移至10 mL离心管。加入0.66 mL C11:0内标(1 mg·mL-1)、0.66 mL 95%乙醇和1.33 mL纯水,于全自动样品快速研磨仪中60 Hz研磨2 min。转移混合物至含有33 mg焦性没食子酸、33 mg沸石和3.3 mL盐酸(8.3 mol·L-1)烧瓶中。75 ℃水浴孵育40 min后,加入3 mL 95%乙醇、10 mL乙醚和石油醚混合物(V: V = 1:1)。振摇5 min后转移至分液漏斗中静置5 min,收集醚层提取液。重复上述步骤3次,将提取液转移至旋转蒸发仪浓缩至干,残留物即为脂肪提取物。加入1.6 mL 2% NaOH-甲醇溶液,80 ℃水浴孵化3 min。加入1.4 mL 15%的三氟化硼甲醇溶液,继续80 ℃水浴孵化3 min。待烧瓶冷却至室温后,加入正庚烷2 mL,振摇5 min,再加入3 mL饱和氯化钠水溶液,静置5 min。吸取上层正庚烷提取液1.5 mL至含有0.6 g无水硫酸钠的离心管中,振摇1 min并静置5 min后,吸取上清液1 mL,经0.22 μm有机相滤器过滤后至进样瓶中待测定。
脂肪酸甲酯分离参照陈兴勇等[19]的方法进行,并做适当修改。样品由安捷伦7890A气相色谱仪(安捷伦技术公司,USA)分析。色谱柱为DEGS毛细管柱(DB-WAX, 30 m×0.25 mm×0.25 mm)。柱温箱参数设置如下:初始柱温为60 ℃,保持2 min后,以15 ℃·min-1升高至200 ℃,然后以3 ℃·min-1升高至230 ℃,保持19 min。载气为高纯氮气,流速为0.8 mL·min-1。进样口和检测器温度为240 ℃,进样体积为1 μL,分流比为10:1。使用37种脂肪酸甲酯标准品(CDAA-252795,上海安谱实验科技有限公司)定性脂肪酸。使用C11为内标,通过公式计算各脂肪酸含量,计算公式参照国标GB5009.168—2016进行[18]。同时计算SFA、MUFA、PUFA和UFA含量。
1.7 数据统计分析采用SPSS 20.0单因素方差分析对试验数据作统计与分析,数据以“平均值±标准误”表示,若无特殊说明,样品均为15个重复。
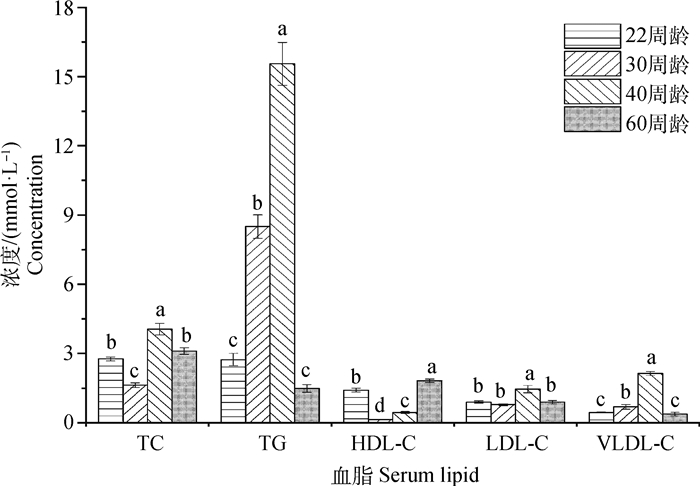
2 结果 2.1 番鸭产蛋各期血脂水平分析番鸭产蛋各期血脂水平如图 1所示,TC和LDL-C水平在40周龄显著高于22、30和60周龄(P < 0.05);TG和VLDL-C水平在各产蛋期变化规律相似,在30和40周龄显著高于22和60周龄(P < 0.05),并在40周龄均达到最大值;30和40周龄番鸭HDL-C水平显著低于22和60周龄(P < 0.05)。
|
柱上不同字母表示组间差异显著(P < 0.05)。下同 The different letters on columns represent significant difference (P < 0.05) within groups. The same as below 图 1 番鸭产蛋各期血脂水平 Fig. 1 Levels of serum lipids of Muscovy duck at different egg-laying stages |
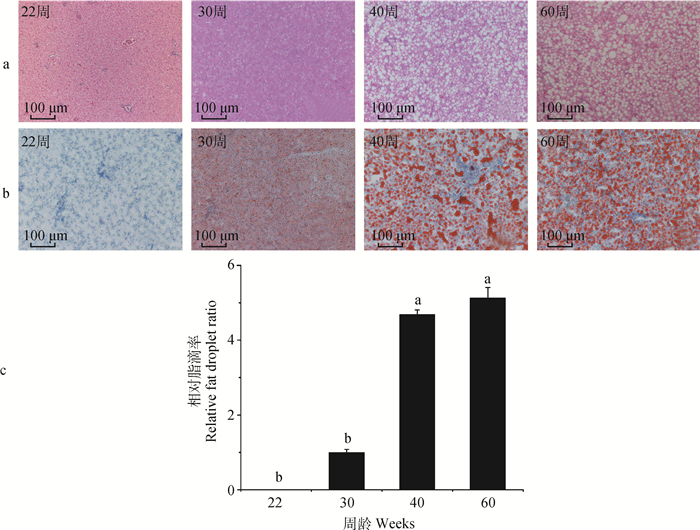
肝HE和油红O染色切片可观察到,22周龄时,肝呈实质状,此时肝细胞间无可明显观察的脂滴。30周龄时,番鸭肝细胞间有少量脂滴产生,至40周龄时,细胞间脂滴明显增多,60周龄时肝细胞间脂滴显著增加呈空泡状,经油红O染色呈连片红色。相对脂滴率在40和60周龄显著高于22和30周龄(P < 0.05,图 2)。
|
a.HE染色切片;b. 油红O染色切片;c.相对脂滴率。HE染色切片中,不同大小白色空泡代表脂滴;油红O染色切片中,红色圆圈滴代表脂滴(n=3) a. HE staining section; b. Oil Red O staining section; c. Relative fat droplet ratio. The white cavities with different sizes all mean fat droplets in HE staining sections; Red circle drops are on behalf of fat droplets in Oil Red O staining sections (n=3) 图 2 番鸭产蛋各期肝染色切片分析 Fig. 2 Analysis of liver staining sections of Muscovy duck at different egg-laying stages |
各基因在产蛋各期的表达量如表 2所示,LKB1在30周龄表达量显著低于22、40和60周龄(P < 0.05);CPT1在30、40和60周龄表达量显著高于22周龄(P < 0.05);FAS在22和40周龄表达量显著高于30周龄(P < 0.05);AMPKα1、HMGR、HNF4α、ACC1和SREBP1c在40周龄表达量显著高于22和30周龄表达量(P < 0.05)。
|
|
表 2 番鸭产蛋各期肝AMPK信号通路基因mRNA表达 Table 2 The mRNA expression level of genes in AMPK signaling pathway in the liver of Muscovy duck at different egg-laying stages |
AMPK通路基因在产蛋各期表达量如表 2所示。番鸭产蛋各期AMPKα1均处于本底水平低表达,并显著低于产蛋各期CPT1和FAS表达量(P < 0.05)。番鸭22、40和60周龄肝FAS在AMPK通路各基因中的表达量最高。HNF4α和SREBP1c在产蛋各期表达量均处于较低水平。
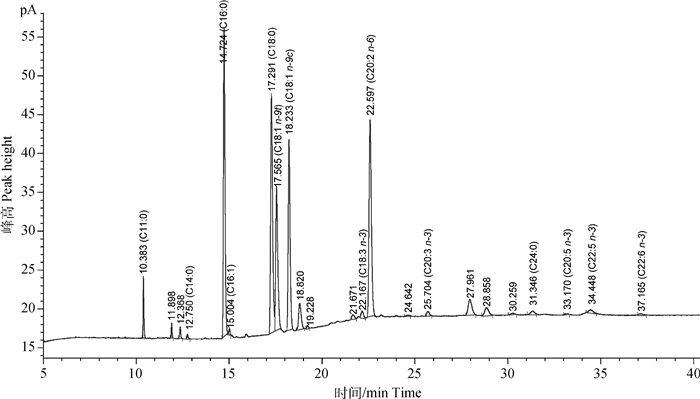
2.4 番鸭产蛋各期肝脂肪酸组成分析番鸭肝脂肪酸主要由13种脂肪酸组成(图 3)。产蛋各期肝组织中SFA、MUFA和PUFA主要由C16:0、C18:0、C18:1和C20:2 n-6构成,分别占总脂肪酸含量的32%、16%、30%和9%。C14:0、C16:0含量在40周龄显著高于22周龄(P < 0.05);C24:0在60周龄含量为0.23 g·100 g-1,显著高于22、30和40周龄(P < 0.05);C20:2 n-6和ΣPUFA含量在60周龄显著高于22和40周龄(P < 0.05,表 3)。
|
图 3 肝样品GC-MS总离子图 Fig. 3 Total ion chromatogram of liver samples by GC-MS |
|
|
表 3 产蛋各期番鸭肝脂肪酸组成(n=3) Table 3 The fatty acid composition in the liver of Muscovy duck at different egg-laying stages(n=3) |
番鸭产蛋期卵泡生长迅速,需要从血液中摄取大量极低密度脂蛋白和卵黄蛋白原等脂类物质[3]。TC为血液中所有脂蛋白所含胆固醇总和,HDL具有促进多余胆固醇从周围组织运输回肝,并最终排出体外的功能,LDL可将胆固醇从肝运输至外周组织细胞[20-21]。禽类40周龄体成熟,蛋重达到平均蛋重,蛋重增加同时伴随蛋黄重增加,需要肝向血液中输出大量卵黄脂质,因此,番鸭在40周龄时血液中TC和LDL-C水平升高,HDL-C水平降低。血液中的TG在肝中合成,主要以VLDL形式运输,最后以卵黄靶向的小型VLDLy的形式沉积在卵黄中[4],故血清中TG和VLDL-C水平在各产蛋期变化规律相似,且在30和40周龄水平显著高于22和60周龄。
3.2 番鸭肝脂肪沉积受日龄影响不同于哺乳动物,禽类脂质约90%于肝中合成。脂滴是脂质和能量稳态中心的贮藏细胞器,能促进不同细胞器之间的协调和沟通,并为细胞代谢的重要枢纽[22]。脂肪肝的产生受饲料、饲喂的影响,随日龄增加,亦会受肝脏代谢能力减弱的影响。番鸭开产后,随着机体发育成熟和饲料摄入量增加,肝合成部分脂质转化为脂滴以满足卵泡增长需要。产蛋末期,肝中甘油三酯生物合成速度超过VLDL分泌至血液及肝内脂肪酸氧化速度,过量的甘油三酯在肝积聚成脂滴。因此,随着番鸭产蛋时间的增长,肝脂滴逐渐增大。
3.3 番鸭产蛋各期AMPKα1低表达以满足肝脂质合成需要AMPK作为代谢主开关,已证实能够显著降低肝脂质生成相关基因的表达,从而抑制肝脂质生成[23]。CPT1为AMPK信号通路下游基因,为线粒体脂肪酸β-氧化的限速酶[24]。从产蛋初期到产蛋结束,肝为满足机体能量需求和脂质合成需要,处于新陈代谢旺盛期。因此,CPT1在产蛋各期表达量较高。AMPK活化可抑制FAS表达,从而抑制肝脂肪酸合成[23]。本试验中,AMPKα1本底水平低表达,以及FAS高表达,提示产蛋期肝脂肪合成可能是通过抑制AMPKα1进而促进FAS表达得以实现。22周龄时,卵巢原始卵泡激活,开始从血液中吸收大量富含蛋白质的卵黄物质,以发育成等级前卵泡,为卵泡选择做准备[25],40周龄时处于产蛋高峰期,需要大量卵黄前体物来满足卵泡快速生长需要,因此,FAS在22和40周龄表达量显著高于30周龄。SREBP1c为一种关键的脂肪生成转录因子,它直接激活多个基因的表达,促进脂肪酸摄取和甘油三酯合成[26-27]。ACC1为肝脂肪从头合成的限速酶,抑制肝ACC1表达会减少脂肪生成,增加脂肪酸氧化[28]。HMGR为胆固醇生物合成途径中关键的限速酶[29]。HNF4α为一种核受体蛋白,通过转录调控与VLDL分泌相关的基因,在维持肝脂质稳态中发挥重要作用[30]。卵泡快速生长需要肝脂质和固醇类等物质,故40周龄SREBP1c、ACC1、HMGR和HNF4α表达量显著高于22和30周龄。SREBP1c和HNF4α在产蛋各期表达量较低可能表明其在肝脂肪酸合成中起辅助作用。
3.4 番鸭产蛋中后期肝脂滴中长链脂肪酸增加脂肪酸为TG和VLDL等脂类物质重要组成部分,也是脂肪酸β-氧化的底物[31]。动物和植物组织中,以16和18个碳原子的脂肪酸最为丰富[31],故本试验中SFA主要由C16:0和C18:0组成,MUFA主要由C18:1组成。C16:0为TG和VLDL脂肪酸的重要组成部分,分别占总脂肪的25%和25.5%[32-33]。而TG和VLDL为产蛋期肝合成的重要脂类物质,因此C16:0在40周龄含量显著高于22周龄。产蛋末期,肝脏中脂滴含量高于开产前、产蛋初期和产蛋中期,可能导致C24:0含量在60周龄显著高于其他3个时期,以及C20:2 n-6含量在60周龄显著高于22和40周龄。ΣPUFA含量在60周龄显著高于22和40周龄可能是由于C20:2 n-6含量在60周龄显著高于22和40周龄所致,C20:2 n-6在PUFA中所占比例最高。
4 结论番鸭产蛋中期血清TC、TG、LDL-C及VLDL-C等血脂水平显著增加,且肝脂滴沉积明显。产蛋期通过下调AMPKα1表达,促进肝脂质合成相关基因FAS等表达上调,刺激长链脂肪酸合成,形成脂滴沉积于肝,并分泌至血液以增加血脂水平。
| [1] |
YE P F, LI M, LIAO W, et al. Hypothalamic transcriptome analysis reveals the neuroendocrine mechanisms in controlling broodiness of Muscovy duck (Cairina moschata)[J]. PLoS One, 2019, 14(5): e0207050. DOI:10.1371/journal.pone.0207050 |
| [2] |
YE P F, GE K, LI M, et al. Egg-laying and brooding stage-specific hormonal response and transcriptional regulation in pituitary of Muscovy duck (Cairina moschata)[J]. Poult Sci, 2019, 98(11): 5287-5296. DOI:10.3382/ps/pez433 |
| [3] |
朱文俊, 杨万里, 韦聪聪, 等. 番鸭产蛋前期和产蛋期肝脏组织非靶向代谢组学比较分析[J]. 中国农业大学学报, 2020, 25(12): 76-85. ZHU W J, YANG W L, WEI C C, et al. Comparative analysis of nontargeted metabolomics in liver tissue of Muscovy duck in pre-laying and laying stages[J]. Journal of China Agricultural University, 2020, 25(12): 76-85. (in Chinese) |
| [4] |
WALZEM R L, HANSEN R J, WILLIAMS D L, et al. Estrogen induction of VLDLy assembly in egg-laying hens[J]. J Nutr, 1999, 129(2S Suppl): 467S-472S. |
| [5] |
SCHMIDINGER B, WEIJLER A M, SCHNEIDER W J, et al. Hepatosteatosis and estrogen increase apolipoprotein O production in the chicken[J]. Biochimie, 2016, 127: 37-43. DOI:10.1016/j.biochi.2016.04.017 |
| [6] |
RATNA W N, BHATT V D, CHAUDHARY K, et al. Estrogen-responsive genes encoding egg yolk proteins vitellogenin and apolipoprotein Ⅱ in chicken are differentially regulated by selective estrogen receptor modulators[J]. Theriogenology, 2016, 85(3): 376-383. DOI:10.1016/j.theriogenology.2015.08.015 |
| [7] |
LI H, WANG T A, XU C L, et al. Transcriptome profile of liver at different physiological stages reveals potential mode for lipid metabolism in laying hens[J]. BMC Genomic, 2015, 16: 763. DOI:10.1186/s12864-015-1943-0 |
| [8] |
陈兴勇, 耿照玉, 廖望, 等. 一种基于脂联素基因ADP鉴定鸭繁殖性状的分子标记及其应用: 中国, 201711459759.6[P]. 2020-05-08. CHEN X Y, GENG Z Y, LIAO W, et al. Molecular marker for identifying duck reproduction trait based on adiponectin (ADP) gene and application of molecular marker: CN, 201711459759.6[P]. 2020-05-08. (in Chinese) |
| [9] |
ALVES-BEZERRA M, COHEN D E. Triglyceride metabolism in the liver[J]. Compr Physiol, 2017, 8(1): 1-8. |
| [10] |
TUMOVÁ E, TEIMOURI A. Fat deposition in the broiler chicken: a review[J]. Sci Agric Bohemica, 2010, 41(2): 121-128. |
| [11] |
KNIGHT B L, HEBBACHI A, HAUTON D, et al. A role for PPARalpha in the control of SREBP activity and lipid synthesis in the liver[J]. Biochem J, 2005, 389(Pt 2): 413-421. |
| [12] |
SKOP V, CAHOVÁ M, PAPÁČKOVÁ Z, et al. Autophagy-lysosomal pathway is involved in lipid degradation in rat liver[J]. Physiol Res, 2012, 61(3): 287-297. |
| [13] |
MA Z, LI H, ZHENG H, et al. MicroRNA-101-2-5p targets the ApoB gene in the liver of chicken (Gallus Gallus)[J]. Genome, 2017, 60(8): 673-678. DOI:10.1139/gen-2017-0020 |
| [14] |
ALVARENGA R R, ZANGERONIMO M G, PEREIRA L J, et al. Lipoprotein metabolism in poultry[J]. World's Poult Sci J, 2011, 67(3): 431-440. DOI:10.1017/S0043933911000481 |
| [15] |
DE MORENTIN P B M, GONZÁLEZ C R, SAHA A K, et al. Hypothalamic AMP-activated protein kinase as a mediator of whole body energy balance[J]. Rev Endocr Metab Disord, 2011, 12(3): 127-140. DOI:10.1007/s11154-011-9165-5 |
| [16] |
周华金, 胡希怡, 杨家昶, 等. 热应激对肉仔鸡肝AMPKα1及脂肪代谢相关分子基因表达的影响[J]. 畜牧兽医学报, 2018, 49(1): 102-110. ZHOU H J, HU X Y, YANG J C, et al. Effects of heat stress on gene expression of AMPKα1 and lipid metabolism related molecules in the liver of broiler chickens[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(1): 102-110. (in Chinese) |
| [17] |
National Research Council. Nutrient requirements of poultry[M]. 9th ed. Washington, DC: National Academy Press, 1994.
|
| [18] |
国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.168-2016食品安全国家标准食品中脂肪酸的测定[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission of the People's Republic of China, China Food and Drug Administration. GB 5009.168-2016 National food safety Stan-dard: determination of fatty acid in foods[S]. Beijing: China Standard Press, 2017. (in Chinese) |
| [19] |
陈兴勇, 赵宁, 张燕, 等. 皖西白鹅育肥期肌肉脂肪酸组成及肝PPARα、FADS2和ME1基因表达规律的研究[J]. 畜牧兽医学报, 2017, 48(10): 1912-1919. CHEN X Y, ZHAO N, ZHANG Y, et al. The fatty acid profile in muscles and expression of PPARα, FADS2 and ME1 genes in liver of Chinese Wanxi white geese in fattening period[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(10): 1912-1919. DOI:10.11843/j.issn.0366-6964.2017.10.014 (in Chinese) |
| [20] |
VON ECKARDSTEIN A, NOFER J R, ASSMANN G. High density lipoproteins and arteriosclerosis: role of cholesterol efflux and reverse cholesterol transport[J]. Arterioscler, Thromb, Vasc Biol, 2001, 21(1): 13-27. DOI:10.1161/01.ATV.21.1.13 |
| [21] |
KISS R S, SNIDERMAN A. Shunts, channels and lipoprotein endosomal traffic: a new model of cholesterol homeostasis in the hepatocyte[J]. J Biomed Res, 2017, 31(2): 95-107. |
| [22] |
OLZMANN J A, CARVALHO P. Dynamics and functions of lipid droplets[J]. Nat Rev Mol Cell Biol, 2019, 20(3): 137-155. DOI:10.1038/s41580-018-0085-z |
| [23] |
WANG Q, LIU S D, ZHAI A H, et al. AMPK-mediated regulation of lipid metabolism by phosphorylation[J]. Biol Pharm Bull, 2018, 41(7): 985-993. DOI:10.1248/bpb.b17-00724 |
| [24] |
NADA M A, ABDEL-ALEEM S, SCHULZ H. On the rate-limiting step in the β-oxidation of polyunsaturated fatty acids in the heart[J]. Biochim Biophys Acta, 1995, 1255(3): 244-250. DOI:10.1016/0005-2760(94)00223-L |
| [25] |
JOHNSON A L. Ovarian follicle selection and granulosa cell differentiation[J]. Poult Sci, 2015, 94(4): 781-785. DOI:10.3382/ps/peu008 |
| [26] |
EBERLÉ D, HEGARTY B, BOSSARD P, et al. SREBP transcription factors: master regulators of lipid homeostasis[J]. Biochimie, 2004, 86(11): 839-848. DOI:10.1016/j.biochi.2004.09.018 |
| [27] |
邢智洋, 张梦璐, 张菡, 等. 沉默SCAP基因对奶牛乳腺上皮细胞脂滴的影响[J]. 畜牧兽医学报, 2019, 50(3): 507-516. XING Z Y, ZHANG M L, ZHANG H, et al. Effect of silencing SCAP gene on lipid droplets in dairy mammary epithelial cells[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(3): 507-516. (in Chinese) |
| [28] |
KIM C W, ADDY C, KUSUNOKI J, et al. Acetyl CoA carboxylase inhibition reduces hepatic steatosis but elevates plasma triglycerides in mice and humans: a bedside to bench investigation[J]. Cell Metab, 2017, 26(2): 394-406. DOI:10.1016/j.cmet.2017.07.009 |
| [29] |
HAMPTON R Y. Proteolysis and sterol regulation[J]. Annu Rev Cell Dev Biol, 2002, 18: 345-378. DOI:10.1146/annurev.cellbio.18.032002.131219 |
| [30] |
YU D S, CHEN G, PAN M L, et al. High fat diet-induced oxidative stress blocks hepatocyte nuclear factor 4α and leads to hepatic steatosis in mice[J]. J Cell Physiol, 2018, 233(6): 4770-4782. DOI:10.1002/jcp.26270 |
| [31] |
TVRZICKA E, KREMMYDA L S, STANKOVA B, et al. Fatty acids as biocompounds: their role in human metabolism, health and disease-a review.Part 1:classification, dietary sources and biological functions[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2011, 155(2): 117-130. DOI:10.5507/bp.2011.038 |
| [32] |
TVRZICKÁ E, VECKA M, STAŇKOVÁ B, et al. Analysis of fatty acids in plasma lipoproteins by gas chromatography-flame ionization detection: quantitative aspects[J]. Anal Chim Acta, 2002, 465(1-2): 337-350. DOI:10.1016/S0003-2670(02)00396-3 |
| [33] |
ROSQVIST F, MCNEIL C A, PRAMFALK C, et al. Fasting hepatic de novo lipogenesis is not reliably assessed using circulating fatty acid markers[J]. Am J Clin Nutr, 2019, 109(2): 260-268. DOI:10.1093/ajcn/nqy304 |
(编辑 郭云雁)



