2. 内蒙古华天制药有限公司, 赤峰 024000
2. Inner Mongolia Huatian Pharmaceutical Co. Ltd., Chifeng 024000, China
家禽肠道中栖息着复杂而又处于动态平衡的肠道菌群,这些肠道菌群与宿主相互作用,对宿主健康与代谢有着重要的影响。肠道菌群代谢可以产生短链脂肪酸、氨基酸、维生素及酶类,为宿主提供营养物质[1-3]。肠道菌群还能通过竞争性排斥来抵抗病原微生物的侵袭,提高动物对肠道病原微生物的抵抗力[4]。
鸡肠道菌群具有多样性,Wei等[5]通过大数据分析发现,鸡肠道菌群可归属为13个门,117个属,以拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicute)及变形菌门(Proteobacteria)为优势菌群。鸡不同肠道区段的菌群有所差异,对18日龄肉仔鸡嗉囊、回肠和盲肠微生物菌群的研究表明,厚壁菌门丰度达60%,其次是拟杆菌门,在嗉囊和小肠中乳杆菌属(Lactobacillus)是优势菌属[6]。十二指肠和空肠因pH较低,菌群多样性也最低,有研究发现,十二指肠和空肠的乳杆菌属丰度达到了99%[7]。也有研究报道了中药对鸡及其他动物肠道菌群的影响,于佳楠等[8]发现,复方中草药能够降低变形菌门的丰度,并在属水平上显著降低瘤胃球菌属(Ruminococcus)丰度,提高考拉杆菌属(Phascolarctobacterium)丰度。李琳倩等[9]发现,中草药提高了后备母猪粪样中粪球菌属2(Coprococcus 2)、瘤胃球菌属(Ruminococcus)、拟杆菌属(Bacteroides)等的丰度,调节了动物肠道菌群。
本研究以健康白来航雏鸡为研究对象,通过一株致病性大肠杆菌引起雏鸡腹泻,选用赤芍黄柏中药制剂来进行治疗,观察其对雏鸡肠道菌群的影响,探寻肠道菌群变化在鸡腹泻性疾病中的作用,以期为生产及相关理论研究提供参考。
1 材料与方法 1.1 试验材料试验动物为15日龄健康白来航雏鸡,由通辽某孵化场提供。赤芍黄柏中药制剂由华天制药提供,每毫升含生药1 g,具体配方:赤芍与黄柏比例为4∶5(93 g∶117 g),制法为以上两味药加8倍量水煎煮3次,每次1.5 h,滤过,合并滤液,浓缩至1 mL相当于1 g原药材,即得。致病性大肠杆菌(Escherichia coli)菌种由内蒙古民族大学动物科技学院预防兽医学教研室微生物实验室在鸡体内分离并冷冻保存。
1.2 主要仪器与试剂超净台、漩涡振荡器、37 ℃恒温培养箱、电子天平、显微镜、高压灭菌锅。所用培养基主要有普通固体培养基及普通液体培养基。
1.3 雏鸡处理与饲养1.3.1 试验设计 本试验选用240只15日龄健康白来航雏鸡,随机分为对照组(CON)、感染组(BC)、低剂量治疗组(TL)及高剂量治疗组(TH),每组3个重复,每个重复20只雏鸡。BC组、TL组及TH组的雏鸡按照半数致死量(8.6×105CFU·只-1) 腹腔注射致病性大肠杆菌,CON组注射等量的灭菌生理盐水。TL组及TH组在感染后0.5 d使用赤芍黄柏制剂治疗,制剂按不同的剂量与灭菌水充分混匀,每日两次饮水,CON组及BC组正常饮用灭菌水,所有试验组饲料均不进行处理,连续治疗5 d。感染1 d后,每天记录发病数与死亡数。
1.3.2 饲养管理 雏鸡在室内饲养,温度控制在35 ℃左右,随着雏鸡日龄增长适当降低温度。饲养雏鸡前1周先对饲养环境使用0.5%的新洁尔灭进行消毒,包括地面、墙壁、饮水器、饲喂器等。每日定时更换鸡笼下垫的报纸,并使用0.5%的新洁尔灭对鸡笼进行消毒。每日观察雏鸡的精神状态,做好记录并保存死亡雏鸡。
1.3.3 中药饮水的制备 中药制剂为赤芍与黄柏混合物,由华天制药提供。TL组赤芍黄柏制剂与灭菌水浓度配比为4 mL·L-1,TH组赤芍黄柏制剂与灭菌水浓度配比为12 mL·L-1,CON组与BC组雏鸡均饮用灭菌水。
1.4 样本采集与处理试验结束后,每个重复随机选取3~4只雏鸡放血处死,随后无菌状态下解剖留取十二指肠内容物及黏膜装于1.5 mL离心管,-80 ℃留存备用。
1.5 肠道菌群多样性的测定取存于-80 ℃的肠道内容物与黏膜混合样品约0.5 g,按照MP-bio土壤DNA提取试剂盒说明书进行细菌基因组的提取。首先,针对16S rRNA基因的V3~V4区设计引物(338F:5′-ACTCCTACGGGAGGCAGCAG-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′),引物两端带有12 bp的barcode,用以识别不同样品的序列。然后进行PCR扩增,程序如下:95 ℃预变性5 min,之后进入扩增循环,循环过程为95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,循环数为35,最后是72 ℃延伸10 min。使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,CA,USA) 进行纯化。根据Illumina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE 2*300的文库。构建好的文库经过Qubit定量和检测合格后,基于Illumina Miseq PE300平台进行高通量测序(上海美吉生物工程有限责任公司)。
1.6 肠道菌群分析对原始序列使用Trimmomatic软件质控,主要包括去除尾部质量值低于20(即碱基错误率低于1%)的序列,去除低于50 bp及含N碱基的序列。根据双端序列之间的重叠关系,使用FLASH软件进行拼接、所得序列使用QIIME进行分类学鉴定和α多样性分析(Shannon、Simpson、Sobs、Ace、Chao)。使用Uparse(vsesion 7.1 http://drive5.com/uparse/)平台,基于97% 相似性水平上对所得序列进行OTU聚类分析,并采用RDP classifier贝叶斯算法对OTU代表序列进行分类学分析,序列对比数据库Silva(Release132 http://www.arb-silva.de)。
1.7 统计分析使用R语言进行物种组成、主成分(PCA)统计分析和作图。采用R语言pheatmap包对染毒组及其处理组雏鸡肠道菌群进行环境因子的关联性分析。所得数据采用“平均数±标准差”表示,采用SPSS19.0软件,对雏鸡发病率及死亡率采用ANOVA检验不同组间差异性,对所得菌群序列数据及其多样性采用Kruskal-Wallis H test检验进行样本间的显著性分析,P < 0.05表示差异显著,P>0.05表示差异不显著。
2 结果 2.1 赤芍黄柏制剂对致病性大肠杆菌感染雏鸡的治疗效果发病雏鸡表现为精神委顿、耳耷头低、不思饮水、拉稀便、眼半闭、不鸣叫、反应迟钝、缩颈。剖检后发现肝组织淤血,表面有部分坏死;脾肿大出血;部分雏鸡心表面有纤维素性渗出,呈心包炎症状;气囊混浊,肾肿大充血,肠系膜出血,腹腔内有淡黄色积液,伴有臭味。治疗5 d后,BC组和TL组发病率和死亡率都显著高于CON组,TH组的发病率和死亡率显著高于CON组但低于BC组和TL组(P < 0.05,表 1)。
|
|
表 1 赤芍黄柏制剂对致病性大肠杆菌感染雏鸡的治疗效果 Table 1 Therapeutic effect of Radix paeoniae rubra and Cortex phellodendri preparation on chickens against pathogenic Escherichia coli |
对样本的原始测序数据进行系列质控后得到有效序列数据,结果显示共获得671 993个有效序列,平均序列长度428 bp。4组肠道菌群共获得28个门、50个纲、106个目、167个科、287个属、375个种及474个OTUs。优化序列和OTU数量在各组间无显著差异(P>0.05,表 2)。
|
|
表 2 肠道菌群有效序列及OTU数量分析 Table 2 Effective sequence and OTU quantitative analysis of intestinal bacterial community |
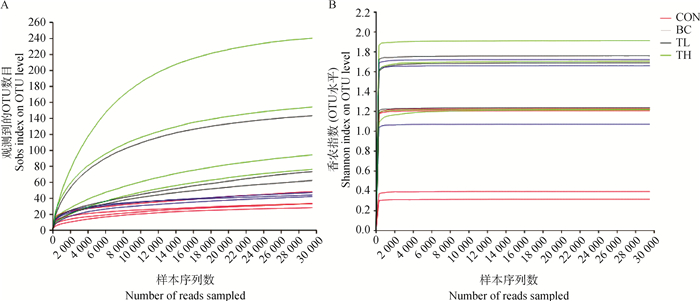
对各组肠道菌群序列抽平至序列数位29 568后,进行α多样性分析,分析指标包括物种多样性指数(Shannon、Simpson)和物种丰富度指数(Sobs、Ace、Chao)。结果显示,Sobs指数和Ace指数在TL和TH组显著高于CON组,CON组的Simpson指数显著高于其他各组,而Chao指数显著低于其他各组(P < 0.05,表 3)。稀释曲线(Rarefaction curve)及香农-威尔曲线(Shannon-Wiener)均趋于平坦,说明测序数据量合理,能够反映样品中主要的菌群多样性信息(图 1)。由Sobs、Chao指数可见,添加赤芍黄柏制剂显著增加了物种丰富程度(P < 0.05)。
|
|
表 3 肠道菌群α多样性指数分析 Table 3 Analysis of α-diversity index of intestinal bacterial community |
|
图 1 肠道样本稀释曲线(A)及香农指数曲线(B) Fig. 1 Rarefaction curves (A) and Shannon curves (B) of gut bacterial community |
主成分分析显示(图 2),鸡肠道样品聚类明显,所有样品可以聚类为3个类群:CON组的样品单独聚类,TH组样品单独聚类,BC及TL的样本聚类在一起。Adonis分析显示,组间差异显著(R2=0.52, P=0.005)。

|
图 2 不同处理对雏鸡肠道菌群影响的主成分分析(PCA) Fig. 2 Principal component analysis (PCA) showed the difference of gut bacterial community between groups |
厚壁菌门在各组占绝对优势,其丰度在CON组为96.96%、在BC组为62.57%、在TL组为97.41%、TH组为94.94%。变形菌门(Proteobacteria)在某些处理组中也占有一定的丰度,CON为2.89%,BC为37.39%,TL为2.30%,TH为2.13%。此外,TH组尚有ε-变形菌纲丰度为1.91%(图 3)。

|
图 3 门分类水平的雏鸡肠道菌群变化 Fig. 3 The intestinal bacterial community of chick at the phylum level |
在目水平上,各组雏鸡肠道菌群丰度差别较大。CON组优势菌群为乳杆菌目(Lactobacillales),丰度为96.03%,其他丰度大于1%的菌属为肠杆菌目(Enterobacteriales)(2.67%)。BC组优势菌群有3个菌目,即乳杆菌目(42.77%)、芽孢杆菌目(Bacillales)(19.79%)、肠杆菌目(34.41%)。其他丰度大于1%的尚有:假单胞菌目(Pseudomonadales)(2.96%)。TL组优势菌群有乳杆菌目(68.12%)和芽孢杆菌目(29.03%)。其他丰度大于1%的有肠杆菌目(1.44%)。TH组优势菌群为乳杆菌目(90.93%),丰度在1%以上菌属为芽孢杆菌目(3.11%)、弯曲菌目(Campylobacterales)(1.91%)、β- 变形菌目(Betaproteobacteriales)(1.46%)(图 4)。

|
图 4 目分类水平的雏鸡肠道菌群变化 Fig. 4 The intestinal bacterial community of chick at the order level |
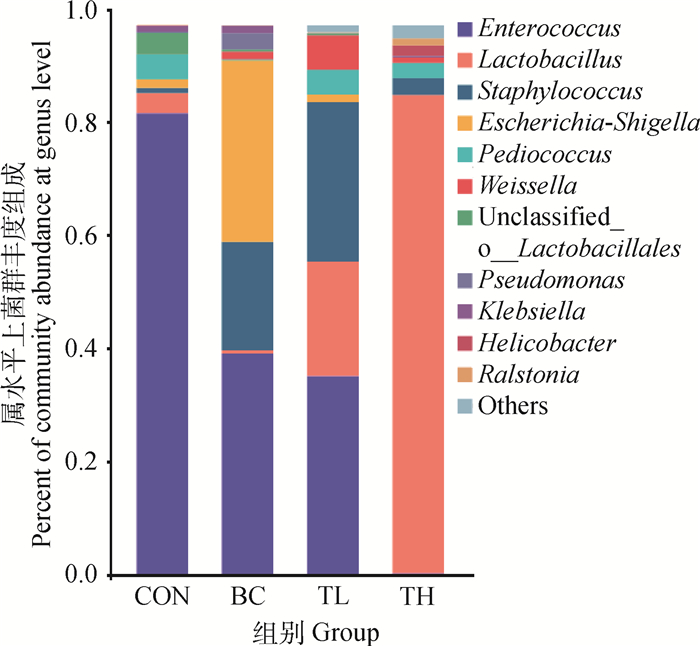
在属水平上空白对照组和试验组肠道菌群丰度差别较大(图 5)。CON组优势菌群为肠球菌属(Enterococcus),丰度为83.92%,其他丰度大于1%的菌属分别为乳球菌属(Lactobacillus)(3.70%)、片球菌属(Pediococcus)(4.49%)、大肠杆菌属(Escherichia)(1.58%),克雷伯氏菌属(Klebsiella)(1.09%)。BC组优势菌群有3个菌属,即肠球菌属(40.12%)、葡萄球菌属(19.79%)及大肠杆菌志贺氏菌属(33.03%)。其他丰度大于1%的尚有: 假单胞菌属(Pseudomonas)(2.96%)、魏斯氏菌属(Weissella)(1.45%)、克雷伯氏菌属(1.38%)。TL组优势菌群也有3个菌属,即肠球菌属(36.11%)、葡萄球菌属(29.01%)、及乳杆菌属(20.80%)。其他丰度大于1%的尚有片球菌属(4.49%)、魏斯氏菌属(6.29%)大肠杆菌属(1.42%)。TH组优势菌群为乳酸杆菌(Lactobacillus)(87.09%),丰度在1%以上菌属为葡萄球菌属(3.08%),片球菌属(2.71%)、螺杆菌属(Helicobacter) (1.88%)、罗尔斯通菌属(Ralstonia)(1.28%)。
|
图 5 属水平上雏鸡肠道菌群 Fig. 5 The intestinal bacterial community of chick at genus level |
差异显著性分析显示,肠球菌属在CON组显著高于其他各组,在BC组显著高于TH组(P < 0.05)。乳杆菌属在TH组显著高于其他各组,葡萄球菌属在TL组显著高于其他各组,埃希氏菌属在BC组显著高于其他各组(P < 0.05,表 4)。
|
|
表 4 属水平上雏鸡各组样本主要肠道菌群的相对丰度 Table 4 Relative abundance of main intestinal microflora in chicks of different treatment groups at genus level |
相关性heatmap图通过相关性数值能够可视化展示样本中不同物种与环境变量之间的关系,评估微生物分类与环境变量之间的相关性。通过对感染雏鸡肠道菌群与其发病率和死亡率的相关性进行分析,结果显示,大肠杆菌属及肠球菌属与发病率和死亡率成正相关,而乳杆菌属与发病率和死亡率成负相关(P < 0.05)。葡萄球菌属与发病率成正相关(P < 0.05,图 6)。

|
图 6 热图分析环境因子与肠道菌群物种之间相关性 Fig. 6 Relationship of gut bacterial community with environmental factors analyzed by thermography |
中药制剂在我国有着悠久的历史,中药制剂具有很多优势,因其副作用较小、治本作用较好、价格便宜、临床疗效确切而被广泛应用于临床[10]。研究发现,赤芍具有免疫活性、抗菌活性、抗病毒活性、抗氧化活性和抗炎作用等[11]。赤芍化学成分和药理作用较为明确,在临床上多与黄柏配伍使用。在临床方面,黄柏具有降血糖、降血压、免疫抑制等多种药理作用[12]。因中草药不易产生耐药性,并且能调节机体免疫力等优点使其在家禽疾病预防的应用中更具价值[13]。本研究发现,赤芍黄柏制剂对雏鸡感染致病性大肠杆菌的治疗及预防具有很好的效果,并且高剂量治疗组比低剂量治疗组效果好。因此,本试验条件下,建议以剂量为12 mL·L-1的饮水(1 g·mL-1生药)治疗雏鸡大肠杆菌性腹泻。
在健康的肠道中存在着多种微生物,它们与机体之间相互作用,保持着动态平衡,如果这种平衡被打破,机体便可能会患肠道疾病。稳定的肠道菌群与人体能量的摄取、代谢以及免疫系统疾病有关[14]。由于鸡十二指肠pH低,肠道菌群比较单一,因此,对这一肠段的肠道菌群进行考察可以更为显著地发现不同处理对雏鸡肠道菌群的影响。
本研究显示,在门水平上,雏鸡十二指肠以厚壁菌门为主,感染后增加了变形菌门的丰度,降低了厚壁菌门的丰度。其他对于盲肠和回肠的研究显示了与本试验不同的结果。罗雯等[15]研究显示,宁都黄鸡盲肠菌群以拟杆菌门丰度最大,厚壁菌门次之;梁小瑞等[16]研究显示,肉鸡盲肠厚壁菌门为优势菌群;而Han等[6]研究显示,回肠以厚壁菌门为优势菌门。这些研究表明,不同鸡品种、不同肠段以及不同饮食条件下鸡肠道菌群是存在着一定差异的。
本试验结果显示,在属水平上,对照组雏鸡十二指肠肠道菌群以肠球菌属为主。肠球菌属是动物肠道正常的菌群,大部分不引起动物疾病,如粪肠球菌对大肠杆菌、肠炎耶尔森菌和普通变形杆菌致病菌具有抑菌作用,被认为是可以提高畜禽抗病力和生产性能的益生菌[17-18]。与本研究有所差异的是,Ewers等[19]研究显示,肉鸡盲肠拟杆菌属丰度最大,其次是粪杆菌属。
本研究显示,大肠杆菌的感染显著增加了鸡肠道菌群中大肠杆菌属及葡萄球菌属的丰度,降低了肠球菌属丰度。大肠杆菌属的一些种类是重要的致病菌,如致病性大肠杆菌常引起动物腹泻,在世界范围内引起了人类及动物极大的发病率和死亡率[20-21]。有研究发现,对肉鸡腹腔注射志贺菌后,免疫组化和电镜结果显示,志贺菌可以侵入肠道上皮,引起鸡肠道病理学变化[22]。由此推测,本试验中感染组肠道中志贺菌丰度的增长可能来源于注射的菌株入侵肠道后增殖所致。而梁小瑞等[19]也使用大肠杆菌注射感染肉仔鸡,显示感染后肉仔鸡盲肠肠道菌群发生了轻微的变化,如拟杆菌属丰度有所降低,粪杆菌属及乳杆菌属丰度有所升高。与本试验结果的差异可能是由于肠道部位的不同及感染菌株的不同所致。本研究显示,葡萄球菌属丰度在感染组显著高于对照组。葡萄球菌属中的金黄色葡萄球菌是一种条件性致病菌,可在人类和动物中引起广泛的疾病[23]。本研究对葡萄球菌属和鸡的发病率做的相关性分析也显示了葡萄球菌属与鸡发病率成正相关。
乳杆菌属为益生菌,具有良好的产有机酸性能,该属在食品发酵或人类及动物健康方面有广泛应用,如鼠李糖乳杆菌用来提高人类或动物的免疫力及生长繁殖性能[24-25],干酪乳杆菌不但可以用来制作酸奶,还能增强人类免疫力,促进急性腹泻和关节炎的康复[26-27]。本研究发现,赤芍黄柏制剂可以降低雏鸡肠道菌群多样性,提高乳杆菌属的丰度。乳杆菌属在低剂量赤芍黄柏制剂处理后有一定量的增加,在高剂量赤芍黄柏制剂处理组则达到了最大值(87.09%)。本试验结果显示,高剂量组发病率和死亡率显著降低,由相关性热图分析可见,乳杆菌属与感染雏鸡发病率和死亡率呈负相关,说明乳杆菌属对大肠杆菌感染引起的腹泻具有一定的治疗作用。同时,肠球菌属及葡萄球菌属丰度随着赤芍黄柏剂量的增加而降低。在属水平上空白对照组和实验组肠道菌群丰度差别较大。
肠道内乳杆菌属及粪肠球菌均为益生菌。本研究发现,赤芍黄柏制剂极大地促进了乳杆菌属的增长,由空白对照组3.7%的丰度增加到高剂量组的87.09%,丰度增加了23.54倍。本研究使用环境因子关联性分析发现,乳杆菌属的发病率及死亡率呈负相关,表明它能够抑制大肠杆菌的增长,促进肠道菌群的平衡,对疾病的预防及治疗具有一定的效果。本研究显示,肠球菌属与发病率和死亡率在处理组之间呈正相关,这可能是由于处理组乳杆菌属丰度的增加引起的一种被动关系,因为对照组中肠球菌属丰度也很高,但其发病率和死亡率很低。肠球菌属是健康动物肠道中主要的常存菌群,包括的种类和作用复杂,既有益生菌,又有条件性致病菌,其在动物肠道菌群中的作用尚需深入研究[28]。
4 结论本研究结果表明,饮水中添加赤芍黄柏中药制剂可治疗致病性大肠杆菌引起的肠道疾病,使大肠杆菌感染的雏鸡发病率及死亡率降低。大肠杆菌感染及赤芍黄柏制剂治疗均可改变雏鸡肠道菌群丰富度及多样性。大肠杆菌感染使十二指肠肠道大肠杆菌属及葡萄球菌属丰度增加,赤芍黄柏中药制剂的使用可使乳杆菌属丰富度增加。环境因子关联性分析认为,乳杆菌属在提高雏鸡抗病力方面起到正相关的作用,而大肠杆菌属的增加会提高雏鸡发病率和死亡率。综合认为,饮水中添加赤芍黄柏制剂可使雏鸡肠道内物种多样性和丰富度降低,益生菌丰度增加,有害菌受到抑制,从而改善胃肠道疾病。研究结果将对生产和科学研究提供有价值的参考。
| [1] |
马青山, 张瑞涛, 王长法, 等. 肠道菌群及其功能代谢物对脂肪代谢及肌内脂肪沉积影响的研究进展[J]. 畜牧兽医学报, 2020, 51(12): 2921–2933.
MA Q S, ZHANG R T, WANG C F, et al. Research progress on the effects of gut microbiota and its functional metabolites on fat metabolism and intramuscular fat deposition[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(12): 2921–2933. DOI: 10.11843/j.issn.0366-6964.2020.12.002 (in Chinese) |
| [2] | GASKINS H R. Intestinal bacteria and their influence on swine growth[M]//LEWIS A J, SOUTHERN L L. Swine Nutrition. 2nd ed. Boca Raton: CRC Press, 2000. |
| [3] | SAVAGE D C. Gastrointestinal microflora in mammalian nutrition[J]. Annu Rev Nutr, 1986, 6: 155–178. DOI: 10.1146/annurev.nu.06.070186.001103 |
| [4] | SNEL J, HARMSEN H J, VAN DER WIELEN P W, et al. Dietary strategies to influence the gastrointestinal microflora of young animals, and its potential to improve intestinal health[M]//BLOK M C, VAHL H A, DE LANGE L, et al. Nutrition and Health of the Gastrointestinal Tract: Dietary strategies to influence the gastrointestinal microflora of young animals, and its potential to improve intestinal health. Wageningen, Netherlands: Wageningen Academic Publishers, 2002: 37-69. |
| [5] | WEI S, MORRISON M, YU Z. Bacterial census of poultry intestinal microbiome[J]. Poult Sci, 2013, 92(3): 671–683. DOI: 10.3382/ps.2012-02822 |
| [6] | HAN G G, KIM E B, LEE J, et al. Relationship between the microbiota in different sections of the gastrointestinal tract, and the body weight of broiler chickens[J]. SpringerPlus, 2016, 5(1): 911. DOI: 10.1186/s40064-016-2604-8 |
| [7] | YEOMAN C J, CHIA N, JERALDO P, et al. The microbiome of the chicken gastrointestinal tract[J]. Anim Health Res Rev, 2012, 13(1): 89–99. DOI: 10.1017/S1466252312000138 |
| [8] |
于佳楠, 王晶, 陈贝妮, 等. 复方中草药添加剂对芦花鸡生长性能及肠道菌群结构的影响[J]. 中国兽医学报, 2020, 9(40): 1832–1835.
YU J N, WANG J, CHEN B N, et al. Effects of compound Chinese herbal medicine additives on growth performance, blood biochemical indexes and intestinal flora of Luhua chicken[J]. Chinese Journal of Veterinary Science, 2020, 9(40): 1832–1835. (in Chinese) |
| [9] |
李琳倩, 张云龙, 刘日亮, 等. 中草药添加剂对后备母猪生长性能、发情率、血清指标和肠道微生物的影响[J]. 动物营养学报, 2020, 32(6): 2586–2600.
LI L Q, ZHANG Y L, LIU R L, et al. Effects of compound Chinese herbal medicine on growth performance, estrus rate, serum indices and intestinal microflora of replacement gilts[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2586–2600. DOI: 10.3969/j.issn.1006-267x.2020.06.018 (in Chinese) |
| [10] |
顾小军. 浅析中药制剂在治疗心血管疾病方面的合理使用[J]. 中西医结合心血管病电子杂志, 2018, 6(34): 16.
GU X J. Analysis of rational use of traditional Chinese medicine preparation in the treatment of cardiovascular diseases[J]. Cardiovascular Disease Journal of Integrated Traditional Chinese and Western Medicine, 2018, 6(34): 16. DOI: 10.3969/j.issn.2095-6681.2018.34.011 (in Chinese) |
| [11] |
孟广杰, 刘静, 朴成玉, 等. 赤芍相关药对配伍比例与药理作用研究进展[J]. 中医药学报, 2020, 48(5): 30–34.
MENG G J, LIU J, PIAO C Y, et al. Research progress on the compatibility ratio and pharmacological effect of Radix Paeoniae Rubra related drug pair[J]. Acta Chinese Medicine and Pharmacology, 2020, 48(5): 30–34. (in Chinese) |
| [12] |
李嘉诚, 吴岚, 蔡同凯, 等. 黄柏化学成分及其药理作用研究进展[J]. 药学实践杂志, 2018, 36(5): 389–391, 398.
LI J C, WU L, CAI T K, et al. Research progress of Cortex Phellodendri in the chemical constituents and their pharmacological effects[J]. Journal of Pharmaceutical Practice, 2018, 36(5): 389–391, 398. DOI: 10.3969/j.issn.1006-0111.2018.05.002 (in Chinese) |
| [13] |
郭全海, 王留, 王中华. 中药组方与西药治疗犬大肠杆菌病效果的对比试验[J]. 广东畜牧兽医科技, 2018, 43(2): 27–29.
GUO Q H, WANG L, WANG Z H. Contrast test on the therapeutic efficacy of traditional Chinese medicine and Western medicine in treating E.coli disease in canines[J]. Guangdong Journal of Animal and Veterinary Science, 2018, 43(2): 27–29. DOI: 10.3969/j.issn.1005-8567.2018.02.010 (in Chinese) |
| [14] |
王冉, 包红霞. 肠道菌群代谢产物与宿主疾病[J]. 中国现代应用药学, 2020, 37(23): 2936–2944.
WANG R, BAO H X. Metabolites of intestinal flora and host diseases[J]. Chinese Journal of Modern Applied Pharmacy, 2020, 37(23): 2936–2944. (in Chinese) |
| [15] |
罗雯, 艾佐佐, 饶友生, 等. 肉鸡盲肠微生物群落特征与体质量的相关性[J]. 西北农业学报, 2020, 29(4): 502–511.
LUO W, AI Z Z, RAO Y S, et al. Correlration analysis of cecal microbiota and body mass of broilers[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2020, 29(4): 502–511. (in Chinese) |
| [16] |
梁小瑞, 王丹阳, 乔彦杰, 等. 三味清热类中药水提物对肉仔鸡肠道菌群和黏膜屏障功能的影响[J]. 中国畜牧兽医, 2020, 47(7): 2043–2054.
LIANG X R, WANG D Y, QIAO Y J, et al. Effects of water extract of three Qingre Chinese medicine on intestinal flora and mucosal barrier function of broilers[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(7): 2043–2054. (in Chinese) |
| [17] |
鲍延娥, 董晓芳, 佟建明, 等. 粪肠球菌益生特性的体外评价[J]. 西北农业学报, 2013, 22(11): 202–207.
BAO Y E, DONG X F, TONG J M, et al. Evaluation of probiotic characteristics of Enterococcus faecalis in vitro[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2013, 22(11): 202–207. DOI: 10.7606/j.issn.1004-1389.2013.11.035 (in Chinese) |
| [18] |
王佳慧, 姜仲文, 满永恒, 等. 粪肠球菌BN6株的体外益生特性评价[J]. 中国兽医科学, 2021, 51(3): 337–342.
WANG J H, JIANG Z W, MAN Y H, et al. Evaluation of probiotic characteristics of Enterococcus faecalis BN6 isolate in vitro[J]. Chinese Veterinary Science, 2021, 51(3): 337–342. (in Chinese) |
| [19] | EWERS C, ANTÃO E M, DIEHL I, et al. Intestine and environment of the chicken as reservoirs for extraintestinal pathogenic Escherichia coli strains with zoonotic potential[J]. Appl Environ Microbi, 2009, 75(1): 184–192. DOI: 10.1128/AEM.01324-08 |
| [20] | ALONSO M Z, PADOLA N L, PARMA A E, et al. Enteropathogenic Escherichia coli contamination at different stages of the chicken slaughtering process[J]. Poult Sci, 2011, 90(11): 2638–2641. DOI: 10.3382/ps.2011-01621 |
| [21] | SHI R, YANG X, CHEN L, et al. Pathogenicity of Shigella in chickens[J]. PLoS One, 2014, 9(6): e100264. DOI: 10.1371/journal.pone.0100264 |
| [22] | LEONARD F C, MARKEY B K. Meticillin-resistant Staphylococcus aureus in animals: a review[J]. Vet J, 2008, 175(1): 27–36. DOI: 10.1016/j.tvjl.2006.11.008 |
| [23] | PRESCOTT S L, WICKENS K, WESTCOTT L, et al. Supplementation with Lactobacillus rhamnosus or Bifidobacterium lactis probiotics in pregnancy increases cord blood interferon-γ and breast milk transforming growth factor-β and immunoglobin a detection[J]. Clin Exper Alle, 2008, 38(10): 1606–1614. DOI: 10.1111/j.1365-2222.2008.03061.x |
| [24] | GIOACCHINI G, MARADONNA F, LOMBARDO F, et al. Increase of fecundity by probiotic administration in zebrafish (Danio rerio)[J]. Reproduction, 2010, 140(6): 953–959. DOI: 10.1530/REP-10-0145 |
| [25] | SPANHAAK S, HAVENAAR R, SCHAAFSMA G. The effect of consumption of milk fermented by Lactobacillus casei strain Shirota on the intestinal microflora and immune parameters in humans[J]. Eur J Clin Nutr, 1998, 52(12): 899–907. DOI: 10.1038/sj.ejcn.1600663 |
| [26] | ISOLAURI E, JUNTUNEN M, RAUTANEN T, et al. A human Lactobacillus strain (Lactobacillus casei sp strain GG) promotes recovery from acute diarrhea in children[J]. Pediatrics, 1991, 88(1): 90–97. |
| [27] | WAITAYANGKOON P, SENGPRASERT P, SAWATPANICH A, et al. Lactobacillus casei l39 as a potential disease-modifying treatment for knee osteoarthritis by reducing intraarticular inflammation[J]. Osteoarthr Cartilage, 2020, 28(Suppl 1): S476–S477. |
| [28] | MURRAY B E. The life and times of the Enterococcus[J]. Clin Microbiol Rev, 1990, 3(1): 46–65. DOI: 10.1128/CMR.3.1.46 |



