犊牛腹泻是世界范围内引起犊牛疾病最重要的因素[1]。引起犊牛腹泻的病毒主要有牛星状病毒(bovine astroviruses,BAstV)、牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)、牛冠状病毒(bovine coronavirus,BCV)和牛轮状病毒(bovine rotavirus,BRV)等。这四种病毒在国内均有流行。据调查在发生腹泻的犊牛粪便中BAstV阳性率为5.2%~9.9%[2-4]。对于BVDV,虽然在犊牛耳缘组织和血液中病毒阳性率较低,但血液抗体阳性率较高,达15.94%~91.10%,且主要为BVDV-1型[5-7]。BCV在具腹泻症状犊牛粪便样本中的抗原阳性率为0.0%~26.4%[2, 4, 8-10]。BRV在中国具腹泻症状犊牛粪便样本中的抗原阳性率为9.20%~ 73.83%[2, 4, 9-12]。
星形病毒是鸟类和哺乳动物腹泻疾病的致病因素[13],Mitchell等[14]发现从腹泻前1~8 d开始至腹泻停止后的1~20 d能检测到星状病毒排毒。BAstV感染1~4月龄犊牛将导致排大量水样棕褐色至黄色的粪便和黏液等症状的严重的急性肠道疾病,多数症状在发病后5~7 d消失,少数则会演变为慢性病,导致明显的发育延迟和少毛症[15]。BVDV非细胞病变型和细胞病变型感染犊牛后均会导致一些温和的急性呼吸道疾病和腹泻的症状:感染后3~5 d开始出现精神沉郁,拒食,体温高达41.9 ℃,从鼻腔和眼睛排出浆液性分泌液,短期血便,白细胞减少症(可低至2 700个·mm-3),并且呼吸器官及肠道有肉眼可见的变化。这些感染的动物大多在感染后12~15 d后恢复,并且90%的病例在感染25 d后形成体液免疫[16]。非细胞病变型BVDV急性感染妊娠25~90 d的母牛,通过抑制干扰素tau刺激的子宫内膜Ⅰ型干扰素刺激基因的产生等原因使病毒逃避子宫内膜中的宿主检测,穿过胎盘进入免疫系统未发育完全的胎儿建立持续感染,持续感染的牛终身排毒[17-20]。BCV和BRV是牛最常见的病毒性肠道病原体[21]。BCV是犊牛肠胃炎和呼吸系统疾病,泌乳牛冬季痢疾和饲养场牛运输性肺炎的主要原因[22]。Boileau等[23]用BCV感染犊牛,感染后48 h内排出高水平的病毒,这种情况可持续至14 d。而Oma等[24]以自然感染BCV的牛与阴性牛混群感染,得到牛感染后间歇性地排毒,鼻排毒虽早于粪便排毒,但鼻排毒到第28天,而粪便排毒可达35 d,且排毒高峰伴随精神沉郁和咳嗽,高峰一周后达到最高的呼吸频率和直肠温度。Grover等[25]用夹心ELISA检测验证了BRV感染犊牛后能持续排毒5~8 d,且出现腹泻症状后1~2 d病毒滴度最高。鉴于各种病毒在感染后的排毒时间不同,依据单次的核酸定量检测结果不足以确定感染病原的主次,应结合临床表现进行综合判断或间隔一定时间重复检测一次。
为了辅助临床兽医准确诊断犊牛腹泻的病因以及开展流行病学监测,迫切需要能够鉴别这四种病毒的实验室检验方法。而在多病原鉴别检验方法中,荧光定量PCR方法是目前最可靠和准确的方法之一。对于以上四种犊牛腹泻常见病毒的Real-time PCR方法,现已建立同时检测BVDV与牛传染性鼻气管炎病毒[26-27],BVDV与HoBi样瘟病毒[28],BVDV与牛细小病毒[29],BCV与环曲病毒[21]以及BCV与BRV[30]等两种病原的方法,甚至同时检测BVDV、牛传染性支气管炎病毒与口蹄疫病毒[31]以及BVDV、BCV和牛肠道病毒[32]等三种病原的方法。而对于BAstV,由于研究较少,暂时未有建立与其他病原同时检测的Real-time PCR方法。由于现有的Real-time PCR方法暂未能涵盖在国内流行的四种犊牛腹泻常见病毒,作者选择BAstV、BVDV、BCV和BRV这四种病毒建立四重荧光定量RT-PCR方法,以减少检测次数,进而缩短诊断时间,为及时治疗作出指导。
1 材料与方法 1.1 试验材料1.1.1 病毒株和菌株 BAstV B76-2/HK株、BVDV 1型JL株(BVDV-JL)、BVDV 2型HLJ-10株(BVDV- HLJ-10)、BCV Aks-01新疆南疆株(BCV-Aks-01)、BRV G8P[1]型NX23株(BRV-NX23)、牛腺病毒3型HLJ0955株和牛副流感病毒3型SD0835株由本实验室保存。牛支原体PG45株购自美国模式菌种收集中心。牛支原体NM2012株、牛传染性鼻气管炎病毒BK1295株、肠炎沙门菌CVCC3949株、多杀性巴氏杆菌CVCC391株购自中国兽医微生物菌种保藏管理中心。
1.1.2 临床样品 北京市大兴区奶牛粪样88份,北京市昌平区奶牛粪样20份,天津市武清区牛粪样17份,牛抗凝血17份,牛胃内容物10份,牛肺研磨液10份,牛脾研磨液10份,牛口腔黏液7份。
1.1.3 主要试剂 病毒基因组RNA提取试剂盒购自天根生化科技(北京)公司,One Step PrimeScriptTM RT-PCR Kit (Perfect Real Time)购自宝生物(大连)公司,氨苄青霉素、pEASY-T1克隆质粒,Trans1-T1 Phage Resistant Chemically Competent Cell,EasyTaq PCR Mix,TransTaq HiFi PCR Mix I,TransScript cDNA合成Mix,TransScript® Ⅱ One-Step RT-PCR SuperMix等购自北京全式金生物技术公司,细菌基因组DNA提取试剂盒、琼脂糖凝胶纯化回收试剂盒、质粒小量提取试剂盒等购自北京艾德莱生物科技公司。
1.1.4 仪器设备 Biometra GmbH PowerCycler SL 96 Gradient常规PCR仪、LightCycler®96 Real-time PCR仪、ThermoFisher NanoDrop 2000c全自动核酸微量测定仪。
1.1.5 引物与探针 分别在BAstV ORF2基因、BVDV-1 5′端非编码区、BCV N pro基因和BRV基因VP6保守区域设计并合成引物及探针,并采用扩增星状病毒的pol基因[34]、BVDV的5′UTR[35]、BCV的N pro[36]和A群轮状病毒的VP6基因[30]的方法作为对照,相应序列见表 1。
|
|
表 1 引物及探针信息 Table 1 Primer and probe information |
1.2.1 重组质粒的制备 使用病毒基因组RNA提取试剂盒,分别提取BAstV B76-2/HK株、BVDV JL株、BCV Aks-01株、BRV NX23株的全基因组RNA,将BAstV、BVDV和BCV的全基因组RNA反转录为cDNA,分别使用引物C-BAstVF-2、C-BAstVR-2,BVDVF-1、BVDVR-1和BCVF-2、BCVR-2对BAstV、BVDV、BCV的cDNA进行PCR,电泳并胶回收获得目的片段。BRV的全基因组RNA在95 ℃ 5 min后置于冰上,采用One-Step RT-PCR使用引物BRV-F6、BRV-R6对处理后的BRV的RNA进行PCR, 电泳并胶回收获得BRV的目的片段。将回收产物连接到pEASY-T1克隆质粒上,通过大肠杆菌感受态细胞Trans1-T1转化,涂板,挑取白色菌落,提质粒,PCR鉴定并送生工测序,确认序列正确后,增殖阳性菌,大量提取质粒DNA,测其浓度及纯度后,冻存于-20 ℃,作为实时荧光定量PCR检测四种病毒的重组质粒。
1.2.2 四重Real-time RT-PCR的优化 先对每种病毒的Real-time PCR反应单独进行优化,模板为每种病毒的重组质粒,反应体系为2×One Step RT-PCR BufferⅢ 10 μL,TaKaRa Ex Taq HS(5 U·μL-1) 0.4 μL,PrimeScript RT Enzyme MixⅡ 0.4 μL,上、下游引物(10 μmol·L-1) 各0.4 μL,探针(10 μmol·L-1)0.8 μL,RNase Free dH2O 5.6 μL,模板2 μL。反应程序:42 ℃ 5 min反转录后,95 ℃ 10 s灭活反转录酶;然后95 ℃变性5 s,退火10 s,72 ℃延伸10 s,45个循环。首先优化退火温度,BAstV、BVDV和BCV的退火温度设置48.0、48.3、49.0、50.0、51.2、52.4、53.6、54.8、56.0、57.0、57.7、58.0 ℃ 12个温度梯度,BRV的退火温度设置48.0、48.3、48.7、49.3、50.0、50.7、51.3、52.0、52.5、52.8、53.0 ℃ 11个温度梯度,根据扩增结果确定最适退火温度。反应程序采用最适退火温度后,优化单重Real-time RT-PCR的引物浓度,BAstV和BCV的引物浓度设50、100、200、300、400、500、600、700、800、900、1 000 nmol·L-1共11个梯度,BVDV和BRV的引物浓度设100、200、300、400、500、600 nmol·L-1共6个梯度。然后以等量4种病毒重组质粒的混合液为模板,并将单重反应中的最适退火温度,引物及探针浓度应用于四重反应后,BVDV和BAstV两种病毒的反应出现相互抑制现象,其他病毒无相互抑制,因此对四重Real-time RT-PCR反应再进行优化。首先试验了30、45、60 s 3种退火时间,确定了最佳退火时间。所有优化反应针对每种变量均做了3个重复,且以RNase Free dH2O为模板,作为阴性对照。然后对四重Real-time RT-PCR反应体系中BVDV和BAstV的引物和探针浓度进行再优化。BVDV探针设50、100、150、200、250 nmol·L-1共5个梯度,BAstV探针设100、150、200、250、300、400 nmol·L-1共6个梯度,每种变量做4个重复,2个重复的模板为4种病毒的重组质粒,2个重复的模板为BVDV和BAstV的重组质粒。将浓度300~700 nmol·L-1的BAstV引物与浓度100~500 nmol·L-1的BVDV引物做棋盘式优化,每种变量做6个重复,2个重复的模板为4种病毒的重组质粒,2个重复的模板为BVDV的重组质粒,2个重复的模板为BAstV的重组质粒。根据Ct值和曲线峰值确定最优引物浓度和探针浓度。
1.2.3 标准曲线的建立及敏感性分析 将4种病毒的引物和探针均加入PCR管内进行四重Real-time PCR反应,反应体系:2×One Step RT-PCR Buffer Ⅲ 10 μL,TaKaRa Ex Taq HS (5 U·μL-1) 0.4 μL,PrimeScript RT Enzyme Mix Ⅱ 0.4 μL,引物及探针为之前优化的最优体积,模板2 μL,RNase Free dH2O补足至20 μL。反应程序:反转录42 ℃ 5 min,灭活反转录酶95 ℃ 10 s,三步法45个循环(变性95 ℃ 5 s,退火50 ℃ 45 s,延伸72 ℃ 10 s)。模板分别为1010~100copies·μL-1的BAstV、BVDV、BCV、BRV重组质粒。所有反应均做了3个重复,且以RNase Free dH2O为模板,作为阴性对照。构建重组质粒拷贝数-Ct值标准曲线并确定方法检测4种病毒的最低检测限。
1.2.4 特异性分析 以优化好的四重体系及四重反应条件进行反应,模板依次加入牛传染性鼻气管炎病毒BK1295株、牛腺病毒3型HLJ0955株、牛支原体PG45株、牛支原体NM2012株、肠炎沙门菌CVCC3949株、多杀性巴氏杆菌CVCC391株全基因组DNA和BVDV 2型HLJ-10株、牛副流感病毒3型SD0835株全基因组RNA,以BAstV、BVDV-1、BCV和BRV G8P[1]型的重组质粒作为阳性模板,所有反应均做了3个重复,且以RNase Free dH2O为模板,作为阴性对照。
1.2.5 重复性分析 以优化好的四重体系及四重反应条件进行反应,模板分别加入107 copies·μL-1的BAstV、BVDV、BCV、BRV的重组质粒,所有反应均做了3个重复,且以RNase Free dH2O为模板,作为阴性对照,重复进行3次试验。
1.2.6 同时检测四种模板与只检测单种模板的差异 以优化好的四重体系与反应程序进行Real-time PCR,模板分别为BAstV、BVDV、BCV和BRV的重组质粒混和模板,BAstV重组质粒,BVDV重组质粒,BCV重组质粒,BRV重组质粒为阳性对照,所有反应均做了3个重复,且以RNase Free dH2O为模板,作为阴性对照,对比单种模板存在的四重Real-time PCR与四种模板同时存在的四重Real-time PCR的Ct值差异。
1.2.7 热处理解链对四重Real-time PCR检测病原效果的影响 以优化好的四重体系及反应程序进行Real-time PCR,模板分别采用BVDV JL株的RNA,95 ℃ 5 min水浴后置于冰上的BVDV JL株的RNA,所有反应均做了3个重复,且以RNase Free dH2O为模板,作为阴性对照。
1.2.8 临床样品检测 采集了北京市大兴区3月龄以内犊牛粪样X1~X13共13份,3~6月龄犊牛粪样M1~M33共33份,成年奶牛粪样C1~C39共39份,成年奶牛腹泻粪样B1~B3共3份;北京市昌平区成年奶牛腹泻粪样150035、150120等共20份;天津市武清区成年奶牛腹泻粪样19056、19083、19087等共17份,抗凝血1~17共17份,胃内容物1~10共10份,肺研磨液1~10共10份,脾研磨液1~10共10份,口腔黏液1~7共7份。对各待检样品提取RNA并95 ℃ 5 min水浴解链后置于冰上,进行四重Real-time PCR和PCR检测,所有反应均做了3个重复,且以RNase Free dH2O为模板,作为阴性对照。
2 结果 2.1 重组质粒的制备BAstV、BVDV-1、BCV和BRV的克隆质粒经PCR扩增和电泳,分别获得了146、142、179和121 bp的目的条带(图 1),测序并BLAST鉴定表明与目的基因序列相符。质粒浓度分别为2.52×1010、6.14×1010、4.05×1010和2.05×1010 copies·μL-1。

|
M. Trans DNA相对分子质量标准Ⅰ; 1. BAstV重组质粒; 2. BVDV-1重组质粒; 3. BCV重组质粒; 4. BRV重组质粒; 5. 阴性对照 M. Trans DNA marker Ⅰ; 1. BAstV plasmids; 2. BVDV-1 plasmids; 3. BCV plasmids; 4. BRV plasmids; 5. Negative control 图 1 4种重组质粒的PCR检测结果 Fig. 1 PCR amplification of four recombinant plasmids |
根据四重Real-time PCR优化结果,最适退火温度和时间分别为50.0 ℃和45 s,BAstV、BVDV-1、BCV和BRV的引物浓度分别为300、300、400和500 nmol·L-1。BAstV、BVDV-1、BCV和BRV的探针浓度分别为250、150、100和300 nmol·L-1。
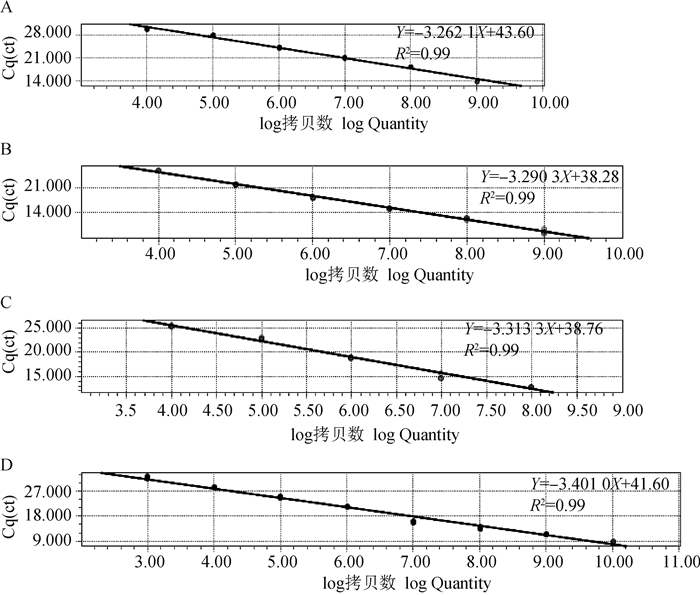
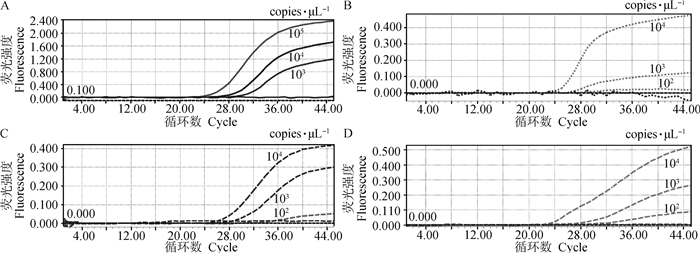
2.3 标准曲线的建立及敏感性分析BAstV、BVDV-1、BCV和BRV的标准曲线见图 2,其斜率分别为-3.262 1、-3.290 3、-3.313 3和-3.401 0,相关系数均为0.99,扩增效率分别为103%、101%、100%和97%,说明标准曲线有良好的线性关系。BAstV、BVDV-1、BCV和BRV的敏感性扩增曲线见图 3,BAstV、BVDV-1、BCV和BRV的最低检测限分别为103、102、102和102copies·μL-1。
|
A. BAstV标准曲线; B. BVDV-1标准曲线; C. BCV标准曲线; D. BRV标准曲线 A. The standard curve of BAstV; B. The standard curve of BVDV-1; C. The standard curve of BCV; D. The standard curve of BRV 图 2 四重Real-time PCR标准曲线 Fig. 2 The standard curves of the Quadruple Real-time PCR |
|
A. BAstV灵敏度扩增曲线; B. BVDV-1灵敏度扩增曲线; C. BCV灵敏度扩增曲线; D. BRV灵敏度扩增曲线 A. The sensitivity amplification curves of BAstV; B. The sensitivity amplification curves of BVDV-1; C. The sensitivity amplification curves of BCV; D. The sensitivity amplification curves of BRV 图 3 四重Real-time PCR灵敏度扩增曲线 Fig. 3 The sensitivity amplification curves of the Quadruple Real-time PCR |
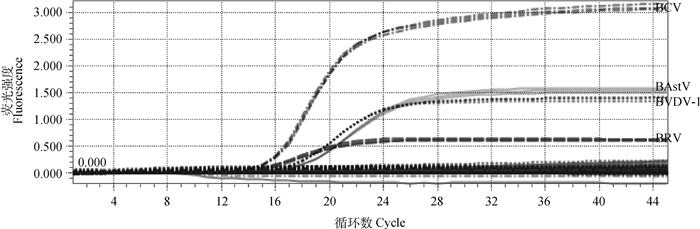
四重Real-time PCR扩增结果如图 4所示,除四种重组质粒有荧光扩增曲线外,其余核酸及ddH2O均无荧光扩增曲线,说明建立的四重Real-time PCR方法有较强的特异性。
|
图 4 四重Real-time PCR特异性扩增曲线 Fig. 4 The specific amplification curves of the Quadruple Real-time PCR |
四重Real-time PCR检测结果见表 2,批内Ct值变异系数为0.52%~0.78%,批间Ct值变异系数为1.18%~2.48%,均小于10.0%,说明该Real-time PCR方法的重复性良好。
|
|
表 2 四重Real-time PCR重复性检测结果 Table 2 The reproducibility of the Quadruple Real-time PCR |
每种单种模板存在的四重Real-time PCR与四种模板同时存在的四重Real-time PCR的Ct值差异均小于3,即拷贝数差异小于10倍,且差异不显著(P>0.05),可进行10的倍数的拷贝数定量。
2.7 热处理解链对四重Real-time PCR检测病原效果的影响BVDV JL株的RNA可检出,其Ct值为18.05,RNA浓度为111.80 ng·μL-1,TCID50为10-4.5·0.1 mL-1,所对应的拷贝数为1.41×106 copies·μL-1,检测的2 μL病毒含2.5×103个TCID50。95 ℃ 5 min水浴后置于冰上的BVDV JL株的RNA的Ct值为17.37,差异不大,则前期BRV病毒RNA高温解链操作不影响BVDV病毒RNA的检测。高志强等[33]检测得到IDEXX的BVDV抗原检测试剂盒检测50 μL病毒液的敏感度为1.2×103个TCID50。则本方法检测病毒培养液敏感度高于IDEXX的BVDV抗原检测试剂盒的敏感度。
2.8 临床样品检测179份样品的检测结果及分析见表 3。在临床粪样的检测中,本方法能够检出并定量3.91×104 copies·μL-1及其以上拷贝数的BAstV,而PCR方法检测中4.00×104 copies·μL-1及其以下拷贝数的BAstV就显示为阴性;对于BCV,1.26×103 copies·μL-1及其以上拷贝数本方法能够检出并定量,而PCR方法检测该拷贝数的BCV为阴性,因此本方法对临床粪样的阳性检出率高于PCR方法。同时,能够看出BAstV和BRV在3月龄内犊牛的阳性率远高于其他年龄段,而BCV在犊牛中阳性率较高,但成年牛也有检出。
|
|
表 3 临床样本检测结果 Table 3 The detection results of clinical samples |
目前,同时检测相关牛病原的方法存在多种,Asano等[37]的半嵌套式的多重RT-PCR方法以及Fukuda等[38]、柳强等[30]和侯佩莉等[32]的多重RT-PCR方法均需要在PCR反应完成后,进行琼脂糖凝胶电泳,通过是否有目的条带来确定是否为阳性,过程较为繁琐耗时,且需要在核酸胶中依次加样,在样品较多时容易混乱,而本方法所使用的多重Real-time PCR反应在PCR反应结束时即可得到结果,且可同时进行96孔样品的检测。以SYBR Green作为染料的多重Real-time PCR反应中,染料与双链DNA结合后发射荧光信号,引物二聚体、错配以及错误的扩增产物均能够发射荧光信号,需要通过熔解曲线对产物的特异性进行判定,而本方法采用的探针是与目的片段特异性结合的,当DNA扩增到探针结合区域时,探针才会断裂释放出荧光,特异性更强,不需要检测熔解曲线的步骤,更节省时间。但多对引物及探针将混合在一个反应体系中,反应之间相互影响往往使得多重Real-time PCR反应的定量不准确,从而导致许多多重Real-time PCR反应不能够准确定量,只能定性,而我们在设计和筛选引物及探针时,通过DNAstar的Primerselect将所用引物及探针逐一配对预测是否存在严重的二聚体或发卡结构,PCR验证四种引物和单种引物存在下条带的变化以及进行单重和四重实时荧光定量PCR反应观察其扩增曲线是否呈S型且平台对应的荧光值较高,成功地建立了反应之间影响不显著、能够准确定量的四重实时荧光定量PCR方法。且本方法中,BAstV、BVDV、BCV、BRV阳性时能够分别通过FAM、HEX、Texas Red和CY5四种荧光发射基因发射不同的荧光,被实时荧光定量PCR仪的四个通道分别捕捉,能够简单易懂地区分阳性抗原和分别定量。相比于微阵列[39]、GeXP[40]等方法,本方法所需的平台相对简单,只需要实时荧光定量PCR仪即可,现已有轻巧、便携的实时荧光定量PCR仪投入使用。
本方法首次将可能导致犊牛腹泻的BAstV、BVDV、BCV、BRV四种病毒放在一起,只需一个反应便能同时检测这四种病毒,更加方便、快捷,而且不同于普通RT-PCR显示的PCR扩增后结果[30, 32, 37-38],本方法所测量的是所加初始模板的量,能够较为准确地定量样品中的病毒含量,便于通过排毒量判断感染处于哪个阶段,是持续感染还是急性感染等。由于这四种病毒急性感染成年牛,大多是一过性感染,且急性感染时排毒时间短、量少,想要研究这四种病毒的急性感染期就必须能够及时并准确地发现少量病毒感染。本方法的敏感性与其他已有方法[26-41]相似,且对于BVDV-1病毒培养液的检测敏感度高于IDXX的BVDV抗原检测试剂盒的敏感度[33]。并且本方法能够检测包括粪样、组织、血液、血浆、胃内容物和口腔黏液等在内的各种样品所提取的RNA,没有样品类型的局限性,能够在采集样品时选择最早出现病毒的部位进行采集,保证及时发现感染,也能够从分泌物或排泄物中检测病毒,有效地减少对牛的刺激和采样时的工作量。同时,本方法一方面针对BRV是双链RNA病毒,一般的预变性过程无法保证RNA双链开链,从而导致引物难以结合的问题,我们使用95 ℃高温解链然后置于冰上的RNA前期处理在保证其他病毒的检测不受影响的同时,提高了检测BRV的敏感性;另一方面,其他已有方法大多是提前以随机引物进行反转录,再以反转录后的模板进行PCR反应,以随机引物反转录,每次获得的总cDNA量大致相同,但可能由于酶量或引物量的限制,未能反转录完全所要检测的模板,致使定量不准确,而本方法中反转录是包含在Real-time PCR反应过程中的,以特异性引物反转录模板的,微量模板即可反应,能够更好地增加检出率且定量初始模板量更准确。同时,本方法不需要额外反转录,RNA直接反应即可获得结果,首先,减少了操作过程,更加节省时间;其次,由于cDNA比RNA更稳定,长期检测可能产生气溶胶,而Real-time PCR作为更为灵敏的PCR检测方法,环境中模板浓度稍高就能导致检测结果出现假阳性,DNA气溶胶一旦产生难以彻底去除,十分地费时费力,而一步法很好地避免了这些错误的发生。对于临床检测,前期我们筛选了诸多文献的PCR引物,PCR扩增验证其特异性,以这些验证后的PCR引物为对照[30, 34-36],检测临床样品,对比发现本方法对临床粪样的阳性检出率更高。临床样品的检测结果也提示我们3月龄内犊牛更易感染BAstV和BRV,而BCV主要感染犊牛,但成年牛也有一定程度的感染,有助于我们确定这四种病毒的易感年龄,从而通过牛的年龄提前判断诊断方向。使用本方法进行四种病毒的流行病学监测,能够快速、准确地获取疾病感染状况,一方面便于及时采集相应时期的样品更深入地研究病原,如,研究这四种病毒急性感染期的免疫状况,产生的记忆细胞等;另一方面,便于牛场对疾病流行状况进行掌控,能够合理地制定防疫措施。
4 结论建立了同时定量、快速、灵敏地检测BAstV、BVDV-1、BCV和BRV的四重Real-time PCR方法,在牛场BAstV、BVDV-1、BCV和BRV监测,特别是犊牛腹泻原因确定中具有重要应用价值。
| [1] | SVENSSON C, LUNDBORG K, EMANUELSON U, et al. Morbidity in Swedish dairy calves from birth to 90 days of age and individual calf-level risk factors for infectious diseases[J]. Prev Vet Med, 2003, 58(3-4): 179–197. DOI: 10.1016/S0167-5877(03)00046-1 |
| [2] |
王牧川, 岳华, 汤承, 等. 重庆肉牛腹泻相关病毒的检测及遗传进化分析[J]. 中国畜牧兽医, 2017, 44(9): 2731–2738.
WANG M C, YUE H, TANG C, et al. Detection and genetic evolution of diarrhea-related viruses in Chongqing beef cattle[J]. China Animal Husbandry and Veterinary Medicine, 2017, 44(9): 2731–2738. (in Chinese) |
| [3] |
田欣睿, 汤承, 岳华. 川西北牦牛源牛星状病毒的检测及ORF2基因序列分析[J]. 动物医学进展, 2019, 40(10): 32–38.
TIAN X R, TANG C, YUE H. Detection of bovine Astrovirus in yaks of northwest Sichuan and sequence analysis of ORF2 gene[J]. Progress in Veterinary Medicine, 2019, 40(10): 32–38. DOI: 10.3969/j.issn.1007-5038.2019.10.007 (in Chinese) |
| [4] |
闫占云, 吕秉林, 拉加, 等. 青海省湟中县牦牛病毒性腹泻5种相关病原的检测与分析[J]. 畜牧与兽医, 2019, 51(1): 88–92.
YAN Z Y, LYU B L, LA J, et al. Detection and analysis of five viral pathogens associated with diarrhea in yaks in Huangzhong County, Qinghai Province[J]. Animal Husbandry and Veterinary Medicine, 2019, 51(1): 88–92. (in Chinese) |
| [5] | HOU P L, ZHAO G M, WANG H M, et al. Prevalence of bovine viral diarrhea virus in dairy cattle herds in eastern China[J]. Trop Anim Health Prod, 2019, 51(4): 791–798. DOI: 10.1007/s11250-018-1751-z |
| [6] |
孟庆森, 季烨, 张学成, 等. 2018年我国部分地区牛病毒性腹泻病毒感染情况调查[J]. 中国奶牛, 2019(2): 22–24.
MENG Q S, JI Y, ZHANG X C, et al. Seroepidemiological survey on bovine viral diarrhea virus infection in some areas of China in 2018[J]. China Dairy Cattle, 2019(2): 22–24. (in Chinese) |
| [7] | DENG M L, CHEN N, GUIDARINI C, et al. Prevalence and genetic diversity of bovine viral diarrhea virus in dairy herds of China[J]. Vet Microbiol, 2020, 242: 108565. DOI: 10.1016/j.vetmic.2019.108565 |
| [8] |
张坤. 新疆北疆地区规模化奶牛场犊牛病毒性腹泻相关病原的调查研究[D]. 石河子: 石河子大学, 2016.
ZHANG K. Investigation of calves viral diarrhea related pathogen of large-scale dairy farm in northern Xinjiang region[D]. Shihezi: Shihezi University, 2016. (in Chinese) |
| [9] |
王海瑞. 甘肃等13省区犊牛腹泻主要病原调查及大肠杆菌生物学特性分析[D]. 兰州: 中国农业科学院, 2017.
WANG H R. The investigation of major pathogens of the calf diarrhea and the analysis of biological characteristics of E. coli in 13 Provinces, China[D]. Lanzhou: Chinese Academy of Agricultural Sciences, 2017. (in Chinese) |
| [10] |
赵玉玺. 河南省犊牛腹泻主要病原调查及犊牛腹泻微流控芯片验证[D]. 郑州: 河南农业大学, 2018.
ZHAO Y X. Investigation on main pathogens of calf diarrhea in Henan Province and verification microfluidic chips for calf diarrhea[D]. Zhengzhou: Henan Agricultural University, 2018. (in Chinese) |
| [11] |
陆亚冬, 刘贤侠, 陈创夫. 新疆部分地区致犊牛腹泻轮状病毒病的调查[J]. 新疆农垦科技, 2018, 41(4): 25–27.
LU Y D, LIU X X, CHEN C F. Investigation on diarrhea caused by rotavirus in calves in some areas of Xinjiang[J]. Xinjiang Farm Research of Science and Technology, 2018, 41(4): 25–27. DOI: 10.3969/j.issn.1001-361X.2018.04.018 (in Chinese) |
| [12] |
王文佳, 程成, 张凯, 等. 宁夏地区犊牛腹泻的病原调查[J]. 畜牧与兽医, 2019, 51(2): 107–109.
WANG W J, CHENG C, ZHANG K, et al. Investigation of various pathogens causing calf diarrhea in Ningxia Hui Autonomous Region[J]. Animal Husbandry and Veterinary Medicine, 2019, 51(2): 107–109. (in Chinese) |
| [13] | CORTEZ V, MELIOPOULOS V A, KARLSSON E A, et al. Astrovirus biology and pathogenesis[J]. Annu Rev Virol, 2017, 4(1): 327–348. DOI: 10.1146/annurev-virology-101416-041742 |
| [14] | MITCHELL D K, VAN R, MORROW A L, et al. Outbreaks of astrovirus gastroenteritis in day care centers[J]. J Pediatr, 1993, 123(5): 725–732. DOI: 10.1016/S0022-3476(05)80846-7 |
| [15] | MARTELLA V, CATELLA C, CAPOZZA P, et al. Identification of astroviruses in bovine and buffalo calves with enteritis[J]. Res Vet Sci, 2020, 131: 59–68. DOI: 10.1016/j.rvsc.2020.04.010 |
| [16] | GLOTOV A G, GLOTOVA T I, KOTENEVA S V, et al. Virulent properties of Russian bovine viral diarrhea virus strains in experimentally infected calves[J]. Scientifica (Cairo), 2016, 2016: 7034509. |
| [17] | PETERHANS E, SCHWEIZER M. BVDV: a pestivirus inducing tolerance of the innate immune response[J]. Biologicals, 2013, 41(1): 39–51. DOI: 10.1016/j.biologicals.2012.07.006 |
| [18] | CHENG Z R, CHAUHAN L, BARRY A T, et al. Acute bovine viral diarrhea virus infection inhibits expression of interferon tau-stimulated genes in bovine endometrium[J]. Biol Reprod, 2017, 96(6): 1142–1153. |
| [19] | KHODAKARAM-TAFTI A, FARJANIKISH G H. Persistent bovine viral diarrhea virus (BVDV) infection in cattle herds[J]. Iran J Vet Res, 2017, 18(3): 154–163. |
| [20] | LANYON S R, HILL F I, REICHEL M P, et al. Bovine viral diarrhoea: Pathogenesis and diagnosis[J]. Vet J, 2014, 199(2): 201–209. DOI: 10.1016/j.tvjl.2013.07.024 |
| [21] | LOJKIĆ I, KREŠIĆ N, ŠIMIĆ I, et al. Detection and molecular characterisation of bovine corona and toroviruses from Croatian cattle[J]. BMC Vet Res, 2015, 11: 202. DOI: 10.1186/s12917-015-0511-9 |
| [22] | AMER H M. Bovine-like coronaviruses in domestic and wild ruminants[J]. Anim Health Res Rev, 2018, 19(2): 113–124. DOI: 10.1017/S1466252318000117 |
| [23] | BOILEAU M J, KAPIL S. Bovine coronavirus associated syndromes[J]. Vet Clin North Am: Food Anim Pract, 2010, 26(1): 123–146. DOI: 10.1016/j.cvfa.2009.10.003 |
| [24] | OMA V S, TRÅVÉN M, ALENIUS S, et al. Bovine coronavirus in naturally and experimentally exposed calves; viral shedding and the potential for transmission[J]. Virol J, 2016, 13: 100. DOI: 10.1186/s12985-016-0555-x |
| [25] | GROVER Y P, YOGESH S, KAPOOR S, et al. Studies on the rotavirus excretion pattern in cow calves using polyclonal antibody sandwich ELISA test[J]. J Immunol Immunopathol, 2004, 6(2): 49–54. |
| [26] |
张贵刚, 王艳杰, 陈君彦, 等. 牛病毒性腹泻病毒和牛传染性鼻气管炎病毒双重荧光定量PCR检测方法的建立[J]. 中国预防兽医学报, 2018, 40(10): 922–925, 939.
ZHANG G G, WANG Y J, CHEN J Y, et al. Establishment of the duplex TaqMan real-time PCR method of bovine viral diarrhea virus and infectious bovine rhinotracheitis virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2018, 40(10): 922–925, 939. (in Chinese) |
| [27] |
刘梦瑶, 张秋楠, 吴文学, 等. BVDV和IBRV双重实时荧光定量PCR检测方法建立[J]. 中国兽医杂志, 2019, 55(11): 28–31, 36.
LIU M Y, ZHANG Q N, WU W X, et al. The development of the duplex real-time PCR for BVDV and IBRV[J]. Chinese Journal of Veterinary Medicine, 2019, 55(11): 28–31, 36. (in Chinese) |
| [28] | MARI V, LOSURDO M, LUCENTE M S, et al. Multiplex real-time RT-PCR assay for bovine viral diarrhea virus type 1, type 2 and HoBi-like pestivirus[J]. J Virol Methods, 2016, 229: 1–7. DOI: 10.1016/j.jviromet.2015.12.003 |
| [29] | GONG Z D, GENG J J, LIANG H Q, et al. Synchronous detection of BPV and BVDV with duplex Taqman qPCR method[J]. Acta Sci Vet, 2019, 47: 1669. |
| [30] |
柳强, 侯喜林, 车车, 等. 牛冠状病毒和轮状病毒的双重RT-PCR检测方法的建立及应用[J]. 中国预防兽医学报, 2009, 31(9): 701–704.
LIU Q, HOU X L, CHE C, et al. The establishment and application of a double PCR for bovine coronavirus and bovine rotavirus[J]. Chinese Journal of Preventive Veterinary Medicine, 2009, 31(9): 701–704. (in Chinese) |
| [31] |
宋爽, 赵柏林, 曲萍, 等. 牛病毒性腹泻病毒、牛传染性支气管炎病毒和口蹄疫病毒多重TaqMan荧光定量PCR检测方法的建立[J]. 中国预防兽医学报, 2017, 39(2): 133–136.
SONG S, ZHAO B L, QU P, et al. Establishment of multiplex TaqMan real-time PCR for the detection of Bovine viral diarrhea virus, infectious bovine rhinotracheitis virus and Foot-mouth disease virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(2): 133–136. (in Chinese) |
| [32] |
侯佩莉, 王洪梅, 何洪彬. 牛病毒性腹泻病毒、牛冠状病毒和牛肠道病毒多重RT-PCR检测方法的建立及初步应用[J]. 中国兽医学报, 2016, 36(10): 1672–1675, 1700.
Hou P L, WANG H M, HE H B, et al. Establishment and application of a multiple RT-PCR for detection of BVDV, BCoV and BEV[J]. Chinese Journal of Veterinary Science, 2016, 36(10): 1672–1675, 1700. (in Chinese) |
| [33] |
高志强, 张鹤晓, 刘继红, 等. 病毒分离结合荧光抗体技术与抗原捕获ELISA检测牛病毒性腹泻病毒(BVDV)抗原的敏感性比较研究[J]. 检验检疫科学, 2005, 15(6): 12–14.
GAO Z Q, ZHANG H X, LIU J H, et al. Study on the sensitivity of virus isolation combined with fluorescent antibody technique and antigen capture ELISA to detect bovine viral diarrhea virus (BVDV) antigen[J]. Inspection and Quarantine Science, 2005, 15(6): 12–14. DOI: 10.3969/j.issn.1674-5354.2005.06.004 (in Chinese) |
| [34] | TSE H, CHAN W M, TSOI H W, et al. Rediscovery and genomic characterization of bovine astroviruses[J]. J Gen Virol, 2011, 92(8): 1888–1898. DOI: 10.1099/vir.0.030817-0 |
| [35] | KANG G, ITURRIZA-GOMARA M, WHEELER J G, et al. Quantitation of group A rotavirus by real-time reverse-transcription-polymerase chain reaction: correlation with clinical severity in children in South India[J]. J Med Virol, 2004, 73(1): 118–122. DOI: 10.1002/jmv.20053 |
| [36] |
徐威. 北京地区三种牛呼吸道病毒病的流行病学调查[D]. 北京: 中国农业大学, 2014.
XU W. The epidemiological investigations of the three bovine respiratory viruses in Beijing[D]. Beijing: China Agriculture University, 2014. (in Chinese) |
| [37] | ASANO K M, DE SOUZA S P, DE BARROS I N, et al. Multiplex semi-nested RT-PCR with exogenous internal control for simultaneous detection of bovine coronavirus and group A rotavirus[J]. J Virol Methods, 2010, 169(2): 375–379. DOI: 10.1016/j.jviromet.2010.08.008 |
| [38] | FUKUDA M, KUGA K, MIYAZAKI A, et al. Development and application of one-step multiplex reverse transcription PCR for simultaneous detection of five diarrheal viruses in adult cattle[J]. Arch Virol, 2012, 157(6): 1063–1069. DOI: 10.1007/s00705-012-1271-5 |
| [39] | THANTHRIGE-DON N, LUNG O, FURUKAWA-STOFFER T, et al. A novel multiplex PCR-electronic microarray assay for rapid and simultaneous detection of bovine respiratory and enteric pathogens[J]. J Virol Methods, 2018, 261: 51–62. DOI: 10.1016/j.jviromet.2018.08.010 |
| [40] |
范晴, 谢芝勋, 谢志勤, 等. 同时监测8种牛常见病原体的GeXP高通量快速检测技术[J]. 畜牧兽医学报, 2017, 48(10): 1920–1931.
FAN Q, XIE Z X, XIE Z Q, et al. Development of a GeXP assay for simultaneous differentiation of 8 pathogens of bovine infectious diseases[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(10): 1920–1931. DOI: 10.11843/j.issn.0366-6964.2017.10.015 (in Chinese) |
| [41] | PANSRI P, KATHOLM J, KROGH K M, et al. Evaluation of novel multiplex qPCR assays for diagnosis of pathogens associated with the bovine respiratory disease complex[J]. Vet J, 2020, 256: 105425. DOI: 10.1016/j.tvjl.2020.105425 |



