2. 中国兽医药品监察所, 北京 100081
2. China Institute of Veterinary Drug Control, Beijing 100081, China
布鲁氏菌病(Brucellosis),又称波浪热,是由布鲁氏菌(Brucella)感染所引起的一种细菌性人兽共患传染病[1-2],世界动物卫生组织(Office International des Epizooties,OIE)将其列为B类动物疫病[1],猪、牛、羊等普通家畜均易感该病,人主要是通过接触病畜或食用被布鲁氏菌污染的食物而感染。该病主要发生在内蒙古、东北等地的牧区[3],近年来,我国布病疫情虽然基本得到控制,但多点散发的情况依然存在,给畜牧业和公众健康造成严重威胁。
目前,针对布鲁氏菌的检测方法很多,其中,细菌的分离鉴定是布病诊断的“金标准”,该方法主要是以病料的组织、生殖道分泌物、血液等作为可培养物进行布鲁氏菌的分离鉴定[1, 4],但细菌分离鉴定操作繁琐,所需时间较长,且对试验技术人员的危险较大;PCR、荧光定量PCR等技术目前已经应用于布鲁氏菌的检测,但这些方法的灵敏度还有待提高,特别是在菌含量极低时可能会出现假阴性或可疑结果,因此有必要建立一种高灵敏度的方法,从而有效提高布鲁氏菌检测的精确度。
微滴式数字PCR(droplet digital PCR,ddPCR)目前已被应用于病原微生物检测、肿瘤相关基因检测等多个领域[5-6]。ddPCR将一个待分析的PCR反应体系进行微滴化处理,每个微滴中含有一个、多个或不含有待检测的核酸靶分子,数万个微滴进行独立PCR扩增反应后,对每个微滴的荧光信号进行统计学分析,含有荧光信号的微滴判读为1,不含荧光信号则判读为0,从而实现对病原体DNA或RNA的绝对定量[7]。与传统的荧光定量PCR方法相比,ddPCR技术的定量方式不依赖于标准曲线[8],敏感性和准确性均比传统方法高[9]。
作者利用微滴式数字PCR方法的技术优势,拟建立布鲁氏菌微滴式数字PCR检测方法,希望为布病的早期诊断、准确检测和科学防控提供一种新的技术手段。
1 材料与方法 1.1 材料1.1.1 试验样品 4个种属共9株布鲁氏菌菌株(牛种2株、羊种3株、猪种2株、犬种2株)、小肠结肠炎耶尔森菌O: 9菌株、大肠杆菌O157:H7菌株、沙门氏菌都柏林菌株、沙门氏菌1791菌株、伤寒沙门氏菌及136份牛阴道拭子临床样品的核酸均由中国兽医药品监察所专业实验室保存并提供。
1.1.2 主要仪器设备 YOSE-S32天根全自动核酸提取仪,微滴式数字PCR检测系统(QX100Droplet Generator、QX100Droplet Reader、QX100微滴式数字PCR仪),ABI-ViiA7 PCR仪。
1.1.3 主要试剂及材料 细菌基因组DNA提取试剂盒购自天根生化科技北京有限公司,ddPCRTM Supermix for probes、Droplet generation oil for probe等购自伯乐公司,引物和探针由英潍捷基公司合成。
1.2 方法1.2.1 引物探针设计 参考刘志国等[10]发表的文献,选取布鲁氏菌属特异性基因BCSP31的保守序列设计引物和探针,探针5′端标记FAM荧光报告基团,3′端标记BHQ1荧光淬灭基团。上游引物F:5′-ACCTTGCCCTTGCCATCAT-3′;下游引物R:5′-AGTCCGGCTTTACGCAGTCA-3;探针P:FAM-TGCCGTTATAGGCCCAATAGGCAACG-BHQ1。
1.2.2 细菌核酸提取 按细菌基因组DNA提取试剂盒说明书步骤提取布鲁氏菌核酸,置-80 ℃备用。所有菌株在提取核酸前均经过了灭活等预处理,且所有操作均是专业人员在生物安全三级实验室进行。
1.2.3 微滴式数字PCR方法建立主要包括3个步骤。1.2.3.1 生成微滴:布鲁氏菌ddPCR反应体系含ddPCR DNA supermix 10 μL,10 μmol·L-1上、下游引物各0.9 μL,10 μmol·L-1探针0.5 μL,水5.7 μL,模板2 μL。参考文献[11]步骤在微滴生成卡中加入样品及微滴生成油,于微滴生成仪生成微滴。
1.2.3.2 PCR扩增:取生成的微滴全部转移至96孔板内,参考文献[11]方法盖膜、封膜,PCR扩增。PCR的扩增程序为95 ℃ 10 min,94 ℃ 30 s,40个循环;52~62 ℃ 1 min;98 ℃ 10 min;4 ℃结束反应。
1.2.3.3 读取微滴:扩增完毕后,参考文献[11]在QX100 Droplet Reader微滴读取仪上读取微滴数据。
1.2.4 微滴式数字PCR反应条件的优化 优化ddPCR反应,包括引物、探针浓度及退火温度。设置3个引物和探针浓度组:第1组引物浓度500 nmol·L-1、探针浓度100 nmol·L-1,第2组引物浓度900 nmol·L-1、探针浓度250 nmol·L-1,第3组引物浓度1 200 nmol·L-1、探针浓度350 nmol·L-1;退火温度设置为52、55、58、60、62 ℃。反应体系和反应程序如“1.2.3”所示。通过比较ddPCR的微滴生成数,微滴分布状态、微滴荧光信号的强度等来确定优化的结果。
1.2.5 灵敏度试验 为评估布鲁氏菌ddPCR检测方法的线性关系、扩增效率、灵敏度,将羊种布鲁氏菌16M提取核酸后10倍倍比稀释(10-0~10-6),进行ddPCR检测,每个浓度重复检测3次,以评价方法的灵敏度。
1.2.6 特异性试验 提取9株不同种属布鲁氏菌菌株(牛种2308、牛种A19、羊种16M、羊种M5、羊种M28、猪种S2、猪种S1330、犬种RM6/66、犬种ZG)、小肠结肠炎耶尔森菌O: 9菌株、大肠杆菌O157:H7菌株、沙门氏菌都柏林菌株、沙门氏菌1791菌株、伤寒沙门氏菌的核酸,使用已经优化的布鲁氏菌ddPCR方法分别对其进行检测,验证该方法的特异性。
1.2.7 重复性试验 选取不同浓度的布鲁氏菌感染临床样品的核酸为模板,使用已经优化的布鲁氏菌ddPCR方法进行检测,每个浓度设立3个重复孔,计算其标准偏差和变异系数,以评价方法的批内重复性;在同样的反应条件下进行3次试验,计算其标准偏差和变异系数,评价该方法的批间重复性。
1.2.8 临床样品检测 收集136份牛阴道拭子样品,应用细菌分离培养方法和本研究建立的布鲁氏菌ddPCR方法对以上样品进行鉴定和检测,评价两种方法的符合率。
2 结果 2.1 布鲁氏菌ddPCR方法的建立及优化按照微滴生成、PCR扩增和微滴读取3个步骤建立了布鲁氏菌ddPCR方法,并优化了引物、探针浓度和退火温度。
2.1.1 引物和探针浓度优化 如“1.2.4”所述,设置3组引物和探针的浓度进行筛选和优化,每组浓度检测3次。结果显示,3个组检测细菌拷贝数的平均值分别为1 217、1 452、1 305 copies·μL-1,第2组引物和探针浓度组合检测的细菌拷贝数最多,所以确定最佳的引物和针浓度分别900 nmol·L-1和250 nmol·L-1。
2.1.2 退火温度优化 退火温度摸索了52、55、58、60、62 ℃,结果显示,退火温度在58 ℃时,拷贝数最高,因此将退火温度定为58 ℃。
2.2 ddPCR灵敏度试验提取羊种布鲁氏菌16M的核酸,将核酸从0~1 000 000倍连续稀释6个梯度,编号分别为1~7,进行ddPCR检测,每个浓度重复检测3次,选取其中5个合适浓度获得梯度稀释扩增图(图 1)和标准曲线(图 2)。ddPCR的标准曲线为y =-0.991x+ 5.121 3、R2=0.997 7,线性关系良好。
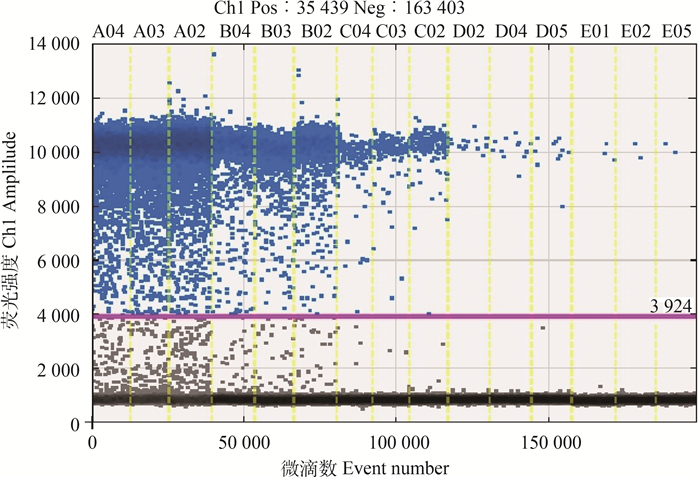
|
A04、A03、A02为100倍稀释核酸;B04、B03、B02为1 000倍稀释核酸;C04、C03、C02为10 000倍稀释核酸;D02、D04、D05为100 000倍稀释核酸;E01、E02、E05为1 000 000倍稀释核酸 A04, A03, A02 nucleic acid of 100 multiple concentration; B04, B03, B02 nucleic acid of 1000 multiple dilution; C04, C03, C02 nucleic acid of 10 000 multiple dilution; D02, D04, D05 nucleic acid of 100 000 multiple dilution; E01, E02, E05 1 000 000 multiple dilution 图 1 梯度稀释扩增图 Fig. 1 Amplification plot of serial dilutions |
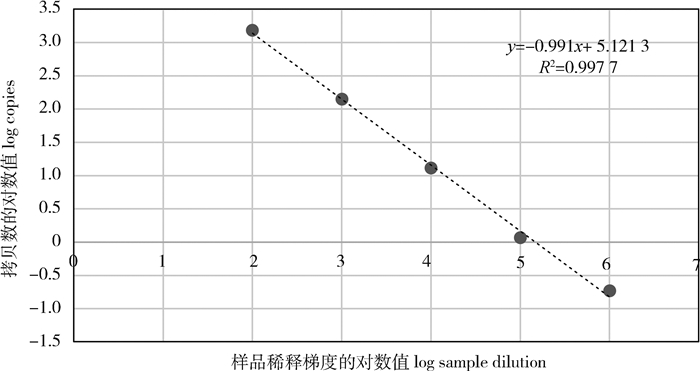
|
图 2 ddPCR标准曲线 Fig. 2 Standard curve of ddPCR |
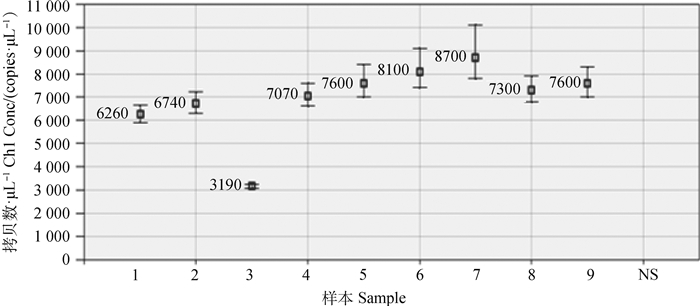
羊种布鲁氏菌16M的核酸梯度稀释后其拷贝数检测结果如表 1,当检测浓度低于10拷贝以下时该方法也能稳定检出,且CV值为6.84%,故取其平均值1.12 copies·μL-1确定为该方法的最低检测下限。
|
|
表 1 倍比稀释检测结果 Table 1 Test results of multiple dilution |
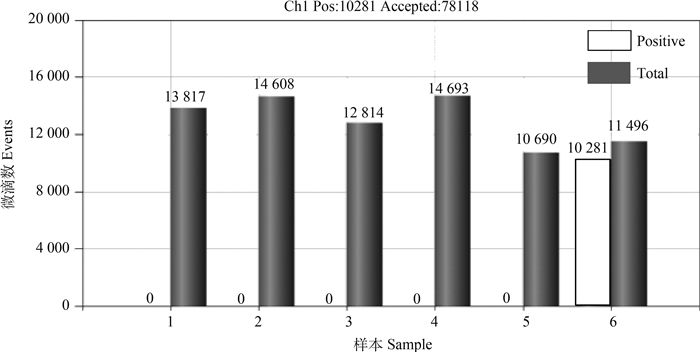
用本次所建立的布鲁氏菌数字PCR方法分别检测9株不同种属的布鲁氏菌菌株、小肠结肠炎耶尔森菌O: 9菌株、大肠杆菌O157:H7菌株、沙门氏菌都柏林菌株、沙门氏菌1791菌株、伤寒沙门氏菌,结果如图 3、4所示,9株不同种属的布鲁氏菌菌株均能被检测到,而其他5种细菌均不能被检测到,说明本方法的特异性较好。
|
1~9.布鲁氏菌牛种2308、牛种A19、羊种16M、羊种M5、羊种M28、猪种S2、猪种S1330、犬种RM6/66、犬种ZG;NS代表阴性对照 1-9. B. abortus 2308, B. abortus A19, B. melitensis 16M, B. melitensis M5, B. melitensis M28, B. suis S2, B. suis S1330, B. canis 6/66, B. canis ZG; NS.Negative control 图 3 9株布鲁氏菌ddPCR特异性试验结果 Fig. 3 ddPCR specificity test of nine Brucellas |
|
1~6. 小肠结肠炎耶尔森菌O: 9菌株、大肠杆菌O: 157菌株、沙门氏菌都柏林菌株、沙门氏菌1791菌株、伤寒沙门氏菌、羊种布鲁氏菌16M 1-6. Y.enterocolitica O: 9, E.coli O157:H7, S. dublin, S. 1791, S. Typhi, B. melitensis 16M 图 4 6种细菌ddPCR特异性试验结果 Fig. 4 ddPCR specificity test of 6 bacterium |
选取4个浓度的布鲁氏菌感染临床样品的核酸为模板进行微滴数字PCR反应,每个浓度设立3个重复孔,计算得到其批内变异系数分别为2.92%、4.03%、4.92%和4.77%,说明ddPCR方法的批内重复性好;在同样的反应条件下进行3次试验,计算得到其批间变异系数分别为3.67%、4.60%、6.53%和7.20%,说明ddPCR方法的批间重复性好,检测结果稳定、可靠。
2.5 临床样品检测应用细菌培养方法(动物布鲁氏菌病诊断技术,GB/T 18646-2018)和本研究建立的布鲁氏菌ddPCR方法分别对136份牛阴道拭子样品进行鉴定和检测。结果显示,两种方法均检测到阳性样品78份,阴性样品58份,两种方法的符合率为100%。使用布鲁氏菌ddPCR方法可以测得这78份阳性样品的拷贝数为1.4~20.4 copies·μL-1,说明本方法实现了对样品中细菌含量的绝对定量检测。
3 讨论自1985年聚合酶链式反应技术问世以来,PCR技术作为一种快速、高效、简便的体外核酸扩增技术被广泛应用于医学、生物学、食品卫生等多个领域[12-13],随着分子生物学技术的进步,定量PCR技术也在更新换代,从传统的定量PCR逐渐发展到数字PCR[6]。与传统的PCR方法相比,数字PCR方法更加灵敏,可以在样品浓度较低时,发现目的片段,不需要依赖CT值和标准曲线而实现绝对核酸定量[11, 14]。近几年,数字化PCR方法在微生物研究和诊断中发挥了广泛作用[11],赵丽清等[15]利用数字PCR技术建立了可定量检测食品中单核细胞增生李斯特菌的方法;董莲华等[16]以出血性大肠杆菌O157∶H7的rfbE 基因为目标基因,构建了可以准确定量检测肠出血性大肠杆菌的ddPCR方法。虽然数字PCR方法仍存在一定的缺陷,如检测时间长、通量有待进一步提高等,但随着技术的不断发展和改进,数字PCR技术的应用前景也会更加广泛。
对于布鲁氏菌的诊断,血清学方法主要用于抗体检测,且容易产生交叉反应,判定结果多出现假阴性或假阳性[17],细菌分离虽然是布鲁氏菌病检测的标准方法,但由于其操作繁琐、周期长、危险性较大,已不适用于兽医实验室对该病快速、简便检测的需求。本研究选取布鲁氏菌的保守序列设计引物,通过对引物、探针浓度以及退火温度进行优化,建立了布鲁氏菌数字PCR检测方法。该方法灵敏度高,最低检测限达到单个拷贝,灵敏度高于荧光定量;特异性强,9株不同种属的布鲁氏菌菌株均能被检测到,而与大肠杆菌O: 157菌株等其他4种细菌均无交叉反应;重复性好,批内和批间变异系数均小于10%;可实现对临床样品的绝对定量,特别是对于低细菌载量样品的检测,数字PCR可作为荧光定量PCR的重要补充,为布鲁氏菌的诊断和防控提供可靠保障。
4 结论建立了布鲁氏菌数字PCR检测方法,该方法灵敏度高、特异性强、重复性好,为布鲁氏菌病的准确检测和诊断提供了技术储备。
| [1] |
张士军. 布鲁氏菌快速核酸检测方法的建立[D]. 长春: 吉林大学, 2017.
ZHANG S J. Development of rapid nucleic acid detection methods for Brucella[D]. Changchun: Jilin University, 2017. (in Chinese) |
| [2] |
梁丽萍, 武坤莎, 刘蓓蓓, 等. 布氏杆菌病的护理[J]. 中国伤残医学, 2013(5): 427–428.
LIANG L P, WU K S, LIU B B, et al. Attendance of Brucellosis[J]. Chinese Journal of Trauma and Disability Medicine, 2013(5): 427–428. DOI: 10.3969/j.issn.1673-6567.2013.05.396 (in Chinese) |
| [3] |
杨羽, 吴清民. 羊布鲁氏菌16M基因组分泌蛋白的生物信息学分析[J]. 畜牧兽医学报, 2009, 40(7): 1059–1062.
YANG Y, WU Q M. Analysis of the secreted protein encoding genes in genome of Brucella melitensis 16M[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(7): 1059–1062. DOI: 10.3321/j.issn:0366-6964.2009.07.015 (in Chinese) |
| [4] | ALTON G G, JONES L M, PIETZ D E. Laboratory techniques in brucellosis[J]. Monogr Ser World Health Organ, 1975(55): 1–163. |
| [5] |
王琦, 范颖. 微滴式数字PCR技术进展[J]. 中国医学前沿杂志, 2016, 8(11): 15–19.
WANG Q, FAN Y. Progress of droplet digital PCR[J]. Chinese Journal of the Frontiers of Medical Science, 2016, 8(11): 15–19. DOI: 10.12037/YXQY.2016.11-05 (in Chinese) |
| [6] |
杨德平, 刘维薇. 数字PCR技术在临床诊断中的应用进展[J]. 临床检验杂志, 2016, 34(10): 785–787.
YANG D P, LIU W W. Application progress of droplet digital PCR in clinical diagnosis[J]. Chinese Journal of Clinical Laboratory Science, 2016, 34(10): 785–787. (in Chinese) |
| [7] |
龚永平, 郝中香, 陈珍容, 等. 微滴式数字PCR绝对定量应用研究进展[J]. 中国预防兽医学报, 2017, 39(8): 686–690.
GONG Y P, HAO Z X, CHEN Z R, et al. Application progress of droplet digital PCR in absolute quantification[J]. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(8): 686–690. (in Chinese) |
| [8] |
原霖, 董浩, 倪建强, 等. 非洲猪瘟病毒微滴数字PCR检测方法的建立[J]. 畜牧与兽医, 2019, 51(7): 81–84.
YUAN L, DONG H, NI J Q, et al. Development of droplet digital PCR for detection of African swine fever virus[J]. Animal Husbandry and Veterinary Medicine, 2019, 51(7): 81–84. (in Chinese) |
| [9] | WHALE A S, HUGGETT J F, COWEN S, et al. Comparison of microfluidic digital PCR and conventional quantitative PCR for measuring copy number variation[J]. Nucleic Acids Res, 2012, 40(11): e82. DOI: 10.1093/nar/gks203 |
| [10] |
刘志国, 罗成旺, 张利, 等. 多重荧光定量PCR方法鉴定布鲁氏菌属及牛羊种布鲁氏菌研究[J]. 中国人兽共患病学报, 2012, 28(9): 869–874.
LIU Z G, LUO C W, ZHANG L, et al. Multiplex fluorescence quantitative PCR detection on Brucella spp., Brucella abortus, and Brucella melitensis[J]. Chinese Journal of Zoonoses, 2012, 28(9): 869–874. DOI: 10.3969/cjz.j.issn.1002-2694.2012.09.002 (in Chinese) |
| [11] |
梅力, 王英超, 吴迪, 等. 1种检测新城疫病毒的微滴式数字PCR方法[J]. 畜牧兽医学报, 2020, 51(12): 3187–3192.
MEI L, WANG Y C, WU D, et al. A droplet digital PCR method for detection of Newcastle disease virus[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(12): 3187–3192. DOI: 10.11843/j.issn.0366-6964.2020.12.028 (in Chinese) |
| [12] |
马新冉, 肖雨晴, 雷春, 等. 数字PCR技术在水产病原菌检测中的应用[J]. 鲁东大学学报: 自然科学版, 2020, 36(1): 48–54.
MA X R, XIAO Y Q, LEI C, et al. Application of digital PCR in detection of aquatic pathogens[J]. Journal of Ludong University: Natural Science Edition, 2020, 36(1): 48–54. (in Chinese) |
| [13] | SAIKI R K, SCHARF S, FALOONA F, et al. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia[J]. Science, 1985, 230(4732): 1350–1354. DOI: 10.1126/science.2999980 |
| [14] | HINDSON B J, NESS K D, MASQUELIER D A, et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number[J]. Anal Chem, 2011, 83(22): 8604–8610. DOI: 10.1021/ac202028g |
| [15] |
赵丽青, 方佩佩, 唐静, 等. 数字PCR定量检测食品中单核细胞增生李斯特氏菌方法的研究[J]. 食品安全质量检测学报, 2017, 8(11): 4133–4138.
ZHAO L Q, FANG P P, TANG J, et al. Detection of Listeria monocytogenes in foods by droplet digital PCR[J]. Journal of Food Safety and Quality, 2017, 8(11): 4133–4138. DOI: 10.3969/j.issn.2095-0381.2017.11.009 (in Chinese) |
| [16] |
董莲华, 张玲, 姜君, 等. 大肠杆菌O157:H7微滴数字PCR定量方法的建立[J]. 分析化学, 2015, 43(3): 319–324.
DONG L H, ZHANG L, JIANG J, et al. Development of droplet digital polymerase chain reaction for quantifying Escherichia coli O157:H7[J]. Chinese Journal of Analytical Chemistry, 2015, 43(3): 319–324. (in Chinese) |
| [17] |
崔玉花, 田莉莉, 王晓亮, 等. 基于样品检测的布鲁氏菌荧光定量PCR方法的建立[J]. 中国人兽共患病学报, 2016, 32(5): 469–472.
CUI Y H, TIAN L L, WANG X L, et al. Development of real-time PCR method based on sample detection for Brucella[J]. Chinese Journal of Zoonoses, 2016, 32(5): 469–472. DOI: 10.3969/j.issn.1002-2694.2016.05.010 (in Chinese) |



