2. 东北林业大学野生动物与自然保护地学院, 哈尔滨 150040
2. College of Wildlife and Protected Area, Northeast Forestry University, Harbin 150040, China
缺血再灌注损伤(ischemia reperfusion injury, IRI)是缺氧器官在恢复供氧后组织细胞损伤加重的现象[1],在复杂的肝手术中,不可避免地会出现肝缺血再灌注损伤(hepatic ischemia reperfusion injury, HIRI),它是导致术后并发症和肝功能障碍的关键因素[2],而氧化应激是IRI早期重要的病理生理过程[3]。肝组织缺血缺氧期间会消耗大量的营养物质,线粒体的结构和功能遭到严重破坏,腺苷三磷酸(adenosine triphosphate, ATP)生成主要由厌氧糖酵解制造。细胞内的黄嘌呤二加氢酶转化为黄嘌呤氧化酶,这将导致活性氧(reactive oxygen species, ROS)的产生,此外,肝中细胞色素P450氧化酶也能产生大量ROS,ROS蓄积会影响细胞的功能,直接损伤细胞核酸、蛋白、脂质和碳水化合物代谢[4],严重将导致细胞死亡[5]。因此,有效减弱氧化应激反应是缓解缺血再灌注损伤的重要方法。
脂肪来源间充质干细胞(adipose-derived mesenchymal stem cells, ADSCs)越来越被认为是细胞治疗和组织工程的一种有前景的种子细胞[6]。最近,研究表明,干细胞通过释放可溶性细胞因子进行的旁分泌机制可能是细胞移植后组织修复和功能改善的关键[7],一些研究甚至证明,直接注射干细胞分泌的因子可以起到优于移植细胞本身带来的治疗效果[8]。脂肪间充质干细胞条件培养基(adipose-derived mesenchymal stem cells-conditioned medium, ADSCs-CM)来源丰富,取材简单,且易储存,起效快,在心肌梗死[9]、创面愈合[10]、治疗骨关节炎[11]、调节葡萄糖水平[12]等方面具有明显的疗效。腹腔镜手术具有创口小、术后恢复快等优势,广泛用于动物模型的建立[13-16]。目前,干细胞条件培养基对氧化应激损伤的研究多限于啮齿动物试验以及体外细胞模型试验,而干细胞条件培养基对小型猪肝缺血再灌注合并肝部分切除的氧化应激反应的研究尚未见报导,因此,本试验通过腹腔镜手术建立小型猪肝缺血再灌注合并肝部分切除肝损伤模型,观察肝损伤后移植ADSCs-CM和ADSCs对肝功能和氧化应激指标的变化,探讨ADSCs-CM和ADSCs对小型猪肝缺血再灌注合并肝部分切除术后氧化应激反应的影响。为肝缺血再灌注氧化应激的治疗寻找新的无细胞疗法,具有较强的临床研究价值。
1 材料与方法 1.1 试验动物广西巴马小型猪24头(20~30 kg),4~6月龄,经临床和实验室检查健康后进行试验,在整个试验过程中饲养管理条件保持一致。
1.2 仪器设备与试验试剂高清医用内窥镜摄像系统、医用内窥镜冷光源(深圳市神州医疗设备有限公司),全自动气腹机、腹腔镜手术器械(日本Olympus公司),兽用便携式多参数监护仪(深圳迈瑞生物医疗电子股份有限公司),动物呼吸麻醉机(美国SurgiVet公司),EPOCH连续波长酶标仪(美国BIOTEK基因有限公司),组织研磨仪(上海净信实业发展有限公司),二氧化碳培养箱(德国Eppendorf公司)。
硫酸阿托品注射液(山西省芮城科龙兽药有限公司),痛立定托芬那酸注射液(巍隆贸易有限公司),丙泊酚乳状注射液(西安力邦制药有限公司),异氟烷(河北一品制药有限公司生产),DMEM低糖培养基(美国Invitrogen生命技术有限公司),胎牛血清(美国CLARK公司),总胆红素、乳酸脱氢酶、总蛋白、丙二醛、髓内过氧化物酶、超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶试剂盒均购于南京建成生物工程有限公司,干细胞成脂、成骨、成肝诱导分化培养基均购于美国赛业生物科技公司,CD29、CD34、CD44、CD90抗体均购于英国Abcam公司。
1.3 小型猪脂肪干细胞的鉴定及培养基的制备实验动物选用经实验室检测健康的小型猪。麻醉后于无菌条件下取腹部脂肪,使用Ⅰ型胶原酶消化、终止、离心后,用200目铜网过滤,收集滤过后的细胞悬液用离心(1 500 r·min-1,10 min),弃去上清,使用红细胞裂解液重悬细胞,再次离心(1 500 r·min-1,5 min),弃去上清,用完全培养基(10% FBS,1%青链霉素和1%谷氨酰胺)重悬细胞并接种在25 cm2的细胞培养瓶中,置于培养箱(37 ℃,50 mL·L-1 CO2)中培养。待细胞80%融合传代接种到新的培养瓶中继续培养。
使用干细胞诱导分化培养基将P4代ADSCs向成脂、成骨和成肝细胞诱导分化。诱导结束后,成脂细胞用油红O对脂质液滴染色鉴定,成骨细胞用茜素红对矿化的钙基质染色鉴定,成肝细胞用PAS染液对糖原染色鉴定。此外,将ADSCs与抗猪FITC-CD29、FITC-CD34、FITC-CD44和FITC-CD90孵育,用流式细胞检测仪检测细胞表面抗原。
本试验中使用P4代细胞制备干细胞条件培养基,待细胞融合80%左右,用PBS轻柔洗去残留的培养液,换用无血清培养液饥饿培养。48 h后,收集细胞上清离心(1 500 r·min-1,10 min),去除死细胞和细胞碎片。无菌滤器过滤,收集滤液于3 KD超滤浓缩管中,5 000 g·min-1,浓缩25倍后,分装,储存在-80 ℃备用。
1.4 试验动物分组及手术模型的建立将24头广西巴马小型猪随机分为4组,每组6头,分别为模型组(IRI组)、基础培养基对照组(DMEM组)、脂肪间充质干细胞条件培养基组(CM组)以及脂肪间充质干细胞组(ADSCs组)。各组均通过腹腔镜手术建立小型猪肝缺血再灌注合并部分肝切除模型。
小型猪称重后,肌内注射硫酸阿托品(0.05 mg· kg-1),15 min后耳缘静脉注射小型猪复合麻醉剂(0.02 mg· kg-1),然后耳缘静脉缓慢注射丙泊酚进行诱导麻醉,气管插管完成后立即连接呼吸麻醉机,麻醉过程中,异氟烷浓度维持在2.5%~4.0%,氧流量0.8~1.0 L·min-1,呼吸频率15~20次·min-1,潮气量10~15 mL·kg-1,呼吸比1∶2,术中通过静脉通路注射生理盐水。待麻醉稳定后建立腹腔镜手术通路,手术采用四套管法,10 mm内径套管为腹腔镜镜头进出通路,5 mm内径套管皆为腹腔镜手术器械的进出通路。腹腔镜视野下,充分分离肝实质与胆囊管和胆囊动脉,使用自制带针止血带阻断右半肝入肝血流,缺血60 min后,用带线双针将肝实质贯穿缝合结扎3排,每排3~4针。然后使用高频电刀沿着预切线离断肝左叶,如遇大血管用超声刀闭合离断,然后用电凝球和明胶海绵对肝断面进行止血,最后用预温的生理盐水冲洗肝断面,确保断面再无出血。
左半肝切除后,对不同分组实验动物注射不同的物质(图 1),脂肪间充质干细胞组(ADSCs组)按照按每千克体重注射1×106个脂肪间充质干细胞,脂肪间充质干细胞条件培养基组(CM组)注射与ADSCs组等量细胞分泌的培养基的浓缩液,基础培养基对照组(DMEM组)注射与CM组等体积浓缩的DMEM基础培养基,模型组(IRI组)注射与DMEM组等体积的生理盐水,注射方法选择肝实质内注射。
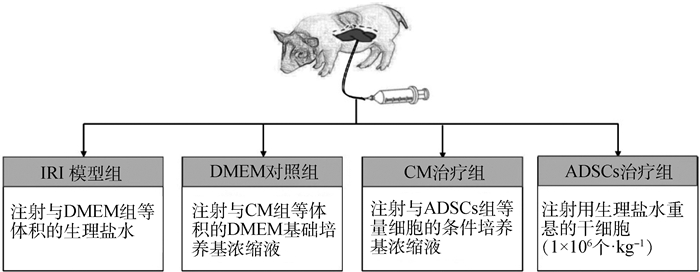
|
图 1 试验分组示意图 Fig. 1 Experimental grouping diagram |
1.5.1 样本采集 各组实验动物分别于术前、术后1、3、7 d通过前腔静脉采集血液样本,用于肝功能的检测;组织标本通过腹腔镜手术对各组实验动物术前、术后1、3、7 d进行肝组织的采样,取出的肝组织液氮罐中迅速冷冻,保存于-80 ℃冰箱,待检测使用。
1.5.2 肝功能的检测 取各组术前,术后1、3、7 d的血清样本,按照肝功能检测试剂盒说明书测定总胆红素(T-BIL)、乳酸脱氢酶(LDH)、总蛋白(TP)指标的变化。
1.5.3 氧化应激反应的检测 取各组术前、术后1、3、7 d冻存于-80 ℃的组织样本,根据丙二醛(MDA)试剂盒、髓内过氧化物酶(MPO)试剂盒、超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒的说明书,使用EPOCH连续波长酶标仪或分光光度计检测各组相应指标的变化。
1.6 数据统计分析使用Graphpad Prism 7软件分析统计作图,4组间各指标的差异显著性分析采用单因素方差分析方法(one-way ANOVA),P<0.05表示差异显著,P<0.01表示差异极显著,数据以“平均数±标准差(x±s)”的形式表示。
2 结果 2.1 腹腔镜建立肝损伤模型安全性监测本试验通过腹腔镜技术完成了小型猪肝缺血再灌注合并部分切除的肝损伤模型。术中、术后均未出现严重的并发症。手术安全性监测结果见表 1,对术前、术后1、3、7 d 4个时间点的心率(HR)、体温(BT)、呼吸(RR)、收缩压(SBP)、舒张压(DBP)、平均动脉压(MAP)进行检测,4组之间的心率(HR)、体温(BT)、呼吸(RR)、收缩压(SBP)、舒张压(DBP)和平均动脉压(MAP)在各个时间点均无明显差异。
|
|
表 1 生理指标监测结果(x±s,n=6) Table 1 The results of physiological parameters(x±s, n=6) |
体外分离培养的小型猪脂肪间充质干细胞呈长梭形,旋涡状生长,如图 2A瑞氏染色所示。ADSCs经成骨诱导后,茜素红染色发生显色反应,如图 2 B所示。成脂诱导两周后,油红O染色,如图 2C所示。成肝诱导21 d后进行PAS染色,见图 2D所示。取P4代小型猪脂肪间充质干细胞,经流式细胞仪检测干细胞表面特异性抗原的阳性率,结果如图 2 E~H所示,显示猪ADSCs不表达CD34,阳性率为1.0%,表达CD29、CD44、CD90,阳性率分别为99.8%、99.5%、98.2%。
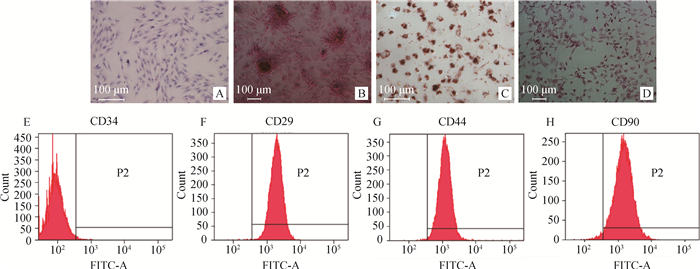
|
图 2 小型猪脂肪间充质干细胞的鉴定 Fig. 2 Identification of miniature pig ADSCs |
肝功结果如图 3显示:4组血清LDH水平均呈现先升高后降低的趋势,见图 3A,CM组与IRI组相比,术后1和3 d血清LDH水平极显著降低(P<0.01);ADSCs组与IRI相比,术后1和3 d血清LDH水平极显著降低(P<0.01);CM组与DMEM组相比,术后1和3 d差异极显著(P<0.01)。TBIL水平均同样呈现先升高后降低的趋势,见图 3B,CM组与IRI组相比,术后1和3 d血清TBIL水平极显著降低(P<0.01);ADSCs组与IRI相比,术后1和3 d血清TBIL水平极显著降低(P<0.01);CM组与DMEM组相比,术后1和3 d差异极显著(P<0.01)。4组血清中TP水平均呈现先降低后升高的趋势,见图 3C,CM组与IRI组相比,术后1和3 d血清TP水平极显著升高(P<0.01);ADSCs组与IRI相比,术后1 d血清TP水平极显著升高(P<0.01),3 d显著升高(0.01 < P<0.05);CM组与DMEM组相比,术后1和3 d差异显著(0.01 < P<0.05);而CM组与ADSCs组两组之间在各个时间点均无明显差异(P>0.05)。即CM组与ADSCs组可以降低LDH和TBIL的升高程度,提高TP的表达水平,促进肝功能的恢复。
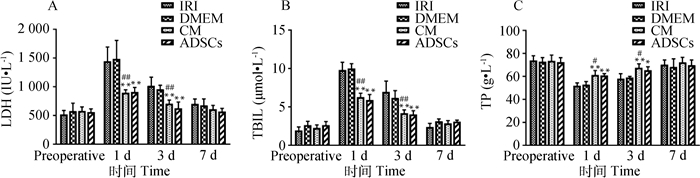
|
*.0.01 < P<0.05,各时间点DMEM组、CM组、ADSCs组与IRI组比较差异显著;**.P<0.01,各时间点DMEM组、CM组、ADSCs组与IRI组比较差异极显著;#.0.01 < P<0.05,各时间点CM组与DMEM组比较差异显著;##.P < 0.01,各时间点CM组与DMEM组比较差异极显著。下图同 *.0.01 < P < 0.05, DMEM group, CM group, ADSCs group and IRI group were significantly different at each time point; **.P < 0.01, DMEM group, CM group, ADSCs group and IRI group were extremely significant different at each time point; #.0.01 < P < 0.05, the CM group was significantly different from the DMEM group at each time point; ##.P < 0.01, the CM group was extremely significantly different from the DMEM group at each time point. The same as below 图 3 肝功生化指标检测结果 Fig. 3 Detection results of hepatic biochemical parameters |
4组肝组织MDA水平均呈现先升高后降低的趋势,见图 4A,CM组与IRI组相比,术后1和3 d肝组织MDA水平极显著降低(P<0.01);ADSCs组与IRI相比,术后1和3 d肝组织MDA水平极显著降低(P<0.01);DMEM组与IRI组相比,各时间点均无显著性差异(P>0.05);CM组与DMEM组相比,术后1 d差异极显著(P<0.01), 3 d差异显著(0.01<P<0.05);而CM组与ADSCs组两组之间在各个时间点均无明显差异(P>0.05)。

|
图 4 氧化应激反应指标检测结果 Fig. 4 Detection results of oxidative stress marker |
图 4B显示,4组肝组织SOD水平,均呈现先降低后升高的趋势,CM组与IRI组相比,肝组织SOD水平术后1 d极显著升高(P<0.01)、术后3 d显著升高(0.01<P<0.05);ADSCs组与IRI相比,术后1和3 d肝组织SOD水平极显著升高(P<0.01);DMEM组与IRI组相比,各时间点均无显著性差异(P>0.05);CM组与DMEM组相比,术后1 d差异极显著(P<0.01),术后3 d差异显著(0.01 < P<0.05);而CM组与ADSCs组两组之间在各个时间点均无明显差异(P>0.05)。
图 4C显示,4组肝组织CAT水平,均呈现先降低后升高的趋势,CM组与IRI组相比,肝组织CAT水平术后1 d极显著升高(P<0.01);术后3 d差异显著(0.01<P<0.05);ADSCs组与IRI相比,术后1 d肝组织CAT水平显著升高(0.01<P<0.05),术后3 d无明显差异(P>0.05);DMEM组与IRI组相比,各时间点均无显著性差异(P>0.05);CM组与DMEM组相比,术后1 d差异显著(0.01<P<0.05);而CM组与ADSCs组两组之间在各个时间点均无明显差异(P>0.05)。
图 4D显示,4组肝组织GSH-Px水平,均呈现先降低后升高的趋势,CM组与IRI组相比,肝组织GSH-Px水平术后1 d极显著升高(P<0.01);术后3 d无明显差异(P>0.05);ADSCs组与IRI相比,术后1 d肝组织GSH-Px水平显著升高(0.01<P<0.05),术后3 d无明显差异(P>0.05);DMEM组与IRI组相比,各时间点均无显著性差异(P>0.05);CM组与DMEM组相比,术后1 d差异极显著(P<0.01);而CM组与ADSCs组两组之间在各个时间点均无明显差异(P>0.05)。
图 4E显示,4组肝组织MPO水平,均呈现先升高后降低的趋势,CM组与IRI组相比,肝组织MPO水平术后1 d极显著降低(P<0.01),术后3 d无明显差异(P>0.05);ADSCs组与IRI相比,术后1 d肝组织MPO水平极显著降低(P<0.01),术后3 d无明显差异(P>0.05);DMEM组与IRI组相比,各时间点均无显著性差异(P>0.05);CM组与DMEM组相比,术后1 d差异极显著(P<0.01);而CM组与ADSCs组两组之间在各个时间点均无明显差异(P>0.05)。
3 讨论间充质干细胞由于低免疫原性及多向分化的潜能,成为再生医学中一种广泛的细胞来源。一直以来,人们普遍认为间充质干细胞治疗效果的作用机制是分化作用。最近的研究表明,干细胞通过释放可溶性细胞因子进行的旁分泌机制可能是干细胞移植后组织修复和功能改善的关键机制。干细胞的条件培养基(conditioned medium, CM)是指细胞分泌到细胞外的生物活性因子,包括可溶性蛋白质、游离核酸、脂质体、凋亡小体、微粒子和外泌体等[17]。直接移植干细胞的条件培养基具有许多优点,首先避免了细胞移植后存活率低的问题,有数据表明只有不到3%的间充质干细胞能够在移植后持续存活2周[18-19];其次移植干细胞仍然存在免疫排斥反应[20];同时还存在恶性转化的可能[21]。因此,脂肪来源干细胞培养基作为潜在的无细胞疗法,目前在治疗各种疾病的研究以及应用也逐渐开展。
氧化应激损伤是肝缺血再灌注常见的病理过程,肝缺血再灌注和部分切除为ROS的产生创造了必要条件,ROS可以通过干扰碳水化合物、核酸、脂质和蛋白质的各种新陈代谢来改变或恶化细胞;同时,缺血期使线粒体的功能受损,细胞色素氧化酶系统功能失调导致细胞内的氧还原形成氧自由基,致使短时间内ROS大量聚集引起生物膜的脂质过氧化反应,严重的氧化应激反应造成细胞死亡。目前已有体外细胞模型的研究,证实干细胞的条件培养基对细胞的氧化应激损伤具有保护作用[22-24],但尚缺乏干细胞条件培养基在大动物在体试验氧化应激反应的相关研究。
肝缺血再灌注及肝部分切除会对肝实质造成不同程度的损伤,剩下健康的肝组织也会由于缺血再灌注发生病理损伤。本试验通过对肝功能的检测探究ADSCs-CM和ADSCs对肝损伤后肝功能的影响。LDH是催化乳酸氧化为丙酮酸的一种糖酵解酶,当肝细胞发生损伤时,LDH的含量升高;当肝细胞坏死时,TBIL含量上升;TP可以分为白蛋白和球蛋白,在机体生理中具有维持血液渗透压、运输代谢物质以及营养作用的生理功能,但在肝细胞发生损伤,肝功能受阻时,蛋白合成发生障碍,会导致血清TP的降低。因此,LDH、TBIL、TP是判断肝功能的重要指标。有研究表明,单独移植猪的脂肪间充质干细胞可以有效改善肝缺血再灌注后的肝功能[25]。而在本试验中,可以观察到CM组、ADSCs组在术后1和3 d均能降低IRI组LDH、TBIL的表达水平,提高TP的表达水平,说明ADSCs-CM与ADSCs均有明显的治疗效果,因为CM组与DMEM组呈显著性差异,DMEM组与IRI组无显著性差异,表明DMEM基础培养基对肝功能的恢复无治疗作用,而CM组起治疗作用的是溶于培养基中ADSCs分泌的有效生物成分,即ADSCs-CM能够改善肝功能,加快术后肝功能的恢复,对小型猪肝缺血再灌注与肝切除损伤起保护作用。
ROS是一种生物体内作为细胞代谢副产物产生的含氧化学物质,ROS的大量聚集引起生物膜的脂质过氧化反应,机体氧自由基脂质过氧化的产物MDA会随氧化反应程度而升高,因此MDA可以用来衡量细胞受自由基攻击的严重程度,判断氧化应激反应的程度;而MPO是发生氧化应激反应时内皮细胞分泌的酶,当MPO从细胞释放后,可以通过催化氧化氯离子产生次氯酸,破坏多种靶物质,MPO还能催化生成大量的氧化剂,当氧化剂与抗氧化剂的平衡被破坏后,过量的氧化剂又会加重组织的氧化应激反应。但在氧化应激反应中,抗氧化酶系的SOD、CAT、GSH-Px能够催化超氧阴离子自由基生成氧和过氧化氢,对机体的氧化和抗氧化的平衡起至关重要的作用,抗氧化物酶SOD、CAT可以清除自由基的产生,GSH-Px可以直接和自由基反应保护细胞膜。在肝缺血再灌注的过度氧化应激反应中,氧化应激产物MDA以及引起释放MPO的水平持续增加,而抗氧化应激的SOD、CAT、GSH-Px酶活力减弱,提示可以通过增强抗氧化物酶SOD、CAT、GSH-Px活性,减少MDA以及MPO含量,减少脂质过氧化物,增强肝抗氧化应激能力,继而缓解HIRI后的肝细胞损伤。
本研究建立小型猪的肝缺血再灌注合并部分切除模型,通过对肝组织的氧化应激相关指标的检测,试验结果发现,CM组和ADSCs组在术后显著提高了抗氧化酶的活性,降低了氧化应激产物MDA与MPO的表达水平,减少了氧化应激反应对肝细胞的损伤。国内有研究将人的羊膜间充质干细胞移植用来修复肝缺血的再灌注损伤,发现可以显著降低肝组织MDA的浓度[26],移植猪的脂肪间充质干细胞也可减缓肝缺血再灌注后的氧化应激反应[27],还有学者在体外构建神经元氧化应激损伤模型,通过神经干细胞条件培养基干预,证明了神经干细胞条件培养基能够一定程度上减轻小鼠皮层神经元氧化应激损伤[28]。相似的是,国外一些研究证实了干细胞条件培养基的抗氧化能力,研究表明骨髓间充质干细胞的条件培养基可以通过减少ROS来提高氧化应激条件下神经元的存活数量[29]。体外试验用过氧化氢诱导人正常肝细胞的氧化应激损伤,MSC-CM可以通过抑制细胞凋亡减轻过氧化氢引起肝细胞的氧化应激损伤[30];Hong等[31]使用人的脂肪间充质干细胞条件培养基和本试验同样采用3 KD浓缩25倍,构建小鼠70%肝切除模型,试验结果发现,脂肪间充质干细胞条件培养基处理能显著增加肝中SOD、GSH-Px、过氧化氢酶等3种抗氧化蛋白的表达,并通过增加抗氧化酶的表达来提供对肝细胞的保护作用。本试验同样发现,小型猪ADSCs-CM能够提高肝缺血再灌注合并部分切除术后的抗氧化物酶SOD、CAT、GSH-Px活性,减少MDA以及MPO的表达,提示ADSCs-CM可以提高抗氧化酶的活性,从而减轻肝氧化应激反应的损伤。
4 结论通过移植ADSCs和ADSCs-CM对小型猪肝缺血再灌注合并部分肝切除损伤中肝功能和氧化应激影响的研究,发现ADSCs和ADSCs-CM均能够减轻缺血再灌注导致的肝损伤,减缓氧化应激反应,表明ADSCs-CM作为无细胞疗法可减轻肝缺血再灌注后的氧化应激损伤,争取实现替代细胞治疗的弊端,并具有一定的临床应用和转化价值。
| [1] |
曾利, 曹海平, 陈凯. 槲皮素对重要脏器缺血再灌注损伤保护作用的研究现状及进展[J]. 世界最新医学信息文摘, 2017, 17(94): 22–23.
ZENG L, CAO H P, CHEN K. Research status and progress of the protective effect of quercetin on ischemia-reperfusion injury of important organs[J]. World Latest Medicine Information (Electronic Version), 2017, 17(94): 22–23. (in Chinese) |
| [2] | PANISELLO-ROSELLÓ A, ROSELLÓ-CATAFAU J. Molecular mechanisms and pathophysiology of ischemia-reperfusion injury[J]. Int J Mol Sci, 2018, 19(12): 4093. DOI: 10.3390/ijms19124093 |
| [3] | LOOR G, KONDAPALLI J, IWASE H, et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion[J]. Biochim Biophys Acta Mol Cell Res, 2011, 1813(7): 1382–1394. DOI: 10.1016/j.bbamcr.2010.12.008 |
| [4] | JAESCHKE H, WOOLBRIGHT B L. Current strategies to minimize hepatic ischemia-reperfusion injury by targeting reactive oxygen species[J]. Transplant Rev (Orlando), 2012, 26(2): 103–114. DOI: 10.1016/j.trre.2011.10.006 |
| [5] | SCHIEBER M, CHANDEL N S. ROS function in redox signaling and oxidative stress[J]. Curr Biol, 2014, 24(10): R453–R462. DOI: 10.1016/j.cub.2014.03.034 |
| [6] | DUBEY N K, MISHRA V K, DUBEY R, et al. Revisiting the advances in isolation, characterization and secretome of adipose-derived stromal/stem cells[J]. Int J Mol Sci, 2018, 19(8): 2200. DOI: 10.3390/ijms19082200 |
| [7] | NAHAR S, NAKASHIMA Y, MIYAGI-SHIOHIRA C, et al. Cytokines in adipose-derived mesenchymal stem cells promote the healing of liver disease[J]. World J Stem Cells, 2018, 10(11): 146–159. DOI: 10.4252/wjsc.v10.i11.146 |
| [8] | VAN POLL D, PAREKKADAN B, CHO C H, et al. Mesenchymal stem cell-derived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo[J]. Hepatology, 2008, 47(5): 1634–1643. DOI: 10.1002/hep.22236 |
| [9] | LI X T, MA T, SUN J C, et al. Harnessing the secretome of adipose-derived stem cells in the treatment of ischemic heart diseases[J]. Stem Cell Res Ther, 2019, 10(1): 196. DOI: 10.1186/s13287-019-1289-7 |
| [10] |
王晓宇, 郭家辰, 刘勇. 脂肪间充质干细胞上清液对小鼠皮肤创伤的作用及可能机制[J]. 解剖科学进展, 2015, 21(3): 263–266.
WANG X Y, GUO J C, LIU Y. The effect and possible mechanism of supernatant of adipose mesenchymal stem cells on the skin wound healing in mice[J]. Progress of Anatomical Sciences, 2015, 21(3): 263–266. (in Chinese) |
| [11] | NIADA S, GIANNASI C, GOMARASCA M, et al. Adipose-derived stromal cell secretome reduces TNFα-induced hypertrophy and catabolic markers in primary human articular chondrocytes[J]. Stem Cell Res, 2019, 38: 101463. DOI: 10.1016/j.scr.2019.101463 |
| [12] | HAJMOUSA G, PRZYBYT E, PFISTER F, et al. Human adipose tissue-derived stromal cells act as functional pericytes in mice and suppress high-glucose-induced proinflammatory activation of bovine retinal endothelial cells[J]. Diabetologia, 2018, 61(11): 2371–2385. DOI: 10.1007/s00125-018-4713-0 |
| [13] |
张千振, 葛延松, 焦智慧, 等. 小型猪腹腔镜肝缺血再灌注合并肝部分切除对肝细胞凋亡及相关基因影响的研究[J]. 中国兽医杂志, 2018, 54(4): 22–25, 28.
ZHANG Q Z, GE Y S, JIAO Z H, et al. Effect of laparoscopic ischemia reperfusion combined with partial hepatectomy on hepatocyte apoptosis and related gene expression in miniature pigs[J]. Chinese Journal of Veterinary Medicine, 2018, 54(4): 22–25, 28. (in Chinese) |
| [14] |
李辉, 葛延松, 白鸽, 等. 富氢生理盐水干预小型猪肝脏缺血再灌注合并肝脏部分切除损伤中内质网应激影响的研究[J]. 中国畜牧兽医, 2018, 45(6): 1692–1699.
LI H, GE Y S, BAI G, et al. Hydrogen-rich saline protects effect against liver ischemia-reperfusion injury and hepatectomy by inhibiting endoplasmic reticulum stress in miniature pig[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(6): 1692–1699. (in Chinese) |
| [15] | JIAO Z H, LIU X N, MA Y J, et al. Adipose-derived stem cells protect ischemia-reperfusion and partial hepatectomy by attenuating endoplasmic reticulum stress[J]. Front Cell Dev Biol, 2020, 8: 177. DOI: 10.3389/fcell.2020.00177 |
| [16] | JIAO Z H, MA Y J, LIU X N, et al. Adipose-derived stem cell transplantation attenuates inflammation and promotes liver regeneration after ischemia-reperfusion and hemihepatectomy in swine[J]. Stem Cells Int, 2019, 2019: 2489584. |
| [17] | BEER L, MILDNER M, ANKERSMIT H J. Cell secretome based drug substances in regenerative medicine: when regulatory affairs meet basic science[J]. Ann Transl Med, 2017, 5(7): 170. DOI: 10.21037/atm.2017.03.50 |
| [18] | PITTENGER M F, MARTIN B J. Mesenchymal stem cells and their potential as cardiac therapeutics[J]. Circ Res, 2004, 95(1): 9–20. DOI: 10.1161/01.RES.0000135902.99383.6f |
| [19] | ABAZOV V, ABBOTT B, ACHARYA B, et al. Precision measurement of the ratio B (t→ Wb)/B (t→ Wq) and extraction of Vtb[J]. Phys Rev Lett, 2011, 107(12): 121802. DOI: 10.1103/PhysRevLett.107.121802 |
| [20] | ZANGI L, MARGALIT R, REICH-ZELIGER S, et al. Direct imaging of immune rejection and memory induction by allogeneic mesenchymal stromal cells[J]. Stem Cells, 2009, 27(11): 2865–2874. DOI: 10.1002/stem.217 |
| [21] | BAGLIO S R, PEGTEL D M, BALDINI N. Mesenchymal stem cell secreted vesicles provide novel opportunities in (stem) cell-free therapy[J]. Front Physiol, 2012, 3: 359. |
| [22] |
牛杨, 申才良, 宋旆文, 等. BMSC-CM通过抑制Notch1信号通路减轻H2O2诱导的神经干细胞凋亡[J]. 安徽医科大学学报, 2018, 53(6): 845–850.
NIU Y, SHEN C L, SONG P W, et al. BMSC-CM reduces the effects of oxidative stress damage on neural stem cells by inhibiting Notch1 signaling pathway[J]. Acta Universitatis Medicinalis Anhui, 2018, 53(6): 845–850. (in Chinese) |
| [23] |
秦森, 张枫惠, 朱自欣, 等. 诱导性多能干细胞条件培养基对成肌细胞氧化应激损伤的保护作用[J]. 黑龙江畜牧兽医, 2017(11): 32–34, 291.
QIN S, ZHANG F H, ZHU Z X, et al. Protective effect of induced pluripotent stem cell-conditioned medium on oxidative stress injury of myoblasts[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(11): 32–34, 291. (in Chinese) |
| [24] |
徐雪晶, 李栋, 李雪, 等. 间充质干细胞条件培养基治疗肝氧化应激损伤中部分miRNA的变化[J]. 中国病理生理杂志, 2016, 32(9): 1670–1676.
XU X J, LI D, LI X, et al. MicroRNA expression in hepatocytes with hydrogen peroxide-induced oxidative stress-injury and alleviating effect of mesenchymal stem cell-conditioned medium[J]. Chinese Journal of Pathophysiology, 2016, 32(9): 1670–1676. DOI: 10.3969/j.issn.1000-4718.2016.09.023 (in Chinese) |
| [25] | GE Y S, ZHANG Q Z, JIAO Z H, et al. Adipose-derived stem cells reduce liver oxidative stress and autophagy induced by ischemia-reperfusion and hepatectomy injury in swine[J]. Life Sci, 2018, 214: 62–69. DOI: 10.1016/j.lfs.2018.10.054 |
| [26] |
王新党, 张建军, 叶奎. 人羊膜间充质干细胞移植修复肝脏缺血-再灌注损伤[J]. 中国组织工程研究, 2016, 20(45): 6788–6794.
WANG X D, ZHANG J J, YE K. Human amniotic mesenchymal stem cell transplantation for the repair of liver ischemia-reperfusion injury[J]. Chinese Journal of Tissue Engineering Research, 2016, 20(45): 6788–6794. DOI: 10.3969/j.issn.2095-4344.2016.45.015 (in Chinese) |
| [27] |
葛延松. 小型猪ADSCs对腹腔镜肝脏I/R合并部分切除损伤保护作用的研究[D]. 哈尔滨: 东北农业大学, 2019.
GE Y S. Study of the protective effect of miniature pig adipose derived stem cells on hepatic Ischemia-Reperfusion combined with laparoscopic epatectomy injury[D]. Harbin: Northeast Agricultural University, 2019. (in Chinese) |
| [28] |
叶松庆, 李永全. 神经干细胞条件培养基对氧化应激损伤小鼠皮层神经元的作用[J]. 中国中西医结合外科杂志, 2018, 24(4): 466–471.
YE S Q, LI Y Q. Effect of neural stem cell-conditioned medium on mice cortical neurons injured by oxidative stress[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine, 2018, 24(4): 466–471. DOI: 10.3969/j.issn.1007-6948.2018.04.020 (in Chinese) |
| [29] | WEN C Y, HUANG C Q, YANG M, et al. The secretion from bone marrow mesenchymal stem cells pretreated with berberine rescues neurons with oxidative damage through activation of the keap1-Nrf2-HO-1 signaling pathway[J]. Neurotox Res, 2020, 38(1): 59–73. DOI: 10.1007/s12640-020-00178-0 |
| [30] | XU X J, LI D, LI X, et al. Mesenchymal stem cell conditioned medium alleviates oxidative stress injury induced by hydrogen peroxide via regulating miR143 and its target protein in hepatocytes[J]. BMC Immunol, 2017, 18(1): 51. DOI: 10.1186/s12865-017-0232-x |
| [31] | HONG H E, KIM O H, KWAK B J, et al. Antioxidant action of hypoxic conditioned media from adipose-derived stem cells in the hepatic injury of expressing higher reactive oxygen species[J]. Ann Surg Treat Res, 2019, 97(4): 159–167. DOI: 10.4174/astr.2019.97.4.159 |



