2. 教育部农业与农产品安全国际合作联合实验室, 扬州 225009
2. Joint International Research Laboratory of Agriculture and Agri-Product Safety, the Ministry of Education of China, Yangzhou 225009, China
RNA修饰发生在转录后水平,包括100余种调控方式,其中RNA甲基化是RNA修饰的主要方式[1]。RNA甲基化与DNA甲基化类似,都是以S-腺苷甲硫氨酸(S-adenosyl methionine, SAM)为甲基供体,在一系列酶的作用下,将甲基催化转移到其他化合物的过程[2]。近年来,陆续发现一系列RNA甲基化修饰方式,6-甲基腺嘌(N6-methyladenosine,m6A)、5-甲基胞嘧啶(N5-methylcytosine,m5C)、1-甲基腺苷(N1-methyl-adenosine,m1A)是较为常见的类型[3],其中对m6A的研究较为深入。肾母细胞瘤1-相关蛋白(Wilm’s tumor 1-associated protein,WTAP)是m6A甲基化转移酶复合物的核心组分之一。现有大量研究表明,WTAP基因的表达紊乱能够造成m6A甲基化调控失衡,与人类多种肿瘤通路的抑制和激活有关[4-8];m6A甲基化修饰还与动物的生长发育以及疾病的发生和调控密切相关,然而在猪WTAP基因功能的报道较少。
断奶仔猪腹泻病(post-weaning diarrhoea, PWD)是造成仔猪死亡的主要原因之一,其中,F18大肠杆菌(E. coli F18)是引起仔猪细菌性腹泻的主要病原菌之一。目前,已有相关研究从DNA甲基化修饰水平阐述了仔猪细菌性腹泻的调控机制[9-10],而在m6A RNA甲基化水平上尚无相关报道。本研究在个体水平上利用实时荧光定量PCR(RT-qPCR)检测 WTAP在断奶苏太仔猪E. coli抗性型与敏感型个体肠道组织的差异表达情况,并且在细胞水平上利用大肠杆菌F18ab、F18ac刺激和内毒素LPS诱导猪小肠上皮细胞系IPEC-J2,检测处理前后WTAP基因mRNA表达水平的变化。同时,为了进一步探究WTAP基因表达水平与F18大肠杆菌感染的关系,本研究构建并获得了RNA干扰WTAP基因的猪小肠上皮细胞系,并通过大肠杆菌菌毛定量和菌落计数试验以及间接免疫荧光检测沉默WTAP基因对猪小肠上皮细胞大肠杆菌(F18ab、F18ac)黏附能力的影响。本研究初步验证了RNA甲基化酶WTAP与仔猪抗F18大肠杆菌感染的关系,为今后深入探讨仔猪大肠杆菌抗性的RNA甲基化调控机制提供参考和依据。
1 材料与方法 1.1 材料课题组前期进行F18菌株口服攻毒试验,并通过粪便表型观察、肠道E. coli F18菌落计数、组织病理检测以及体外细菌黏附试验,将出现“水样粪便”、小肠上皮细胞大量黏附大肠杆菌的仔猪定义为敏感型个体,“正常粪便”、小肠上皮细胞几乎不黏附大肠杆菌的仔猪定义为抗性型个体,建立了苏太猪(Sus scrofa)F18大肠杆菌抗性型与敏感型群体,并且已经基于抗性型与敏感型全同胞个体开展了大量相关工作[11-12],本研究选择F18大肠杆菌抗性型与敏感型断奶仔猪公猪各4头,屠宰后采十二指肠组织和空肠组织置于无酶管中,-70 ℃保存备用。猪小肠上皮细胞系IPEC-J2由美国宾夕法尼亚大学惠赠;产肠毒素大肠杆菌F18ab、F18ac由扬州大学兽医学院馈赠。DMEM培养基、胎牛血清、LB培养基均购自美国Gibco公司;血液/组织/细胞DNA提取试剂盒购自天根生物科技有限公司(中国,北京);LPS购自美国Sigma公司;干粉PBS缓冲液购自塞因坦科技有限公司(北京);Trizol购自Invitrogen公司(美国);反转录试剂盒SYBR、定量试剂盒购自Vazyme公司(中国,南京);E. coli抗体购自美国GeneTeX公司;Anti-rabbit lgG二抗购自美国R&D Systems公司。
1.2 细胞总RNA的提取和RT-qPCR1.2.1 细胞总RNA的提取及反转录 按照Trizol法分别提取每孔细胞中RNA,通过1.2%琼脂糖凝胶电泳和分光光度计检测RNA的浓度和纯度,-70 ℃保存备用。以每个个体RNA为模板进行反转录。反转录体系:细胞总RNA 500 ng,5×qRT SuPerMix Ⅱ 2 μL,无酶水补足至10 μL。反应程序:25 ℃ 10 min,50 ℃ 30 min,85 ℃ 5 min,4 ℃保存。
1.2.2 荧光定量PCR 根据NCBI(https://www.ncbi.nlm.nih.gov/)数据库中猪WTAP基因的序列(序列号:NM_001244241.1),同时以大肠杆菌菌毛蛋白基因PILIN(M25302.1)为模板设计定量引物,利用Primer Express 2.0软件跨外显子设计Real-Time PCR引物,并以GAPDH作为内参。上述引物均由上海生工生物工程股份有限公司合成,引物信息如表 1所示。
|
|
表 1 荧光定量引物序列 Table 1 The sequence of fluorescence quantitative primers |
反应体系包含模板cDNA 2 μL,上、下游引物(10 μmol ·L-1)各0.4 μL,2 × AceQ qPCR SYBR Green 10 μL,50 × ROX Reference Dye I 0.4 μL,无酶水补足至20 μL,每个样本设置3个重复。反应程序: 95 ℃ 5 min;95 ℃ 10 s,60 ℃ 34 s,40个循环。扩增结束后,通过熔解曲线和扩增曲线分析产物特异性,程序:95 ℃ 15 s,60 ℃ 1 min;95 ℃ 15 s,60 ℃ 15 s。
1.3 大肠杆菌侵染和LPS诱导IPEC-J2细胞取IPEC-J2细胞以1×106个·孔-1的密度接种到12孔板中,用含10%胎牛血清(FBS)的DMEM完全培养液培养,至密度达到接近80%;在LB培养基中分别接种E. coli F18ab、F18ac菌株,37 ℃ 200 r·min-1摇菌12 h,然后3 000 r·min-1离心10 min,收集菌体沉淀,PBS缓冲液重悬反复洗涤3次;稀释菌体沉淀,加入细胞培养液后稀释至细菌密度在1.0×109 CFU·mL-1左右;12孔板中,按1 mL·孔-1加入菌液,每组菌体刺激设立3个重复孔,并设置1个未经菌体刺激空白孔作为对照,5 ℃恒温培养4 h后,提取细胞RNA。
用细胞培养液将LPS稀释至0.1 μg·mL-1,在12孔板中每孔加入1 mL细胞进行诱导,将只加细胞培养液的孔作为对照组,每组设置3个平行样。分别在诱导后的2、4和6 h收集细胞。
1.4 构建靶向WTAP基因的siRNA干扰载体针对WTAP mRNA设计3对siRNA序列和1个阴性对照序列(表 2),由上海吉玛基因公司负责合成。使用Lipofectamine 2000将上述siRNAs和空白组(Mock)转染至IPEC-J2细胞中,每个处理组设3个重复。转染后在5% CO2的37 ℃细胞培养箱中过夜孵育,24 h后观察荧光素标记(FAM)在IPEC-J2中的表达情况,通过RT-qPCR检测并计算RNA干扰效率,选择干扰效率较高的一组序列用于后续试验。
|
|
表 2 siRNA干扰序列 Table 2 The sequence of siRNAs |
F18ab和F18ac菌株分别接种至LB液体培养液,37 ℃摇床220 r·min-1培养12 h,4 000 r·min-1离心5 min收集菌体沉淀,用PBS重悬沉淀并离心,重复洗涤3次。用细胞培养液将菌体沉淀稀释到1.0×109 CFU·mL-1。设大肠杆菌侵染组及空白组,分别按5.0×105个·孔-1将细胞铺板到12孔细胞培养板,培养至90%左右的细胞覆盖度。加入1.0 mL上述细菌稀释液于细胞培养孔中,设置3个重复,37 ℃ 5% CO2培养箱孵育2 h。吸去孔中细菌培养液,PBS缓冲液重悬洗涤3次。
向培养孔中加入200 μL的DNA提取裂解液,按照DNA提取试剂盒试验步骤提取细胞和细菌总DNA。以抽提所得混合DNA为扩增模板,通过荧光定量PCR检测进行相对定量分析,每个样本设置3个重复,引物信息见表 1。
1.6 细菌计数法检测大肠杆菌对细胞的黏附情况大肠杆菌制备及细胞培养同上,PBS缓冲液重悬洗涤3次。立即用0.5% Triton X-100 (超纯水配制)溶液处理细胞20 min,再用移液枪吹打收集细菌悬液,将其按10倍梯度稀释后涂布于LB固体平板,37 ℃恒温培养过夜。对1 000倍细菌稀释液涂布的平板进行细菌计数,利用Image J软件统计平板上的菌落数,最终用平板上的菌落数×103表示黏附细菌数(单位:CFU·mL-1)。
1.7 间接免疫荧光法观察大肠杆菌对细胞的黏附情况取出细胞生长密度达到90%左右的细胞爬片,PBS漂洗3遍,置于4%多聚甲醛4 ℃固定20 min,PBS冲洗5 min×3遍;1% Trtion X-100破膜处理15 min,PBS冲洗5 min×3遍;加入含5% BSA封闭液,37 ℃封闭1 h;加入抗E. coli一抗(浓度为1∶50,使用含5% FBS的PBS配制),37 ℃孵育2 h后,于4 ℃冰箱过夜;次日吸掉一抗,PBS冲洗5 min×3遍;加入红色荧光标记的二抗(浓度为1∶200,使用5% FBS的PBS配制),37 ℃避光孵育1 h;吸掉抗体,PBST冲洗5 min×3遍;加入DAPI溶液(1 mg·mL-1)进行染核,37 ℃孵育5 min,PBST冲洗5 min×3遍;使用防荧光淬灭封片剂封片,于共聚焦显微镜下观察。
1.8 数据处理与分析采用2-△△Ct法对荧光定量结果进行处理,其中△△Ct=(待测目的基因平均Ct值-待测组内参基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参基因平均Ct值)。利用SPSS 17.0软件一般线性模型(general linear model,GLM)进行基因差异表达分析。
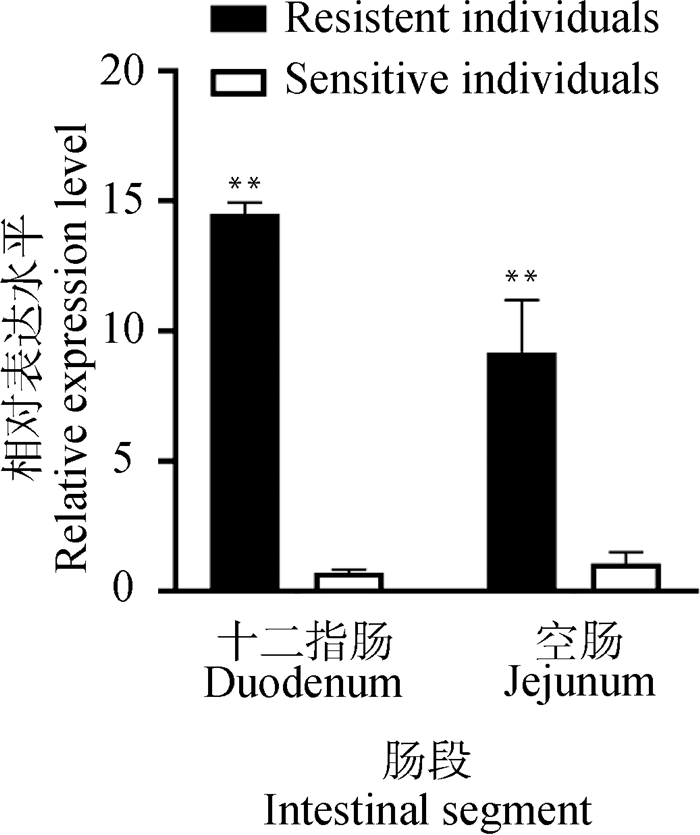
2 结果 2.1 大肠杆菌抗性型和敏感型仔猪十二指肠和空肠组织中WTAP差异表达分析对苏太断奶仔猪大肠杆菌抗性和敏感型个体十二指肠和空肠组织进行表达水平检测。结果显示(图 1),在十二指肠和空肠组织中,抗性型个体WTAP基因mRNA表达量极显著高于敏感型(P<0.01)。
|
*. P<0.05;**. P<0.01。下同 * means P < 0.05; ** means P < 0.01. The same as below 图 1 WTAP基因在F18抗性型与敏感型个体十二指肠、空肠组织中的表达分析 Fig. 1 Expression analysis of WTAP gene in duodenum and jejunum of E. coli F18 resistant- and sensitive- induviduals |
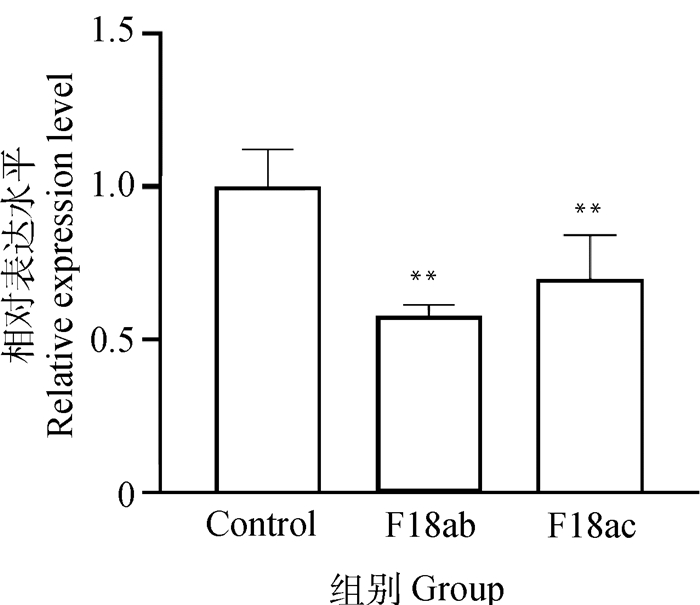
分别用F18ab、F18ac刺激小肠上皮细胞IPEC-J2,检测WTAP mRNA的相对表达量。结果显示(图 2), 与对照组(Control)相比,F18ab和F18ac处理组WTAP基因mRNA表达量均显著下降(P<0.01)。
|
Control表示空白对照。下同 Control means blank control. The same as below 图 2 F18ab、F18ac刺激IPEC-J2后WTAP基因的表达分析 Fig. 2 Expression levels of WTAP gene in cells stimulated by F18ab, F18ac |
由图 3可知,使用LPS诱导小肠上皮细胞后,WTAP基因表达量呈下降趋势。与0 h相比,在诱导2和4 h后WTAP基因表达水平没有显著变化,但是在诱导6 h后其表达量极显著下降(P<0.01)。

|
图 3 LPS诱导小肠上皮细胞IPEC-J2后不同时间WTAP的表达差异 Fig. 3 Expression levels of WTAP in IPEC-J2 induced by LPS at different time |
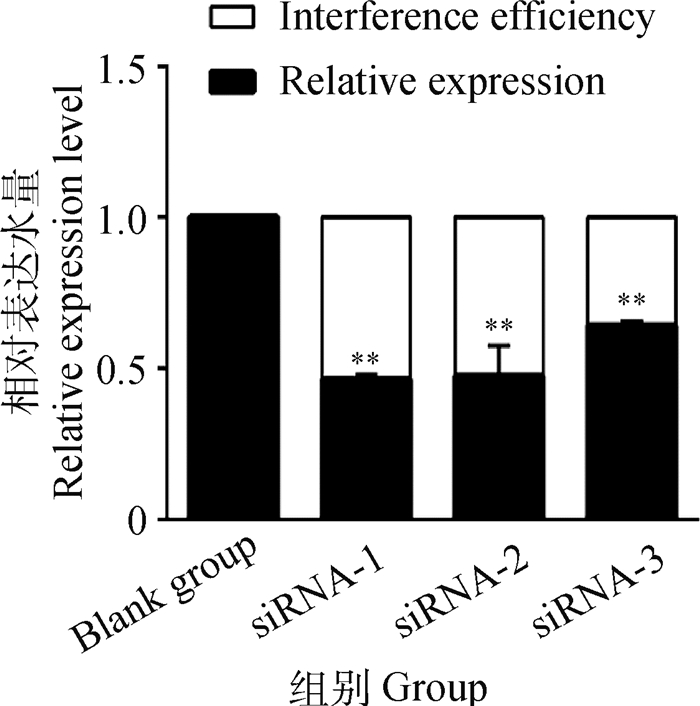
干扰载体成功转染细胞后,检测WTAP基因mRNA的表达量,结果显示siRNA-1相对表达水平为0.46,干扰效率为54%,干扰效率最高,可用于后续试验(图 4)。
|
图 4 WTAP基因mRNA表达量及干扰效率分析 Fig. 4 Analysis of mRNA expression and interference efficiency of WTAP gene |
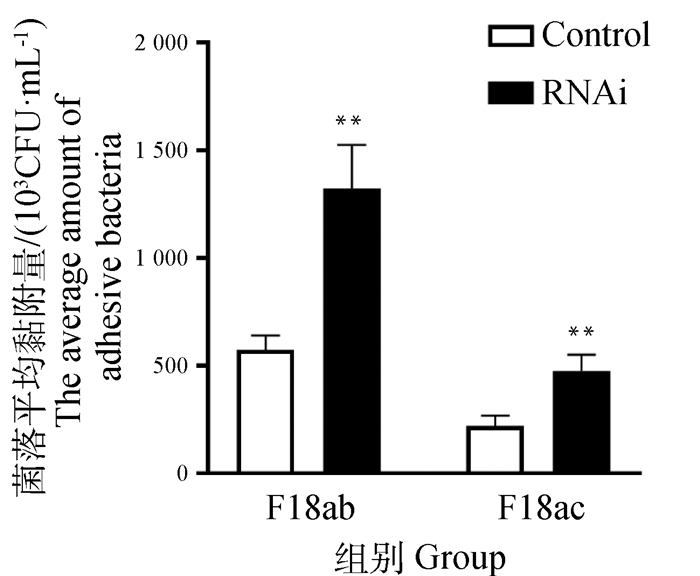
通过检测大肠杆菌菌毛蛋白基因PILIN的表达水平以及对大肠杆菌的菌落计数来探究WTAP基因沉默对大肠杆菌黏附的影响,如图 5、6所示,WTAP基因沉默后,F18大肠杆菌(F18ab、F18ac)对猪小肠上皮细胞的黏附能力均极显著上升(P<0.01),其中,F18ab的黏附量高于F18ac。间接免疫荧光结果显示,WTAP基因沉默后,IPEC-J2对F18大肠杆菌黏附量明显增多(图 7)。

|
图 5 WTAP基因沉默的IPEC-J2细胞与F18大肠杆菌黏附水平的关系 Fig. 5 The relationship between the WTAP gene silencing of IPEC-J2 cells and the adhesion of E. coli F18 |
|
图 6 WTAP基因沉默的IPEC-J2细胞对F18大肠杆菌黏附水平的菌落计数 Fig. 6 The colony quantification of IPEC-J2 cells with WTAP gene silencing on the adhesion level of E. coli F18 |

|
蓝色荧光代表DAPI染色的细胞核;红色荧光代表结合大肠杆菌抗体的大肠杆菌 Blue fluorescence represents nucleus stained by DAPI; Red fluorescence represents E. coli F18 combined with E. coli F18 antibody 图 7 WTAP基因沉默的IPEC-J2细胞与F18大肠杆菌黏附的间接免疫荧光试验结果 Fig. 7 The relationship between the WTAP gene silencing of IPEC-J2 cells and the adhesion level of E. coli F18 |
RNA作为中心法则的重要一环,对基因表达起着十分重要的作用,在几种RNA甲基化修饰中,m6A修饰被认为是转录组中最普遍、丰富、保守的内转录修饰[13]。F18大肠杆菌是造成断奶前后仔猪腹泻的主要致病菌,F18大肠杆菌通过菌毛黏附在小肠内壁上,分泌内毒素(LPS)造成机体肠道的炎症,打破小肠水盐平衡,大量液体涌入肠腔引起腹泻,虽然LPS是大肠杆菌造成细胞损伤的主要途径,但并不代表大肠杆菌只能通过LPS破坏细胞结构,其黏附素、菌毛等仍会对细胞造成损伤[14-16]。因此,为了探究m6A甲基转移酶WTAP是否与仔猪抗大肠杆菌感染有关,本研究在个体水平对m6A甲基转移酶WTAP在断奶仔猪大肠杆菌抗性型和敏感性型个体之间进行表达差异分析,同时在细胞水平用F18大肠杆菌(F18ab、F18ac)刺激和LPS诱导猪小肠上皮细胞IPEC-J2,结果发现,WTAP基因的高表达可能有助于仔猪抵抗大肠杆菌的侵染。为了进一步探究WTAP的表达水平与F18大肠杆菌感染的关系,本研究检测WTAP基因沉默后,大肠杆菌对猪小肠上皮细胞黏附能力的影响。结果显示,WTAP基因沉默后,大肠杆菌的黏附量明显上升,表明WTAP基因的高表达有利于仔猪抵抗F18大肠杆菌的感染,其中大肠杆菌F18ab的黏附量高于F18ac。大肠杆菌F18ab与仔猪水肿病有关,F18ac与仔猪腹泻相关,沉默WTAP基因后大肠杆菌F18ab的黏附量高于F18ac,说明WTAP可能在F18ab引起的仔猪水肿病中发挥重要作用。现有研究表明,WTAP本身并不具有甲基化活性,而是作为调节亚基在m6A修饰的形成过程中发挥定位作用,敲低WTAP表达量能够显著减少m6A修饰[17-18],证明WTAP的表达水平与m6A修饰的形成密切相关。本研究中,大肠杆菌抗性型猪中WTAP基因表达量显著高于敏感型,并且大肠杆菌刺激下调了该基因的表达,表明高m6A修饰可能有助于抵抗大肠杆菌F18的侵染,但是其具体机制仍有待研究。另一方面,在急性髓细胞性白血病、结直肠癌、肾细胞癌中[19-20],WTAP过表达能够促进细胞增殖,这可能是由于WTAP能够影响某些细胞周期蛋白的mRNA稳定性,进而影响细胞增殖周期[21]。同时,有研究表明,WTAP通过激活Wnt/β-catenin信号通路促进结直肠癌细胞的增殖和迁移[22],说明WTAP对细胞周期的影响是包括转录后修饰、通路调控等一系列综合调控的结果。大肠杆菌通过分泌肠毒素造成小肠上皮细胞凋亡,而WTAP基因的高表达能够促进细胞增殖分化,因此该基因的表达或许能够加快猪小肠上皮细胞更新,进而维持肠道屏障的完整以抵抗大肠杆菌的侵染。
本研究发现并验证了RNA甲基化酶WTAP的高表达有利于提高仔猪大肠杆菌抗性,但是其具体机制有待研究。因此,下一步将在蛋白水平上进一步验证WTAP基因与大肠杆菌感染的关系,以及通过转录组测序技术筛选与WTAP调控仔猪抵抗大肠杆菌有关的相关通路,以期进一步探究RNA甲基化在仔猪抵御大肠杆菌侵染过程中的调控机制。
4 结论在十二指肠和空肠组织中,WTAP基因在抗性型个体中的表达量显著高于敏感型个体(P<0.01);并且在F18ab和F18ac刺激后表达量显著下降;沉默WTAP基因后,大肠杆菌黏附能力极显著上升(P<0.01),在细胞和个体水平上初步发现并验证了RNA甲基化酶WTAP的高表达有利于提高仔猪大肠杆菌抗性。
| [1] | CRAIN P F, MCCLOSKEY J A. The RNA modification database[J]. Nucleic Acids Res, 1996, 24(1): 98–99. DOI: 10.1093/nar/24.1.98 |
| [2] | MOTORIN Y, HELM M. RNA nucleotide methylation[J]. Wiley Interdiscip Rev RNA, 2011, 2(5): 611–631. DOI: 10.1002/wrna.79 |
| [3] |
金春, 李蒙蒙, 李余佳, 等. 肝细胞癌的RNA甲基化修饰[J]. 中国病理生理杂志, 2019, 35(7): 1339–1344.
JIN C, LI M M, LI Y J, et al. RNA methylation modifications in hepatocellular carcinoma[J]. Chinese Journal of Pathophysiology, 2019, 35(7): 1339–1344. DOI: 10.3969/j.issn.1000-4718.2019.07.030 (in Chinese) |
| [4] | WANG X, LU Z K, GOMEZ A, et al. N6-methyladenosine-dependent regulation of messenger RNA stability[J]. Nature, 2014, 505(7481): 117–120. DOI: 10.1038/nature12730 |
| [5] |
汪毅, 张杰, 皮静楠, 等. WTAP基因在胃癌组织中低表达[J]. 基础医学与临床, 2016, 36(11): 1548–1553.
WANG Y, ZHANG J, PI J N, et al. Low expression of WTAP gene in gastric cancer[J]. Basic & Clinical Medicine, 2016, 36(11): 1548–1553. (in Chinese) |
| [6] |
陶然, 王策, 殷婷婷, 等. 敲低WTAP基因对肺腺癌A549细胞恶性生物学行为的影响[J]. 中国肿瘤生物治疗杂志, 2019, 26(5): 512–517.
TAO R, WANG C, YIN T T, et al. Effect of WTAP gene knockdown on malignant biological behaviors of lung adenocarcinoma A549 cells[J]. Chinese Journal of Cancer Biotherapy, 2019, 26(5): 512–517. (in Chinese) |
| [7] | CHEN Y H, PENG C H, CHEN J R, et al. WTAP facilitates progression of hepatocellular carcinoma via m6A-HuR-dependent epigenetic silencing of ETS1[J]. Mol Cancer, 2019, 18(1): 127. DOI: 10.1186/s12943-019-1053-8 |
| [8] | ZHANG J W, TSOI H, LI X X, et al. Carbonic anhydrase IV inhibits colon cancer development by inhibiting the Wnt signalling pathway through targeting the WTAP-WT1-TBL1 axis[J]. Gut, 2016, 65(9): 1482–1493. DOI: 10.1136/gutjnl-2014-308614 |
| [9] | WU Z C, FENG H Y, CAO Y, et al. New insight into the molecular mechanism of the FUT2 regulating Escherichia coli F18 resistance in weaned piglets[J]. Int J Mol Sci, 2018, 19(11): 3301. DOI: 10.3390/ijms19113301 |
| [10] |
戴超辉, 冯海悦, 宗秋芳, 等. TLR5基因启动子区甲基化修饰与苏太断奶仔猪E. coli F18抗性的关系[J]. 畜牧兽医学报, 2018, 49(5): 897–906.
DAI C H, FENG H Y, ZONG Q F, et al. Relationship between methylation in promoter region of TLR5 gene and resistance to Escherichia coli F18 of Sutai weaned piglets[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 897–906. (in Chinese) |
| [11] | WU Z C, XIA R W, YIN X M, et al. Proteomic analysis of duodenal tissue from Escherichia coli F18-resistant and -susceptible weaned piglets[J]. PLoS One, 2015, 10(6): e0127164. DOI: 10.1371/journal.pone.0127164 |
| [12] |
吴正常, 冯海悦, 黄焱杰, 等. F18大肠杆菌抗性型与敏感型苏太断奶仔猪十二指肠组织比较转录组分析[J]. 畜牧兽医学报, 2018, 49(10): 2112–2123.
WU Z C, FENG H Y, HUANG Y J, et al. Comparative transcriptome analysis of duodenal tissues between sutai E. coli F18-resistant and E. coli F18-sensitive weaned piglets[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(10): 2112–2123. DOI: 10.11843/j.issn.0366-6964.2018.10.007 (in Chinese) |
| [13] | ROUNDTREE I A, EVANS M E, PAN T, et al. Dynamic RNA modifications in gene expression regulation[J]. Cell, 2017, 169(7): 1187–1200. |
| [14] |
吴森, 吴嘉韵, 戴超辉, 等. 大肠杆菌侵染猪肠上皮细胞IPEC-J2后TAP1基因表达量的变化分析[J]. 畜牧与兽医, 2017, 49(8): 53–56.
WU S, WU J Y, DAI C H, et al. Analysis of the expression changes of TAP1 gene in pig intestine epithelial cell IPEC-J2 infected by Escherichia coli[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(8): 53–56. (in Chinese) |
| [15] |
冯海悦, 黄焱杰, 朱国强, 等. 大肠杆菌刺激和LPS诱导条件下猪小肠上皮细胞FUT1和FUT2基因表达变化[J]. 中国畜牧杂志, 2018, 54(4): 24–28.
FENG H Y, HUANG Y J, ZHU G Q, et al. Expression validation of FUT1 and FUT2 genes in porcine epithelial cells after LPS-induction or bacteria-stimulation[J]. Chinese Journal of Animal Science, 2018, 54(4): 24–28. (in Chinese) |
| [16] |
段强德. F18+大肠杆菌鞭毛与其致病相关性的研究[D]. 扬州: 扬州大学, 2012.
DUAN Q D. Study on the flagella from F18+ Escherichi coli related to its pathogenicity[D]. Yangzhou: Yangzhou University, 2012. (in Chinese) |
| [17] | LIU J Z, YUE Y N, HAN D L, et al. A METTL3-METTL14 complex mediates mammalian nuclear RNA N6-adenosine methylation[J]. Nat Chem Biol, 2014, 10(2): 93–95. DOI: 10.1038/nchembio.1432 |
| [18] | PING X L, SUN B F, WANG L, et al. Mammalian WTAP is a regulatory subunit of the RNA N6-methyladenosine methyltransferase[J]. Cell Res, 2014, 24(2): 177–189. DOI: 10.1038/cr.2014.3 |
| [19] | BANSAL H, YIHUA Q, IYER S P, et al. WTAP is a novel oncogenic protein in acute myeloid leukemia[J]. Leukemia, 2014, 28(5): 1171–1174. DOI: 10.1038/leu.2014.16 |
| [20] |
韩娟娟, 张新安, 艾福录. m6A RNA甲基化修饰异常在肿瘤中的作用[J]. 中国生物化学与分子生物学报, 2020, 36(4): 383–391.
HAN J J, ZHANG X A, AI F L. The role of m6A RNA methylated abnormality in tumor[J]. Chinese Journal of Biochemistry and Molecular Biology, 2020, 36(4): 383–391. (in Chinese) |
| [21] | HORIUCHI K, UMETANI M, MINAMI T, et al. Wilms' tumor 1-associating protein regulates G2/M transition through stabilization of cyclin A2 mRNA[J]. Proc Natl Acad Sci U S A, 2006, 103(46): 17278–17283. DOI: 10.1073/pnas.0608357103 |
| [22] |
李炳琦. WTAP对胰腺癌恶性表型的调控及其分子机制研究[D]. 北京: 北京协和医学院, 2019.
LI B Q. The investigation of WTAP on regulating pancreatic cancer malignant phenotype and associated molecular mechanism[D]. Beijing: Peking Union Medical College, 2019. (in Chinese) |



