2. 马鞍山史记动物健康管理有限公司, 马鞍山 238251;
3. 安徽省动物疫病预防与控制中心, 合肥 230091
2. Maanshan Shiji Animal Health Management Co., Ltd, Maanshan 238251, China;
3. Anhui Animal Disease Prevention and Control Center, Hefei 230091, China
猪丹毒(swine erysipelas,SE)是由猪丹毒丝菌(Erysipelothrix rhusiopathiae,ER)引起猪的一种高度传染性疾病,最易侵害母猪和架子猪,临床表现主要有突然死亡的急性败血型、皮肤紫色菱形疹块的亚急性型、多发性关节炎或心内膜炎的慢性型等3类[1-3],常引起重大的经济损失。20世纪80年代,SE与猪瘟、猪肺疫并称为我国养猪业的3大传染病。到了90年代,随着疫苗的普遍使用及猪场管理的升级,SE病例显著减少。但自2010年以后,国内多家实验室研究结果显示,SE在我国出现流行的趋势[4-6]。
目前,在养猪生产中,使用抗生素和接种疫苗是防治SE的常用手段。随着新型ER耐药菌株的出现,疫苗免疫则成为控制SE最经济、最有效的选择。然而灭活疫苗成本高,减毒活疫苗可能存在散毒风险,因此迫切需要研制出有效的亚单位疫苗或基因工程疫苗。ER最重要的毒力因子是神经氨酸酶、荚膜多糖和表面蛋白,其中表面蛋白SpaA目前公认是ER的主要免疫抗原,为SE亚单位疫苗研究奠定了基础[7-9]。ER表面的胆碱结合蛋白(choline-binding protein, CBPs)由CbpA、CbpB、CbpC三部分组成。CbpB基因大小为1 855 bp,编码的CpbB蛋白由606个氨基酸组成,主要包括N端的一段信号序列(the signal sequence)和C端的胆碱结合区域(choline-binding domain)[10]。研究表明,CbpB作为ER荚膜修饰蛋白[11],不仅介导增强ER对宿主细胞的黏附作用、减弱吞噬细胞对病原菌的吞噬作用,而且经CbpB蛋白免疫的小鼠血清具有促进体外巨噬细胞的吞噬作用[12-13]。
本研究以表达的ER重组蛋白CbpB、SpaA、CbpB+SpaA以及ER灭活全菌体(V-AEr21)、商品化弱毒疫苗、商品化灭活疫苗分别免疫小鼠,利用间接ELISA检测血清中IgG抗体,血清杀菌试验测定功能性抗体水平,腹腔攻毒试验测定免疫保护率,组织荷菌数测定ER定植情况,并制作肺、肝、脾、肾组织切片,观察病理变化,综合评价CbpB蛋白的免疫原性和免疫保护力,从而为研制SE亚单位疫苗或基因工程疫苗提供新的思路和技术储备。
1 材料与方法 1.1 菌株和质粒ER-AEr 21(血清型1a型,源自急性败血型,LD50为50.3 CFU·mL-1)、ER-AEr31(血清型1a型,源自急性败血型,LD50为35.5 CFU·mL-1)、重组质粒pGEx-6P-1-SpaA、pGEx-6P-1-CbpB均由安徽农业大学动物传染病实验室保存。
1.2 实验动物18~22 g清洁级雌性昆明小鼠购自安徽医科大学实验动物中心。
1.3 主要试剂HRP标记的山羊抗鼠IgG、IgA(IgG-HRP、IgA-HRP)购自博士德生物工程有限公司;弗氏完全佐剂、不完全佐剂购自美国SIGMA公司;商品化猪丹毒灭活疫苗购自四川海林格生物制药有限公司(生产批号:20171001);商品化猪丹毒弱毒疫苗(GC42株)购自广西丽原生物股份有限公司(生产批号:18060601)。
1.4 SpaA蛋白、CbpB蛋白的表达、纯化与鉴定将重组质粒(pGEx-6P-1-SpaA和pGEx-6P-1-CbpB)菌分别接种到LB肉汤中并振荡培养12 h。分别吸取1 mL菌液转接于100 mL含有氨苄青霉素的LB液体培养基中,并将其振荡培养至对数生长期,加入0.6 mmol·L-1的IPTG在37 ℃诱导4 h。离心收集菌体并进行超声破碎后再次离心取上清,将蛋白液与GST琼脂糖凝胶FF在冰盒上振荡结合1.5 h,再用PBS缓冲液洗涤杂蛋白,最后用20 mmol·L-1谷胱甘肽进行洗脱。通过核酸蛋白仪测定纯化后的目的蛋白含量[14-15]。将纯化后的目的蛋白转移到硝酸纤维素膜上,于含5%脱脂奶粉的封闭液中4 ℃封闭过夜。以ER阳性血清(1∶100稀释)为一抗,37 ℃孵育1 h,洗膜后用1∶2 000稀释的羊抗猪IgG-HRP为酶标二抗,37 ℃孵育1 h,最后置于DAB缓冲液中显色。
1.5 ER-AEr21灭活全菌体的制备将ER-AEr 21在TSB-YE(含5%小牛血清)培养基中37 ℃振荡培养生长至稳定期后,用终浓度为0.2%的甲醛灭活11 h,离心收集菌体[16],即成V-AEr21。
1.6 免疫及攻毒保护试验1.6.1 试验分组 将280只小鼠随机分成8组(编号A~H),每组35只,其中A~F为试验组,G、H组均为对照组。免疫试验中G组为生理盐水对照组,攻毒保护试验中G组为攻毒对照组、H组为空白对照组。试验分组及免疫方法见表 1。采取二次免疫,第一次免疫14 d后采用同样方式和同等剂量进行第二次免疫。
|
|
表 1 试验分组 Table 1 Exprimental grouping of Mice |
1.6.2.1 血清中IgG抗体检测 二免14 d后,每组取5只小鼠进行眼球静脉丛采血,间接ELISA检测血清中IgG抗体效价[17]。
1.6.2.2 血清杀菌试验 采集第一次免疫和第二次免疫14 d后的所有免疫组和阴性对照组的小鼠血清,每组5只。将阴性兔血清分为未灭活兔血清(不做任何处理)和灭活兔血清(56 ℃热处理30 min) 备用。在96孔细胞板中倍比稀释免疫组小鼠血清以备用。试验组每孔含25 μL倍比稀释的血清+未灭活兔血清12.5 μL+AEr31菌悬液12.5 μL (含AEr31 2.0×104 CFU·mL-1),同时设置补体对照(未灭活兔血清12.5 μL+菌悬液12.5 μL+稀释液25 μL)和体系对照(灭活兔血清12.5 μL+菌悬液12.5 μL+稀释液25 μL),37 ℃孵育1 h后。后涂布于TSA-YE固体培养上,37 ℃培养箱中培养18~24 h后进行菌落计数。如试验组孔内菌落数为补体对照孔的50%以下,则判断为“杀菌”,否则判断为“不杀菌”。重复试验2次[18]。
1.6.3 攻毒保护试验 二免14 d后,每组取10只小鼠,采用腹腔注射方式对A~G组进行攻毒,攻毒菌株为AEr31(剂量为100 LD50),G组为攻毒对照组,H组注射等量灭菌生理盐水作为空白对照组。攻毒后,观察7 d,记录各组小鼠的精神状态及死亡等情况,并计算各组的免疫保护率。免疫保护率(%)=(1-免疫组死亡率/对照组死亡率)×100%。
1.6.4 组织荷菌数测定与病理学观察 攻毒3 d后,每组取5只小鼠,无菌采取小鼠的肺、肝、脾和肾于1.5 mL的离心管中,称重并记录,计算组织质量,研磨后按照10倍递增稀释,分别取100、10-1、10-2 3个稀释度的组织悬液1 mL,将其均匀涂于TSA-YE固体培养基上;37 ℃培养18~24 h,平板计数法统计细菌菌落数。
攻毒14 d后,每组取3只小鼠,采集各组小鼠的内脏(肝、脾、肺、肾),置于福尔马林(浓度为10%的甲醛)中,24 h后重新更换福尔马林,进行固定和保存。送至安徽医科大学制作病理组织切片,观察各脏器的病理组织学变化。
2 结果 2.1 SpaA蛋白、CbpB蛋白的表达、纯化与鉴定重组质粒(pGEx-6P-1-SpaA和pGEx-6P-1-CbpB)菌经过诱导表达并纯化,SDS-PAGE电泳结果显示:获得了纯度较高的GST-SpaA蛋白和GST-CbpB蛋白,两种蛋白均以可溶性形式进行表达,纯化后的重组蛋白GST-SpaA含量为0.65 mg·mL-1,GST-CbpB为0.58 mg·mL-1。对纯化后的SpaA、CbpB重组蛋白进行Western blot分析,分别在75和73 ku处出现预期的特异性条带,表明表达产物能够与ER阳性血清发生特异性结合,具有良好的反应原性。详见图 1、2。
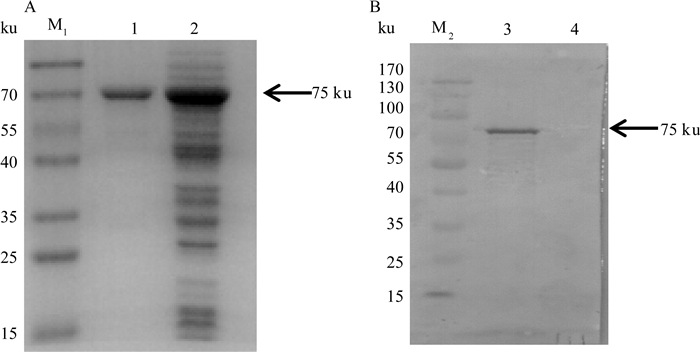
|
A. 重组蛋白GST-SpaA纯化分析;B. 重组蛋白SpaA的Western blot鉴定;M1.蛋白相对分子质量标准;M2.蛋白相对分子质量标准;1.纯化后的SpaA蛋白;2.未纯化的SpaA蛋白;3.纯化后的SpaA蛋白;4.阴性对照 A. Purification of recombinant protein GST-SpaA; B. Western blot identification of recombinant SpaA protein; M1. Protein marker; M2. Protein marker; 1. Purified SpaA protein; 2. Unpurified SpaA protein; 3. Purified SpaA protein; 4. Negative control 图 1 重组蛋白GST-SpaA纯化分析与Western blot鉴定 Fig. 1 Purification and Western blot analysis of recombinant protein GST-SpaA |
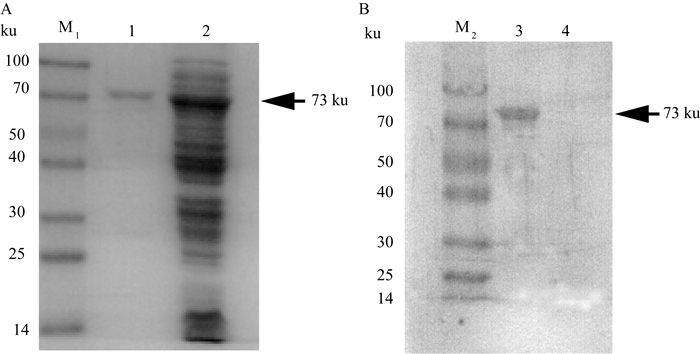
|
A. 重组蛋白GST-CbpB纯化分析;B. 重组蛋白CbpB的Western blot鉴定;M1.蛋白相对分子质量标准;M2.蛋白相对分子质量标准;1.纯化后的CbpB蛋白;2.未纯化的CbpB蛋白;3.纯化后的CbpB蛋白;4.阴性对照 A. Purification of recombinant protein GST-CbpB; B. Western blot identification of recombinant CbpB protein; M1. Protein marker; M2. Protein marker; 1. Purified CbpB protein; 2. Unpurified CbpB protein; 3. Purified CbpB protein; 4. Negative control 图 2 重组蛋白GST-CbpB纯化分析与Western blot鉴定 Fig. 2 Purification and Western blot analysis of recombinant protein GST-CbpB |
AEr21培养8~10 h达到稳定期后,将其浓度调整至1.5×1010CFU·mL-1,灭活后即为V-AEr21。
2.3 免疫及攻毒保护试验2.3.1 血清中IgG抗体检测结果 除了A、B组之外,其他试验组在二免后抗体效价均升高。结果显示,商品化弱毒疫苗产生的抗体效价最高,SpaA、CbpB产生的抗体效价最低且相同(图 3)。
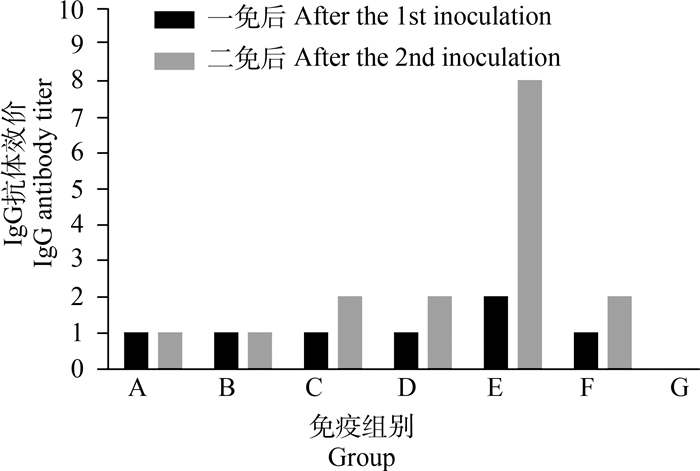
|
纵坐标中,“1”代表免疫后IgG抗体效价为“1∶6 400”,“2”代表“1∶12 800”,“8”代表“1∶51 200”。横坐标中,A. SpaA;B. CbpB;C. V-AEr21;D. CbpB+SpaA;E.商品化弱毒疫苗;F.商品化灭活疫苗;G.对照组 In the ordinate, "1" represents the IgG antibody titer after immunization is "1∶6 400", "2" represents "1∶12 800", and "8" represents "1∶51 200". In the abscissa, A. SpaA; B. CbpB; C. V-AEr21; D. CbpB+SpaA; E. Commercial attenuated vaccine; F. Commercial inactivated vaccine; G. The control group 图 3 间接ELISA检测小鼠血清中IgG抗体的结果 Fig. 3 The result of indirect ELISA detecting IgG antibody in mouse serum |
2.3.2 血清杀菌试验结果 各试验组在二免后对ER均具有一定的杀菌作用,其细菌数量位于G组50%以下并与G组均差异显著(P<0.05)。E组细菌数量最少,为4.92×103CFU·mL-1,与其他试验组差异显著(P<0.05);A、B组的细菌数量分别为5.76×103和5.92×103 CFU·mL-1,D组的细菌数量为6.68×103 CFU·mL-1,C、F组的细菌数量分别为7.56×103和7.48×103CFU·mL-1。A、B组与C、D、F组相比,细菌数量显著减少(P<0.05),而A、B组之间差异不显著(P>0.05);D组与C、F组相比,细菌数量差异显著降低(P<0.05)(图 4)。结果显示,商品化弱毒疫苗的杀菌效果最强,其次是SpaA、CbpB,再者为SpaA+CbpB。
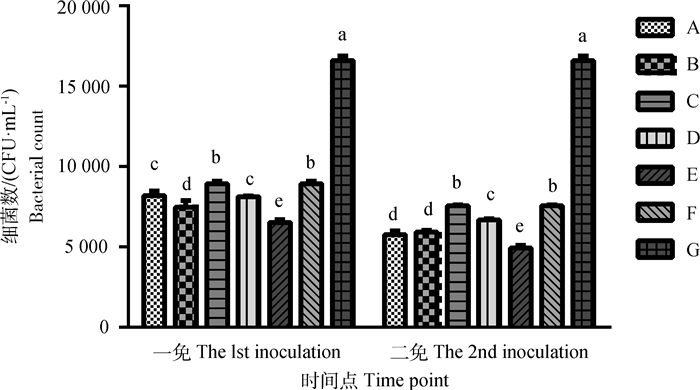
|
A. SpaA;B. CbpB;C. V-AEr21;D. CbpB+SpaA;E.商品化弱毒疫苗;F.商品化灭活疫苗;G.对照组。相同免疫后时间内不同小写字母表示差异显著(P<0.05),下同 A. SpaA; B. CbpB; C. V-AEr21; D. CbpB+SpaA; E. Commercial attenuated vaccine; F. Commercial inactivated vaccine; G. The control group. Different lowercase letters in the same number of weeks after immunization indicate significant difference (P < 0.05), the same as below 图 4 血清杀菌试验结果 Fig. 4 Serum bactericidal test result |
2.3.3 免疫保护率测定结果 攻毒7 d后,G组所有小鼠全部死亡,H组所有小鼠全部存活,除C、F组之外的各试验组均具有良好的免疫保护水平,保护率为100%(图 5)。结果显示,SpaA、CbpB、SpaA+CbpB和商品化弱毒疫苗对小鼠的免疫保护率均为100%,而V-AEr21、商品化灭活疫苗免疫保护率分别为30%和20%。
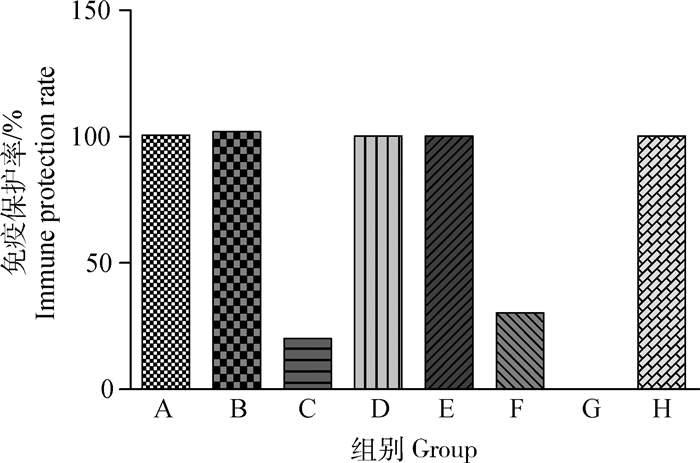
|
A. SpaA;B. CbpB;C. V-AEr21;D. CbpB+SpaA;E.商品化弱毒疫苗;F.商品化灭活疫苗;G.攻毒对照组; H.空白对照组 A. SpaA; B. CbpB; C. V-AEr21; D. CbpB+SpaA; E. Commercial attenuated vaccine; F. Commercial inactivated vaccine; G. The challenged group; H. Blank control group 图 5 各组小鼠的免疫保护率 Fig. 5 Mouse protection rate in each group |
2.3.4 组织荷菌数测定结果 攻毒3 d后,C、F组与G组相比各脏器(肝、脾、肺、肾)载菌量显著降低(P<0.05),而其他试验组(A、B、D、E组)均无细菌定植(图 6)。结果显示,SpaA、CbpB、SpaA+CbpB和商品化弱毒疫苗均能显著降低ER在小鼠体内的定植量。

|
A. SpaA;B. CbpB;C. V-AEr21;D. CbpB+SpaA;E.商品化弱毒疫苗;F.商品化灭活疫苗;G.攻毒对照组 A. SpaA; B. CbpB; C. V-AEr21; D. CbpB+SpaA; E. Commercial attenuated vaccine immunization; F. Commercial inactivated vaccine immunization; G. The challenged group 图 6 感染后小鼠各组织器官中的载菌量 Fig. 6 Bacterial survival in mouse blood and organs |
2.3.5.1 肺 H组整体结构正常,肺泡结构清晰,肺泡壁无明显增厚;G组组织可见肺动脉血管充血和明显炎症细胞浸润。在各试验组(A~F组)中,A、D组肺支气管轻微出血;B组轻微炎症细胞浸润;C组可见明显的炎性细胞浸润;E组未见明显病变;F组肺泡壁明显增厚(图 7)。结果显示,商品化弱毒疫苗的保护作用最强,其次是SpaA、CbpB、SpaA+CbpB。

|
A. SpaA;B. CbpB;C. V-AEr21;D. CbpB+SpaA;E.商品化弱毒疫苗;F.商品化灭活疫苗;G.攻毒对照组;H.空白对照组 A. SpaA; B. CbpB; C. V-AEr21; D. CbpB+SpaA; E. Commercial attenuated vaccine; F. Commercial inactivated vaccine; G. ER challenged group; H. Blank control group 图 7 小鼠肺病理组织学观察(HE染色,200×) Fig. 7 Histopathological observation of lung in mice(HE staining, 200×) |
2.3.5.2 肝 H组整体结构正常,肝组织中央静脉轮廓清晰,肝细胞结构饱满;G组肝细胞结构疏松,肝细胞广泛水肿,部分水肿至空泡变性。在各试验组(A~F组)中,A组肝窦间隙轻微增大;B、D组轻微炎症细胞浸润;C、F组明显的炎症细胞浸润;E组肝细胞结构疏松(图 8)。结果显示,SpaA、CbpB、SpaA+CbpB和商品化弱毒疫苗均具有较强的保护作用。
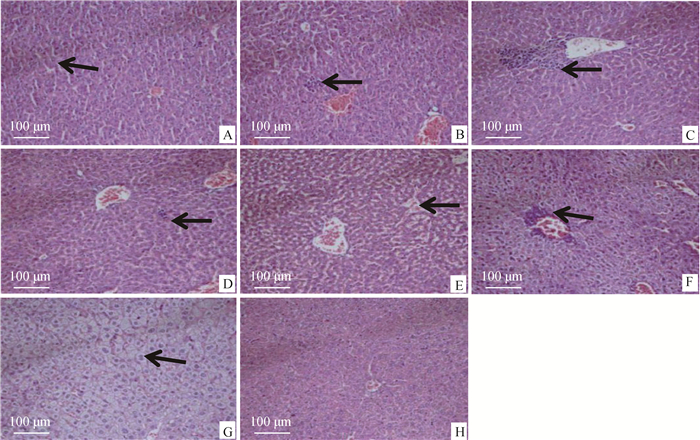
|
A. SpaA;B. CbpB;C. V-AEr21;D. CbpB+SpaA;E.商品化弱毒疫苗;F.商品化灭活疫苗;G.攻毒对照组;H.空白对照组 A. SpaA; B. CbpB; C. V-AEr21; D. CbpB+SpaA; E. Commercial attenuated vaccine; F. Commercial inactivated vaccine; G. ER challenged group; H. Blank control group 图 8 小鼠肝病理组织学观察(HE染色,200×) Fig. 8 Histopathological observation of liver in mice(HE staining, 200×) |
2.3.5.3 脾 H组整体结构正常,脾小结结构清晰,红髓白髓界限分明;G组整体结构轻度异常,脾小体结构消失,红髓白髓界限不清,组织可见大量粒细胞浸润。在各试验组(A~F组)中,A组结缔组织增多;B、E组无明显病变;C、D、F组少量粒细胞浸润(图 9)。结果显示,CbpB、商品化弱毒疫苗的保护作用最强。
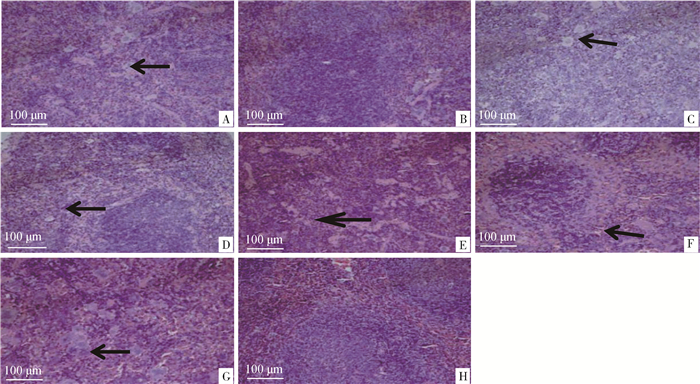
|
A. SpaA;B. CbpB;C. V-AEr21;D. CbpB+SpaA;E.商品化弱毒疫苗;F.商品化灭活疫苗;G.攻毒对照组;H.空白对照组 A. SpaA; B. CbpB; C. V-AEr21; D. CbpB+SpaA; E. Commercial attenuated vaccine; F. Commercial inactivated vaccine; G. ER challenged group; H. Blank control group 图 9 小鼠脾病理组织学观察(HE染色,200×) Fig. 9 Histopathological observation of spleen in mice(HE staining, 200×) |
2.3.5.4 肾 H组结构正常,肾小结结构清晰可见,组织未见明显炎症细胞浸润;G组肾小管上皮细胞脱落水肿,部分肾小球萎缩,组织可见明显的炎症细胞浸润。在各试验组(A~F组)中,A组少量炎症细胞浸润;B组血管明显充血;C组部分肾小球萎缩,组织可见少量炎症细胞浸润;D、E组未见明显病变;F组组织间质明显瘀血(图 10)。结果显示,SpaA+CbpB、商品化弱毒疫苗的保护作用最强,其次是SpaA、CbpB。
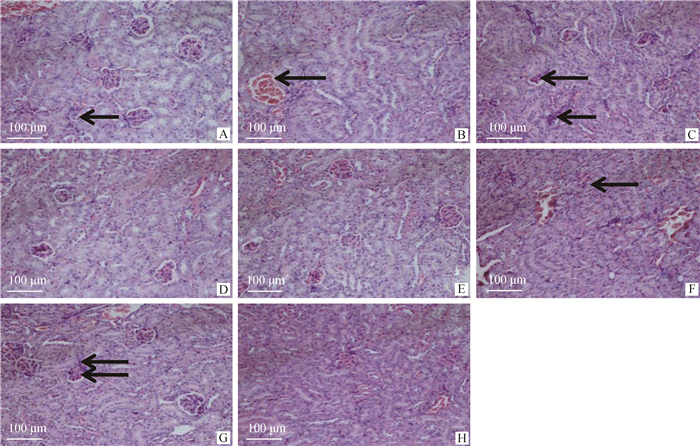
|
A. SpaA;B. CbpB;C. V-AEr21;D. CbpB+SpaA;E.商品化弱毒疫苗;F.商品化灭活疫苗;G.攻毒对照组;H.空白对照组 A. SpaA; B. CbpB; C. V-AEr21; D. CbpB+SpaA; E. Commercial attenuated vaccine; F. Commercial inactivated vaccine; G. ER challenged group; H. Blank control group 图 10 小鼠肾病理组织学观察(HE染色,200×) Fig. 10 Histopathological observation of kidney in mice(HE staining, 200×) |
抗原能否成为疫苗候选抗原的其中一个指标就是抗原刺激机体产生的免疫反应及其类型[14-15, 19]。IgG在机体抗细菌感染的免疫中发挥着重要的作用。血清中产生的抗体能与细菌产生特异性的结合,从而对细菌造成一定的杀菌效果。本研究中,尽管商品化弱毒疫苗产生的抗体效价最高为1∶51 200,而CbpB、SpaA重组蛋白均仅为1∶6 400,其余各组则为1∶12 800~1∶25 600,但在血清杀菌试验中,除了商品化弱毒疫苗外,CbpB和SpaA重组蛋白均呈现出较强的杀菌效果,表明CbpB重组蛋白刺激机体产生的功能性抗体能够抵抗细菌的感染,具有良好的免疫作用。造成检测抗体效价低的可能原因是:本研究中用于检测抗体效价的ELISA采用的是全菌体超声破碎裂解物作为包被抗原,与全菌体相比,单一蛋白作为免疫抗原刺激机体仅产生相对应的特异性抗体,因此抗体水平的检测值会出现偏低的现象。而姚焱彬等[20]利用SpaA重组蛋白作为包被抗原建立的ELISA进行免疫小鼠的血清抗体检测,结果显示SpaA重组蛋白免疫产生的IgG水平显著高于灭活全菌体,这也可进一步诠释CbpB和SpaA重组蛋白产生的抗体效价不及其他组的原因。
ER主要是通过消化道或损伤皮肤的黏膜引起机体产生局部或全身性的感染[21]。病原菌在造成机体产生永久性的病理性损伤的同时,也引起了机体产生一系列的抵抗反应行为,炎症的本质就是机体在应对病原菌入侵时引起损伤产生的一种防御性反应[22]。研究发现,结核分枝杆菌(MTB)在小鼠肺组织低荷菌数的状态下,能够持续刺激机体产生免疫应答引发轻度的病理损伤[23]。但当细菌侵入已产生特异性免疫应答的机体中,机体产生体液免疫和细胞免疫能够将病原体杀灭,使病原体数量减少或灭亡,减轻对机体的病理损伤,从而对机体产生良好的保护力,产生耐受现象[22, 24]。本研究中采用腹腔注射的方式对第二次免疫后的小鼠进行攻毒,结果显示:除商品化灭活疫苗和V-AEr21对ER强毒株的攻毒保护率仅为30%和20%外,其余试验组均为100%,且均无细菌定植;结合肺、肝、脾和肾的病理组织学观察,CbpB重组蛋白同商品化弱毒疫苗、SpaA重组蛋白一样均表现出无病变或病变轻微(肺、肝均轻微炎症细胞浸润)。表明CbpB重组蛋白产生良好的免疫应答能够杀灭体内的ER,从而阻止机体产生系统性感染,具有较强的保护作用。
4 结论免疫小鼠试验证明,CbpB重组蛋白诱导产生的高水平IgG抗体具有较强的杀菌效果;攻毒试验及病理组织学观察显示,CbpB重组蛋白具有良好的免疫原性和保护作用,能刺激机体产生较强的体液免疫和细胞免疫,可以作为猪丹毒基因工程亚单位疫苗的候选抗原。
| [1] | WANG Q N, CHANG B J, RILEY T V. Erysipelothrix rhusiopathiae[J]. Vet Microbiol, 2010, 140(3-4): 405–417. DOI: 10.1016/j.vetmic.2009.08.012 |
| [2] | MCNEIL M, GERBER P F, THOMSON J, et al. Serotypes and Spa types of Erysipelothrix rhusiopathiae isolates from British pigs (1987 to 2015)[J]. Vet J, 2017, 225: 13–15. DOI: 10.1016/j.tvjl.2017.04.012 |
| [3] |
吴琼娟, 杨志鹏, 姚焱彬, 等. 猪红斑丹毒丝菌制苗用菌株的筛选[J]. 浙江农业学报, 2018, 30(9): 1467–1475.
WU Q J, YANG Z P, YAO Y B, et al. Screening of strains for inactivated vaccine of Erysipelothrix rhusiopathiae[J]. Acta Agriculturae Zhejiangensis, 2018, 30(9): 1467–1475. DOI: 10.3969/j.issn.1004-1524.2018.09.04 (in Chinese) |
| [4] |
王力波, 刘芳, 谢江, 等. 猪丹毒丝菌不同年代分离菌株流行病学特征及部分生物学特性比较研究[J]. 中国兽医学报, 2016, 36(3): 423–430.
WANG L B, LIU F, XIE J, et al. Comparative analysis on the epidemiological and some biological characteristics of Erysipelothrix rhusiopathiae isolates from different years[J]. Chinese Journal of Veterinary Science, 2016, 36(3): 423–430. (in Chinese) |
| [5] | DING Y, ZHU D M, ZHANG J M, et al. Virulence determinants, antimicrobial susceptibility, and molecular profiles of Erysipelothrix rhusiopathiae strains isolated from China[J]. Emerg Microbes Infect, 2015, 4(11): e69. |
| [6] |
魏文涛, 姚焱彬, 刘全喜, 等. 2012-2015年江淮地区猪丹毒杆菌分离株血清型、spaA基因遗传进化及PFGE基因型分析[J]. 微生物学通报, 2017, 44(3): 664–672.
WEI W T, YAO Y B, LIU Q X, et al. Analysis of serotypes, spaA gene phylogeny and PFGE genetic patterns of Erysipelothrix rhusiopathiae isolated between 2012 and 2015 in Jianghuai areas[J]. Microbiology China, 2017, 44(3): 664–672. (in Chinese) |
| [7] | MORIMOTO M, KATO A, KOJIMA H, et al. Serovars and SpaA types of Erysipelothrix rhusiopathiae isolated from pigs in Japan from 2012 to 2019[J]. Curr Microbiol, 2021, 78(1): 55–66. DOI: 10.1007/s00284-020-02254-2 |
| [8] | ZHU W F, WANG Y, CAI C Z, et al. Erysipelothrix rhusiopathiae recruits host plasminogen via the major protective antigen SpaA[J]. FEMS Microbiol Lett, 2017, 364(5): fnx036. |
| [9] | ZHU W F, CAI C Z, WANG Y, et al. Characterization of roles of SpaA in Erysipelothrix rhusiopathiae adhesion to porcine endothelial cells[J]. Microb Pathog, 2017, 113: 176–180. DOI: 10.1016/j.micpath.2017.10.020 |
| [10] | ZHU W F, WU C, KANG C, et al. Evaluation of the protective efficacy of four newly identified surface proteins of Erysipelothrix rhusiopathiae[J]. Vaccine, 2018, 36(52): 8079–8083. DOI: 10.1016/j.vaccine.2018.10.071 |
| [11] | ZHU W F, CAI C Z, LI J T, et al. Characterization of protective antigen CbpB as an adhesin and a plasminogen-binding protein of Erysipelothrix rhusiopathiae[J]. Res Vet Sci, 2019, 124: 352–356. DOI: 10.1016/j.rvsc.2019.04.002 |
| [12] | BERGMANN S, HAMMERSCHMIDT S. Versatility of pneumococcal surface proteins[J]. Microbiology, 2001, 152(2): 295–303. |
| [13] | SHI F, HARADA T, OGAWA Y, et al. Capsular polysaccharide of Erysipelothrix rhusiopathiae, the causative agent of swine erysipelas, and its modification with phosphorylcholine[J]. Infect Immun, 2012, 80(11): 3993–4003. DOI: 10.1128/IAI.00635-12 |
| [14] | HADAD R, MARKS E, KALBINA I, et al. Protection against genital tract Chlamydia trachomatis infection following intranasal immunization with a novel recombinant MOMP VS2/4 antigen[J]. APMIS, 2016, 124(12): 1078–1086. DOI: 10.1111/apm.12605 |
| [15] |
杨振龙. 红斑丹毒丝菌的致病性研究及其表面蛋白的MALDI-TOF质谱分析[D]. 吉首: 吉首大学, 2015.
YANG Z L. Characterization of Erysipelothrix rhusiopathiae pathogenicity and identification of surface protein though MALDI-TOF-MS analysis[D]. Jishou: Jishou University, 2015. (in Chinese) |
| [16] |
陈章, 刘晓露, 姚焱彬, 等. 猪丹毒丝菌灭活疫苗制备及其对小鼠免疫效力的评价[J]. 西北农业学报, 2019, 28(6): 877–887.
CHEN Z, LIU X L, YAO Y B, et al. Preparation of inactivated vaccine against Erysipelothrix rhusiopathiae and evaluation of immune efficacy in mice[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2019, 28(6): 877–887. (in Chinese) |
| [17] |
辛伟. 副猪嗜血杆菌安徽株分型及tbpA基因的克隆表达和免疫保护作用的研究[D]. 合肥: 安徽农业大学, 2011.
XIN W. The research of typing Haemophilus parasuis and cloning expression of tbpA gene and analysis of the protection of the expressed protein[D]. Hefei: Anhui Agricultural University, 2011. (in Chinese) |
| [18] |
李大鹏. 副猪嗜血杆菌病重组亚单位疫苗候选抗原蛋白的免疫保护效力评价[D]. 北京: 中国农业科学院, 2016.
LI D P. Evaluation of the immunoprotective efficacy of subunit vaccine candidates of Haemophilus parasuis serovar 5[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese) |
| [19] | LAMBKIN-WILLIAMS R, GELDER C, BROUGHTON R, et al. An intranasal proteosome-adjuvanted trivalent influenza vaccine is safe, immunogenic & efficacious in the human viral influenza challenge model. Serum IgG & Mucosal IgA are important correlates of protection against Illness associated with infection[J]. PLoS One, 2016, 11(12): e0163089. DOI: 10.1371/journal.pone.0163089 |
| [20] |
姚焱彬, 陆萍, 杨志鹏, 等. 猪丹毒丝菌SpaA基因原核表达及表达蛋白质的免疫原性分析[J]. 畜牧兽医学报, 2017, 48(3): 492–500.
YAO Y B, LU P, YANG Z P, et al. Prokaryotic expression and immunogenicity analysis of SpaA gene in Erysipelothrix rhusiopathiae[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(3): 492–500. (in Chinese) |
| [21] |
罗满林.
动物传染病学[M]. 北京: 中国林业出版社, 2013.
LUO M L. Animal epidemiology[M]. Beijing: China Forestry Publishing House, 2013. (in Chinese) |
| [22] |
赵德明.
兽医病理学[M]. 北京: 中国农业大学出版社, 2005: 133-135.
ZHAO D M. Veterinary pathology[M]. Beijing: China Agricultural University Press, 2005: 133-135. (in Chinese) |
| [23] |
王平. 表达Ag85B-ESAT-6融合蛋白的重组耻垢分枝杆菌对结核分枝杆菌感染小鼠免疫治疗效果评价[D]. 西安: 第四军医大学, 2014.
WANG P. Immunotherapy efficacy of recombinant Mycobacterium smegmatis expressing Ag85B-ESAT-6 fusion protein against Mycobacterium tuberculosis infection in mice[D]. Xi'an: Fourth Military Medical University, 2014. (in Chinese) |
| [24] |
杨汉春.
动物免疫学[M]. 2版. 北京: 中国农业大学出版社, 2003.
YANG H C. Animal immunology[M]. 2nd ed. Beijing: China Agricultural University Press, 2003. (in Chinese) |



