阿法沙龙为新型固醇类快速起效麻醉药,诱导麻醉迅速平稳,且有轻微的肌松效果[1]。无刺激性,犬猫临床通常静脉或肌肉注射,该药经肝代谢后即可苏醒,故可重复用药或连续注射延长作用时间[2]。阿法沙龙具有安全性高、意识及食欲恢复快、代谢迅速在体内不造成药物累积[3]等优点,在国外小动物临床中广泛使用。阿法沙龙的临床应用已成为备受关注的领域,在全凭静脉麻醉(TIVA)、连续静脉滴注(CRI)等方面均有相关研究[4-6]。现阶段改良后水溶性阿法沙龙,避免了组胺释放和过敏反应,但部分文献提示其单用易造成苏醒期不平稳、浅麻醉状态下可见肌肉颤搐和静脉注射诱导麻醉时发生呼吸暂停的不良反应[7],可能由于此原因导致国内小动物临床对该药应用较少,且大多仅将其作为诱导麻醉剂使用。
异氟烷作为目前小动物临床广泛使用的吸入性麻醉剂,具有可逆、可控、安全性高的优点。但其作为吸入麻醉剂,给药方式对小动物呼吸道具有刺激性,药物本身对心功能也有一定的抑制作用,麻醉过深时同样会造成呼吸抑制、颤栗、血压心率骤降的不良反应[8],而烷类气体的大量使用也会造成环境污染问题[9]。
综上所述,IVIA可大幅度降低异氟烷的剂量,人医和兽医中有大量关于氯胺酮、芬太尼类药物的IVIA研究[10-12],而关于阿法沙龙IVIA的研究则较少。因此,本文采用不同剂量的阿法沙龙CRI配合0.5%异氟烷的IVIA,与单纯的2%异氟烷吸入麻醉比较,探讨阿法沙龙和异氟烷静吸复合麻醉对机体生理功能和麻醉效果的影响。
1 材料与方法 1.1 试验动物体况良好的成年小型犬18只,雌雄各半,体重为(3.79±1.08) kg。在同一条件下饲养10 d,经体检判定为健康后,进行IVIA试验(静吸组)。每只试验犬间隔45 d,在体检健康后,进行单纯吸入麻醉试验(吸入组)。
1.2 主要试验器材Midmark Cardell touch监护仪,EDAN VE-300兽用心电图仪,瑞沃德RM400S兽用麻醉挥发罐,美国MATRX麻醉机。
1.3 试验药品阿法沙龙(alfaxalone,ALF)购自Jurox公司(Batch No: 72247),丙泊酚(propofol,PRO)购自广东嘉博制药有限公司(Batch No: 19AA007),异氟烷(isoflurane,ISO)购自江苏恒丰强生物技术有限公司(Batch No: 20190406), 布托啡诺(butrophanol,BUT)购自Merial公司(Batch No: A141A03)。
1.4 试验分组及方法试验犬在给药前禁食禁水8 h,称重后,前肢臂头静脉埋留置针,待试验犬体征稳定后,记录诱导麻醉前1 h的各项指标,并设为T0,诱导麻醉前30 min皮下注射BUT 0.2 mg·kg-1(麻醉前给药)。30 min后,静脉推注5 mg·kg-1 PRO(诱导麻醉),进入麻醉状态后5 min内进行气管插管,接通麻醉机,打开挥发罐,并调至相应浓度,同时,连接所有监护仪器。进行IVIA方案时,连接静脉恒速输液泵,进行ALF静脉给药(维持麻醉)。
维持麻醉期间,各组给药分别如下, L组(编号1~6号):ALF 3 mg·(kg·h)-1连续恒速静脉滴注(CRI),0.5% ISO吸入给药;M组(7~12号):ALF 6 mg·(kg·h)-1,0.5% ISO;H组(13~18号):ALF 9 mg·(kg·h)-1,0.5% ISO;CⅠ(1~6号)、CⅡ(7~12号)、CⅢ(13~18号)组:2% ISO。
记录维持麻醉15、30、45、60 min以及停止给药后15 min(75 min)的各项指标,记录停药后动物自主呼吸、自主站立的时间,并在试验后3 d对试验犬进行基础生理检查,观察是否有异常情况。
1.5 监测指标试验犬侧卧位,分别测量体温(T)、脉搏(P)、呼吸频率(RR)、心率(HR)、收缩压(SBP)、舒张压(DBP)、平均压(MBP)、呼末二氧化碳(EtCO2)、血氧(SpO2)、心电图(ECG),评估眼球位置、眼睑反射、镇痛效果、镇静效果和肌松效果。其中,HR、EtCO2、SpO2、ECG利用监护仪进行监测;SBP、DBP、MBP利用血压仪进行监测。人为各项疼痛刺激结合墨尔本评分[13]评估试验犬麻醉中的镇痛效果;从监测的各项生理指标、眼睑反射、眼球位置及镇静效果试验和肌松效果试验综合评估麻醉质量[14],观察有无任何不良反应。
1.6 数据处理应用SPSS 25.0数据统计分析软件,将6组的T0数据分别与其15~75 min数据进行独立t检测;将数据分组为L-CⅠ组、M-CⅡ组、H-CⅢ组进行两个相关样本成对t检测,试验结果以“x±s”表示;P<0.05为差异显著,P<0.01为差异极显著。
2 结果 2.1 基础生理体征监测2.1.1 体温(T) 维持麻醉过程中,试验犬T均发生下降,除CⅠ组和L组在15 min时无显著下降外,其余各组各时间点均发生显著或极显著下降(P<0.05,P<0.01)。比较静吸组和吸入组结合表 1可见,在30、45及75 min CⅠ组显著或极显著低于L组(P<0.05,P<0.01);在15、45、60及75 min CⅡ组显著或极显著低于M组(P<0.05,P<0.01);在15、30 min CⅢ组显著低于H组(P<0.05)。将静吸组与吸入组的T0与75 min比较,均存在极显著差异(P<0.01)。
|
|
表 1 试验各组不同时间点体温的变化(x±s) Table 1 The changes of body temperature in each groups at different time points(x±s) |
2.1.2 脉搏(P)及心率(HR) 维持麻醉过程中,静吸组和吸入组的P及HR差异较大,CⅠ、CⅡ、CⅢ及L组在麻醉后各时间点均发生显著或极显著下降(P<0.05,P<0.01),M组和H组则在麻醉不同时间点显著或极显著升高(P<0.05,P<0.01)。比较静吸组及吸入组结合表 2可见,15 min时,CⅠ组的P极显著低于L组(P<0.01),30 min时,CⅠ组的HR显著低于L组(P<0.05);维持麻醉全过程中,CⅡ组的P及HR显著或极显著低于M组(P<0.05,P<0.01);15、30、45及60 min时,CⅢ组的P及HR显著或极显著低于H组(P<0.05,P<0.01)。吸入组及在60 min左右P及HR达到最低点,静吸M、H组在60 min左右P及HR升至最高点,仅静吸M组的P在75 min时与T0比较仍存在极显著差异(P<0.01)。
|
|
表 2 试验各组不同时间点脉博(P)及心率(HR)的变化(x±s) Table 2 The changes of P and HR in each group at different time points(x±s) |
2.1.3 呼吸频率(RR)及呼末二氧化碳(EtCO2) 维持麻醉时RR均下降并大致与EtCO2成反比,由于无法测量诱导麻醉前EtCO2的数值,则不进行EtCO2的组内比较。RR除CⅡ组在维持麻醉过程中无统计学差异外,其余各组维持麻醉过程中均发生显著或极显著下降(P<0.05,P<0.01)。比较静吸组及吸入组结合表 3可见,CⅡ组的RR在15、30、45、60 min时显著或极显著低于M组(P<0.05,P<0.01),CⅢ组的EtCO2在45 min显著低于H组(P<0.05),其他组无统计学差异。由表 3可见,除CⅢ组外,RR均在45 min时达到最低点,同时,EtCO2达到最高点,静吸组维持麻醉时呼吸抑制程度高于吸入组,且ALF剂量越大呼吸抑制越严重。在75 min时RR均有回升,并与T0比较无统计学差异(P>0.05)。
|
|
表 3 试验各组不同时间点呼吸频率(RR)及呼末二氧化碳(EtCO2)的变化(x±s) Table 3 The changes of respiratory rate (RR) and EtCO2in each group at different time points (x±s) |
2.1.4 血压(BP) 包括SBP、DBP、MBP。静吸组和吸入组的BP中,各组维持麻醉过程中均发生显著或极显著下降(P<0.05,P<0.01),而静吸L、H组75 min时,与T0比较也提示显著或极显著下降(P<0.05,P<0.01)。比较静吸组与吸入组结合表 4可见,在45 min时,CⅠ组MBP极显著低于L组(P<0.01);在维持麻醉过程中的DBP,在15、30 min时的MBP以及在75 min时的SBP、DBP、MBP,CⅡ组显著或极显著低于M组(P<0.05,P<0.01);在75 min时CⅢ组SBP显著高于H组(P<0.05)。吸入组与静吸组比较可见,两者对试验犬SBP的影响相似,对DBP的影响差异较大,维持麻醉时DBP的最低值与T0比较,全试验组下降44.95~54.55 mmHg,其中,吸入组对DBP抑制作用较强,静吸M组的BP在75 min时与T0比较无显著差异(P>0.05)。
|
|
表 4 试验各组不同时间点收缩压(SBP)、舒张压(DBP)及平均压(MBP)的变化(x±s) Table 4 The changes of systolic pressure (SBP), diastolic blood pressure (DBP) and mean blood pressure (MBP) in each group at different time points(x±s) |
2.1.5 血氧(SpO2) 维持麻醉时氧流量均保持不变,但静吸组和吸入组SpO2差异较大,除吸入CⅠ、CⅢ组在维持麻醉后无统计学差异外,其余各组维持麻醉时均发生显著或极显著下降(P<0.05,P<0.01)。比较静吸组及吸入组结合表 5可见,在15 min时CⅠ组显著低于L组(P<0.05);在30、45、60 min时CⅡ组显著或极显著低于M组(P<0.05,P<0.01);在75 min时CⅢ组显著低于H组(P<0.05)。吸入组在麻醉后SpO2呈下降趋势,静吸组呈上升趋势。
|
|
表 5 试验各组不同时间点血氧(SpO2)的变化(x±s) Table 5 The changes of SpO2in each group at different time points(x±s) |
2.1.6 心电图(ECG) 图 1为随机挑选的某试验犬诱导麻醉前及维持麻醉期间的ECG纸图,该图提示,该犬在两次诱导麻醉前均出现窦性心律不齐的现象,怀疑是由于紧张引起的窦性心律不齐[15]。而在维持麻醉时,静吸组ECG多提示心律规律;吸入组则表现出更严重的心律不齐和窦性心率变缓。
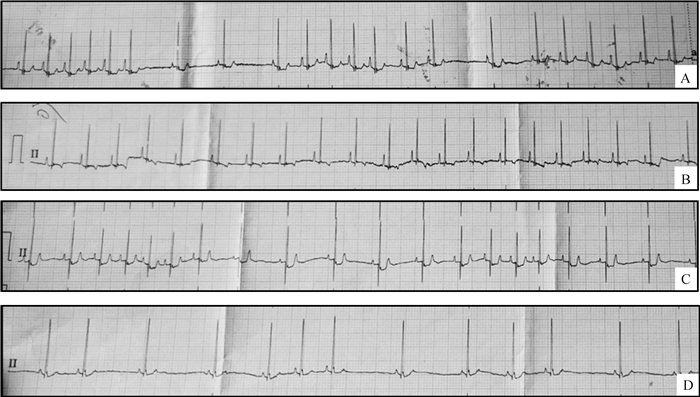
|
A. M组麻醉前心电图,心率165次·min-1(25 mm·s-1, 10 mm·mv-1);B. M组麻醉后30 min心电图,心率128次·min-1(25 mm·s-1, 10 mm·mv-1);C. CⅡ组麻醉前心电图,心率144次·min-1(25 mm·s-1, 10 mm·mv-1);D. CⅡ组麻醉后30 min心电图,心率95次·min-1(25 mm·s-1, 10 mm·mv-1) A. ECG before anesthesia in group M, heart rate 165 times·min-1 (25 mm·s-1, 10 mm·mv-1); B. ECG 30 min after anesthesia in group M, heart rate 128 times·min-1 (25 mm·s-1, 10 mm·mv-1); C. ECG anesthesia in group CⅡ, heart rate 144 times·min-1 (25 mm·s-1, 10 mm·mv-1); D. ECG 30 min after anesthesia in group CⅡ, heart rate 95 times ·min-1 (25 mm·s-1, 10 mm·mv-1) 图 1 随机挑选1只试验犬(10号)前后两次试验的ECG Fig. 1 ECG of two trials of a randomly selected experimental dog (No.10) |
2.1.7 眼球位置及眼睑反射 临床上常将眼球位置和眼睑反射来作为简单判别犬的麻醉深度的指标之一,在本试验中,吸入组的眼球位置均转向腹侧达到围手术期麻醉深度[16],且在维持麻醉期间眼睑均无反射。静吸L组中,2只试验犬(2号、4号)眼球在15~30 min时并未下落,同时,伴有轻微的眼睑反射,可能提示ALF 3 mg·(kg·h)-1的静吸麻醉方案对部分犬只存在麻醉剂量过小;而静吸H组中,1只试验犬(15号)则发生眼球后翻下落过深及无眼睑反射的现象。
2.2 镇痛效果(夹尾反射、针刺试验)、镇静效果评估结合各类文献及墨尔本疼痛评分[17],维持麻醉过程中,针刺唇鼻无反应计1分;针刺四肢躯干无反应计1分;针刺腹部无反应计1分;针刺肛周无反应计1分;钳夹尾根下方无反应计1分;钳夹四肢趾部无反应计1分;钳夹腹部皮肤无反应计1分。根据表 6可见,静吸L组在15、30 min时有轻微的疼痛反应,其他静吸组和吸入组无明显疼痛反应。
|
|
表 6 各试验组给药后镇痛效果评分(x±s) Table 6 Analgesic effect rating scale of each group after administration(x±s) |
维持麻醉过程中,用手术器械敲打桌面观察观察试验犬是否出现动耳、眨眼、肌肉颤抖、抽动四肢和抬头等行为。在所有试验犬麻醉过程中均无发生以上现象,提示镇静效果良好。
2.3 肌松效果评估结合文献资料[18],评估试验犬维持麻醉后舌肌松弛程度、肛门松弛程度以及摆尾松弛程度。打开口腔牵拉舌部,完全无阻力计3分;轻度阻力计2分;中度阻力计1分;阻力严重计0分。监测人员小指伸入肛门0.5~1.0 cm指检,试验犬清醒状态下肛门松弛程度为0分后依次递增,肛门完全松弛无阻力计5分。监测人员摆动尾根部,完全无阻力计3分;轻度阻力计2分;中度阻力计1分;阻力严重计0分。表 7可见,在肛门松弛评分多计为3分中度松弛时,维持麻醉时吸入组肌松效果均良好,静吸L组在15、30 min时肌松效果较差,部分试验犬尾根部有轻度阻力和肛门较紧张;静吸H组部分试验犬在45 min时,肛门括约肌过度松弛。
|
|
表 7 各试验组给药后肌松效果评分(x±s) Table 7 Muscle relaxantion effect rating scale of each group after administration(x±s) |
2.4.1 各组苏醒时间 苏醒时间分为恢复眨眼反射时间和自主站立时间,从(60±2) min关闭所有麻醉药物给药途径,结束维持麻醉开始计时。表 8可见,眨眼反射项目中L-CⅠ组差异显著(P<0.05);M-CⅡ组差异极显著(P<0.01)。自主站立项目中H-CⅢ组差异极显著(P<0.01)。静吸L、M组眨眼反射和自主站立时间,均小于同试验犬的吸入CⅠ、CⅡ组,可提示ALF 3和6 mg·(kg·h)-1的IVIA中,犬的苏醒时间要快于单纯吸入麻醉。
|
|
表 8 各试验组停药后的苏醒时间(x±s) Table 8 Muscle relaxantion effect rating scale of each group after administration(x±s) |
2.4.2 苏醒期异常情况 所有试验犬在苏醒时均未发生异常情况,苏醒较为平稳,在试验后3 d的基础生理检查时也均未发生异常。
3 讨论 3.1 ALF+ISO的IVIA对主要生理指标的影响3.1.1 对体温的影响 试验结果显示,各组体温存在不同的统计学差异。PRO诱导的ISO吸入麻醉会对犬的体温造成显著下降[19],据刘庆等[20]报道,与TIVA比较,IVIA在给予更高剂量的氟类麻醉剂时,机体的体温会下降更多。围麻醉期的低体温会引起如心律失常、术后颤栗缺氧、BP、HR下降及手术后切口更易感染等一系列问题[21],故体温是保证机体在围麻醉期安全性的重要条件之一。本试验中,单纯吸入麻醉对体温有明显的抑制作用,而ALF的IVIA,从整体来看,对试验犬体温的影响小于吸入组,其中, M组在围麻醉期对体温的影响最小。
3.1.2 对P、HR、BP、SBP、DBP、MBP及SpO2的影响 P、HR、BP及SpO2可反映机体的循环系统问题,各类麻醉剂的使用都会不同程度地抑制循环系统[22],在人医和兽医中,关于IVIA和吸入麻醉的对比试验,结果多为吸入麻醉对机体循环、呼吸系统影响较大[23-24]。ALF在TIVA、诱导麻醉、超量静脉麻醉等麻醉方式中都表现出对循环系统影响极小[25]。结合表 2的P及HR,IVIA与吸入麻醉的对比很显著,在静吸M、H组的维持麻醉过程中,P及HR均有不同程度的升高,且剂量越大,试验犬P及HR越接近T0的数值。
BP的监测分成了SBP、DBP、MBP 3项,在Psatha等[26]的研究中,提出ALF在健康犬中作为诱导麻醉剂使用时,平均动脉压的基线会比给予PRO的犬更早恢复。Ambros等[27]研究表明,仅使用ALF的犬心脏指数(CI)似乎表现的更好,甚至在诱导麻醉后CI数值还会轻微上升。同时,ISO在维持麻醉中更容易出现低血压的情况[28],本试验中,SBP、DBP、MBP在维持麻醉过程中均出现下降,但M-CⅡ组的DMP在维持麻醉过程中存在显著差异,提示该剂量ALF的IVIA对DBP有较好的正向提高作用,在全试验组中对BP的舒张功能影响最小。从表 4可见,静吸组维持麻醉时整体BP值高于吸入组,且波动更小,可合理推测静吸组对试验犬BP的影响,尤其是DBP要小于吸入组。
在Muir等[29]研究中, 在给予ALF后会造成HR上升、BP下降,但每分输出量(CO)和CI并未改变的结果,该作者解释怀疑是由于体循环阻力(SVR)的补偿反应所导致。本试验仅进行了基础监测,但静吸组HR及BP的监测结果,也反映出在ALF 6及9 mg·(kg·h)-1的IVIA时,对心血管影响极小。
麻醉状态下的SpO2可以评估机体的氧合状态和麻醉剂对呼吸、心血管的抑制作用[30],评估是否出现低氧血症或突发性缺氧。本试验可见,静吸组比吸入组在维持麻醉中整体SpO2值更高,M-CⅡ组有统计学差异。O’Hagan等[31]研究显示ALF对SpO2几乎无影响。Juan等[32]也提出的ALF可提供稳定的麻醉和温和的麻醉恢复期,与本试验结果基本相一致。
3.2 ALF+ISO的IVIA对镇静、镇痛和肌松效果的影响ALF具有与PRO类似的快速起效的麻醉效果,镇静作用良好但无镇痛作用,与PRO相比,ALF对心血管的影响更小安全性更高[3],Buisman等[33]研究表明,与氯胺酮比较,ALF的麻醉恢复期更短。本试验均在试验前30 min皮下注射BUT,因此,镇痛、镇静效果良好,仅静吸L组个别试验犬有疼痛反应和眼睑反射,怀疑是由于个体麻醉耐受程度不同,导致ALF 3 mg·(kg·h)-1的IVIA无法满足部分犬围手术期的麻醉深度。
与ISO相比,ALF的肌松作用较轻微[34-36],肌松效果试验其他组表现良好,仅静吸H组个别试验犬肛门松弛程度较高及摆尾试验评分较高,可能是由于ALF 9 mg·(kg·h)-1的IVIA麻醉方案的药物剂量过高,造成部分犬围手术期过度肌松。
3.3 ALF+ISO的IVIA对麻醉质量的提高ALF(3α-hydroxy-5α-pregnane-11, 20-dione)是具有麻醉特性的神经活性类固醇,对氨基丁酸A型受体(GABAA)有正向变构调节作用[37]。静脉注射ALF对犬的血液动力学稳定性优于PRO和硫喷妥钠[38],反复给药后不造成药物积累,可用于TIVA[39]。但该药存在呼吸抑制的现象[40],且用于TIVA的成本较高,因此,临床上ALF的TIVA较少。ISO的可控性和安全性较好,但会造成心功能抑制、血压降低及颤栗等不良反应。
多模式复合麻醉是小动物现代麻醉的热点研究之一,ALF及ISO的优缺点鲜明,两者联合用药的IVIA方案,可降低ALF的TIVA造成呼吸抑制现象且节约成本;与单纯的吸入麻醉相比,IVIA对机体麻醉中体温、HR、DBP及SpO2等生理影响更小。可见,ALF+ISO的IVIA可以有效地提高麻醉质量。
4 结论ALF 6 mg·(kg·h)-1配合0.5% ISO的IVIA的麻醉质量优于单纯吸入麻醉,且对心血管影响极小,因此,在老、幼年犬,特别是患心血管疾病的犬中使用该麻醉方案较为适用。但由于其呼吸抑制作用以及未深入监测的问题,该麻醉方案需进行更深入的试验,建议在使用该方案时,给予纯氧支持并密切关注患犬的RR及ETCO2,及时正压通气,防止出现窒息或高碳酸血症等情况,并且,患呼吸系统疾病的犬慎用此麻醉方案。
| [1] | GOODWIN W A, PASLOSKE K, KEATES H L. Alfaxalone for total intravenous anaesthesia in horses[J]. Vet Anaesth Analg, 2019, 46(2): 188–199. DOI: 10.1016/j.vaa.2018.09.047 |
| [2] | HUNT J R, GOFF M, JENKINS H, et al. Clinical measurements performed during alfaxalone total intravenous anaesthesia for radiography and neurophysiological investigations in dogs[J]. Vet Anaesth Analg, 2019, 46(4): 483–487. DOI: 10.1016/j.vaa.2018.11.010 |
| [3] | MARÍN P, BELDA E, LAREDO F G, et al. Pharmacokinetics and sedative effects of alfaxalone with or without dexmedetomidine in rabbits[J]. Res Vet Sci, 2020, 129: 6–12. DOI: 10.1016/j.rvsc.2019.12.015 |
| [4] | KRUSE T N, MESSENGER K M, BOWMAN A S, et al. Pharmacokinetics and pharmacodynamics of alfaxalone after a single intramuscular or intravascular injection in mallard ducks (Anas platyrhynchos)[J]. J Vet Pharmacol Ther, 2019, 42(6): 713–721. DOI: 10.1111/jvp.12804 |
| [5] | HERBERT G L, BOWLT K L, FORD-FENNAH V, et al. Alfaxalone for total intravenous anaesthesia in dogs undergoing ovariohysterectomy: a comparison of premedication with acepromazine or dexmedetomidine[J]. Vet Anesth Analg, 2013, 40(2): 124–133. DOI: 10.1111/j.1467-2995.2012.00752.x |
| [6] | DEHUISSER V, BOSMANS T, KITSHOFF A, et al. Cardiovascular effects, induction and recovery characteristics and alfaxalone dose assessment in alfaxalone versus alfaxalone-fentanyl total intravenous anaesthesia in dogs[J]. Vet Anaesth Analg, 2017, 44(6): 1276–1286. DOI: 10.1016/j.vaa.2017.04.006 |
| [7] | LERVIK A, TOVERUD S F, KRONTVEIT R, et al. A comparison of respiratory function in pigs anaesthetised by propofol or alfaxalone in combination with dexmedetomidine and ketamine[J]. Acta Vet Scand, 2020, 62(1): 14. DOI: 10.1186/s13028-020-0512-y |
| [8] |
赵修龙, 刘焕奇, 迟良, 等. 犬异氟烷吸入麻醉的模型建立[J]. 中国兽医杂志, 2016, 52(4): 89–91.
ZHAO X L, LIU H Q, CHI L, et al. Establishment of canine isoflurane inhalation anesthesia model[J]. Chinese Journal of Veterinary Medicine, 2016, 52(4): 89–91. (in Chinese) |
| [9] | AMBROS B, DUKE-NOVAKOVSKI T, PASLOSKE K S. Comparison of the anesthetic efficacy and cardiopulmonary effects of continuous rate infusions of alfaxalone-2-hydroxypropyl-β-cyclodextrin and propofol in dogs[J]. Am J Vet Res, 2008, 69(11): 1391–1398. DOI: 10.2460/ajvr.69.11.1391 |
| [10] |
秦立鸣. 静吸复合麻醉与全凭静脉麻醉对老年妇科腹腔镜手术的临床价值[J]. 中国现代药物应用, 2018, 12(4): 53–54.
QIN L M. Clinical value of intravenous-inhalation anesthesia and intravenous anesthesia for senile gynecological laparoscopic surgery[J]. Chinese Journal of Modern Drug Application, 2018, 12(4): 53–54. (in Chinese) |
| [11] |
戴海燕. 静吸复合全身麻醉与全凭静脉麻醉在腹腔镜下结直肠癌根治术中的麻醉效果观察[J]. 中国临床医生杂志, 2016, 44(8): 76–78.
DAI H Y. Observation on the anesthetic effect of intravenous-inhalation anesthesia with intravenous anesthesia in laparoscopic radical resection of colorectal cancer[J]. Chinese Journal for Clinicians, 2016, 44(8): 76–78. (in Chinese) |
| [12] |
张金辉. 七氟醚-瑞芬太尼静吸复合麻醉对子宫肌瘤腹腔镜术后认知功能的影响[J]. 中国计划生育学杂志, 2016, 24(12): 824–827.
ZHANG J H. The impact of sevoflurane-remifentanil inhalation anesthesia on cognitive function postoperative of patients with uterine fibroids by laparoscopic treated[J]. Chinese Journal of Family Planning, 2016, 24(12): 824–827. (in Chinese) |
| [13] | WARNE L N, BETHS T, FOGAL S, et al. The use of alfaxalone and remifentanil total intravenous anesthesia in a dog undergoing a craniectomy for tumor resection[J]. Can Vet J, 2014, 55(11): 1083–1088. |
| [14] |
米洁. 犬吸入麻醉的方案选择、术中监护及其处理方法的研究[D]. 长春: 吉林大学, 2017: 8-15.
MI J. The study of the selection of canine inhalation anesthesia program, intraoperative monitoring and its treatment[D]. Changchun: Jilin University, 2017: 8-15. (in Chinese) |
| [15] | MOÏSE N S, FLANDERS W H, PARIAUT R. Beat-to-beat patterning of sinus rhythm reveals non-linear rhythm in the dog compared to the human[J]. Front Physiol, 2020, 10: 1548. DOI: 10.3389/fphys.2019.01548 |
| [16] | HASKINS S C. General guidelines for judging anesthetic depth[J]. Vet Clin North Am Small Anim Pract, 1992, 22(2): 432–434. DOI: 10.1016/S0195-5616(92)50659-3 |
| [17] |
秦绪伟, 李富金, 刘云. 犬眠宝对猫麻醉效果及心肺功能影响的研究[J]. 山东畜牧兽医, 2013, 34(5): 9–11.
QIN X W, LI F J, LIU Y. Study on the effect of QFM on anesthesia and cardiopulmonary function in cats[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2013, 34(5): 9–11. (in Chinese) |
| [18] |
高利, 肖建华, 王洪斌. 犬眠宝与眠乃宁临床麻醉效果的对比实验[J]. 畜牧兽医杂志, 2008, 27(1): 18–20.
GAO L, XIAO J H, WANG H B. Compare of anestehsia effects between Quanmianbao and Miannaining[J]. Journal of Animal Science and Veterinary Medicine, 2008, 27(1): 18–20. (in Chinese) |
| [19] |
程吉英. 丙泊酚诱导复合异氟烷吸入麻醉对犬生理机能的影响[D]. 合肥: 安徽农业大学, 2017: 28-31.
CHENG J Y. Studies on effects of propofol-induced compound Isoflurane-inhalation anesthesia on physiological function of canine[D]. Hefei: Anhui Agricultural University, 2017: 28-31. (in Chinese) |
| [20] |
刘庆. 七氟烷不同浓度下静吸复合麻醉对肝切患者术后苏醒质量的影响[D]. 南宁: 广西医科大学, 2013: 26-30.
LIU Q. Effects of recovery from different concentrations of sevoflurane combined with propofol on patients undergoing partial hepatic resection[D]. Nanning: Guangxi Medical University, 2013: 26-30. (in Chinese) |
| [21] | GIULIANO K K, HENDRICKS J. Inadvertent perioperative hypothermia: current nursing knowledge[J]. Aorn J, 2017, 105(5): 453–463. DOI: 10.1016/j.aorn.2017.03.003 |
| [22] | FREUNDLICH R E, EHRENFELD J M. Perioperative information systems: opportunities to improve delivery of care and clinical outcomes in cardiac and vascular surgery[J]. J Cardiothorac Vasc Anesth, 2018, 32(3): 1458–1463. DOI: 10.1053/j.jvca.2017.11.002 |
| [23] |
昝小刚, 杜增利. 异丙酚复合芬太尼或瑞芬太尼靶控静脉麻醉与静吸复合麻醉的比较[J]. 河南外科学杂志, 2014, 20(3): 46–47.
ZAN X G, DU Z L. Comparison of target controlled intravenous anesthesia and intravenous-inhalation anesthesia with propofol combined fentanyl or remifentanil[J]. Henan Journal of Surgery, 2014, 20(3): 46–47. (in Chinese) |
| [24] |
李鸿志. 两种麻醉方法对患者HR、呼吸系统、循环系统的影响[J]. 中国疗养医学, 2016, 25(2): 172–175.
LI H Z. Effects of two anesthesia methods on HR, respiratory and circulatory systems of patients[J]. Chinese Journal of Convalescent Medicine, 2016, 25(2): 172–175. (in Chinese) |
| [25] | DEHUISSER V, BOSMANS T, DEVREESE M, et al. Alfaxalone total intravenous anaesthesia in dogs: pharmacokinetics, cardiovascular data and recovery characteristics[J]. Vet Anaesth Analg, 2019, 46(5): 605–612. DOI: 10.1016/j.vaa.2019.04.014 |
| [26] | PSATHA E, ALIBHAI H I, JIMENEZ-LOZANO A, et al. Clinical efficacy and cardiorespiratory effects of alfaxalone, or diazepam/fentanyl for induction of anaesthesia in dogs that are a poor anaesthetic risk[J]. Vet Anaesth Analg, 2011, 38(1): 24–36. DOI: 10.1111/j.1467-2995.2010.00577.x |
| [27] | AMBROS B, DUKE-NOVAKOVSKI T, PASLOSKE K S. Comparison of the anesthetic efficacy and cardiopulmonary effects of continuous rate infusions of alfaxalone-2-hydroxypropyl-β-cyclodextrin and propofol in dogs[J]. Am J Vet Res, 2008, 69(11): 1391–1398. DOI: 10.2460/ajvr.69.11.1391 |
| [28] |
包海泉, 董俊斌. 犬异氟烷吸入麻醉后术中监护和并发症处理方法的探讨[J]. 黑龙江畜牧兽医, 2019(12): 74–76.
BAO H Q, DONG J B. Intraoperative monitoring and management of complications after inhalation of isoflurane in dogs[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(12): 74–76. (in Chinese) |
| [29] | MUIR W, LERCHE P, WIESE A, et al. Cardiorespiratory and anesthetic effects of clinical and supraclinical doses of alfaxalone in dogs[J]. Vet Anesth Analg, 2008, 35(6): 451–462. DOI: 10.1111/j.1467-2995.2008.00406.x |
| [30] |
蒋永琴. 舒芬太尼靶控输注全凭静脉麻醉在围手术期的应用效果[J]. 河南医学研究, 2019, 28(13): 2405–2407.
JIANG Y Q. The application effects of target-controlled infusion of sufentanil in TIVA during the perioperative period[J]. Henan Medical Research, 2019, 28(13): 2405–2407. (in Chinese) |
| [31] | O'HAGAN B J, PASLOSKE K, MCKINNON C, et al. Clinical evaluation of alfaxalone as an anaesthetic induction agent in dogs less than 12 weeks of age[J]. Aust Vet J, 2012, 90(9): 346–350. DOI: 10.1111/j.1751-0813.2012.00974.x |
| [32] | RODRÍGUEZ J M, MUÑOZ-RASCÓN P, NAVARRETE-CALVO R, et al. Comparison of the cardiopulmonary parameters after induction of anaesthesia with alphaxalone or etomidate in dogs[J]. Vet Anaesth Analg, 2012, 39(4): 357–365. DOI: 10.1111/j.1467-2995.2011.00695.x |
| [33] | BUISMAN M, WAGNER M C, HASIUK M M, et al. Effects of ketamine and alfaxalone on application of a feline pain assessment scale[J]. J Feline Med Surg, 2016, 18(8): 643–651. DOI: 10.1177/1098612X15591590 |
| [34] | MURISON P J, TABOADA F M. Effect of propofol and alfaxalone on pain after ovariohysterectomy in cats[J]. Vet Rec, 2010, 166(11): 334–335. DOI: 10.1136/vr.b4788 |
| [35] |
蒋朝霞, 陈启国. 七氟烷、异氟烷分别联合丙泊酚用于腹部手术麻醉中的体会[J]. 实用临床医药杂志, 2013, 17(14): 110–112.
JIANG C X, CHEN Q G. Effect of sevoflurane and isoflurane combined with propofol in the anesthesia of abdominal surgery[J]. Journal of Clinical Medicine in Practice, 2013, 17(14): 110–112. (in Chinese) |
| [36] | YOSHIZAWA K, OKUMURA A, NAKASHIMA K, et al. Role of allopregnanolone biosynthesis in acute stress-induced anxiety-like behaviors in mice[J]. Synapse, 2017, 71(8): e21978. DOI: 10.1002/syn.21978 |
| [37] | VISSER S A G, SMULDERS C J G M, REIJERS B P R, et al. Mechanism-based pharmacokinetic-pharma-codynamic modeling of concentration-dependent hysteresis and biphasic electroencephalogram effects of alphaxalone in rats[J]. J Pharmacol Exp Ther, 2002, 302(3): 1158–1167. DOI: 10.1124/jpet.302.3.1158 |
| [38] | PASLOSKE K, SAUER B, PERKINS N, et al. Plasma pharmacokinetics of alfaxalone in both premedicated and unpremedicated greyhound dogs after single, intravenous administration of Alfaxan? at a clinical dose[J]. Vet Pharmcol Ther, 2009, 32(5): 510–513. DOI: 10.1111/j.1365-2885.2009.01070.x |
| [39] | PASLOSKE K, GAZZARD B, PERKINS N, et al. A multicentre clinical trial evaluating the efficacy and safety of alfaxalone-CD RTU administered to dogs for induction and maintenance of anaesthesia[C]//Proceedings of the 48th Annual British Small Animal Veterinary Congress. Birmingham, UK, 2005: 556. |
| [40] | KEATES H, WHITTEM T. Effect of intravenous dose escalation with alfaxalone and propofol on occurrence of apnoea in the dog[J]. Res Vet Sci, 2012, 93(2): 904–906. DOI: 10.1016/j.rvsc.2011.10.003 |



