2. 山西省生物研究院有限公司, 太原 030006
2. Shanxi Biology Institute Company Limited, Taiyuan 030006, China
黑色素瘤是一种由黑色素细胞恶变而形成的肿瘤,占所有皮肤恶性肿瘤的3%,由于其恶化速度快,转移性强,现如今已成为人类死亡率最高的皮肤癌之一[1]。在动物中,黑色素瘤常见于家养猫、狗、猪的口腔、皮肤和足趾[2]。不论是人还是动物,传统手术治疗预后差,复发性高,并不能根治黑色素瘤,因此,亟需寻找更为简单高效的治疗方式[3]。MITF是黑色素生成过程中最关键的调控基因,可作为转录因子同启动子区域的M-box序列结合,影响黑色素的生成[4-5]。大蒜素(allicin)是大蒜的主要成分,是大蒜中最具生物活性的含硫化合物之一。近些年,随着流行病学的研究,人们发现大蒜素可显著提高机体免疫系统功能,诱导生成干扰素,抑制肿瘤坏死因子的生成[6]。并且大蒜素能通过影响细胞周期、抑制原癌基因的激活、促进细胞凋亡等途径降低癌细胞转移和侵袭的能力[7]。本试验研究不同浓度的大蒜素在相同处理时间下对小鼠黑色素瘤B16F10细胞中MITF基因及蛋白表达的作用,以及对B16F10细胞体外增殖和迁移能力的影响。为阐明大蒜素抑制肿瘤细胞增殖、侵袭的作用及其分子机制提供科学依据,为动物黑色素瘤的治疗提供理论依据。
1 材料与方法 1.1 细胞与试剂小鼠黑色素瘤B16F10细胞株由山西农业大学生命科学学院113号实验室保存。DMEM购自美国Gibco公司;胎牛血清购自浙江天杭生物科技有限公司;胰蛋白酶、青霉素链霉素双抗购自北京索莱宝有限公司;反转录试剂盒购自北京TaKaRa有限公司;MITF兔源单克隆抗体购自上海Abcam,二抗山羊抗兔IgG购自北京康为世纪有限公司;Trizol购自赛默飞世尔有限公司。
1.2 小鼠黑色素瘤B16F10细胞体外培养与处理将B16F10细胞从液氮中取出,水浴锅迅速复苏,加入终止液(DMEM+10%胎牛血清)离心后用完全培养基(DMEM+10%胎牛血清+1%双抗)重悬细胞,将细胞接种至培养瓶,置于5% CO2的37 ℃的培养箱,待细胞长满80%~90%进行传代。加入0.25%胰酶消化,重悬后接种至六孔板。待细胞长至指数生长期即可加入不同浓度大蒜素(0、5、10、15、20和25 μg·mL-1)进行后续试验。
1.3 总RNA的提取与处理将B16F10用新鲜的细胞培养基制成细胞悬液,加入Trizol混匀后冰浴静置10 min。每个离心管加入1/5体积的氯仿混匀。冰浴静置3 min后,离心15 min,取上清,加入等体积的异丙醇混匀,静置10 min后, 离心10 min。弃上清,加75 %乙醇洗涤后, 离心10 min,将沉淀用30 μL DEPC处理水溶解,-80 ℃保存。
1.4 RNA反转录及qRT-PCR体系根据TaKaRa反转录试剂盒与荧光定量试剂盒说明书要求,进行后续试验。20 μL反转录体系将提取的RNA反转录成cDNA。10 μL荧光定量体系检测基因表达量。MITF引物,F:5′-CGAAAGTTGCAACGRGAACAGCA-3′;R:5′-GAGCCTGCATT-TCAAGTTCCTGTA-3′。β-actin引物, F:5′-CGTTGACATCCGTAAAGACC-3′;R:5′-CGTTGACATCCGTAAAGACC-3′。
1.5 总蛋白质的提取与处理将处理后的细胞悬浮液离心10 min。向细胞沉淀中加入添加了苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF)的RIPA裂解液,冰浴30 min,离心,取上清液,并转移到新离心管中,-80 ℃冻存。
1.6 Western blot配制浓缩胶和分离胶,并变性蛋白用于上样。进行80 V浓缩,120 V分离后转膜1.5 h,脱脂牛奶封闭1 h,MITF一抗室温作用1 h,TBST洗4次,每次5 min。加MITF二抗,摇床孵育1 h,10% TBST洗4次,每次5 min。加ECL发光液成像,以MITF和β-actin蛋白表达条带作为AOI进行平均光密度测定。
1.7 大蒜素对B16F10细胞体外增殖能力的影响细胞进入指数生长期后制成细胞悬液,计数后,在96孔板中每孔接种100 μL 1×105个细胞,37 ℃ 5% CO2恒温培养箱中过夜。加入200 μL不同浓度大蒜素的培养基,使大蒜素终浓度为0、5、10、15和20 μg·mL-1。继续培养24 h后,在各孔中加入50 μL 50%三氯乙酸(TCA),4 ℃冰箱放置1 h。蒸馏水洗涤5次去除TCA,晾干。每孔加入100 μL的0.4% SRB染色液进行染色,室温静置20 min。1%乙酸洗涤5次,除去未结合的SRB染色液。在空气中干燥后,用DMSO溶解细胞,振荡10 min。用全波长酶标仪在515 nm处测定各孔的吸光度值,记录数据并计算大蒜素对细胞增殖的抑制率。
| $ \begin{array}{l} \text { 抑制率 }(\%)=\frac{\text { 对照组吸光度值一试验组吸光度值 }}{\text { 对照组吸光度值 }} \times 100 \% \end{array} $ |
将B16F10细胞接种于24孔板上待细胞长满80%~90%后划痕。用无血清DMEM培养基清洗1次,将漂浮的细胞洗去。加入含有不同浓度大蒜素的无血清DMEM培养基,使24孔板内大蒜素终浓度为0、5、10、15、20 μg·mL-1,在37 ℃ 5% CO2恒温培养箱培养42 h,此时对照组划痕基本愈合。在倒置显微镜下拍照分析划痕宽度,使用Image J软件进行图片处理。
1.9 统计分析小鼠黑色素瘤B16F10增殖能力变化情况、荧光定量数据和Western blot数据使用GraphPad Prism 8.0软件进行单因素ANOVA分析并绘图,P<0.05被认为具有统计学意义。细胞划痕试验结果用Image J软件进行分析。
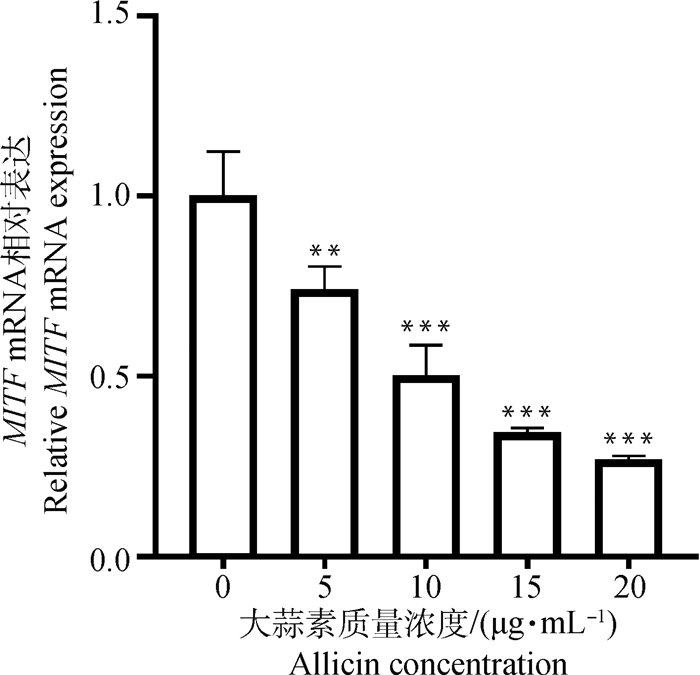
2 结果 2.1 不同浓度大蒜素处理后细胞MITF mRNA的表达量不同浓度大蒜素处理细胞24 h后,提取细胞总RNA。荧光定量PCR检测MITF mRNA的表达量。归一化处理后,结果如图 1所示。对照组MITF mRNA的相对表达量最高,5、10、15、20 μg·mL-1大蒜素组MITF mRNA相对表达量均有所下降(P < 0.01, P < 0.001, P < 0.001, P < 0.001),呈现浓度依赖性。
|
**. P < 0.01; ***. P < 0.001 图 1 不同浓度大蒜素对B16F10细胞MITF mRNA表达的影响 Fig. 1 The expression of MITF mRNA in B16F10 cell treated with different concentrations of allicins |
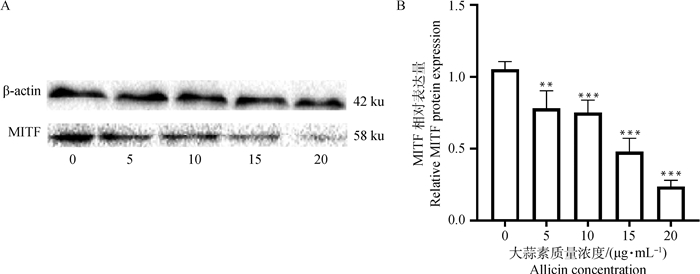
不同浓度的大蒜素处理细胞24 h后,提取蛋白。利用Western blot检测MITF蛋白的表达量。结果如图 2A所示,其中,β-actin为内参蛋白。随着试验组大蒜素浓度的升高,MITF蛋白的表达量逐渐降低,呈剂量依赖性。图 2B是经GraphPad Prism 8.0处理后的蛋白质相对表达量柱状图,可以看出加入不同浓度(5、10、15、20 μg·mL-1)大蒜素后,细胞中MITF蛋白的表达量均受到了显著抑制(P < 0.01, P < 0.01, P < 0.001, P < 0.001)。
|
**. P < 0.01; ***. P < 0.001 图 2 MITF蛋白在B16F10细胞中的表达 Fig. 2 The expression of MITF protein in B16F10 cells |
B16F10细胞增殖情况如表 1所示,在每个浓度都设置了9个重复。从9组数据的平均值和最终的抑制率可看出大蒜素对B16F10细胞的增殖有抑制效果,且抑制效果随浓度升高而增强。与对照组相比,5、10、15、20 μg·mL-1大蒜素处理后B16F10细胞吸光度显著降低(P<0.001)。结果显示,大蒜素对小鼠黑色素瘤B16F10细胞存在抑制作用,且抑制率呈浓度依赖性增加。
|
|
表 1 大蒜素对小鼠黑色素瘤B16F10细胞增殖的影响 Table 1 The effects of allicin on proliferation of murine melanoma B16F10 cells |
由Image J软件分析得出的细胞划痕试验结果如图 3所示。与空白组相比,在5 μg·mL-1浓度大蒜素处理42 h后,划痕宽度相差不显著,说明该浓度大蒜素对B16F10细胞的迁移影响较小。在10、15、20 μg·mL-1大蒜素处理细胞42 h后,细胞划痕愈合程度明显受到抑制。说明10、15、20 μg·mL-1的大蒜素对B16F10细胞的迁移具有明显的抑制作用。

|
A~E分别代表 0、5、10、15、20 μg·mL-1大蒜素处理组;a. 0 h划痕图;b. ImageJ可视化的0 h划痕图;c. 42 h划痕图;d. ImageJ可视化的42 h划痕图 A-E represented 0, 5, 10, 15, and 20 μg·mL-1 allicin treatment groups, respectively; a. 0 h after wound healing assay; b. Visualized 0 h diagram in ImageJ; c.0 h after wound healing assay; d. Visualized 42 h diagram in ImageJ 图 3 细胞划痕结果 Fig. 3 The results of wound healing |
黑色素的异常增殖是导致黑色素成瘤的原因,传统的手术治疗方式就是切除病灶。近年来,随着黑色素瘤发病率的不断提高,宠物和畜牧动物的健康受到了前所未有的挑战。在我国马[8]、牛[9]、犬[10]和猪[11]等动物都有患黑色素瘤的先例,原发于皮肤部位,也存在于各种器官黏膜处。犬的口腔下颌黏膜是黑色素瘤常发部位,发病率达到53%,且小型犬和口腔黏膜较深的犬患口腔黑色素瘤的概率更大[12]。在猫的肿瘤疾病中,最常见的原发性肿瘤就是眼部的黑色素瘤,其发病率仅次于猫乳腺肿瘤,且约60%的病例会发生转移,导致猫的生存期和生存质量严重下降[13]。
MITF作为黑色素合成代谢通路上重要调控基因,起着中心枢纽的作用。MITF可以通过调控TYR基因家族间接参与黑素细胞的分化、增殖和转移[14-15]。目前,已经发现至少有10种MITF的异构,其中,MITF-M只存在于黑色素细胞和黑色素瘤细胞中[16]。在对白化荣昌猪眼圈周围黑素生成相关基因分析后发现与正常黑眼膛毛色猪相比,白化个体中几乎不存在黑色小体,MITF及其下游基因TYR、TYRP1表达量显著降低[17]。将带有MITF-M的真核表达载体转染进绵羊细胞后,TYRP1表达量升高至5.06倍,黑色素生成显著增加[18]。MITF的表达影响黑色素生成的同时,也可能导致黑色素细胞的癌变。已有的研究表明,MITF的表达含量能影响黑色素细胞的恶性转化及黑色素瘤的发生,且在黑色素瘤患者中,MITF处于失调的状态[19]。Rheostat动态模型把MITF作为一个动态的变阻器,高水平的MITF使得细胞具有更多的增殖表型,低水平的MITF则导致细胞增殖活性降低,具有更高的侵袭表型并具有肿瘤细胞起始特征,更低水平的MITF将导致细胞死亡[20]。因此,MITF表达的稳定是维持黑色素正常形成的关键,也是细胞维持正常状态的重要一环。
大蒜素作为大蒜提取物,对于多种细菌都有杀灭的效果。以往对大蒜素的研究主要集中于其抗病毒、抗细菌以及抗真菌的功能[21-23]。近年来,随着研究的不断深入,发现大蒜素不仅有抑菌功能,并且对于多种肿瘤,如肝癌、胃癌、妇科恶性肿瘤等多种肿瘤的发展都有抑制效果[24-25]。在B16F10细胞中,大蒜提取液可通过下调Akt、Bcl-2基因和上调PTEN、Bax的表达来抑制增殖并促进细胞凋亡[26]。最近的研究表明,大蒜素可以参与并激活Wnt/β-catenin信号通路,有效抑制肺癌细胞的增殖、侵袭和转移[27]。另外,在胃癌SGC-7901细胞中,大蒜素会导致细胞内质网的凋亡,从而抑制胃癌SGC-7901细胞的增殖能力[28]。总之,大蒜素对于肿瘤的抑制作用体现在影响基因表达、改变细胞信号通路和阻碍细胞周期等方面[29]。
本试验设置不同大蒜素浓度的试验组,采用qRT-PCR和Western blot检测MITF mRNA和蛋白的表达水平;并通过SRB染色法和细胞划痕试验研究了大蒜素在体外对于小鼠黑色素瘤B16F10细胞的增殖和迁移的影响。结果显示,随着试验组大蒜素浓度的升高,细胞中MITF mRNA的表达量逐渐降低,呈浓度依赖性;Western blot结果与qRT-PCR呈一致趋势,随着大蒜素浓度的升高,MITF蛋白的表达量逐渐降低。大蒜素在5、10、15、20 μg·mL-1浓度时对B16F10细胞增殖能力有显著抑制效果(P<0.001),且随着浓度的升高抑制能力逐渐增强。当大蒜素为20 μg·mL-1时,大蒜素对B16F10细胞的抑制率达到了44.22%。划痕试验结果显示,大蒜素对B16F10细胞的体外迁移有抑制作用。当大蒜素浓度在10、15、20 μg·mL-1时划痕愈合程度较低,对细胞迁移力抑制较大。
4 结论0~20 μg·mL-1大蒜素对黑色素瘤B16F10细胞的增殖、迁移都具有一定的抑制效果,且对小鼠黑色素瘤B16F10细胞MITF的表达有显著的抑制效果,为进一步研究动物黑色素瘤的发生发展及其治疗提供了一定的理论基础。
| [1] |
董小龙. 皮肤恶性黑色素瘤诊断及外科治疗策略[J]. 中国美容医学, 2016, 25(6): 108–112.
DONG X L. Progress in the diagnosis and surgical treatments for cutaneous malignant melanoma[J]. Chinese Journal of Aesthetic Medicine, 2016, 25(6): 108–112. (in Chinese) |
| [2] |
秦毓敏, 钟友刚. 犬黑色素瘤研究进展[C]//第六届西部宠物医师大会论文集. 成都: 中国畜牧兽医学会, 2017: 4.
QIN Y M, ZHONG Y G. Advances in canine melanoma research[C]//The 6th Western Small Animal Veterinarian Congress Collected Papers. Chengdu: China Animal Husbandry and Veterinary Association, 2017: 4. (in Chinese) |
| [3] | BLANKENSTEIN S A, VAN AKKOOI A C J. Adjuvant systemic therapy in high-risk melanoma[J]. Melanoma Res, 2019, 29(4): 358–364. DOI: 10.1097/CMR.0000000000000604 |
| [4] |
刘文艳, 李园, 蔡永强, 等. 黑色素细胞中MITF相关信号通路调控因子的研究进展[J]. 畜牧与兽医, 2017, 49(8): 125–128.
LIU W Y, LI Y, CAI Y Q, et al. Research progress of the regulators involved in MITF-related signaling pathways in melanocytes[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(8): 125–128. (in Chinese) |
| [5] | ULLRICH N, LÖFFEK S, HORN S, et al. MITF is a critical regulator of the carcinoembryonic antigen-related cell adhesion molecule 1 (CEACAM1) in malignant melanoma[J]. Pigment Cell Melanoma Res, 2015, 28(6): 736–740. DOI: 10.1111/pcmr.12414 |
| [6] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7–30. DOI: 10.3322/caac.21332 |
| [7] |
赵美娟, 户晶晶, 倪辉, 等. 黑色素生成信号通路研究进展[J]. 生物工程学报, 2019, 35(9): 1633–1642.
ZHAO M J, HU J J, NI H, et al. Research progress in melanogenesis signaling pathway[J]. Chinese Journal of Biotechnology, 2019, 35(9): 1633–1642. (in Chinese) |
| [8] |
韩涛, 陈世军, 喻昌盛, 等. 马常见皮肤肿瘤的诊断与治疗[J]. 现代农业科技, 2014(15): 298–299.
HAN T, CHEN S J, YU C S, et al. Diagnosis and treatment of equine common skin tumors[J]. Modern Agricultural Science and Technology, 2014(15): 298–299. (in Chinese) |
| [9] |
宋桂太, 宋维臣, 庄欠海, 等. 手术切除牛黑色素瘤1例[J]. 山东畜牧兽医, 1998(5): 42–43.
SONG G T, SONG W C, ZHUANG Q H, et al. Surgical resection of bovine melanoma in 1 case[J]. Shandong Journal of Animal Science and Veterinary Medicine, 1998(5): 42–43. (in Chinese) |
| [10] | RAMOS-VARA J A, BEISSENHERZ M E, MILLER M A, et al. Retrospective study of 338 canine oral melanomas with clinical, histologic, and immunohistochemical review of 129 cases[J]. Vet Pathol, 2000, 37(6): 597–608. DOI: 10.1354/vp.37-6-597 |
| [11] |
韩庆功, 刘超, 陈金山, 等. 猪恶性黑色素瘤的病理学观察[J]. 中国兽医杂志, 2015, 51(8): 37–38.
HAN Q G, LIU C, CHEN J S, et al. Pathological observation of malignant melanoma in pigs[J]. Chinese Journal of Veterinary Medicine, 2015, 51(8): 37–38. (in Chinese) |
| [12] |
蔡彤, 邓佳佳, 彭西. 一例犬口腔恶性黑色素瘤的病理诊断及治疗[J]. 畜禽业, 2019, 30(8): 119.
CAI T, DENG J J, PENG X. Pathological diagnosis and treatment of a case of oral malignant melanoma in dogs[J]. Livestock and Poultry Industry, 2019, 30(8): 119. (in Chinese) |
| [13] |
张琦, 白喜云, 段步婷, 等. 一例原发性猫眼黑色素瘤的组织病理学分析[C]//中国畜牧兽医学会兽医病理学分会第二十五次学术交流会、中国病理生理学会动物病理学专业委员会第二十四次学术研讨会、中国实验动物学会实验病理学专业委员会第四次学术研讨会、中国兽医病理学家第四次研讨会论文集. 天津: 中国畜牧兽医学会兽医病理学分会, 2019: 107.
ZHANG Q, BAI X Y, DUAN B T, et al. Histopathological analysis of a case of primary cat eye melanoma[C]//The 25th Academic Exchange Meeting of Veterinary Pathology Branch of Chinese Animal Husbandry and Veterinary Association, the 24th Academic Seminar of Animal Pathology Professional Committee of Chinese Society of Pathophysiology, the Fourth Academic Seminar of Experimental Pathology Professional Committee of Chinese Society of Experimental Animals, and the Fourth Symposium of Chinese Veterinary Pathologist. Tianjin: Veterinary Pathology Branch of Chinese Animal Husbandry and Veterinary Association, 2019: 107. (in Chinese) |
| [14] | LV J P, FU Y, CAO Y, et al. Isoliquiritigenin inhibits melanogenesis, melanocyte dendricity and melanosome transport by regulating ERK-mediated MITF degradation[J]. Exp Dermatol, 2020, 29(2): 149–157. DOI: 10.1111/exd.14066 |
| [15] |
杨鹏欣, 刘蕾, 马来记, 等. 黑素合成相关MITF基因及其表达研究概况[J]. 日用化学工业, 2017, 47(1): 46–51.
YANG P X, LIU L, MA L J, et al. Situation of research work with respect to melanogenesis-associated MITF gene and its expression[J]. China Surfactant Detergent & Cosmetics, 2017, 47(1): 46–51. (in Chinese) |
| [16] | YUN C Y, ROH E, KIM S H, et al. Stem cell factor-inducible MITF-M expression in therapeutics for acquired skin hyperpigmentation[J]. Theranostics, 2020, 10(1): 340–352. |
| [17] |
余翔. 白化荣昌猪黑色素生成通路相关基因变异分析[D]. 雅安: 四川农业大学, 2011.
YU X. Analysis of gene variation related to melanin production pathway in Rongchang albino pig[D]. Yaan: Sichuan Agricultural University, 2011. (in Chinese) |
| [18] |
杨玉静, 张丹瑾, 聂瑞强, 等. 绵羊MITF-M在黑素细胞中过表达后的功能分析[J]. 中国农业科学, 2016, 49(21): 4214–4221.
YANG Y J, ZHANG D J, NIE R Q, et al. The function analysis of over-expression of oar MITF-M in melanocytes[J]. Scientia Agricultura Sinica, 2016, 49(21): 4214–4221. (in Chinese) |
| [19] | VLČKOVÁ K, VACHTENHEIM J, RÉDA J, et al. Inducibly decreased MITF levels do not affect proliferation and phenotype switching but reduce differentiation of melanoma cells[J]. J Cell Mol Med, 2018, 22(4): 2240–2251. |
| [20] | PHUNG B, SUN J M, SCHEPSKY A, et al. Abstract 3093: elucidation of c-KIT- dependent signaling to MITF[J]. Cancer Res, 2012, 72(8 Suppl): 3093. |
| [21] | FRANZONI A, MARKOVA-CAR E, DEVI C ' -PAVLI C ' S, et al. A polymorphic GGC repeat in the NPAS2 gene and its association with melanoma[J]. Exp Biol Med (Maywood), 2017, 242(15): 1553–1558. |
| [22] | TIFFEN J, WILSON S, GALLAGHER S J, et al. Somatic copy number amplification and hyperactivating somatic mutations of EZH2 correlate with DNA methylation and drive epigenetic silencing of genes involved in tumor suppression and immune responses in melanoma[J]. Neoplasia, 2016, 18(2): 121–132. |
| [23] |
姬凯元, 范瑞文, 张俊珍, 等. 小鼠正常黑色素细胞与黑色素瘤细胞(B16)mRNA表达差异分析[J]. 中国生物化学与分子生物学报, 2019, 35(1): 92–100.
JI K Y, FAN R W, ZHANG J Z, et al. Differential expression of mRNA between murine melanocytes and B16 melanoma cells[J]. Chinese Journal of Biochemistry and Molecular Biology, 2019, 35(1): 92–100. (in Chinese) |
| [24] |
吴达军, 许峰. 晚期恶性黑色素瘤的新药治疗进展[J]. 华西医学, 2016, 31(12): 2079–2083.
WU D J, XU F. Advances in new drug therapy for advanced malignant melanoma[J]. West China Medical Journal, 2016, 31(12): 2079–2083. (in Chinese) |
| [25] | SALEHI B, ZUCCA P, ORHAN I E, et al. Allicin and health: a comprehensive review[J]. Trends Food Sci Technol, 2019, 86: 502–516. |
| [26] |
林思祥, 杨桂青, 王园园, 等. 黑蒜提取液对恶性黑色素瘤B16细胞增殖与凋亡影响及其机制的研究[J]. 中华中医药杂志, 2014, 29(4): 1240–1243.
LIN S X, YANG G Q, WANG Y Y, et al. Study on the mechanism and effect of aged black garlic extract on proliferation and apoptosis of malignant melanoma B16 cells[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2014, 29(4): 1240–1243. (in Chinese) |
| [27] |
李建波, 樊汉利, 王建祥. 大蒜素激活Wnt/β-连环蛋白通路抑制A549肺癌小鼠转移侵袭的研究[J]. 中华实验外科杂志, 2019, 36(11): 2058–2060.
LI J B, FAN H L, WANG J X. Allicin activates Wingless/β-catenin pathway to inhibit metastasis and invasion of A549 lung cancer mice[J]. Chinese Journal of Experimental Surgery, 2019, 36(11): 2058–2060. (in Chinese) |
| [28] |
吴淑芬, 李志晋. 大蒜素抑制内质网自噬影响胃癌SGC-7901细胞增殖和凋亡的研究[J]. 肿瘤药学, 2019, 9(2): 226–230.
WU S F, LI Z J. Effect of allicin on the proliferation and apoptosis of gastric cancer cells SGC-7901 through inhibiting autophagy of endoplasmic reticulum[J]. Anti-tumor Pharmacy, 2019, 9(2): 226–230. (in Chinese) |
| [29] | SINNAMON A J, NEUWIRTH M G, YALAMANCHI P, et al. Association between patient age and lymph node positivity in thin melanoma[J]. JAMA Dermatol, 2017, 153(9): 866–873. |


 , 蓝吴涛1
, 蓝吴涛1