2. 中国农业科学院北京畜牧兽医研究所, 农业农村部动物遗传育种与繁殖(家禽)重点实验室, 北京 100193
2. Key Laboratory of Animal(Poultry) Genetics, Breeding and Reproduction of Ministry of Agriculture and Rural Affairs, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
精子活力是衡量精液质量的重要标准之一,精子活力低下引起的弱精症主要表现为精子前向运动数量(A类和B类)的比例小于50%或快速直线前向运动数量的比例小于25%,其严重影响人和动物的生殖能力[1-3],据不完全统计,每年有5%~12%的种公鸡因产精能力低下而被淘汰[4]。中国地方鸡中,由于各种因素普遍存在着精子活力偏低的问题,精子活力低下成为制约地方鸡种产业化发展的限制因素之一。鸡精子主要贮藏于输精管中,精浆来自睾丸、附睾和输精管,与哺乳动物相比,由于缺少副性腺,鸡精液具有体积小、浓稠且精子密度大的特点。精浆是精子重要的环境载体,为精子提供营养和能量,其中的重要成分精浆蛋白影响精子在雌性生殖道中的贮存,参与精子获能、顶体反应和免疫应答等诸多生殖过程[5-7]。目前,人和动物中对弱精症的研究主要集中于精子、染色体异常或相关生殖器官病变的研究[8-10],而对精浆的研究较少。富丽等[4]采用RT-qPCR技术在公鸡睾丸组织中进行检测发现,COX7B、hPTGDS和WNT2等候选基因在弱精组个体睾丸中的表达量与正常个体相比有显著差异。许红等[11]研究发现,SOX5基因在弱精症公鸡睾丸中的表达显著低于正常公鸡,而且SOX5基因和蛋白的表达趋势与公鸡性成熟和繁殖机能衰退的趋势一致,推测SOX5基因对公鸡睾丸发育水平和精子活力具有重要调控作用。刘一帆[12]利用转录组学技术构建鸡精子活力相关mRNA-miRNA-lncRNA互作网络和蛋白质互作网络,预测到一个包括35个lncRNAs、119个mRNAs和18个miRNAs的调控因子集合。
本试验以宁都黄鸡作为研究对象,采用液相色谱-质谱联用(LC-MS/MS)技术开展鸡精浆蛋白组学的研究,筛选与弱精症相关的差异蛋白,分析差异蛋白可能参与的调控通路以及在精子运动中的作用,为进一步阐明弱精症的病理学基础,寻找弱精症诊断的新靶点并以提高繁殖性能为目标的分子育种奠定理论基础。
1 材料与方法 1.1 试验材料和试剂1.1.1 试验材料 试验动物为来自江西惠大实业有限公司宁都黄鸡原种场同批次孵化的宁都黄鸡公鸡。筛选方法参考文献[4],从42周开始每隔3 d进行1次镜检,共进行3次,选择前向精子比例 < 20%,且直线前向精子比例 < 10%的个体作为弱精组样本,前向精子比例>80%,且直线前向精子比例>40%的个体作为对照组样本,每组各4只。
1.1.2 主要试剂 考马斯亮蓝G250、蛋白酶抑制剂混合物和BCA试剂盒均购自北京康为世纪生物科技有限公司;10% SDS-PAGE预制胶购自伯乐生命医学产品(上海)有限公司;肽N-糖苷酶F(PNGase F)购自NEB(北京)有限公司。
1.2 试验方法1.2.1 样品制备 采集宁都黄鸡公鸡精液,按精液体积加入蛋白酶抑制剂混合物(终浓度为1%),4 500×g 4 ℃离心10 min;吸上清,重复2~3次。采用BCA法测定上清液总蛋白浓度,-80 ℃保存。
1.2.2 蛋白质去糖基 取30 μg总蛋白,加入0.8 μL PNGase F,100 ℃消化10 min。
1.2.3 SDS-PAGE 取25 μg去糖基总蛋白,加入4×DTT buffer,变性,10% SDS-PAGE电泳(200 V·h-1),考马斯亮蓝染色,脱色。
1.2.4 胶内酶解 切下电泳胶上目标条带,置于EP管中,同时切下空白胶块作对照;加入200~400 μL 100 mmol·L-1 NH4HCO3/30% ACN脱色,清洗至透明,弃上清,冻干;每管加入90 μL 100 mmol·L-1 NH4HCO3,10 μL 100 mmol·L-1 DTT,56 ℃孵化30 min;弃上清,每管加100 μL 100% ACN,5 min后吸除;每管加入70 μL 100 mmol·L-1 NH4HCO3,30 μL 200 mmol·L-1 IAA(现配,避光保存),暗处放置20 min;弃上清,加入100 μL 100% ACN,5 min后吸去,冻干;冻干后加入5 μL 2.5~10 ng·μL-1 Trypsin溶液,置于4 ℃冰箱30~60 min,使胶块充分吸胀(弃除剩余液);再加入20~30 μL 50 mmol·L-1 NH4HCO3缓冲液(无Trypsin),pH 7.8~8.0,37 ℃反应过夜20 h左右;吸出蛋白酶解液,转移至新EP管中,原管中加入100 μL 60% ACN/0.1% TFA超声15 min,吸出溶液并入前次溶液,反复抽提3次,合并,冻干;样品制备完成。
1.2.5 质谱分析 质谱上机分析由中国农业科学院北京畜牧兽医研究所农业农村部动物遗传育种与繁殖(家禽)重点实验室完成。
1.3 试验数据分析使用Thermo Proteome Discoverer软件进行蛋白质检索和鉴定,比对红原鸡参考蛋白质组数据库(Gallus gallus(Red jungle fowl)Reference proteome);数据差异分析使用SPSS 23.0软件T检验完成;选择表达差异倍数≥2(上调)或≤0.5(下调)且错误发现率q < 0.05的蛋白为差异表达蛋白;对每个样品中蛋白相对含量进行聚类分析并进行Z值校正,利用聚类热图观察不同蛋白在不同样品间比较时的上调、下调情况;针对筛选出来的差异蛋白进行GO注释、KEGG功能富集分析和互作网络分析。
2 结果 2.1 弱精和正常鸡只筛选42周龄开始筛查宁都黄鸡公鸡的精子质量,包括精子密度、精子活力和精液量,从中筛选出对照组和弱精组个体各4只,T检验显示,弱精组个体的精子密度和精子活力极显著低于对照组(P < 0.01,表 1)。
|
|
表 1 对照组与弱精组精液质量比较 Table 1 Comparison in semen quality between control and asthenospermia groups |
总蛋白去糖基化后,SDS-PAGE结果显示,同组内平行样本间一致性较好,弱精组和对照组间的差异条带明显(图 1)。

|
M. 蛋白质相对分子质量标准;1. 弱精组混合样;2~5. 弱精组L1-L4;6~9. 对照组N1-N4;10. 对照组混合样 M.Protein marker; 1. Mixed samples in asthenospermia group; 2-5. L1-L4 in asthenospermia group; 6-9. N1-N4 in control group; 10. Mixed samples in control group 图 1 SDS-PAGE电泳结果(左)和蛋白marker分子量(右) Fig. 1 SDS-PAGE result(left) and protein marker molecular mass (right) |
本研究在弱精组与对照组中共发现584个蛋白,两组间差异表达蛋白有78个。差异蛋白聚类分析显示,蛋白被分为两个主要的簇(纵向),每一组中又被分为上调(红色)和下调(蓝色)表达蛋白,样品聚类分析结果(横向)与样品实际组别相符(图 2)。与对照组相比,弱精组中有5个精浆蛋白表达上调,包括KRT9、SEPP2、VTG2、ABHD14B和一个未知蛋白,其余73个蛋白均表达下调,其中,VNN1、PLCZ1、GK和SLC2A3等蛋白表达下调倍数较大(q < 0.05),值得注意的是,HOGA1、PAH和LCAT仅在对照组的全部样品中检测到表达,KRT9和SEPP2仅在弱精组全部样品中检测到表达(表 2)。
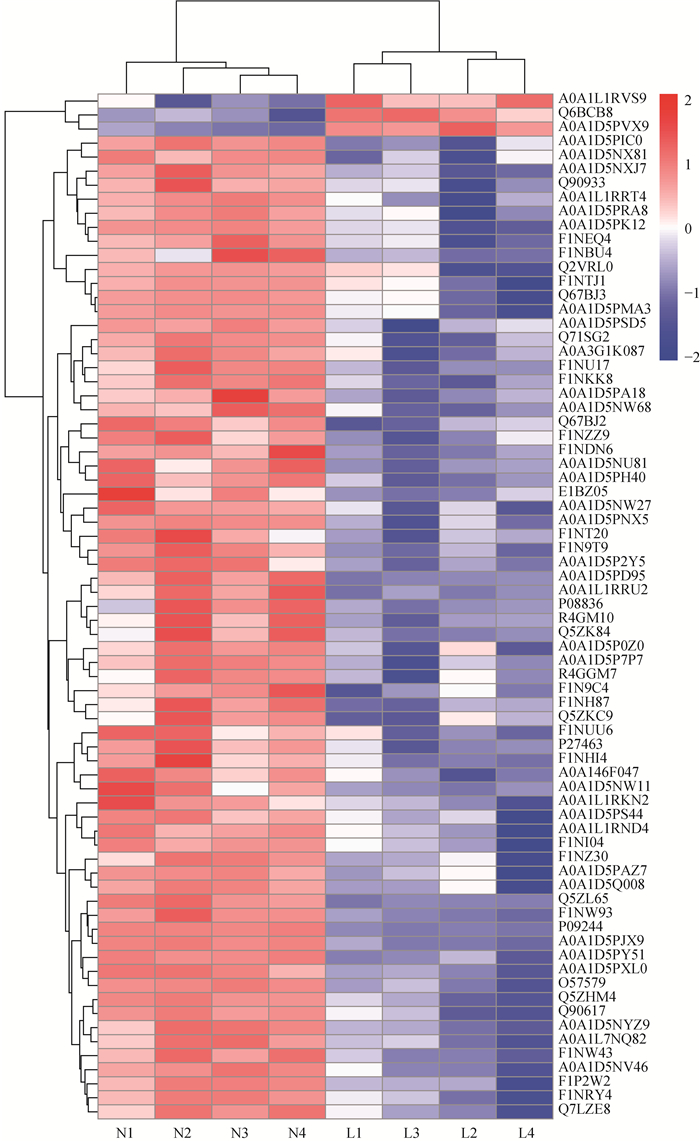
|
图 2 弱精组(L1-L4)和对照组(N1-N4)样本差异表达蛋白聚类热图 Fig. 2 Results of differentially expressed proteins cluster analysis in asthenospermia (L1-L4) and control (N1-N4) groups |
|
|
表 2 部分差异表达蛋白结果 Table 2 Partial results of differentially expressed proteins |
利用DAVID在线进行弱精组和对照组精浆差异蛋白的基因功能注释和信号通路富集分析,结果显示,差异蛋白分子功能涉及蛋白酶活性和蛋白域特异结合;涵盖的生物学过程包括糖代谢、蛋白质水解和高尔基体建立等;涉及的细胞功能包括细胞器、细胞膜、细胞质和髓鞘等(图 3)。KEGG富集分析发现,差异蛋白富集于新陈代谢、糖酵解、碳代谢、抗体合成和氨基酸合成等信号通路(图 4)。
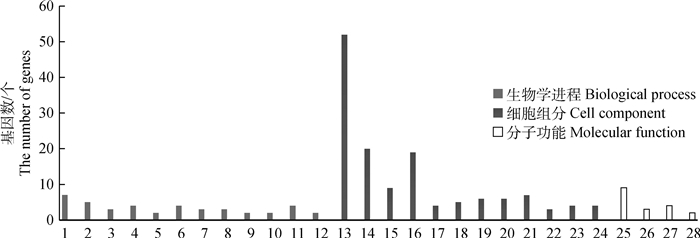
|
生物学过程:1.糖酵解过程;2.糖异生;3.中间丝形态;4.细胞骨架形态;5.甘油醛-3-磷酸生物合成;6.蛋白质水解;7.基于微管进程;8.上皮细胞分化;9.his细胞束浦肯野肌细胞黏附参与细胞通讯;10.高尔基体的建立;11.氧化还原法;12.心室心肌细胞动作电位的调节。细胞组分:13.胞外外切体;14.细胞外间隙;15.髓鞘;16.胞质溶胶;17.角蛋白丝;18.血液微粒;19.中间丝;20.细胞;21.焦点黏附;22.细胞黏附连接;23.质膜外侧;24.细胞外基质。分子功能:25.结构分子活性;26.蛋白域特异性结合;27.丝氨酸型内肽酶活性;28.β-半乳糖苷酶活性 Biological process: 1.Glycolysis process; 2.Gluconeogenesis; 3.Intermediate filament morphology; 4.Cytoskeleton morphology; 5.Glyceraldehyde-3-phosphate biosynthesis; 6.Proteolysis; 7.Microtubule based process; 8.Epithelial cell differentiation; 9.His cell bundle Purkinje myocyte adhesion and participation in cell communication; 10.Establishment of Golgi body; 11.Redox method; 12.Regulation of action potential of ventricular cardiomyocytes. Cell component: 13.Extracellular body; 14. Extracellular space; 15.Myelin sheath; 16.Cytoplasmic sol; 17.Keratin filament; 18.Blood particles; 19.Intermediate filament; 20.Cell; 21.Focal adhesion; 22.Cell adhesion; 23.Outer plasma membrane; 24.Extracellular matrix. Molecular function: 25.Structural molecular activity; 26.Protein domain specific binding; 27.Serine endopeptidase activity; 28.β-galactose glucosidase activity 图 3 GO功能注释结果 Fig. 3 Functional annotation result of gene ontology |
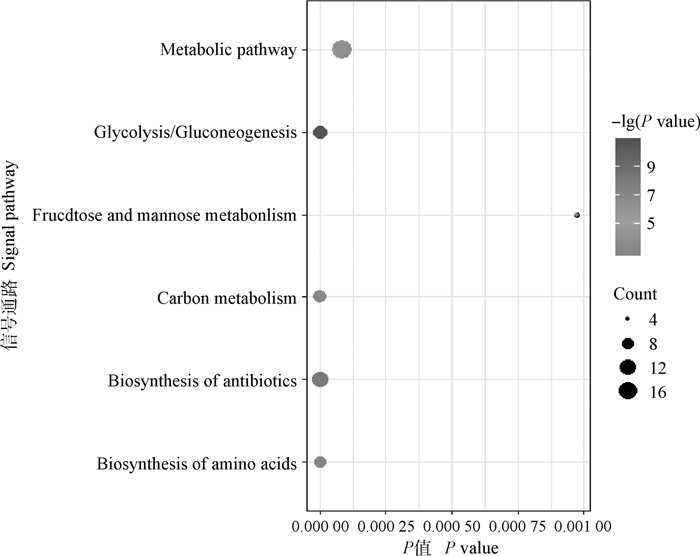
|
图 4 KEGG功能富集分析 Fig. 4 Functional enrichment analysis of KEGG |
利用SRTING在线软件分析差异蛋白间的互作情况,将互作程度为高置信度(Score≥0.7)的蛋白列出(图 5),其功能主要涵盖了糖代谢、脂代谢、ATP合成和小分子代谢等生物学功能(表 2)。
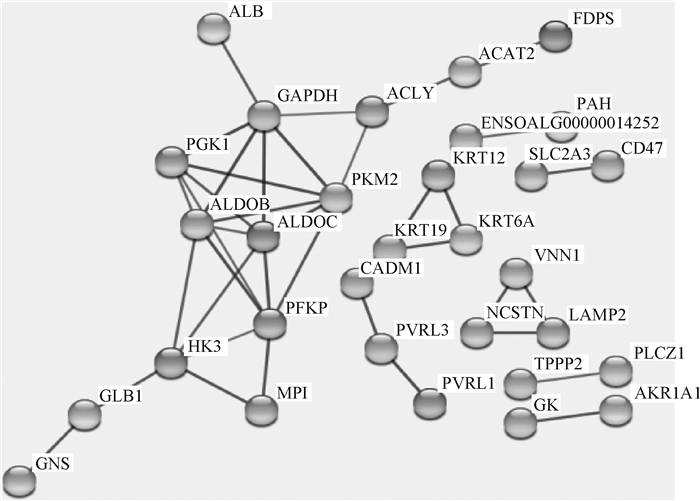
|
图 5 差异蛋白互作分析图 Fig. 5 Differential protein interaction analysis graph |
弱精症影响人和动物的繁殖能力,目前,大量研究集中于精子结构、相关基因和精子蛋白的研究等[13-16]。研究表明,鸡精子从附睾到输精管远端其运动能力逐渐增加,这点与哺乳动物不同,无需经过雌性生殖道内或外界环境的孵育过程[17],而来源于睾丸、附睾和输精管的精浆对鸡精子获能有着潜在的影响。Słowińska等[18]在火鸡精浆蛋白中累计鉴定出175种蛋白质,功能富集分析结果显示,精浆蛋白主要参与应激抵抗、免疫应激、能量代谢和细胞运动等生物学过程。Atikuzzaman等[19]以白来航、红色原鸡和杂交品系为研究对象,分析家禽长期选育对精浆蛋白质组成变化的影响,聚类分析结果显示,现代白来航鸡和杂交品系与红原鸡精浆蛋白质存在显著差异,且差异蛋白与精子受精能力和应激免疫密切相关。Li等[20]分析比较了北京油鸡高精子活力与低精子活力个体的精浆蛋白成分后认为,活性氧诱导的精子降解和线粒体功能障碍可能是精子活力低下的潜在决定因素。此外,分泌蛋白如ADGRG2对维持精子活力的作用值得进一步试验证实。本研究以宁都黄鸡弱精症和正常个体的精浆蛋白为研究对象,筛选出差异蛋白共78个,与正常组相比,弱精组中5个蛋白表现为上调,其余蛋白均表现为下调。经基因功能注释、KEGG富集和蛋白互作分析发现,差异蛋白主要集中于能量代谢、脂代谢、小分子代谢、抗体合成和氨基酸合成等功能和生物学途径,这也与精浆的功能相符合。
本研究仅在正常组或弱精组中检测到的蛋白在人或其他动物中均与能量代谢和精子功能有关。相关研究表明,HOGA1参与谷氨酸和天冬氨酸的代谢过程,将4-羟基-2-氧代戊二酸的物质分解为丙酮酸和乙醛酸盐,其分解产物参与多种能量代谢和新陈代谢,HOGA1突变与原发性高草酸尿3型(pH3)有高度的相关性[21]。PAH是苯丙氨酸羟化为酪氨酸的限速酶,PAH活性下降或显著缺乏会导致苯丙氨酸及其旁路代谢产物堆积和酪氨酸的生物合成减少[22],而酪氨酸磷酸化程度与精子超激活运动有着一定的相关性[23]。PAH基因突变还是引起人先天性、常染色体隐性遗传的氨基酸代谢病—高苯丙氨酸血症的主要原因[24]。LCAT是脂蛋白代谢过程中起关键作用的一种酶,对维持胆固醇稳态、调节胆固醇在血液循环中的转运及胆固醇在外周组织中的清除有十分重要的作用[25-27]。膜脂质主要由胆固醇、磷脂和糖脂组成,它们分别在精子生成的不同阶段发挥细胞黏附、信号转导等作用[28]。有研究表明,人精浆中总胆固醇含量与精子的密度、数量、活力以及形态均呈正相关,包括LCAT在内的多个参与胆固醇代谢和转运的标志物在所研究的组织标本中均有不同程度的表达,而精浆中胆固醇浓度与血清胆固醇、血脂水平、血清中生殖激素(FSH、LH、睾酮、雌二醇、性激素结合球蛋白、抑制素B)水平均无相关性,表明精浆中的胆固醇可能对精子发生具有重要作用[29]。KRT9基因属于细胞骨架中间丝结构蛋白家族,能与均质状基质共同构成的一种硬蛋白质,保护上皮细胞免受损坏或机械压力,KRT9致病突变是导致表皮松解性掌跖角化病的主要原因[30]。目前为止,SEPP2基因被发现仅存在于非哺乳动物基因组内[31],在鸡体内主要负责硒转运,在鸡肝和肾中,该基因的表达随饲喂硒浓度升高而增加[32-33]。有研究显示,在不同浓度硒作用下,鸡不同脑区部位中SEPP2的表达呈现不同趋势。在高硒组,鸡脊髓中SEPP2基因与对照组相比,表达呈极显著增加,而在小脑中表达呈极显著下降;而在低硒组,脊髓中SEPP2基因表达与对照组相比,表达仍呈显著的增加,而在小脑中表达与对照组相比,差异不显著;在鸡嗅球中无论是高硒还是低硒组SEPP2基因表达差异均不显著[34]。相关文献报道显示,硒有利于人和动物精子活力的水平提升[35-36],而本研究中,仅在弱精组公鸡中检测到与硒转运相关的SEPP2蛋白表达,SEPP2蛋白表达量高低与公鸡体内硒含量的高低以及精子活力的关系仍需进一步研究。除此之外,本研究结合差异表达倍数和蛋白互作等信息,筛选出若干与精子获能和代谢等作用相关,可作为研究弱精症发病机理的候选蛋白。其中,VNN1基因编码泛酰巯基乙胺酶,在其催化作用下生成的半胱胺是防止脂类过氧化的强抗氧化剂[37],VNN1基因还受到类固醇生长因子SF-1和SOX9调控,有助于调节睾丸的应激反应以及维持CoA水平[38]。PLCZ1基因是睾丸特异表达基因,它与CAPZA3、IGPB1b和TUBA3b基因具有维持精子头部形状的功能[39]。SLC2A3基因编码葡萄糖转运蛋白3,负责葡萄糖转运。研究显示,热应激通过激活ERK1/2信号通路增加HSP70表达,进而通过上调SLC2A3和LDHA的表达促进乳酸合成[40],SLC2A3在人类精子获能过程中磷酸化水平升高[41]。
本研究所得到的弱精组和对照组差异表达蛋白后续经过进一步验证并结合多组学研究,为今后发现更多与弱精症发生相关的未知蛋白或基因提供可能,也为进一步阐明弱精症的发病机理提供依据。
4 结论在宁都黄鸡弱精症和正常公鸡的精浆蛋白中筛选到78个差异表达蛋白,其中,5个蛋白在弱精组中表现为上调,其余均表现为下调。生物信息学分析显示,差异表达蛋白功能涵盖糖代谢、脂代谢、ATP合成和小分子代谢等生物学功能。
| [1] | ISO-TOURU T, WURMSER C, VENHORANTA H, et al. A splice donor variant in CCDC189 is associated with asthenospermia in Nordic Red dairy cattle[J]. BMC Genomics, 2019, 20(1): 286. DOI: 10.1186/s12864-019-5628-y |
| [2] |
陶明进, 曹艳. 血清性激素指标、精浆锌与果糖检测诊断男性不育症的应用价值[J]. 中国妇幼保健, 2019, 34(9): 2090–2092.
TAO M J, CAO Y. Serum sex hormone, seminal plasma zinc and fructose testing in the application of male infertility diagnosis[J]. Maternal and Child Health Care of China, 2019, 34(9): 2090–2092. (in Chinese) |
| [3] | HEIDARY Z, SALIMINEJAD K, ZAKI-DIZAJI M, et al. Genetic aspects of idiopathic asthenozoospermia as a cause of male infertility[J]. Hum Fertil, 2020, 23(2): 83–92. DOI: 10.1080/14647273.2018.1504325 |
| [4] |
富丽, 孙研研, 薛夫光, 等. 公鸡弱精症相关候选基因的表达分析[J]. 畜牧兽医学报, 2015, 46(6): 889–895.
FU L, SUN Y Y, XUE F G, et al. The expression of the six candidate genes for asthenospermia of the rooster[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(6): 889–895. (in Chinese) |
| [5] | USHIYAMA A, TAJIMA A, ISHIKAWA N, et al. Modification of membrane cholesterol and desmosterol in chicken spermatozoa improves post-thaw survival and prevents impairment of sperm function after cryopreservation[J]. Reprod Fertil Dev, 2018, 30(4): 591–599. DOI: 10.1071/RD17076 |
| [6] | QI X L, SHANG M Y, CHEN C, et al. Dietary supplementation with linseed oil improves semen quality, reproductive hormone, gene and protein expression related to testosterone synthesis in aging layer breeder roosters[J]. Theriogenology, 2019, 131: 9–15. DOI: 10.1016/j.theriogenology.2019.03.016 |
| [7] | MAVI G K, DUBEY P P, CHEEMA R S, et al. Characterization of fertility associated sperm proteins in Aseel and Rhode Island Red chicken breeds[J]. Anim Reprod Sci, 2019, 203: 94–104. DOI: 10.1016/j.anireprosci.2019.02.012 |
| [8] |
陶识博. 56例弱精症不育患者Y染色体微缺失情况及与其血清FSH水平关联性分析[J]. 疾病监测与控制, 2020, 14(2): 126–128.
TAO S B. Correlation Analysis of Y chromosome microdeletion and serum FSH level in fifty-six asthenospermia patients[J]. Journal of Diseases Monitor and Control, 2020, 14(2): 126–128. (in Chinese) |
| [9] | NOWICKA-BAUER K, LEPCZYNSKI A, OZGO M, et al. Sperm mitochondrial dysfunction and oxidative stress as possible reasons for isolated asthenozoo-spermia[J/OL]. J Physiol Pharmacol, 2018, 69(3): doi: 10.26402/jpp.2018.3.05. |
| [10] | CAO X D, CUI Y, ZHANG X X, et al. Proteomic profile of human spermatozoa in healthy and asthenozoospermic individuals[J]. Reprod Biol Endocrinol, 2018, 16(1): 16. DOI: 10.1186/s12958-018-0334-1 |
| [11] |
许红, 孙研研, 石雷, 等. SOX5蛋白对公鸡精子发生和精子活力的作用及其定位[J]. 畜牧兽医学报, 2018, 49(4): 718–724.
XU H, SUN Y Y, SHI L, et al. The effect of SOX5 protein in spermatogenesis and sperm motility regulation and its expression localization in the testis of roosters[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(4): 718–724. (in Chinese) |
| [12] |
刘一帆. 基于睾丸测序的鸡精子活力性状mRNA-miRNA-lncRNA转录调控研究[D]. 北京: 中国农业大学, 2018.
LIU Y F. Mechanism study on chicken sperm motility related mRNA-miRNA-lncRNA regulatory network based on testis transcriptome sequencing[D]. Beijing: China Agricultural University, 2018. (in Chinese) |
| [13] |
廉传江. 猪睾丸组织microRNA的鉴定与差异表达研究[D]. 长春: 吉林大学, 2011.
LIAN C J. Identification and differentially expressed analysis of microRNA in Porcine (Sus scrofa) testis tissue[D]. Changchun: Jilin University, 2011. (in Chinese) |
| [14] |
李鸿岩, 赵兴绪, 张勇, 等. 精子功能相关精浆蛋白质的蛋白组学研究进展[J]. 中国畜牧兽医, 2010, 37(11): 110–114.
LI H Y, ZHAO X X, ZHANG Y, et al. Progress in proteomics assessment of seminal plasma proteins with emphasis on the spermatozoa function[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(11): 110–114. (in Chinese) |
| [15] | CASTANEDA J M, HUA R, MIYATA H, et al. TCTE1 is a conserved component of the dynein regulatory complex and is required for motility and metabolism in mouse spermatozoa[J]. Proc Natl Acad Sci U S A, 2017, 114(27): E5370–E5378. DOI: 10.1073/pnas.1621279114 |
| [16] |
陈德宇, 刘利敏, 谢庆东, 等. 弱精症患者精子基因表达谱的建立及分析[J]. 癌变·畸变·突变, 2009, 21(4): 286–290.
CHEN D Y, LIU L M, XIE Q D, et al. Construction and analysis of gene-expression profiles in the sperms of patients with asthenospermia[J]. Carcinogenesis, Teratogenesis & Mutagenesis, 2009, 21(4): 286–290. DOI: 10.3969/j.issn.1004-616X.2009.04.009 (in Chinese) |
| [17] | AHAMMAD M U, NISHINO C, TATEMOTO H, et al. Maturational changes in motility, acrosomal proteolytic activity, and penetrability of the inner perivitelline layer of fowl sperm, during their passage through the male genital tract[J]. Theriogenology, 2011, 76(6): 1100–1109. DOI: 10.1016/j.theriogenology.2011.05.017 |
| [18] | SŁOWIŃSKA M, NYNCA J, ARNOLD G J, et al. Proteomic identification of turkey (Meleagris gallopavo) seminal plasma proteins[J]. Poult Sci, 2017, 96(9): 3422–3435. DOI: 10.3382/ps/pex132 |
| [19] | ATIKUZZAMAN M, SANZ L, PLA D, et al. Selection for higher fertility reflects in the seminal fluid proteome of modern domestic chicken[J]. Comp Biochem Physiol Part D Genomics Proteomics, 2017, 21: 27–40. DOI: 10.1016/j.cbd.2016.10.006 |
| [20] | LI Y L, SUN Y Y, NI A X, et al. Seminal plasma proteome as an indicator of sperm dysfunction and low sperm motility in chickens[J]. Mol Cell Proteomics, 2020, 19(6): 1035–1046. DOI: 10.1074/mcp.RA120.002017 |
| [21] | WANG X, ZHAO X, WANG X, et al. Two novel HOGA1 splicing mutations identified in a Chinese patient with primary hyperoxaluria type 3[J]. Am J Nephrol, 2015, 42(1): 78–84. DOI: 10.1159/000439232 |
| [22] | NETO E V, LARANJEIRA F, QUELHAS D, et al. Mutation analysis of the PAH gene in phenylketonuria patients from Rio de Janeiro, Southeast Brazil[J]. Mol Genet Genomic Med, 2018, 6(4): 575–591. DOI: 10.1002/mgg3.408 |
| [23] |
胡启蒙. 梅山猪和杜洛克猪精子活力和蛋白磷酸化比较研究[D]. 上海: 上海交通大学, 2014.
HU Q M. The differences in sperm motility and protein phosphorylation between Meishan boar and Duroc boar[D]. Shanghai: Shanghai Jiao Tong University, 2014. (in Chinese) |
| [24] |
陈挺, 赵正言, 蒋萍萍, 等. 高苯丙氨酸血症表型与基因型研究进展[J]. 浙江大学学报(医学版), 2018, 47(3): 219–226.
CHEN T, ZHAO Z Y, JIANG P P, et al. Research progress on phenotype and genotype of hyperphenylalaninemia[J]. Journal of Zhejiang University (Medical Sciences), 2018, 47(3): 219–226. (in Chinese) |
| [25] | VAISMAN B L, NEUFELD E B, FREEMAN L A, et al. LCAT enzyme replacement therapy reduces LpX and improves kidney function in a mouse model of familial LCAT deficiency[J]. J Pharmacol Exp Ther, 2019, 368(3): 423–434. DOI: 10.1124/jpet.118.251876 |
| [26] |
欧露, 彭乐乐, 田英, 等. 卵磷脂胆固醇酰基转移酶的研究进展[J]. 医学综述, 2015, 21(15): 2715–2717.
OU L, PENG L L, TIAN Y, et al. Research progress in lecithin cholesterol acyltransferase[J]. Medical Recapitulate, 2015, 21(15): 2715–2717. DOI: 10.3969/j.issn.1006-2084.2015.15.010 (in Chinese) |
| [27] | DONG Z, SHI H Z, ZHAO M M, et al. Loss of LCAT activity in the golden Syrian hamster elicits pro-atherogenic dyslipidemia and enhanced atherosclerosis[J]. Metabolism, 2018, 83: 245–255. DOI: 10.1016/j.metabol.2018.03.003 |
| [28] | YOKOYAMA S. Release of cellular cholesterol: molecular mechanism for cholesterol homeostasis in cells and in the body[J]. Biochim Biophys Acta, 2000, 1529(1-3): 231–244. DOI: 10.1016/S1388-1981(00)00152-9 |
| [29] | DE NEERGAARD R, NIELSEN J E, J∅RGENSEN A, et al. Positive association between cholesterol in human seminal plasma and sperm counts: results from a cross-sectional cohort study and immunohistochemical investigations[J]. Andrology, 2018, 6(6): 817–828. DOI: 10.1111/andr.12532 |
| [30] |
吕雅素. 表皮松解性掌拓角化症基因突变敲入小鼠的表型分析及靶向shRNA治疗的探索[D]. 杭州: 浙江大学, 2016.
LUE Y S. Phenotypic analysis of a gene mutation knock-in mouse model of epidermolytic palmoplanta keratoderma and investigation on mutant-specific shRNA therapy[D]. Hangzhou: Zhejiang University, 2016. (in Chinese) |
| [31] | MARIOTTI M, RIDGE P G, ZHANG Y, et al. Composition and evolution of the vertebrate and mammalian selenoproteomes[J]. PLoS One, 2012, 7(3): e33066. DOI: 10.1371/journal.pone.0033066 |
| [32] | XU J X, ZHANG C, CAO C Y, et al. Dietary selenium status regulates the transcriptions of selenoproteome and activities of selenoenzymes in chicken kidney at low or super-nutritional levels[J]. Biol Trace Elem Res, 2016, 170(2): 438–448. DOI: 10.1007/s12011-015-0470-9 |
| [33] | LI J L, SUNDE R A. Selenoprotein transcript level and enzyme activity as biomarkers for selenium status and selenium requirements of chickens (Gallus gallus)[J]. PLoS One, 2016, 11(4): e0152392. DOI: 10.1371/journal.pone.0152392 |
| [34] |
江秀清. SepSecS在硒调控鸡脑硒蛋白转录组中的作用[D]. 哈尔滨: 东北农业大学, 2016.
JIANG X Q. Effect of SepSecS on selenium regulated selenotranscriptome in chicken brain[D]. Harbin: Northeast Agricultural University, 2016. (in Chinese) |
| [35] |
齐晓龙, 武海凤, 冯泽新, 等. 硒对公鸡抗氧化和生殖激素及精子活力的影响[J]. 北京农学院学报, 2019, 34(2): 62–66.
QI X L, WU H F, FENG Z X, et al. Effects of selenium yeast on antioxidant capacity, reproductive hormones and sperm motility in roosters[J]. Journal of Beijing University of Agriculture, 2019, 34(2): 62–66. (in Chinese) |
| [36] |
洪烈城. 男性精液质量的影响因素及其与精液微量元素锌、硒的关系研究[D]. 广州: 南方医科大学, 2018.
HONG L C. Study on the influencing factors of male semen quality and its relationship with trace elements zinc and selenium in semen[D]. Guangzhou: Southern Medical University, 2018. (in Chinese) |
| [37] | DI LEANDRO D, MARAS B, SCHININÀ M E, et al. Cystamine restores GSTA3 levels in Vanin-1 null mice[J]. Free Radic Biol Med, 2008, 44(6): 1088–1096. DOI: 10.1016/j.freeradbiomed.2007.12.015 |
| [38] | GRIMMOND S, VAN HATEREN N, SIGGERS P, et al. Sexually dimorphic expression of protease nexin-1 and vanin-1 in the developing mouse gonad prior to overt differentiation suggests a role in mammalian sexual development[J]. Hum Mol Genet, 2000, 9(10): 1553–1560. DOI: 10.1093/hmg/9.10.1553 |
| [39] | GETER C B, INSELMAN A L, SUNMAN J A, et al. A missense mutation in the Capza3 gene and disruption of F-actin organization in spermatids of repro32 infertile male mice[J]. Dev Biol, 2009, 330(1): 142–152. DOI: 10.1016/j.ydbio.2009.03.020 |
| [40] |
关佳瑶. 热应激下ERK1/2信号通路对仔猪睾丸支持细胞乳酸合成的影响[D]. 重庆: 西南大学, 2017.
GUAN J Y. Role of ERK1/2 signaling pathway in heat-stimulated lactate production in immature boar Sertoli cell[D]. Chongqing: Southwest University, 2017. (in Chinese) |
| [41] |
王静. 人类精子获能的磷酸化蛋白质组学研究[D]. 南京: 南京医科大学, 2014.
WANG J. Phosphorylation proteomics of human sperm capacitation[D]. Nanjing: Nanjing Medical University, 2014. (in Chinese) |



