2. 云南农业职业技术学院, 昆明 650212
2. Yunnan Vocational and Technical College of Agriculture, Kunming 650212, China
雄性动物睾丸生精上皮细胞内的精子形成是一个极为复杂、精细调控的生物学过程,涉及精原细胞的有丝分裂、精细胞的减数分裂以及功能性精子的形成等一系列细胞的增殖和分化过程,受众多基因参与调控[1-5]。类无精症缺失基因(deleted in azoospermia like,DAZL)最早由Reijo等[6]报道,发现其和男性不育高度相关,属于DAZ家族中的主要成员,该家族由位于常染色体上的BOLL和DAZL以及位于Y染色体上的DAZ三个成员组成,在物种间高度保守,通过其产物RNA结合蛋白发挥重要功能[7-8]。DAZL特异表达于雄性动物睾丸组织,在早期胚胎发育、初级精母细胞形成和分化及睾丸发育过程中精母细胞的减数分裂中发挥重要功能[9]。此外,DAZL还能促进胚胎干细胞向生殖细胞分化[10-11],影响精子的数量、活力和形态[12]。因此,DAZL能调节人、大鼠、小鼠等哺乳动物的精子发生,调控性细胞的分化,进而影响其生殖生理[13-14],DAZL还能影响mRNA的稳定、转运/定位或翻译以及激活原本翻译沉默的特异生殖细胞的mRNA,从而控制生殖细胞的分化、生长和成熟[15]。DAZL不仅影响雄性,而且对雌性动物的生殖也有影响,能在雌性动物卵巢中表达[16],研究表明,DAZL在卵母细胞成熟过程中可作为mRNA翻译的阻遏物和激活物发挥重要作用[17]。
版纳微型猪近交系(Banna mini-pig inbred line, BMI)是已培育了40年的高度近交系封闭群体,是生命科学,特别是医学研究领域的重要资源[18]。由于多年的严格高度近交,部分公猪出现了睾丸下降延迟、隐睾、单睾、生殖器官发育迟缓、畸形等问题。基于DAZL基因在雄性哺乳动物精子发生中的独特功能,本研究以BMI为试验动物,通过RACE和RT-PCR技术扩增并拼接DAZL基因完整cDNA序列;利用生物信息学分析其核酸和蛋白质序列,确定与哺乳动物中其他物种的进化关系;利用qPCR技术确定其mRNA在15个组织中的表达水平;将猪DAZL和EGFP融合表达,检测其亚细胞定位;为深入挖掘DAZL基因与BMI生殖器官畸形关联的功能研究奠定基础。
1 材料与方法 1.1 试验动物和试剂版纳微型猪近交系(BMI)(10月龄、公猪),屠宰后采集各组织样品。RACE等试剂盒均购自TaKaRa。
1.2 方法1.2.1 引物设计 由NCBI下载DAZL基因mRNA序列(XM_003358321.2)和(NM_001081725.1),前者为猪的预测序列,后者为牛的测序序列,利用Oligo 7设计引物,信息见表 1。
|
|
表 1 引物信息 Table 1 Primers information |
1.2.2 DAZL基因全长cDNA克隆 RNAiso Plus提取BMI睾丸总RNA后,用RACE试剂盒反转录分别合成5′和3′ RACE cDNA,用常规反转录试剂盒合成第一链cDNA。用LA TaqE进行两轮RACE-PCR扩增,体系均为50 μL。第一轮5′RACE体系为16 μL ddH2O,25 μL 2×Gflex PCR Buffer,1 μL Tks Gflex DNA Polymerase,1 μL DAZL-GSP5′,5 μL UPM,2 μL 5′RACE cDNA;第二轮5′RACE反应体系为21 μL ddH2O,1 μL DAZL- NGSP5′,1 μL UPS Primer,1 μL第一轮5′RACE产物,Buffer、Polymerase同第一轮。第一轮3′RACE体系为20 μL ddH2O,1 μL DAZL-GSP3′,2 μL 3′RACE Outer Primer,1 μL 3′RACE cDNA,Buffer、Polymerase同5′第一轮;第二轮3′RACE体系为20 μL ddH2O,1 μL DAZL-NGSP3′,2 μL 3′RACE Inner Primer,1 μL第一轮3′RACE产物,Buffer、Polymerase同5′第一轮。PCR反应程序均为:94 ℃ 60 s,98 ℃ 10 s,60 ℃ 15 s,68 ℃ 1 min,循环30次。取PCR产物5 μL进行1%琼脂糖凝胶电泳检测。
1.2.3 qPCR分析 以DAZL-qPCR-F/DAZL-qPCR-R为引物,进行15个组织的qPCR定量分析,引物序列见表 1。扩增体系25 μL:2×SYBR 12.5 μL,灭RNase的H2O 8.5 μL,50 ng·μL-1 cDNA 2 μL,10 μmol·L-1的上、下游引物各1 μL。运行程序:95 ℃ 30 s,95 ℃ 5 s,58 ℃ 30 s,72 ℃ 30 s, 循环30次。采集荧光信号,结束程序。使用GraphPad Prism 8进行显著性分析并作图。
1.2.4 亚细胞定位分析 以DAZL-C-F/DAZL-C-R为引物再次扩增BMI DAZL基因,通过酶切连接法将其连接在增强型绿色荧光蛋白(EGFP)表达载体上;培养ST猪睾丸细胞系,使用Lipofectamine 2000将去除内毒素的pEGFP-C1-DAZL质粒转入ST细胞,并利用Mito Tracker对线粒体着色,使用荧光显微镜观察结果并成像。
2 结果 2.1 BMI DAZL基因cDNA全长及蛋白序列以BMI睾丸的完整cDNA、5′RACE cDNA以及3′RACE cDNA为模板,通过PCR扩增分别获得了接近1 000 bp(CDS)、250 bp(5′RACE)、1 000 bp(3′RACE)的条带(图 1),克隆测序并将序列拼接组装,获得了2 985 bp的cDNA全长序列(GenBank: KU705632)(图 2)。核酸序列分析表明,该cDNA全长序列包含888 bp CDS区、184 bp 5′UTR区和1 913 bp 3′UTR区,在3′端含有连续12个A的polyA尾巴,polyA上游21 bp处有典型的5′AATAAA3′加尾信号。
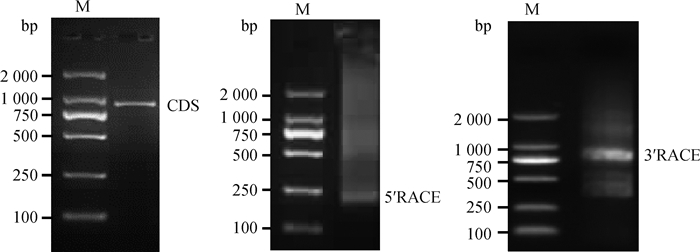
|
M. DNA相对分子质量标准 M. DL2000 ladder 图 1 BMI猪DAZL基因扩增结果 Fig. 1 The amplification results of DAZL gene in BMI pig |

|
上图为序列,下图为保守结构域,阴影部分表示RMP和DAZ结构域,下划线表示5′AATAAA3′加尾信号 The upper picture is the sequence, the lower picture is the conserved domain, shade parts indicate RMP and DAZ domains, respectively, the underline letters indicate the 5′AATAAA3′ tail signals 图 2 BMI DAZL完整cDNA序列、编码蛋白质序列及保守结构域 Fig. 2 The full-length sequences of cDNA, amino acids and conserved domains of BMI DAZL |
BMI DAZL基因编码295个氨基酸残基(AOC89050),蛋白质分子量为33 ku;无跨膜结构域,无信号肽,等电点8.9,为碱性蛋白质;33~113位氨基酸为脊椎动物的RRM和DAZ区(图 2);二级结构中无规则卷曲含量最高(59.58%),β转角含量最低(6.27%),α螺旋和延伸链结构含量分别为17%和17.15%。利用SWISS-MODEL 2xs7.1.A模板构建的三级结构见图 3,由第26~111位氨基酸构成。
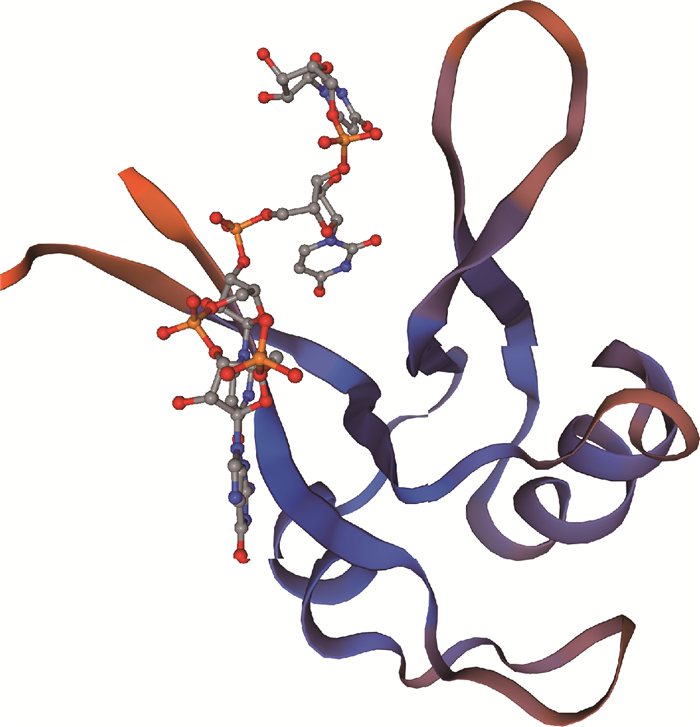
|
图 3 预测的BMI DAZL蛋白的三级结构 Fig. 3 Predicted tertiary structure of BMI DAZL protein |
利用获得的猪DAZL cDNA全长序列作为电子探针,从NCBI猪基因组Sscrofa11.1 (GCA_000003025.6)中钓取了位于猪13号染色体负链3 764 835~3 782 729 bp区的该基因座的基因组序列。之后利用sim4在线程序(http://doua.prabi.fr/software/sim4)分析猪DAZL基因的外显子/内含子结构,结果表明,猪DAZL基因长20 023 bp,含有11个外显子,ATG起始密码子起于外显子1末端,TGA终止密码子止于外显子11起始段,外显子2~10的长度和人类该基因对应外显子的长度等长(图 4)。
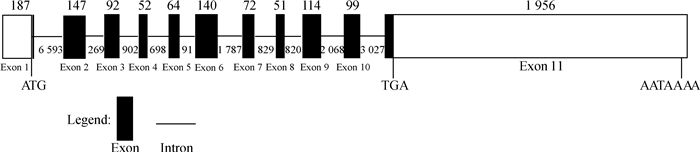
|
图 4 猪DAZL基因组结构 Fig. 4 Genomic structure of pig DAZL gene |
BMI DAZL蛋白质序列与黄牛(NP_001075194)、牦牛(ACP40088)的DAZL蛋白质序列相似性最高,分别为95.9%和94.6%,与大鼠(XP_006244539)、小鼠(BAC28187)、人(NP_001342)、长臂猿(XP_003265409)的相似性分别为92.5%、92.5%、92.5%和91.5%,比对结果见表 2,表明DAZL蛋白在进化中高度保守。利用DAZL蛋白质序列构建了7种哺乳动物的进化树,偶蹄目的黄牛和牦牛聚为一类,啮齿目的大鼠和小鼠聚为一类,二者再与BMI猪聚为一类;灵长目的人和长臂猿聚为一类,见图 5。
|
|
表 2 哺乳动物DAZL氨基酸序列的一致度、分歧度 Table 2 Identity and divergence of DAZL in some mammals |
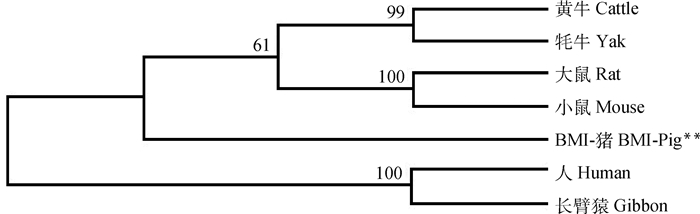
|
图 5 哺乳动物DAZL氨基酸序列进化树 Fig. 5 Phylogenetic tree of DAZL amino acid sequence in some mammals |
利用qRT-PCR技术分析了10月龄BMI公猪15种组织的DAZL mRNA表达水平(图 6),结果表明,DAZL基因在睾丸特异表达且相对表达量极显著高于其他14种组织。
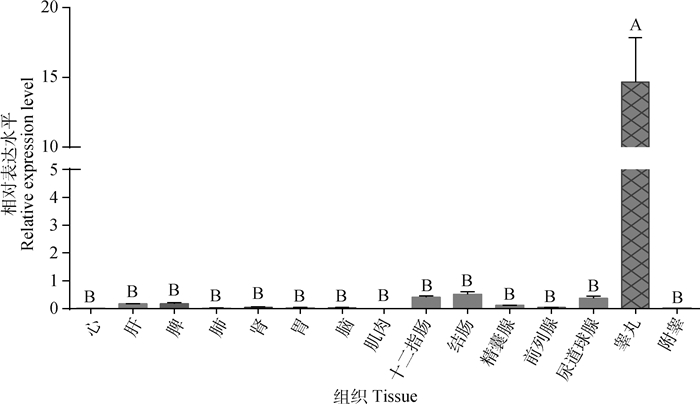
|
图 6 DAZL基因在BMI多种组织中的相对表达水平 Fig. 6 The multi-tissues relative expression level of DAZL gene in BMI |
为确定基因在细胞中发挥功能的具体位置,构建EGFP与BMI猪DAZL基因的融合表达载体,PCR扩增分别得到908和1 641 bp;双酶切后得到902和4 700 bp,均与预期相符,表明表达质粒构建成功,见图 7。
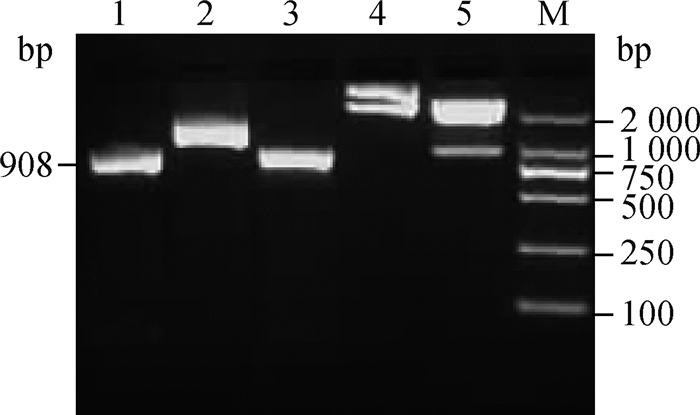
|
1. 菌液PCR产物;2. 质粒PCR (EGFP-F/DAZL-C-R)结果;3. 质粒PCR (DAZL-C-F/DAZL-C-R)结果;4. pEGFP-C1-DAZL融合表达质粒;5. XhoⅠand EcoRⅠ双酶切结果;M. DNA相对分子质量标准 1.PCR product of bacterial liquid; 2. Product of plasmid PCR (EGFP-F/DAZL-C-R); 3. Product of plasmid PCR (DAZL-C-F/DAZL-C-R); 4. pEGFP-C1-DAZL plasmid of fusion expression; 5. The digestion product by double-enzyme XhoⅠand EcoRⅠ; M. DL2000 marker 图 7 真核表达质粒pEGFP-C1-DAZL的鉴定 Fig. 7 Identification of the eukaryotic expression plasmids pEGFP-C1-DAZL |
亚细胞定位结果显示,红色荧光探针Mito Tracker靶向线粒体,从荧光的叠加图中可以看出两种颜色的荧光不重合,融合蛋白EGFP-DAZL主要存在于猪ST细胞的细胞核中,如图 8所示,表明DAZL蛋白主要在猪真核细胞细胞核中发挥功能。
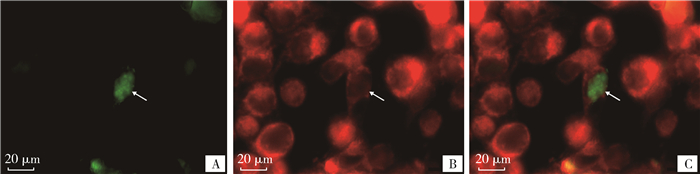
|
A. DAZL绿色荧光蛋白;B. 线粒体Mito Tracker染色;C. 绿色荧光蛋白与线粒体的叠加 A. DAZL protein labeled by green fluorescent protein; B. Mitochondria stained by Mito Tracker; C. Overlay of green fluorescent protein with mitochondria 图 8 DAZL蛋白在ST细胞中的分布 Fig. 8 The distribution of DAZL proteins in ST cells |
类无精症缺失基因DAZL在动物雌、雄配子形成过程中起着重要调控作用,影响脊椎动物的生殖与发育,其表达异常和功能丧失会导致精子发生阻滞,但其作用机制尚不清楚[10-12]。目前,该基因已在多个哺乳动物物种如人[19]、小鼠[20]、牛[21]、猪[22]、羊[23]中有研究报道。BMI猪是生命科学研究的重要模式动物,而且是人异体器官移植的重要供体,但多年的近交导致的部分雄性个体不育是扩繁群体的瓶颈,为了确定BMI DAZL的全长cDNA序列,以及在多组织(特别是睾丸)中的表达模式,本研究使用RACE技术克隆了BMI DAZL全长2 985 bp cDNA序列(包含888 bp的CDS);生物信息学分析发现,BMI DAZL蛋白质含有295个氨基酸,属于碱性蛋白,分子量为33 ku;二级结构中,无规则卷曲比例最大,超过了50%。分子功能的约束以及分子的进化导致了蛋白质序列及其结构的保守性,分析蛋白的保守结构域对于研究基因的功能非常重要,蛋白功能域预测发现,BMI DAZL蛋白含有RMP结构域和DAZ重复结构域。RMP结构域也是生殖细胞特异结合RNA蛋白的区域,由DAZL的同源物编码,是DAZ家族蛋白的祖先保守区域,它能专一性识别目标基因mRNA 3′端GUU三联体,调控目标基因的翻译;DAZ重复结构域是蛋白质-蛋白质互作区,参与蛋白质分子间的相互作用。这两个功能域是DAZL蛋白发挥功能必不可少的,可能与poly(A)结合蛋白(PABP)相互作用,并在配子发生过程中充当特定mRNA的翻译激活剂[24]。
氨基酸序列同源性比对发现,BMI猪DAZL蛋白和其他6种哺乳动物相似性均超过90%,具有高度同源性,在进化上高度保守。DAZ基因家族基因的遗传变异频率非常低,BMI猪的编码序列(KU705632)和大白猪以及中国瘦肉猪新品系DIV的序列(EU430405)完全相同[22]。Ma[25]和Zhang[22]发现,DAZL内含子7和9分别有A>G和C>A两个多态位点,与大白、长白、杜洛克3个商业猪种群的精子质量性状相关。在牛上,Sarova等[26]认为,DAZL启动区CpG岛的高度甲基化可能影响了荷斯坦奶牛杂交后代的生殖。在人上,Nailwal和Chauhan[13]利用NCBI公布的人DAZL基因序列比对发现了7个氨基酸错义突变,但只有N109T可能与男性不育相关,Chen等[27]通过比对4 000多个死精、无精患者的DAZL序列发现了两个SNPs位点:SNP260和SNP386,但只有SNP386可能与男性不育相关,且仅出现在汉族人群。DAZ家族成员BOULE仅在少数减数分裂受阻的人的内含子中存在一些SNP[28];在山羊中,BOULE基因仅在内含子中存在一个g.7254T>C中度多态位点,且可能与产仔数有关[29]。
DAZL不仅对雄性哺乳动物的睾丸发育和精子发生至关重要,而且DAZL在睾丸中的分布和作用会因物种不同而不同,而且相同的物种在不同的发育阶段有时也会不同[23, 30-34]。比如,在驴中,DAZL蛋白不仅存在于青春前期的睾丸细胞中,而且也存在于青春后期的原代精母细胞中[30];在山羊中,DAZL蛋白在青春前期和后期均有表达[31];在藏绵羊中,主要在青春后期的睾丸中表达[32];在牛中,Liu等[34]发现,犏牛睾丸的DAZL mRNA表达明显比黄牛和牦牛低;在大鼠和小鼠中,DAZL蛋白主要在成年睾丸中表达[14, 35]。本研究比较了BMI 15种组织mRNA的表达,发现DAZL基因mRNA单一在BMI猪的睾丸组织中高表达,在其他组织几乎不表达。体外荧光法检测BMI DAZL蛋白质在细胞中的表达部位,结果表明,其主要在ST细胞的细胞核中表达。本研究使用的是BMI 10月龄公猪,对于小型猪,一般4月龄就出现初情期,10月龄基本成年,也表明在成年前后高表达,与其他物种的表达趋势基本相似。
4 结论本研究利用RACE技术扩增并拼接了版纳微型猪近交系(BMI)DAZL基因的完整cDNA序列(包括5′UTR、ORF、3′UTR),从DNA角度解析了该基因的序列特征,从mRNA表达层面发现,该基因主要在BMI成年猪的睾丸中特异表达,从蛋白角度研究了其一级结构、二级结构、三级结构,通过亚细胞定位分析发现主要在细胞核中发挥功能,为进一步深入挖掘DAZL基因与BMI部分不育公猪的功能关系奠定了基础。
| [1] | LAU X, MUNUSAMY P, NG M J, et al. Single-cell RNA sequencing of the Cynomolgus macaque testis reveals conserved transcriptional profiles during mammalian spermatogenesis[J]. Dev Cell, 2020, 54(4): 548–566.e7. DOI: 10.1016/j.devcel.2020.07.018 |
| [2] | TAXIARCHI C, KRANJC N, KRIEZIS A, et al. High-resolution transcriptional profiling of Anopheles gambiae spermatogenesis reveals mechanisms of sex chromosome regulation[J]. Sci Rep, 2019, 9(1): 1481. DOI: 10.1038/s41598-018-37527-1 |
| [3] | SUN Y H, ZHU J, XIE L H, et al. Ribosomes guide pachytene piRNA formation on long intergenic piRNA precursors[J]. Nat Cell Biol, 2020, 22(2): 200–212. DOI: 10.1038/s41556-019-0457-4 |
| [4] | CAI Z L, ZHANG J Z, XIONG J, et al. New insights into the potential mechanisms of spermatogenic failure in patients with idiopathic azoospermia[J]. Mol Hum Reprod, 2020, 26(7): 469–484. DOI: 10.1093/molehr/gaaa033 |
| [5] | KOJI T, SHIBATA Y. Global changes in epigenomes during mouse spermatogenesis: possible relation to germ cell apoptosis[J]. Histochem Cell Biol, 2020, 154(2): 123–134. DOI: 10.1007/s00418-020-01900-x |
| [6] | REIJO R, LEE T Y, SALO P, et al. Diverse spermatogenic defects in humans caused by Y chromosome deletions encompassing a novel RNA-binding protein gene[J]. Nat Genet, 1995, 10(4): 383–393. DOI: 10.1038/ng0895-383 |
| [7] | ROSARIO R, ADAMS I R, ANDERSON R A. Is there a role for DAZL in human female fertility?[J]. Mol Hum Reprod, 2016, 22(6): 377–383. DOI: 10.1093/molehr/gaw024 |
| [8] | ZHANG C W, XUE P, GAO L Z, et al. Highly conserved epigenetic regulation of BOULE and DAZL is associated with human fertility[J]. FASEB J, 2016, 30(10): 3424–3440. DOI: 10.1096/fj.201500167R |
| [9] | EBERHART C G, MAINES J Z, WASSERMAN S A. Meiotic cell cycle requirement for a fly homologue of human Deleted in Azoospermia[J]. Nature, 1996, 381(6585): 783–785. DOI: 10.1038/381783a0 |
| [10] | LIN Y F, PAGE D C. Dazl deficiency leads to embryonic arrest of germ cell development in XY C57BL/6 mice[J]. Dev Biol, 2005, 288(2): 309–316. DOI: 10.1016/j.ydbio.2005.06.032 |
| [11] | YU Z, JI P, CAO J P, et al. Dazl promotes germ cell differentiation from embryonic stem cells[J]. Mol Cell Biol, 2009, 1(2): 93–103. DOI: 10.1093/jmcb/mjp026 |
| [12] | HSU C C, KUO P H, LEE I W, et al. Quantitative trait analysis suggests human DAZL may be involved in regulating sperm counts and motility[J]. Reprod Biomed, 2010, 21(1): 77–83. DOI: 10.1016/j.rbmo.2010.03.026 |
| [13] | NAILWAL M, CHAUHAN J B. In silico analysis of non-synonymous single nucleotide polymorphisms in human DAZL gene associated with male infertility[J]. Syst Biol Reprod Med, 2017, 63(4): 248–258. DOI: 10.1080/19396368.2017.1305466 |
| [14] | GONZALEZ C R, DORFMAN V B, VITULLO A D. IGF1 regulation of BOULE and CDC25A transcripts via a testosterone-independent pathway in sperma-togenesis of adult mice[J]. Reprod Biol, 2015, 15(1): 48–55. DOI: 10.1016/j.repbio.2014.10.003 |
| [15] | LIU J H, LINHER K, LI J L. Porcine DAZL messenger RNA: its expression and regulation during oocyte maturation[J]. Mol Cell Endocrinol, 2009, 311(1-2): 101–108. DOI: 10.1016/j.mce.2009.06.003 |
| [16] | TUNG J Y, ROSEN M P, NELSON L M, et al. Novel missense mutations of the Deleted-in-AZoospermia-Like (DAZL) gene in infertile women and men[J]. Reprod Biol Endocrinol, 2006, 4(1): 40. DOI: 10.1186/1477-7827-4-40 |
| [17] | YANG C R, RAJKOVIC G, DALDELLO E M, et al. The RNA-binding protein DAZL functions as repressor and activator of mRNA translation during oocyte maturation[J]. Nat Commun, 2020, 11(1): 1399. DOI: 10.1038/s41467-020-15209-9 |
| [18] | HUO J L, WANG P, MIAO Y W, et al. Isolation, sequence identification and tissue expression profile of a novel ribokinase gene (RBKS) from Chinese Banna Mini-pig Inbred Line (BMI)[J]. Afr J Biotechnol, 2012, 11(1): 46–53. DOI: 10.5897/AJB11.2885 |
| [19] | COOKE H J, LEE M, KERR S, et al. A murine homologue of the human DAZ gene is autosomal and expressed only in male and female gonads[J]. Hum Mol Genet, 1996, 5(4): 513–516. DOI: 10.1093/hmg/5.4.513 |
| [20] | RUGGIU M, SPEED R, TAGGART M, et al. The mouse Dazla gene encodes a cytoplasmic protein essential for gametogenesis[J]. Nature, 1997, 389(6646): 73–77. DOI: 10.1038/37987 |
| [21] | LIU W S, WANG A, UNO Y, et al. Genomic structure and transcript variants of the bovine DAZL gene[J]. Cytogenet Genome Res, 2007, 116(1-2): 65–71. DOI: 10.1159/000097419 |
| [22] | ZHANG Y H, MEI S Q, PENG X W, et al. Molecular characterization and SNPs analysis of the porcine Deleted in AZoospermia Like (pDAZL) gene[J]. Anim Reprod Sci, 2009, 112(3-4): 415–422. DOI: 10.1016/j.anireprosci.2008.05.069 |
| [23] | BAI M, SUN L M, ZHAO J, et al. Histological analysis and identification of spermatogenesis-related genes in 2-, 6-, and 12-month-old sheep testes[J]. Sci Nat, 2017, 104(9-10): 84. DOI: 10.1007/s00114-017-1505-1 |
| [24] | LI H X, LIANG Z Q, YANG J, et al. DAZL is a master translational regulator of murine spermato-genesis[J]. Natl Sci Rev, 2019, 6(3): 455–468. DOI: 10.1093/nsr/nwy163 |
| [25] | MA C P, LI J L, TAO H, et al. Discovery of two potential DAZL gene markers for sperm quality in boars by population association studies[J]. Anim Reprod Sci, 2013, 143(1-4): 97–101. DOI: 10.1016/j.anireprosci.2013.10.002 |
| [26] | SAROVA N, AHLAWAT S, GREWAL A, et al. Differential promoter methylation of DAZL gene in bulls with varying seminal parameters[J]. Reprod Domest Anim, 2018, 53(4): 914–920. DOI: 10.1111/rda.13187 |
| [27] | CHEN P, WANG X, XU C, et al. Association of polymorphisms of A260G and A386G in DAZL gene with male infertility: a meta-analysis and systemic review[J]. Asian J Androl, 2016, 18(1): 96–101. DOI: 10.4103/1008-682X.153542 |
| [28] | WESTERVELD G H, REPPING S, LESCHOT N J, et al. Mutations in the human BOULE gene are not a major cause of impaired spermatogenesis[J]. Fertil Steril, 2005, 83(2): 513–515. DOI: 10.1016/j.fertnstert.2004.10.013 |
| [29] | SONG X Y, LI J, FEI P F, et al. Polymorphisms within the Boule gene detected by tetra-primer amplification refractory mutation system PCR (T-ARMS-PCR) are significantly associated with goat litter size[J]. Animals, 2019, 9(11): 910. DOI: 10.3390/ani9110910 |
| [30] | LEE Y S, JUNG H J, YOON M J. Undifferentiated embryonic cell transcription factor 1 (UTF1) and deleted in azoospermia-like (DAZL) expression in the testes of donkeys[J]. Reprod Domest Anim, 2017, 52(2): 264–269. DOI: 10.1111/rda.12889 |
| [31] | LI P Z, YAN G Y, HAN L, et al. Overexpression of STRA8, BOULE, and DAZL genes promotes goat bone marrow-derived mesenchymal stem cells in vitro transdifferentiation toward putative male germ cells[J]. Reprod Sci, 2017, 24(2): 300–312. DOI: 10.1177/1933719116654990 |
| [32] | LI T T, WANG X, ZHANG H Y, et al. Gene expression patterns and protein cellular localization suggest a novel role for DAZL in developing Tibetan sheep testes[J]. Gene, 2020, 731: 144335. DOI: 10.1016/j.gene.2020.144335 |
| [33] | LIN Y M, CHEN C W, SUN H S, et al. Expression patterns and transcript concentrations of the auto-somal DAZL gene in testes of azoospermic men[J]. Mol Hum Reprod, 2001, 7(11): 1015–1022. DOI: 10.1093/molehr/7.11.1015 |
| [34] | LIU Z S, LI Q F, PAN Z X, et al. Comparative analysis on mRNA expression level and methylation status of DAZL gene between cattle-yaks and their parents[J]. Anim Reprod Sci, 2011, 126(3-4): 258–264. DOI: 10.1016/j.anireprosci.2011.05.013 |
| [35] | ROCCHIETTI-MARCH M, WEINBAUER G F, PAGE D C, et al. Dazl protein expression in adult rat testis is up-regulated at meiosis and not hormonally regulated[J]. Int J Androl, 2000, 23(1): 51–56. DOI: 10.1046/j.1365-2605.2000.00207.x |



