2. 江苏高校动物重要疫病与人兽共患病防控协同创新中心, 扬州 225009;
3. 扬州大学 教育部农业与农产品安全国际合作联合实验室, 扬州 225009
2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China;
3. Joint International Research Laboratory of Agriculture and Agri-Product Safety of the Ministry of Education of China, Yangzhou University, Yangzhou 225009, China
骨骼肌卫星细胞(muscle satellite cell,MSC)又称为肌源性干细胞,位于肌纤维肌膜和周围细胞外基质之间,即基底膜(ECM)处[1]。细胞呈扁平纺锤形或梭形,在正常条件下,肌肉卫星细胞处于静止的待激活状态,当受到外界各类刺激后被激活,修复损伤。因此,肌肉卫星细胞对骨骼肌再生和生长起着至关重要的作用。
骨骼肌卫星细胞起源尚不完全清楚,目前有两种假说:第一种为体节来源假说,即卫星细胞起源于胚层内体节来源的细胞中,这种假说被证实于鹌鹑胚胎试验[2];第二种为非生肌来源假说,De Angelis等[3]将分离胚胎背部主动脉得到的细胞移植到小鼠中,可参与肌肉再生。但成熟骨骼肌卫星细胞可以同时表达出两种标记物, 且骨骼肌卫星细胞存在异质性,表明两种起源可能都是存在的[4]。
骨骼肌卫星细胞移植作为一种治疗多种再生性疾病(肌营养不良、心力衰竭等)的手段,目前已被广泛研究[5]。因此,高纯度骨骼肌卫星细胞作为移植细胞及基因治疗工程细胞在临床上具有良好的应用前景。然而,由于其干细胞的特性,MSC含量仅占总肌细胞的2%~5%,且目前,MSC分离纯化往往需要使用细胞分选仪,操作复杂且代价较高[6],实验室分离方法一般为组织贴壁法和单双酶解法,但其耗时长、细胞存活率低、保存性差。因此,建立一个快速、简便、高效的骨骼肌卫星细胞体外培养的方法尤为重要。鉴于此,本试验在传统分离方法的基础上对提取细胞使用的酶、纯化细胞的方法以及后续的细胞分化方法进行优化,以期建立一种高效的骨骼肌卫星细胞的分离培养方法。
1 材料与方法 1.1 试验材料12胚龄SPF鸡胚来自济南鑫盛达生物工程有限公司。
1.2 主要试剂和仪器DMEM-F12高糖培养基(Gbico);胎牛血清(Gbico);青链霉素混合液(10 000 mg·L-1青霉素、10 000 mg·L-1链霉素,索莱宝);磷酸盐缓冲液PBS(自配);自制混合酶溶液(胰蛋白酶、Ⅰ型胶原酶;专利号:201911226803.8);0.25%胰蛋白酶(新赛美);CCK-8试剂(上海同仁);4%多聚甲醛(新赛美);Pax7抗体、Desmin抗体(ABclonal);兔抗鼠488标记二抗、DIPI(碧云天);TRIzol试剂(天根);反转录试剂、ChamQ Universal SYBR qPCR Master Mix(Vazyme)。其他试剂均为国产优质分析纯。所有PCR引物均由华大基因有限公司合成。
5810RR型冷冻离心机(Eppendorf);WYJ-857BR型医用净化工作台(苏州金燕净化设备厂);二氧化碳培养箱(Thermo);Sunrise-basic型酶标仪(Tecan);7500型实时荧光定量PCR仪(Applied Biosystems)。
1.3 鸡骨骼肌卫星细胞分离与培养取12胚龄SPF鸡蛋,取出鸡胚;酒精棉擦拭腿部。取髋关节以下腿部,弃筋膜、脂肪、骨骼等非肌肉组织,并用PBS缓冲液冲洗;用眼科剪剪至肉糜状,将其转移至离心管中,吹打混匀,静置5 min,弃上清;加入组织块两倍体积的自制混合酶溶液(专利号:201911226803.8),置37 ℃恒温摇床中消化30 min;待消化完毕后加入同等体积生长培养基(含15% FBS,1%青链霉素混合液的F12-DMEM培养基)终止消化。消化液依次过100目和400目细胞过滤筛。细胞悬液1 500 r·min-1离心10 min;弃上清,生长培养基重悬细胞接种于细胞培养皿内,置于37 ℃、5% CO2培养箱内。
1.4 鸡骨骼肌卫星细胞纯化及传代培养细胞沉淀用生长培养基重悬并移入培养板中,置37 ℃培养箱1 h;取未贴壁细胞悬液移入新的培养板中进行第二次贴壁,以此去除成纤维细胞;24~36 h后换液,从而完成对传统差速贴壁法的优化。
由于MSC密度达到70%后会出现融合,因此,在密度达到60%左右便可以进行传代。弃培养基并用PBS洗两遍,加入1 mL的0.25%胰蛋白酶;培养基终止消化;收集细胞悬液,1 500 r·min-1离心5 min;重悬后接种于细胞培养瓶内,置37 ℃、5% CO2培养箱内。
将细胞用0.25%胰蛋白酶消化,滴管吹落细胞,1 500 r·min-1离心5 min,收集细胞沉淀,冻存液重悬后置液氮中保存。
1.5 鸡骨骼肌卫星细胞诱导分化取培养至第二代的细胞,待其分裂生长至70%且开始融合后,弃培养基,PBS缓冲液洗涤,用诱导分化培养基(含4% FBS的DMEM-F12培养基),诱导分化2~3 d,镜下观察MSC分化情况。
1.6 鸡骨骼肌卫星细胞生长曲线的绘制取第三代细胞接种于96孔板,每孔5×103个细胞;分为7组,每组5个重复。接种时间记为第0天,之后连续7 d在固定的时间提前1 h加入10 μL CCK-8,用酶标仪测定450 nm处吸光值;以时间为横坐标,吸光值为纵坐标,绘制生长曲线。
1.7 鸡骨骼肌卫星细胞免疫荧光鉴定取第三代细胞接种于24孔板上,每孔2×104个细胞。将细胞用PBS洗涤;4%多聚甲醛固定20 min,0.2%~0.5% Triton X-100透膜处理15 min;处理完毕后用PBS洗涤;滴加5% BSA封闭1~2 h;弃封闭液,分别加入Pax7、Desmin一抗,4 ℃过夜孵育;回收一抗,PBS洗涤;加入相应的兔抗鼠488标记二抗,37 ℃孵育1 h;PBS洗涤;加入DIPI染核15 min;PBS洗涤;封片,荧光显微镜下观察。
1.8 鸡骨骼肌卫星细胞RT-PCR鉴定取第四代细胞接种于细胞培养皿中,采用Trizol法进行总RNA的提取,试剂盒反转录为cDNA;以cDNA为模板,加入Pax7、MyHC、MyoD1基因上、下游引物进行RT-PCR,引物序列见表 1;20 μL体系:10 μL SYBR MIX,上、下游引物各0.4 μL, 2 μL cDNA,无酶水补齐至20 μL。反应条件:95 ℃预变性30 s;95 ℃变性10 s, 60 ℃退火30 s, 72 ℃延伸30 s, 循环40次。产物经2%琼脂糖凝胶电泳检测,紫外成像系统采集图像。
|
|
表 1 引物序列 Table 1 Primer sequence |
结果以“平均数±标准差(Mean±SD)”表示,组间差异性采用SPSS 17.0软件中两样本均数t检验的方法进行分析比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果 2.1 鸡骨骼肌卫星细胞形态观察用优化后的差速贴壁法纯化细胞,经过24 h后细胞贴壁,图 1A中细胞生长旺盛、排列整齐、杂质较少;图 1B中细胞接触生长相互连接;图 1C中细胞在分化前呈梭形。

|
A.4倍镜下细胞形态; B.10倍镜下细胞形态; C.20倍镜下细胞形态 A. Cell morphology under ×4 microscope; B. Cell morphology under ×10 microscope; C. Cell morphology under ×20 microscope 图 1 显微镜下细胞形态 Fig. 1 Cell morphology under microscope |
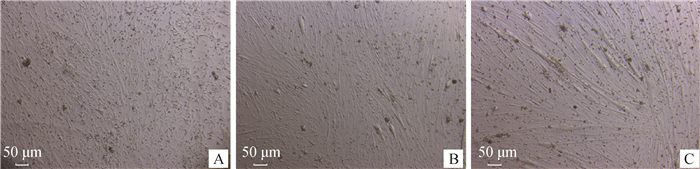
细胞生长到70%趋于融合时,诱导分化。由图 2可见,诱导分化12 h时细胞汇集成簇(图 2A);24 h时形成肌管(图 2B);48 h时肌管粗大、排列整齐(图 2C)。
|
A.诱导分化12 h; B.诱导分化24 h; C.诱导分化48 h A. Induced differentiation for 12 h; B. Induced differentiation for 24 h; C. Induced differentiation for 48 h 图 2 诱导分化后显微镜下细胞形态(40×) Fig. 2 Cell morphology under microscope after induced differentiation(40×) |
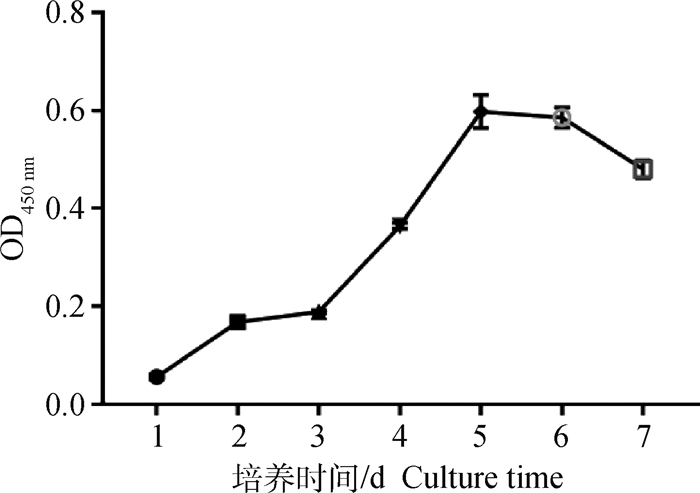
由图 3可见, 第三代的MSC生长曲线呈"S"型。其中, 第1~3天为潜伏期, 细胞增殖缓慢, 第3~5天为对数增长期, 第5天细胞数达到最大, 第5~6天细胞生长进入平台期, 第6天以后, 细胞数量减少。说明鸡骨骼肌卫星细胞在体外培养的环境下能够存活、增殖, 且生长状况良好。
|
图 3 鸡骨骼肌卫星细胞生长曲线 Fig. 3 Growth curve of chicken skeletal muscle satellite cells |
将所得鸡骨骼肌卫星细胞经台盼蓝染色并计算, 由表 2可见, (90.82±1.294)%的细胞不着色, 提示优化改良后的方法所得的细胞存活率较高。
|
|
表 2 细胞活率 Table 2 Cell viability |
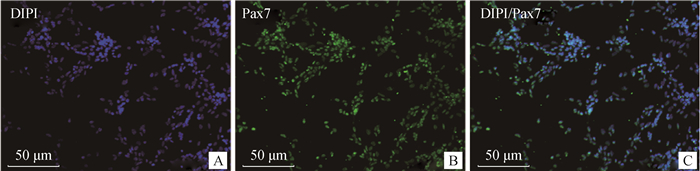
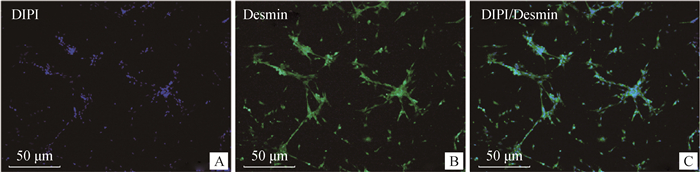
采用免疫荧光对MSC特异性标志基因Pax7、Desmin的表达进行鉴定, 倒置荧光显微镜观察拍照。由图 4可见, Pax7抗体与细胞中蛋白结合良好(图 4B), 蛋白处于细胞核中, 符合卫星细胞特性(图 4C)。由图 5可见, Desmin抗体与细胞中蛋白结合良好(图 5B), 蛋白处于细胞质中, 符合卫星细胞特性(图 5C)。
|
图 4 Pax7免疫荧光染色鉴定(20×) Fig. 4 Pax7 immunofluorescence staining identification (20×) |
|
图 5 Desmin免疫荧光染色鉴定(20×) Fig. 5 Desmin immunofluorescence staining identification (20×) |
随机选取5个视野对照核染位置及明场, 计算阳性率, 得出其纯度可达(90.44±1.264)%。
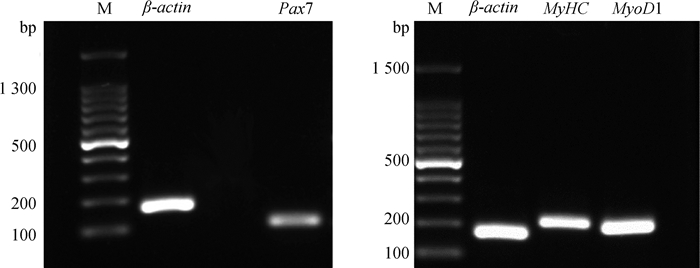
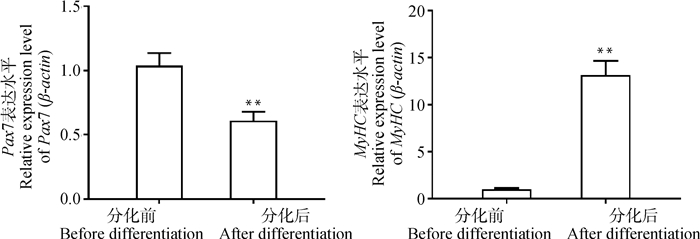
2.4 鸡骨骼肌卫星细胞RT-PCR鉴定采用RT-PCR以及凝胶电泳检测纯化后MSC静止期、分化期、增殖期的标志性基因Pax7、MyHC、MyoD1的表达量。结果如图 6显示, Pax7、MyHC、MyoD1表达阳性; 由图 7可见, 分化后静止期标志性基因Pax7表达量极显著下降(P < 0.01), 比分化前降低了1.705倍; 分化后标志性基因MyHC表达量极显著上升(P < 0.01), 是分化前的13.073倍。
|
M.DNA相对分子质量标准 M.DNA marker 图 6 Pax7、MyHC、MyoD1凝胶电泳鉴定 Fig. 6 Gel electrophoresis to identify Pax7, MyHC, MyoD1 |
|
*.P < 0.05;**.P < 0.01 图 7 分化前后Pax7、MyHC基因转录水平 Fig. 7 Pax7 and MyHC gene transcription levels before and after differentiation |
骨骼肌卫星细胞作为一种肌源质干细胞, 在机体正常情况下处于静止状态, 当受到一定的刺激时, 可瞬时活化进入细胞周期完成修复, 对维持机体稳态有非常重要的作用。长期以来, MSC都被认为是只能分化为肌管的单潜能干细胞; 但近些年的研究结果表明, MSC也具备多潜能分化能力[7-8]。Ruiz-ojeda等[9]发现, 在细胞培养时添加胰岛素、地塞米松和罗格列酮等诱导因子后, 细胞形态会发生变化并产生大量脂滴; 而添加β-甘油磷酸钠、抗坏血酸和地塞米松则可以促进钙质形成, 从而诱导MSC向成骨分化[10]。这些研究表明, MSC具有可塑性强、多潜能等优点, 可广泛应用于损伤修复以及基础研究中。而高效、便捷的分离方法便成为了后续研究的基础, 因此, 近年来分离纯化的方法在不断改进。
常用分离的方法一般为组织贴壁法[11-12]、两步消化法[13]和单酶解法[14]。最传统的为组织贴壁法, 但其需要的时间很长, 已逐渐被淘汰; 两步消化法常用胶原酶或分散酶与胰蛋白酶联合消化, 但其耗时长, 过程中易污染; 单酶解法常只用胶原酶消化, 容易消化不完全。且目前, 成功分离的MSC以人、鼠、猪为主, 在禽类中尚没有很好的分离方法。本试验采用自主研制的混合酶, 综合了胶原酶松散肌肉纤维及胰蛋白酶游离细胞的原理, 通过比例筛选, 择出消化效果最优、成本最低的配方, 最终一步消化完成MSC分离, 从而缩短分离时间, 最大限度地解决了现有技术中细胞活率低、数量少、可保存性差的缺陷和不足。但是, 酶消化法分离细胞不可避免地会导致成纤维细胞混杂其中, 因此, 为了提高MSC的纯度, 必须进行纯化。其中, 最高效的方法是采用高通量细胞分选仪器进行精密的分选纯化[6], 但需要昂贵的仪器, 且分选前还要进行繁琐的细胞标记处理, 因此并不适用于家禽MSC的纯化; 梯度离心法由于其操作复杂且MSC本身数量较少, 会使细胞在纯化过程进一步流失; 而传统差速贴壁法则根据MSC首次贴壁需要12~24 h这一特性, 一般需要进行两次2 h和一次24 h的两次更换培养皿[15]。该方法耗时较长, 因此, 本试验根据成纤维细胞在0.5~1 h就能贴壁这一特性, 在传统差速贴壁法的基础上进行优化, 也就是每隔1 h将上清转移到新培养皿中, 连续重复2~3次, 这一改进大大减少了纯化细胞的时间和工作量, 且纯化效果良好。本试验根据MSC生长到70%开始融合, 并且在外界刺激条件下会定向分化为肌管这一特性, 模拟非适宜的生长环境, 通过多次FBS浓度的筛选, 开创性地采用低血清浓度分化法, 也就是当MSC生长到70%左右时采用含4% FBS的培养基诱导分化MSC, 取代了传统的含2%的马血清与1%~2%鸡胚提取物制成的分化培养基, 在保证细胞活率的情况下, 更加简便快捷, 提高了在普通实验室操作的可行性。
目前, 对MSC的鉴定公认度最高的是免疫荧光标记法, 而Pax7是骨骼肌卫星细胞静止期的特异性标志蛋白, 可以作为鉴定细胞的标志物[16]; Desmin是构成细胞骨架的成分之一, 为肌纤维所特有, 是骨骼肌卫星细胞的基本标记[17]。因此, 本试验采用Pax7、Desmin双染, 从而初步鉴定分离的细胞为具有分化潜能的骨骼肌卫星细胞。同时, 采用RT-PCR的方法检测静止期、增殖期及分化期特异性基因Pax7、MyoD1、MyHC的表达量, 进一步证明本研究分离培养的细胞是具有多潜能分化生物学特性的骨骼肌卫星细胞。
4 结论本试验采用自制混合酶初步建立了鸡骨骼肌卫星细胞的分离方法, 并对细胞纯化和诱导方法进行了优化。同时, 在形态学和基因表达水平上对细胞进行了鉴定。为鸡骨骼肌生长发育、肉质改良、药理毒理试验、细胞移植及基因治疗工程在临床应用提供了研究基础。
| [1] | DUMONT N A, WANG Y X, RUDNICKI M A. Intrinsic and extrinsic mechanisms regulating satellite cell function[J]. Development, 2015, 142(9): 1572–1581. DOI: 10.1242/dev.114223 |
| [2] | MAURO A. Satellite cell of skeletal muscle fibers[J]. J Biophys Biochem Cytol, 1961, 9(2): 493–495. DOI: 10.1083/jcb.9.2.493 |
| [3] | DE ANGELIS L, BERGHELLA L, COLETTA M, et al. Skeletal myogenic progenitors originating from embryonic dorsal aorta coexpress endothelial and myogenic markers and contribute to postnatal muscle growth and regeneration[J]. J Cell Biol, 1999, 147(4): 869–877. DOI: 10.1083/jcb.147.4.869 |
| [4] |
汪茜, 蒲传强. 肌肉卫星细胞的研究进展[J]. 武警医学, 2007, 18(5): 381–383.
WANG Q, PU C Q. Advances in research of muscular satellite cells[J]. Medical Journal of the Chinese People's Armed Police Forces, 2007, 18(5): 381–383. (in Chinese) |
| [5] | YE L, HAIDER H K, TAN R S, et al. Transplantation of nanoparticle transfected skeletal myoblasts overexpressing vascular endothelial growth factor-165 for cardiac repair[J]. Circulation, 2007, 116(11): 113–120. |
| [6] | MOTOHASHI N, ASAKURA Y, ASAKURA A. Isolation, culture, and transplantation of muscle satellite cells[J]. J Vis Exp, 2014(86): 50846. |
| [7] | CASTIGLIONI A, HETTMER S, LYNES M D, et al. Isolation of progenitors that exhibit myogenic/osteogenic bipotency in vitro by fluorescence-activated cell sorting from human fetal muscle[J]. Stem Cell Rep, 2014, 2(1): 92–106. DOI: 10.1016/j.stemcr.2013.12.006 |
| [8] | ASAKURA A, RUDNICKI M A, KOMAKI M. Muscle satellite cells are multipotential stem cells that exhibit myogenic, osteogenic, and adipogenic differentiation[J]. Differentiation, 2001, 68(4-5): 245–253. DOI: 10.1046/j.1432-0436.2001.680412.x |
| [9] | RUIZ-OJEDA F J, RUPÉREZ A I, GOMEZ-LLORENTE C, et al. Cell models and their application for studying adipogenic differentiation in relation to obesity: a review[J]. Int J Mol Sci, 2016, 17(7): 1040. DOI: 10.3390/ijms17071040 |
| [10] | MANIATOPOULOS C, SODEK J, MELCHER A H. Bone formation in vitro by stromal cells obtained from bone marrow of young adult rats[J]. Cell Tissue Res, 1988, 254(2): 317–330. |
| [11] |
林正浩, 王讯, 李晓开, 等. 鸽骨骼肌卫星细胞的分离、培养及成肌特性[J]. 华南农业大学学报, 2019, 40(1): 53–58.
LIN Z H, WANG X, LI X K, et al. Isolation, identification and biological characteristics of skeletal muscle satellite cells in pigeons[J]. Journal of South China Agricultural University, 2019, 40(1): 53–58. (in Chinese) |
| [12] | BRUN C E, WANG Y X, RUDNICKI M A. Single EDL myofiber isolation for analyses of quiescent and activated muscle stem cells[J]. Methods Mol Biol, 2018, 1686: 149–159. |
| [13] | YANG J J, LIU H, WANG K F, et al. Isolation, culture and biological characteristics of multipotent porcine skeletal muscle satellite cells[J]. Cell Tissue Bank, 2017, 18(4): 513–525. DOI: 10.1007/s10561-017-9614-9 |
| [14] |
李方华, 弓慧敏, 冯士彬, 等. 骨骼肌卫星细胞的研究进展[J]. 中国畜牧兽医, 2010, 37(10): 25–28.
LI F H, GONG H M, FENG S B, et al. Research progress of skeletal muscle satellite cells[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(10): 25–28. (in Chinese) |
| [15] | GASTER M, BECK-NIELSEN H, SCHR∅DER H D. Proliferation conditions for human satellite cells the fractional content of satellite cells[J]. APMIS, 2001, 109(11): 726–734. DOI: 10.1034/j.1600-0463.2001.d01-139.x |
| [16] | VON MALTZAHN J, JONES A E, PARKS R J, et al. Pax7 is critical for the normal function of satellite cells in adult skeletal muscle[J]. Proc Natl Acad Sci U S A, 2013, 110(41): 16474–16479. DOI: 10.1073/pnas.1307680110 |
| [17] | LAZARIDES E, HUBBARD B D. Immunological characterization of the subunit of the 100 A filaments from muscle cells[J]. Proc Natl Acad Sci U S A, 1976, 73(12): 4344–4348. DOI: 10.1073/pnas.73.12.4344 |



