表面活性蛋白(surfactant protein,SP)是在人和动物肺泡表面、羊水等组织中存在的一类非特异免疫防御分子[1-3],动物的SP有4种,即SP-A、SP-B、SP-C和SP-D。SP-B和SP-C主要功能为降低肺泡表面液体张力,促进动物的呼吸作用[4-5];而SP-A和SP-D则是肺泡表面的防御分子,在抵御外来病原的侵入发挥重要作用[6-7]。SP-A含有5个独立的结构区:信号肽区,N端二硫键形成区(含半胱氨酸残基)、含Gly-X-Y 3肽重复结构的胶原样区(collagen-like region, CLR)、疏水α-螺旋颈区和C端球状碳水化合物识别区(carbohydrate recognition domain, CRD)(也称凝聚素区)。因其与SP-D相似都具有CLR和CRD区域,因此,同属于胶原凝聚素家族[8-9]。在Ca2+ 存在的条件下,SP-A或SP-D的CRD区可识别寡糖链并与其结合。许多病原,如细菌、囊膜病毒、真菌等,其表面的糖类物质均可被SP-A和SP-D识别并结合,引起病原的凝聚[10-12],从而抑制病原对宿主细胞的入侵。此外,这两种表面活性蛋白还有刺激单核-巨噬细胞的活性[13],促进其吞噬作用,增强其对多种病原菌的摄取,抑制病原菌的增殖。如人SP-A可抑制嗜血杆菌、绿脓杆菌、肺炎链球菌、金黄色葡萄球菌、大肠杆菌以及A型链球菌的增殖,显示明显的抗菌活性[14]。此外SP-A还可与多种病毒囊膜糖蛋白,如流感病毒的血凝素(糖蛋白)[15]、呼吸道合胞病毒的糖蛋白[16]、人类免疫缺陷病毒的gp120糖蛋白[17]等结合,介导吞噬细胞对病毒的识别,中和病毒,从而表现出抗病毒作用。
目前,关于人以及小鼠和家兔等实验动物的SP-A研究较多,但对其他动物的研究较少。笔者实验室曾就猪SP-A进行了较为系统的研究,分别制备了重组猪SP-A和分离纯化了天然猪SP-A,发现SP-A可抑制猪繁殖与呼吸综合征病毒在猪巨噬细胞中的复制,抑制多种革兰阴性/阳性菌在体外的增殖,表明猪SP-A具有明显的抗菌和抗病毒活性[18-19]。
然而目前尚未见对牛SP-A、SP-D研究的相关报道。有许多致病性细菌和病毒均可感染牛的肺部,引起肺部炎症。存在于肺泡表面的SP-A是否对侵入肺部的病原体有抑制作用尚未见报道。为探讨牛SP-A的抗菌和抗病毒活性,需要获得大量牛的SP-A。为此本试验通过亲和吸附层析法从牛肺泡灌洗液中分离纯化了牛天然SP-A,并在体外对其抗菌活性进行初步分析。
1 材料与方法 1.1 牛肺和菌株牛肺由河北保定市保北清真肉联厂提供。致病性大肠杆菌、无乳链球菌购于中国兽医药品监察所微生物菌种保藏管理中心。大肠杆菌DH5α和金黄色葡萄球菌分离株为本室保存的菌种。
1.2 主要试剂及缓冲液DMEM培养基购自Gibco公司;胎牛血清购自Hyclone公司;Sepharose-4B为Pharmacia产品;山羊抗人SP-A抗体(对牛SP-A有交叉反应)及碱性磷酸酶标记的兔抗山羊IgG(IgG-AP)购自Santa Cruz公司;丁二烯砜(butadiene sulfone)和D-麦芽糖(maltose)购自Sigma公司;其他试剂均为进口或国产分析纯。吸附缓冲液:5 mmol·L-1CaCl2,100 mmol·L-1 NaCl,50 mmol·L-1 Tris-HCl,0.02% NaN3,pH 7.4;洗涤缓冲液:含1 mol·L-1 NaCl的吸附缓冲液;洗脱缓冲液:50 mmol·L-1 Tris-HCl, 100 mmol·L-1 NaCl, 5 mmol·L-1 EDTA和0.02% NaN3, pH 7.4.
1.3 麦芽糖-Sepharose(MS)吸附胶粒的制备参考本室建立的方法进行制备[19]。首先活化Sepharose-4B胶粒:用蒸馏水润洗Sepharose-4B胶粒3次,在20 mL 0.5 mol·L-1 Na2CO3中悬浮,在搅拌下慢慢滴加2 mL丁二烯砜(双功能基团试剂),连续搅拌1 h。后用蒸馏水洗涤胶粒至中性,滤干后加入8 mL 20% D-麦芽糖溶液,搅拌30 h,使D-麦芽糖与Sepharose-4B胶粒进行共价交联。用蒸馏水洗涤,用0.5 mol·L-1 NaHCO3(含β-巯基乙醇)封闭1.5~2.0 h。最后用蒸馏水充分洗涤,并悬浮于适量的蒸馏水中,即为麦芽糖-Sepharose吸附胶粒(简称MS胶粒)。在MS胶粒中加入0.02%叠氮钠,在4 ℃条件下保存备用。
1.4 牛SP-A的粗分离用磷酸缓冲液(PBS)灌洗牛肺,收集灌洗液,在4 ℃下离心(2 000×g)10 min,将上清转入另一干净的离心管中,高速离心(13 800×g)40 min,收集富含SP-A的沉淀。向沉淀中加入20 mL含尿素的吸附缓冲液,搅拌1 h,再用吸附缓冲液在4 ℃下透析过夜,使SP-A变性、复性。在4 ℃下10 000×g离心20 min,收集上清液,即获得SP-A粗提液。
1.5 牛SP-A的纯化MS胶粒用蒸馏水润洗后,加4倍体积的吸附缓冲液平衡胶粒。加入等体积的上述制备的SP-A粗提液,室温下搅拌40 min,使胶粒吸附SP-A。1 500×g离心5 min,用5倍体积的含1 mol·L-1 NaCl的吸附缓冲液洗涤胶粒,胶粒装柱后用洗脱缓冲液洗脱SP-A。
1.6 吸附缓冲液Ca2+和洗脱缓冲液EDTA对牛肺SP-A吸附和洗脱影响的分析分别制备含不同Ca2+浓度(0、5、10、15、20、25 mmol·L-1)的吸附缓冲液和不同EDTA浓度(0、10、20、30、40、50 mmol·L-1)的洗脱缓冲液,分析Ca2+浓度对SP-A吸附的影响、EDTA浓度对SP-A洗脱的影响,以确定吸附时最适Ca2+浓度和洗脱时最适EDTA浓度。
1.7 牛SP-A纯度分析及特异性鉴定用SDS-PAGE对牛SP-A进行纯度分析,用Western blot对牛SP-A进行特异性鉴定。主要操作过程:牛SP-A样品先经过12.5 %丙烯酰胺胶进行SDS-PAGE电泳,电泳后用考马斯亮蓝对胶上的蛋白进行染色,通过观察色带是否单一和有无杂带评价样品纯度,根据色带密度估计样品的相对含量。上述牛SP-A样品经SDS-PAGE电泳后,将胶上的蛋白通过半干转装置(Bio-Rad)转到硝酸纤维膜上,用含5 %脱脂奶粉的TBST(20 mmol·L-1 Tri-HCl,pH7.4, 150 mmol·L-1 NaCl, 0.05% Tween 20)封闭过夜后,用山羊抗SP-A抗体(1∶500,一抗)和碱性磷酸酶标记的兔抗山羊IgG(IgG-AP)(1∶1 000,二抗)分别杂交后,最后用碱性磷酸酶底物,氯化硝基四氮唑蓝(NBT)和5-溴-4-氯-3-吲哚磷酸盐(BCIP)(Bio-Rad公司)进行显色,通过拍照记录检测结果。
1.8 牛SP-A生物活性的检测利用细菌凝聚试验检测SP-A的生物活性。在含不同浓度SP-A(0、100、200、300 μg·mL-1)的10 mL LB培养基中加入100 μL大肠杆菌DH5α(OD600 nm = 0.5),在37 ℃下共同培养2 h,显微镜检细菌凝聚状态,观察不同浓度的SP-A对细菌的凝聚作用,以评价SP-A的生物活性。
1.9 牛SP-A抗菌活性的检测参考张永红等[19]测定猪SP-A抗菌活性的检测方法,在含不同浓度牛SP-A(0、50、100、150、200、250 μg·mL-1)的LB液体培养基(10 mL)中,分别接种50 μL已经活化的金黄色葡萄球菌、无乳链球菌和致病性大肠杆菌(OD600 nm = 0.25),在37 ℃下,摇床培养6 h,测定细菌培养液的OD600 nm值,评价牛SP-A对不同细菌的抗菌活性。
1.10 数据统计应用SPSS18.0软件分析试验数据,以t检验进行两样本均数差异显著性分析。P < 0.05表示差异显著, P < 0.01表示差异极显著, NS表示差异不显著。
2 结果 2.1 SP-A的分离纯化及鉴定从牛肺收集的肺泡液经高速离心后得到富含有SP-A的沉淀,即牛SP-A的粗制品(图 1A)。将SP-A溶于PBS中,用MS胶粒吸附SP-A粗制品溶液中的SP-A,得到牛SP-A的纯品(图 1A)。制备的SP-A纯品经SDS-PAGE电泳后在相对分子质量为30和60 ku处出现2条带,纯度达95%以上(图 1A-2),而未经MS胶粒吸附的SP-A粗制品则呈现多个条带,说明SP-A粗制品中含有其他杂蛋白(图 1A-1)。SP-A纯品经Western blot检测,分别在相对分子质量为30和60 ku处出现2条杂交带(图 1B),该结果与SDS-PAGE分析的结果一致,证实牛肺泡液中的SP-A以两种形式存在,分别为SP-A单体蛋白和SP-A二聚体蛋白。上述结果也表明,本试验制备的MS胶粒可以特异地吸附SP-A蛋白。上述的SDS-PAGE和Western blot检测结果均显示,单体SP-A的相对分子质量为30 ku,这与牛SP-A相对分子质量的理论计算值(25 ku)有明显差异,这可能是SP-A分子中含有保守的N-糖基化位点(N178YT),在合成过程中发生糖基化,致使SP-A在SDS-PAGE电泳时蛋白的泳动速度变慢,从而出现SP-A分子量偏高的现象。
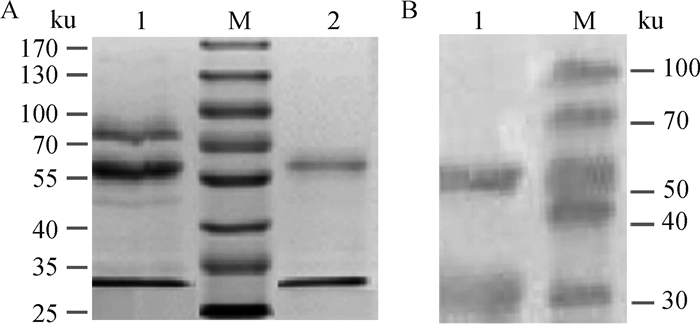
|
A. 牛SP-A蛋白的SDS-PAGE鉴定(M.蛋白质相对分子质量标准;1.肺泡洗出液样品;2.分离纯化的牛SP-A蛋白);B. 牛SP-A蛋白的Western blot鉴定(M. 预染蛋白质相对分子质量标准;1. 牛SP-A蛋白) A. Identification of bovine SP-A by SDS-PAGE (M. Protein markers; 1. Bronchoalveolar lavage fluid; 2. Purified bovine SP-A protein); B. Identification of bovine SP-A by Western blot (M. Pre-staining protein markers; 1. Bovine SP-A protein) 图 1 牛SP-A的SDS-PAGE和Western blot鉴定结果 Fig. 1 Identification of bovine SP-A with SDS-PAGE and Western blot |
2.2.1 吸附缓冲液Ca2+浓度对MS胶粒吸附牛SP-A的影响 为了确定吸附缓冲液中最适的Ca2+浓度,用含不同Ca2+浓度(0、5、10、15、20、25 mmol·L-1)的吸附缓冲液分别吸附牛肺泡液中的SP-A,分析每克湿重MS胶粒吸附SP-A的质量(mg)。由图 2A所示,在一定范围内(5~20 mmol·L-1),随着Ca2+浓度的增加,MS胶粒吸附SP-A的能力也随之增加。当Ca2+浓度超过20 mmol·L-1后,吸附能力上升趋缓,所以20 mmol·L-1的Ca2+浓度为最适Ca2+浓度。
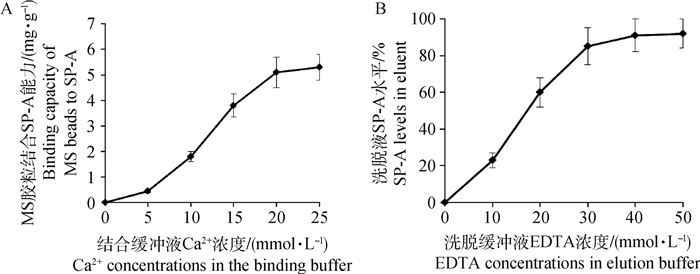
|
A. 吸附缓冲液Ca2+浓度对SP-A纯化效果的影响;B.洗脱缓冲液EDTA浓度对SP-A纯化效果的影响 A. Effects of Ca2+ concentration in the absorption buffer on SP-A purification; B. Effects of EDTA concentration in the elution buffer on SP-A purification 图 2 吸附缓冲液Ca2+和洗脱缓冲液EDTA对SP-A纯化效果的影响 Fig. 2 Effects of Ca2+in the absorption buffer and EDTA in the elution buffer on SP-A purification |
2.2.2 洗脱缓冲液EDTA浓度对牛SP-A从MS胶粒上洗脱的影响 为了确定洗脱缓冲液中最适的EDTA浓度,用含不同EDTA浓度(0、10、20、30、40、50 mmol·L-1)的洗脱缓冲液分别洗脱MS胶粒吸附的牛SP-A,分析其洗脱效果。图 2B数据显示,在较低的EDTA浓度范围内,随着洗脱缓冲液EDTA浓度的增加,洗脱后洗脱液中牛SP-A含量不断增加,当EDTA浓度在30 mmol·L-1时,SP-A的回收率达到85%。当EDTA浓度超过30 mmol·L-1后,洗脱液的SP-A含量增加不明显,因此,选择30 mmol·L-1 浓度为洗脱缓冲液中EDTA的最适用量。
2.3 牛SP-A凝聚细菌活性的分析动物SP-A均具有凝聚细菌和囊膜病毒的作用,所以对菌体或囊膜病毒的凝聚活性常用于评价SP-A是否具有生物活性。为确定制备的牛SP-A是否具有凝聚细菌的作用,利用大肠杆菌DH5α分析了牛SP-A的细菌凝聚活性。图 3结果显示,与对照组(图 3A)相比,分离纯化的牛SP-A可以使大肠杆菌发生凝聚(图 3B~D),并且随着牛SP-A浓度的增高,凝聚作用不断增强,呈剂量依赖性。可见本研究制备的牛SP-A具有促进细菌凝聚作用,表明制备的牛SP-A具有生物学活性。
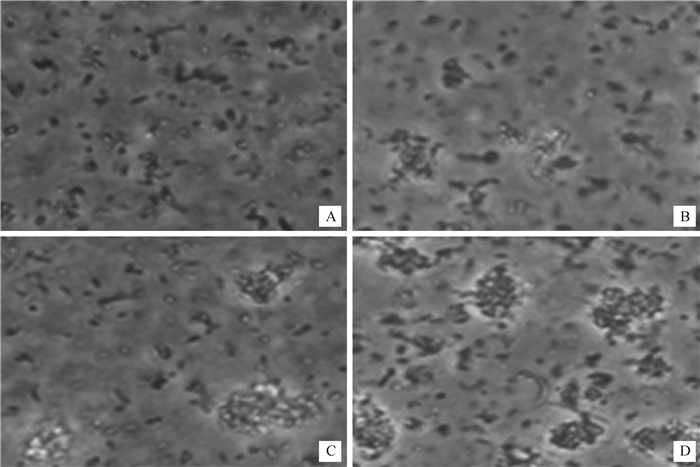
|
A. BSA(300 μg·mL-1)处理后大肠杆菌的状态;B、C、D. 用不同浓度牛SP-A(100、200、300 μg·mL-1)分别处理后大肠杆菌的状态 A. The existing state of E. coli in BSA-treated condition (300 μg·mL-1); B, C and D. The existing state of E. coli in SP-A-treated condition at the different concentrations (100, 200, 300 μg·mL-1) 图 3 牛SP-A对大肠杆菌的凝聚作用(200×) Fig. 3 Effects of bovine SP-A on E. coli aggregation(200×) |
为了确定制备的牛SP-A是否具有抗菌活性,本试验在体外分别分析了SP-A对金黄色葡萄球菌、无乳链球菌和致病性大肠杆菌增殖的影响。用不同浓度(0、50、100、150、200、250 μg·mL-1)的SP-A分别与已活化的不同细菌进行共培养,6 h后测定细菌培养液的OD600 nm值,分析牛SP-A对不同菌的抗菌活性。图 4结果显示,随着SP-A浓度的增加,3种被试细菌菌液的OD600 nm值均随之降低,即SP-A对细菌增殖的抑制作用随浓度的增加而增加(图 4A~D)。但SP-A对不同细菌的抑菌程度有所不同。当SP-A达到150 μg·mL-1时,对致病性大肠杆菌的抑菌程度已超过50%;而对于金黄色葡萄球菌和无乳链球菌(革兰阳性菌)则需更高浓度才能达到相同的抑菌效果。上述结果说明,牛SP-A对金黄色葡萄球菌、无乳链球菌和致病性大肠杆菌均有明显的抑菌活性,且对革兰阴性菌的抑菌效果高于革兰阳性菌。
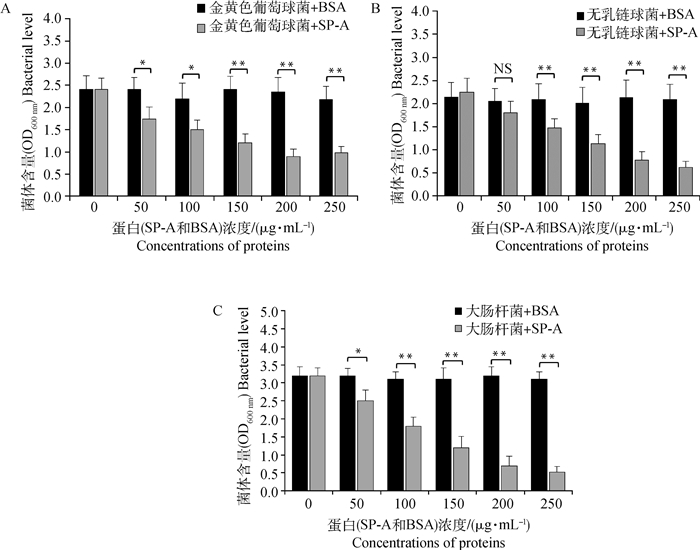
|
A. 金黄色葡萄球菌;B. 无乳链球菌;C. 致病性大肠杆菌;*. P < 0.05; **. P < 0.01 A. Staphylococcus aureus; B. Streptococcus agalactiae; C. Pathogenic E. coli; *. P < 0.05; **. P < 0.01 图 4 牛SP-A对不同细菌增殖的抑制作用 Fig. 4 Inhibition of SP-A on the proliferation of different bacteria |
本试验利用共价交联法将麦芽糖连接在Sepharose胶粒-4B上,制备成能够特异吸附SP-A的MS胶粒。然后利用制备的MS胶粒从牛肺泡洗出液中吸附牛的SP-A蛋白。结果表明,制备的MS胶粒可以特异地与SP-A结合,由此制备的SP-A纯度高达95% 以上。研究显示,牛SP-A蛋白在自然条件下以两种形式存在,即单体SP-A和二聚体SP-A。制备的SP-A具有凝聚细菌的能力,表明SP-A具有生物活性。抗菌活性检测结果显示,牛SP-A在体外对革兰阴性菌(致病性大肠杆菌)和革兰阳性菌(金黄色葡萄球菌和无乳链球菌)的增殖均有明显的抑制作用,表明牛SP-A具有抗菌活性。这项研究不仅为进一步研究牛SP-A的生物学特性及抗菌活性提供了必要的条件,同时,为奶牛及肉牛生产研发潜在的抗菌制剂开辟了新的思路。
奶牛乳腺炎是奶牛的常见病和多发病,不仅影响奶牛的健康,同时严重影响奶牛的产奶量和奶的质量,给奶牛养殖业带来严重的经济损失[20-22]。金黄色葡萄球菌、无乳链球菌和大肠杆菌等是引起奶牛乳腺炎的主要病原菌[23-24],目前,常采用抗生素药物对牛乳腺炎进行治疗,抗生素在奶牛业中滥用不仅引起病菌的耐药性问题,同时,也会引起药物在牛体内和牛乳中的残留, 给人类的食品安全带来一定的隐患[25]。为此,本研究初步分析了牛SP-A对引起牛乳腺炎的3种常见病菌的抗菌活性,旨在为未来研发牛SP-A制剂用于防治奶牛乳腺炎提供依据。
牛肺泡液中含有多种蛋白,包括4种肺泡表面活性蛋白(SP), 不同的SP蛋白理化性质有所不同[26-27],SP-A和SP-D均属于胶凝素家族成员,其分子中含有1个依赖钙离子的糖识别区域(CRD),所以在钙离子存在的条件下,SP-A和SP-D可以识别多种糖类并与之结合[28-30]。利用这一特点,本试验运用共价交联法制备了麦芽糖(糖类)与Sepharose胶粒共价交联的MS胶粒,使其能够与牛肺泡液中的SP-A或SP-D蛋白进行特异结合,从而分离纯化出牛的天然SP-A或SP-D。然而SP-B和SP-C分子中不含有CRD区域,所以不能被MS胶粒吸附。使人感兴趣是尽管SP-A和SP-D均能被MS胶粒特异吸附,但由于两者的结构和理化性质有不同之处,两者的密度也有较大的差异,所以通过高速(13 800×g)离心法就可以将二者分开[26-27],离心后的沉淀部分富含SP-A,而上清部分富含有SP-D。所以如果欲纯化牛的SP-D蛋白,也可用MS胶粒从上清中吸附SP-D。
利用MS胶粒纯化牛的SP-A,吸附缓冲液的Ca2+浓度和洗脱液的EDTA的浓度直接影响SP-A的纯化效果,为优化SP-A纯化条件,本研究分析了吸附缓冲液Ca2+浓度和洗脱缓冲液EDTA浓度对SP-A纯化效果的影响,结果显示,吸附缓冲液Ca2+浓度为20 mmol·L-1和洗脱液EDTA浓度为30 mmol·L-1,可获得良好的分离纯化效果。
动物SP-A的抗菌作用是通过多种途径实现的,但主要是SP-A对病原菌或病毒的凝聚作用,当病原菌或病毒侵入肺时,存在于肺泡表面的SP-A以及SP-D就会使病原菌或病毒发生凝聚,防止它们侵入到肺细胞。同时,被SP-A和SP-D凝聚的病原菌或病毒容易被存在于肺泡表面的肺泡巨噬细胞等吞噬细胞所吞噬,进而达到彻底清除病原菌或病毒的目的,所以SP-A和SP-D对肺吞噬细胞针对病原的吞噬有调理作用[31-32]。有研究证实,SP-A和SP-D凝聚细菌后,还可通过增加细菌细胞膜的通透性抑制细菌的增殖[14]。本试验在体外分析的SP-A对3种病菌表现的抗菌活性,推测主要是通过SP-A对细菌的凝聚作用和增加病菌细胞膜的通透性使细菌的增殖受到抑制所致。
这项研究为今后对牛SP-A的生物学特性及抗菌活性的研究提供了重要的试验依据,同时,为SP-A抗菌制剂的研发提供了新的思路。在试验中,笔者仅通过牛SP-A对引起牛乳腺炎的3种常见病菌的抗菌活性进行了初步分析,有关牛SP-A对其他病菌的抗菌活性、以及抗病毒、抗真菌的活性有待于进一步研究。
4 结论通过制备麦芽糖与Sepharose-4B凝胶共价交联的MS胶粒,成功地从牛肺泡洗出液中分离纯化出牛SP-A蛋白,纯化的牛SP-A蛋白不仅具有凝聚细菌的生物活性,同时对多种病菌表现较强的抗菌活性。
| [1] | WRIGHT J R. Immunoregulatory functions of surfactant proteins[J]. Nat Rev Immunol, 2005, 5(1): 58–68. DOI: 10.1038/nri1528 |
| [2] | HAN S, MALLAMPALLI R K. The role of surfactant in lung disease and host defense against pulmonary infections[J]. Ann Am Thorac Soc, 2015, 12(5): 765–774. DOI: 10.1513/AnnalsATS.201411-507FR |
| [3] | UJMA S, HORSNELL W G C, KATZ A A, et al. Non-pulmonary immune functions of surfactant proteins A and D[J]. J Innate Immun, 2017, 9(1): 3–11. DOI: 10.1159/000451026 |
| [4] | WHITSETT J A. Genetic disorders of surfactant homeostasis[J]. Paediatr Respir Rev, 2006, 7(Suppl 1): S240–S242. |
| [5] | NOGEE L M. Alterations in SP-B and SP-C expression in neonatal lung disease[J]. Annu Rev Physiol, 2004, 66: 601–623. DOI: 10.1146/annurev.physiol.66.032102.134711 |
| [6] | AL-QAHTANI A A, MURUGAIAH V, BASHIR H A, et al. Full-length human surfactant protein a inhibits influenza a virus infection of A549 lung epithelial cells: a recombinant form containing neck and lectin domains promotes infectivity[J]. Immunobiology, 2019, 224(3): 408–418. DOI: 10.1016/j.imbio.2019.02.006 |
| [7] | SARDESAI S, BINIWALE M, WERTHEIMER F, et al. Evolution of surfactant therapy for respiratory distress syndrome: past, present, and future[J]. Pediatr Res, 2017, 81(1-2): 240–248. DOI: 10.1038/pr.2016.203 |
| [8] | VIEIRA F, KUNG J W, BHATTI F. Structure, genetics and function of the pulmonary associated surfactant proteins A and D: The extra-pulmonary role of these C type lectins[J]. Ann Anat Anat Anz, 2017, 211: 184–201. DOI: 10.1016/j.aanat.2017.03.002 |
| [9] | AUTILIO C, PÉREZ-GIL J. Understanding the principle biophysics concepts of pulmonary surfactant in health and disease[J]. Arch Dis Child Fetal Neonatal Ed, 2019, 104(4): F443–F451. |
| [10] | MUNK H L, FAKIH D, CHRISTIANSEN L, et al. Surfactant protein-D, a potential mediator of inflammation in axial spondyloarthritis[J]. Rheumatology (Oxford, England), 2018, 57(10): 1861–1865. DOI: 10.1093/rheumatology/key187 |
| [11] | WATSON A, PHIPPS M J S, CLARK H W, et al. Surfactant proteins A and D: trimerized innate immunity proteins with an affinity for viral fusion proteins[J]. J Innate Immun, 2019, 11(1): 13–28. DOI: 10.1159/000492974 |
| [12] | CASALS C, CAMPANERO-RHODES M A, GARCÍA-FOJEDA B, et al. The role of collectins and galectins in lung innate immune defense[J]. Front Immunol, 2018, 9: 1998. DOI: 10.3389/fimmu.2018.01998 |
| [13] | SENDER V, MOULAKAKIS C, STAMME C. Pulmonary surfactant protein a enhances endolysosomal trafficking in alveolar macrophages through regulation of Rab7[J]. J Immunol, 2011, 186(4): 2397–2411. DOI: 10.4049/jimmunol.1002446 |
| [14] | WU H X, KUZMENKO A, WAN S J, et al. Surfactant proteins A and D inhibit the growth of gram-negative bacteria by increasing membrane permeability[J]. J Clin Invest, 2003, 111(10): 1589–1602. DOI: 10.1172/JCI16889 |
| [15] | MCKENZIE Z, KENDALL M, MACKAY R M, et al. Nanoparticles modulate surfactant protein A and D mediated protection against influenza A infection in vitro[J]. Philos Trans R Soc Lond B Biol Sci, 2015, 370(1661): 20140049. DOI: 10.1098/rstb.2014.0049 |
| [16] | ALCORN J L, STARK J M, CHIAPPETTA C L, et al. Effects of RSV infection on pulmonary surfactant protein SP-A in cultured human type Ⅱ cells: contrasting consequences on SP-A mRNA and protein[J]. Am J Physiol Lung Cell Mol Physiol, 2005, 289(6): L1113–L1122. DOI: 10.1152/ajplung.00436.2004 |
| [17] | GAIHA G D, DONG T, PALANIYAR N, et al. Surfactant protein A binds to HIV and inhibits direct infection of CD4+ cells, but enhances dendritic cell-mediated viral transfer[J]. J Immunol, 2008, 181(1): 601–609. DOI: 10.4049/jimmunol.181.1.601 |
| [18] |
张锋, 仲飞, 李秀锦, 等. 重组猪肺表面活性蛋白A在体外可抑制PRRSV感染宿主细胞[J]. 微生物学报, 2012, 52(5): 654–660.
ZHANG F, ZHONG F, LI X J, et al. Recombinant porcine lung surfactant protein A inhibits porcine reproductive and respiratory syndrome virus infection into host cells in vitro[J]. Acta Microbiologica Sinica, 2012, 52(5): 654–660. (in Chinese) |
| [19] |
张永红, 霍珊珊, 张建楼, 等. 猪肺泡/羊水表面活性蛋白A的分离纯化及抗菌和抗病毒活性的分析[J]. 中国兽医学报, 2017, 37(7): 1309–1315.
ZHANG Y H, HUO S S, ZHANG J L, et al. Preparation of porcine surfactant protein A from alveolar lavage fluid/aminiotic fluid and its antibacterial and antiviral activities[J]. Chinese Journal of Veterinary Science, 2017, 37(7): 1309–1315. (in Chinese) |
| [20] |
吕天星, 李松建, 郝永清. 鉴别显色培养基在奶牛乳房炎病原菌快速鉴定中的应用[J]. 畜牧兽医学报, 2019, 50(4): 851–860.
LÜ T X, LI S J, HAO Y Q. Application of a new on-farm differential chromogenic medium for fast identification of pathogens associated with mastitis in milk of dairy cows[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(4): 851–860. (in Chinese) |
| [21] |
葛影影, 张震, 何国戈, 等. 奶牛乳房炎主要致病原的分离鉴定及药敏试验[J]. 中国奶牛, 2019(3): 36–38.
GE Y Y, ZHANG Z, HE G G, et al. Isolation and identification of the main pathogens of dairy cow mastitis and drug sensitivity test[J]. China Dairy Cattle, 2019(3): 36–38. (in Chinese) |
| [22] |
王慧, 刘伯承, 段洪峰, 等. 湖南部分地区奶牛乳房炎主要病原菌的分离鉴定及药敏试验[J]. 中国奶牛, 2019(8): 36–39.
WANG H, LIU B C, DUAN H F, et al. Isolation, identification and drug susceptibility test for the main pathogenic bacteria of cow mastitis in some local areas of Hunan[J]. China Dairy Cattle, 2019(8): 36–39. (in Chinese) |
| [23] |
刘康军, 曹菲菲, 孙莹慧, 等. 奶牛乳房炎金黄色葡萄球菌的分离鉴定及毒力基因检测[J]. 中国兽医学报, 2019, 39(2): 323–327.
LIU K J, CAO F F, SUN Y H, et al. Identification and investigation on virulence determinants of Staphylococcus aureus isolated from bovine mastitis[J]. Chinese Journal of Veterinary Science, 2019, 39(2): 323–327. (in Chinese) |
| [24] |
郝景锋, 李静姬, 张宇航, 等. 吉林省奶牛乳房炎病原菌分离鉴定及药敏试验[J]. 动物医学进展, 2016, 37(12): 126–129.
HAO J F, LI J J, ZHANG Y H, et al. Isolation, identification and drug sensitivity test of pathogenic bactcria causing dairy cow mastitis in Jilin province[J]. Progress in Veterinary Medicine, 2016, 37(12): 126–129. DOI: 10.3969/j.issn.1007-5038.2016.12.026 (in Chinese) |
| [25] | OLIVER J P, GOOCH C A, LANSING S, et al. Invited review: fate of antibiotic residues, antibiotic-resistant bacteria, and antibiotic resistance genes in US dairy manure management systems[J]. J Dairy Sci, 2020, 103(2): 1051–1071. DOI: 10.3168/jds.2019-16778 |
| [26] | KARBANI N, DODAGATTA-MARRI E, QASEEM A S, et al. Purification of native surfactant protein SP-A from pooled amniotic fluid and bronchoalveolar lavage[J]. Methods Mol Biol, 2014, 1100: 257–272. |
| [27] | DODAGATTA-MARRI E, QASEEM A S, KARBANI N et al. Purification of surfactant protein D (SP-D) from pooled amniotic fluid and bronchoalveolar lavage[M]//GADJEVA M. The Complement System. Totowa: Humana Press, 2014: 273-290. |
| [28] | GOYAL S, CASTRILLÓN-BETANCUR J C, KLAILE E, et al. The interaction of human pathogenic fungi with C-type lectin receptors[J]. Front Immunol, 2018, 9: 1261. DOI: 10.3389/fimmu.2018.01261 |
| [29] | HSIEH I N, DE LUNA X, WHITE M R, et al. The Role and molecular mechanism of action of surfactant protein d in innate host defense against influenza a virus[J]. Front Immunol, 2018, 9: 1368. DOI: 10.3389/fimmu.2018.01368 |
| [30] | CARRETO-BINAGHI L E, ALIOUAT E M, TAYLOR M L. Surfactant proteins, SP-A and SP-D, in respiratory fungal infections: their role in the inflammatory response[J]. Respir Res, 2016, 17(1): 66. DOI: 10.1186/s12931-016-0385-9 |
| [31] | HOLMSKOV U, THIEL S, JENSENIUS J C. Collectins and ficolins: humoral lectins of the innate immune defense[J]. Annu Rev Immunol, 2003, 21: 547–578. DOI: 10.1146/annurev.immunol.21.120601.140954 |
| [32] | ABDEL-RAZEK O, NI L, YANG F Y, et al. Innate immunity of surfactant protein a in experimental otitis media[J]. Innate Immun, 2019, 25(7): 391–400. DOI: 10.1177/1753425919866006 |



