2. 江苏大学生命科学学院, 镇江 212013;
3. 江苏大学食品与生物工程学院, 镇江 212013
2. School of Life Sciences, Jiangsu University, Zhenjiang 212013, China;
3. School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China
猪鼻支原体(Mycoplasma hyorhinis,Mhr)是猪上呼吸道的一种常见寄生菌,在猪群中广泛流行,尤其是在断奶仔猪及生长猪中感染率极高[1-2]。猪群感染猪鼻支原体后通常不表现出明显的临床症状,但特定情况下可以引起仔猪的多发性浆膜炎、关节炎、结膜炎、中耳炎等症状,在大猪中则主要引发关节炎。同时猪鼻支原体在临床中常与其他病原菌混合感染,有报道显示猪鼻支原体在与猪繁殖与呼吸综合征病毒或猪圆环病毒共感染时会加重对肺部的损伤[3-4]。目前国内养猪行业对猪鼻支原体认识较少,因其与副猪嗜血杆菌感染引起的临床症状极其相似,常因误诊导致猪鼻支原体在猪场内的持续性感染,造成猪群生产性能下降,产生严重经济损失。由于猪鼻支原体感染的普遍性,临床常用抗生素已产生了一定的耐药性[5]。目前猪鼻支原体致病机制尚不清楚,缺乏特异性血清诊断试剂盒,亦无商品化疫苗。
感染模型是致病机制研究和疫苗研发的基础。从20世纪60年代开始陆续有多家研究机构对猪鼻支原体发病模型开展研究,但至今为止尚没有标准的攻毒方法或菌株。本实验室从安徽某猪场的发病猪关节液中分离得到一株支原体,经PCR鉴定为猪鼻支原体。将该菌株人工感染自然分娩不吃初乳猪(SF-pCD猪,snatch-farrowed, porcine-colostrum-deprived pigs),成功建立感染模型,为研究猪鼻支原体的致病机制及疫苗奠定了重要基础。
1 材料与方法 1.1 材料1.1.1 主要试剂 PCR试剂、DNA分子量标准购自南京诺维赞生物科技股份有限公司;细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;KM2培养基由本实验室自制。
1.1.2 实验动物 试验猪选用1月龄SF-pCD猪(杜长大三元猪)9头,由本实验室和南京洲邦生物科技有限公司联合培育。试验猪使用前经PCR/RT-PCR方法和血清抗体检测确定猪伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪鼻支原体(Mhr)、猪肺炎支原体(Mhp)抗原、抗体均为阴性。
1.1.3 病料来源 病料采集自安徽省合肥市某猪场,该猪场20%左右保育猪出现精神沉郁、被毛粗乱、食欲下降,跛行及关节肿大的症状,期间使用阿莫西林、头孢噻呋等药物治疗无效,判断可能存在猪鼻支原体强毒株感染。选择关节肿胀的发病猪,于无菌条件下抽取关节液用于后续支原体的分离。
1.2 方法1.2.1 猪鼻支原体的分离培养 将关节液用KM2培养基稀释10倍,用0.45 μm无菌滤器过滤除菌,将滤液按1∶10的比例接种入KM2培养基中,置37 ℃培养箱中静置培养,每天观察培养物颜色的变化。
1.2.2 培养物鉴定 待培养物由红色变为黄色后,利用细菌基因组提取试剂盒按说明书操作进行培养物基因组的提取。采用本实验室以P37基因为靶标建立的套式PCR方法进行初步鉴定[6],然后利用英聪[7]以16S rRNA基因为靶标建立的PCR方法进行再次确认,所用到的引物序列及PCR参数见表 1。测序后通过BLAST与NCBI公布的猪鼻支原体相关序列信息进行比对。
|
|
表 1 引物信息 Table 1 Primers information |
1.2.3 菌株纯化及形态观察 将新鲜的猪鼻支原体分离株菌液作104倍稀释后涂布KM2固体平板,置于37 ℃静置培养,进行连续3次单克隆。3次单克隆后用体视显微镜观察菌落形态。将新鲜培养的猪鼻支原体菌液离心收集菌体,用磷酸缓冲液洗涤两次后,用2.5%戊二醛电镜固定液固定,用于电镜观察其显微形态。
1.2.4 MLST分析 参考文献方法设计合成猪鼻支原体6个看家基因(adk、gmk、gltX、rpoB、dnaA、gyrB)的引物序列,进行多位点序列分型(multilocus sequence typing,MLST)分析[8]。PCR扩增结束后将扩增产物进行测序,测序结果上传至https://pubmlst.org/进行比对,获得6个看家基因的等位基因数值和ST型。
1.2.5 分离菌株的致病性试验 选择9头1月龄SF-pCD三元猪进行猪鼻支原体分离株毒力评价试验。试验方法:试验猪随机分为感染组(6头)和对照组(3头),置于隔离房间分开饲养。将新鲜培养的HEF16分离株10倍浓缩后,用磷酸盐缓冲液进行重悬,感染组经气管注射、腹腔注射、肺内注射和滴鼻四个途径共接种109CCU(color change unit,颜色变化单位)的HEF16分离株[9]。每个途径接种2 mL(2.5×108 CCU),共8 mL。对照组用磷酸盐缓冲液取代菌液,采用相同途径及体积进行接种。攻毒后每天观察临床症状并记录,每周测定试验猪体重并采血。血清样品用本实验室建立的Vlp-ELISA猪鼻支原体血清抗体检测方法进行IgG抗体的测定[10]。试验猪于感染21 d后剖杀,观察病变情况,参考文献[11]方法进行关节炎、心包炎、胸膜炎、腹膜炎的评分,具体评分方法见表 2。采集含有支气管的肺组织块进行组织固定,切片后HE染色(hematoxylin-eosin staining),观察。同时,采集心、肺、扁桃体和关节积液进行猪鼻支原体的再分离,并对分离得到的猪鼻支原体进行MLST分析。如试验过程中出现死亡,立即剖检。
|
|
表 2 猪鼻支原体感染猪剖检评分表 Table 2 Postmortem observations and scores of relative lesion severity in pigs infected with Mycoplasma hyorhinis |
1.2.6 统计方法 利用SPSS20.0软件对试验数据进行T检验分析,P < 0.05判定为具有明显统计学差异。
2 结果 2.1 猪鼻支原体分离鉴定及分离株MLST分析采集发病猪关节液样品,用KM2培养基进行菌株分离,平行接种3瓶,结果均在第3天时出现由红变黄的颜色变化。收集培养物,提取核酸后分别进行猪鼻支原体P37基因及16S rRNA基因的PCR鉴定,结果如图 1所示。3份分离培养物的P37基因的外套和内套PCR产物分别在627和346 bp处出现了特异性条带(图 1 A、B),16S rRNA基因PCR产物在826 bp处出现特异性条带(图 1 C)。取产物进行测序,将测序结果与GenBank中收录的猪鼻支原体序列进行比对,相似性为99.3%,证明分离获得的菌株为猪鼻支原体。将其中一份培养物接种固体培养基,5 d后生长出单菌落,菌落呈典型的煎蛋状,直径约0.4 mm(图 1 D)。离心收集菌体,用扫描电镜观察,菌体呈球形,直径约400 nm(图 1 E)。对单克隆后的菌株再次进行PCR验证,并正式命名为猪鼻支原体HEF16株。
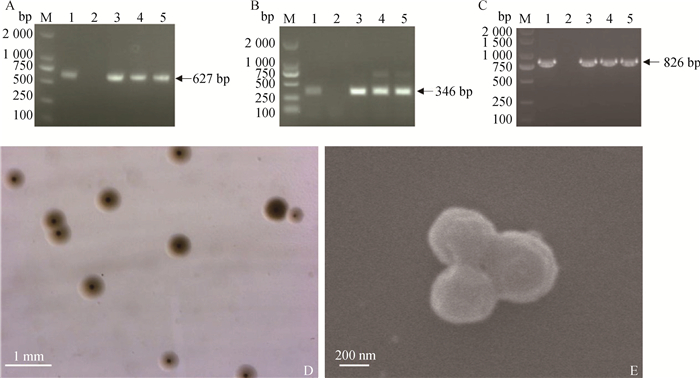
|
A. P37 PCR外套试验结果;B. P37 PCR内套试验结果;C. 16S rRNA PCR试验结果;M. DL2000 DNA相对分子质量标准; 1.猪鼻支原体阳性对照;2.阴性对照;3~5.3份分离样品;D. 固体菌落形态;E. 菌体形态(扫描电镜) A. The result of first round P37 nest-PCR; B. The result of second round P37 nest-PCR; C. The result of 16S rRNA PCR; M. DL2000 DNA marker; 1. M. hyorhinis positive control; 2. Negative control; 3-5. Three isolates; D. The colony of Mycoplasma hyorhinis isolates; E. The cell morphology of Mycoplasma hyorhinis isolates (scanning electron microscope) 图 1 猪鼻支原体分离株PCR鉴定结果及分离株菌落、菌体形态观察 Fig. 1 PCR identification results of Mycoplasma hyorhinis isolates and observation of the colony and morphology of Mycoplasma hyorhinis isolates |
对猪鼻支原体HEF16株的6个看家基因进行测序,结果通过网站中的数据库进行比对,确定了6个看家基因的等位基因数值,具体见表 3。ST型在现有数据库中未有匹配,说明该猪鼻支原体分离株属于一个新基因型。
|
|
表 3 猪鼻支原体分离株MLST分型结果 Table 3 MLST results of Mycoplasma hyorhinis isolates |
猪鼻支原体感染组6头猪在感染后的第4天开始均出现后肢关节轻度肿胀,食欲出现下降;感染7 d后,多个关节出现中度肿大,跛行,食欲差,关节触诊疼痛;感染14 d后,试验猪行动困难,消瘦,卧地不起,2头试验猪死亡;攻毒后17 d,另有1头试验猪死亡,剩余3头试验猪中有2头状态出现好转。对照组的3头猪均未出现临床症状(图 2 A、B)。

|
A.感染组关节肿胀;B.对照组关节;C.日增重变化测定(**.P < 0.01) A. The joint swelling of infected pigs; B. Control group; C. Average daily weight gain (DWG) by group for study(**.P < 0.01) 图 2 猪鼻支原体感染猪关节肿胀情况观察及日增重变化测定 Fig. 2 Observation of joint swelling in pigs infected with Mycoplasma hyorhinis and average daily weight gain by group for study |
猪鼻支原体感染后每7 d对试验猪进行体重测定,结果发现感染组猪生长缓慢,在攻毒后14~21 d体重下降明显,平均日增重为负值。对照组试验猪随着日龄的增加,体重持续上升,平均日增重达0.3 kg·d-1。攻毒组与对照组猪日增重差异显著(图 2 C)。
2.3 感染猪的大体与显微病变观察猪鼻支原体感染21 d后对试验猪进行剖检观察,并进行关节炎、心包炎、胸膜炎以及腹膜炎评分。由表 4可知,攻毒组6头猪均出现了胸膜炎、心包炎及关节炎,其中2头猪出现了腹膜炎(图 3A)。胸膜炎、心包炎、关节炎以及腹膜炎的平均分值分别为2.3分、2.3分、3分以及0.5分。对照组3头猪均未出现上述病变,评分均为0。
|
|
表 4 猪鼻支原体感染猪剖检发病情况及评分统计 Table 4 Postmortem lesion scores in Mycoplasma hyorhinis infected pigs |
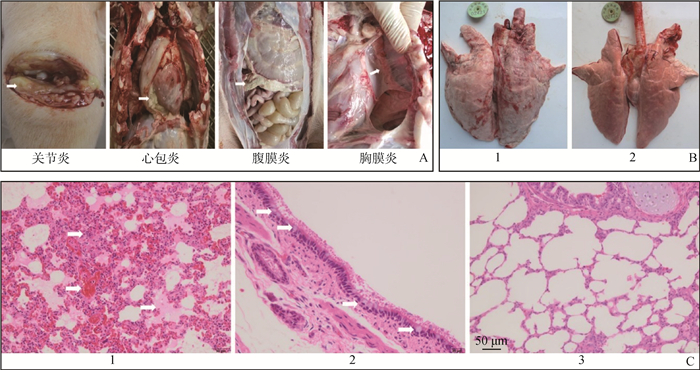
|
A. 猪鼻支原体感染猪剖检病变观察;B. 猪鼻支原体感染猪肺剖检病变(1.感染组肺;2.对照组肺);C.猪鼻支原体感染猪肺病理组织学变化(1.感染组,肺间质增宽,肺淤血,肺泡内有浆液性和纤维素性渗出;2.感染组,气管上皮细胞杯状细胞增多;3.对照组肺,无明显变化;200×) A. Mycoplasma hyorhinis-related changes at autopsy in infected pigs; B. Observation of lung lesion in pigs infected with M. hyorhinis (1. The lung of the pigs of the infected group; 2. The lung of the pigs of the control group; ), C. Histopathological changes of lung in M. hyorhinis infected pigs (1. The infected group, lung interstitial widening, pulmonary congestion, serous and fibrinous exudation in the alveoli; 2. The infected group, increased goblet cells of tracheal; 3. The control group, no obvious change; 200×) 图 3 感染猪的大体与显微病变观察 Fig. 3 Observation of gross and microscopic changes in infected pigs |
肺肉眼变化显示感染组肺黏连严重,未出现肺脏实变的情况(图 3 B1)。显微观察显示肺间质增宽,淤血,肺泡内有浆液性和纤维素性渗出(图 3 C1),支气管黏膜层杯状细胞增多(图 3 C2)。对照组肉眼观察及显微观察均没有明显病变(图 3 B2、C3)。
2.4 感染猪血清中的抗体检测试验猪于感染后每周采血一次,进行血清IgG抗体的检测,结果如图 4所示,感染组猪血清的猪鼻支原体IgG抗体水平在感染14 d后开始上升,21 d维持在一定的抗体水平,而对照组试验猪IgG抗体水平无明显变化,组间具有统计学差异(P < 0.05)。
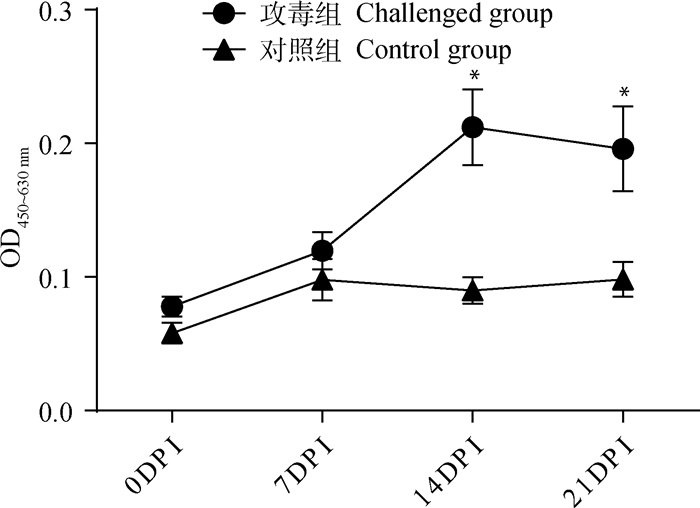
|
DPI. 感染后时间/d;*.P < 0.05 DPI. Day post infection; *.P < 0.05 图 4 猪鼻支原体感染后血清IgG抗体变化 Fig. 4 The change of IgG antibody in sera from the infected pigs |
试验猪剖检后,采集心、肺、扁桃体、关节积液进行猪鼻支原体的再分离,具体结果如表 5所示。感染组试验猪均能从至少一处组织中再分离到猪鼻支原体,而对照组均未分离到。进一步将分离到的菌株按“1.2.4”的方法进行MLST分型,结果显示,从感染猪中再分离得到的菌株MLST分型结果均与HEF16株一致。
|
|
表 5 猪鼻支原体再分离情况统计(分离数/总数) Table 5 M. hyorhinis re-isolation after challenge(Isolated number/total number) |
猪场猪鼻支原体的感染率非常高,主要定植于上呼吸道,根据文献报道断奶仔猪鼻拭子中的检出率可达98%[1]。支原体对营养要求高,且生长缓慢,一般从临床样品中分离培养支原体成功率较低。与猪肺炎支原体等其他猪支原体相比,猪鼻支原体具有更强的能量获取能力及代谢能力[12],其临床分离率能达到7%~35%[13]。值得注意的是,大多数情况下猪鼻支原体感染阳性猪并不表现出临床症状,一般认为致病性的出现与猪鼻支原体突破呼吸道实现全身性感染有关。但全身性感染的出现究竟是取决于菌株毒力的差异还是动物状态差异导致的条件性致病,目前尚不清楚。从呼吸道分离的猪鼻支原体菌株其致病力可能并不强。本研究选择从发病猪的关节病变部位采集样品进行菌株分离,更容易分离到致病性强的菌株。
发病模型是开展感染机制研究或疫苗研发的基础,虽然猪鼻支原体人工感染模型已有一些报道,但目前尚无标准的试验方法,使用的接种途径也各不相同。已经报道的接种途径包括滴鼻、腹腔注射、静脉注射、气管内注射[3, 14-18]。多途径联合接种的方式也常见于猪鼻支原体的人工感染,如气管内和腹腔注射联用[3, 17]、滴鼻、腹腔注射和静脉注射联用[18]。本试验也采用了多途径联用的方式接种分离株,包括滴鼻、腹腔注射、气管内注射和肺内注射,试验猪感染后出现精神沉郁、食欲下降的现象,感染后体重增长缓慢,后期甚至出现下降。感染4 d后部分试验猪的关节开始肿胀,并出现跛行,一周后所有感染猪均出现较为严重的临床症状,这与文献报道的症状出现时间相近[14, 19],剖检观察到明显的多发性浆膜炎和关节炎的典型发病症状,说明通过滴鼻、腹腔注射、气管内注射、肺内注射四种途径联合接种可以成功诱导疾病的发生。然而,四种途径联合接种存在操作繁琐、对试验猪应激较大的问题,在后续试验中将对比各途径感染效果,优化攻毒途径。Martinson等[18]对滴鼻、腹腔注射、静脉注射三种途径及其联合接种的感染效果进行了比较,数据显示感染途径的差异会导致发病程度和组织的差异性,静脉注射更容易诱导多发性浆膜炎,腹腔注射则可增加关节肿胀和跛行的概率,而仅滴鼻不容易诱导发病,联合接种效果优于单一途径接种。该研究也可为我们后续的接种途径优化提供一定参考。
猪鼻支原体感染对肺部的影响尚存在争议。猪鼻支原体最早被认为是猪地方性肺炎(enzootic pneumonia,EP)的致病菌之一。Lin等[16]报道,通过气管注射的方法感染6周龄试验猪,剖检时肺部可见类似于猪肺炎支原体感染产生的虾肉样病变;危艳武等[17]将猪鼻支原体感染巴马猪后,剖检同样可见肺部呈虾肉样病变。但肺产生肉变的数据并不多,数据的差异有可能来自毒株或接种途径两个方面。本研究选择联合接种途径时,作者参考猪肺炎支原体的接种方式,有针对性地加入了下呼吸道攻毒常用的气管内注射和肺内注射的方式进行联合接种,以充分考察肺部的病变情况。结果显示:感染组均出现了胸膜炎,显微病理检查发现肺间质增宽,肺泡内有浆液性和纤维素性渗出,支气管黏膜层杯状细胞增多,但所有感染猪的肺均未出现肉变。由此作者推测肺部肉变的发生可能更多是因为毒株毒力或嗜性的差异,而非接种途径。
猪场中猪鼻支原体感染主要引起断奶仔猪发病,表现为多发性浆膜炎及关节炎,而大猪很少发病,或仅出现轻微的关节炎症状[20]。因此仔猪更适合用于建立猪鼻支原体发病模型。根据流行病学数据,猪鼻支原体在仔猪断奶后会出现感染率的上升[1],因此本试验选取1月龄刚断奶仔猪用于感染试验,更接近猪鼻支原体自然状态下的临床感染时间。在感染的过程中出现了3头试验猪死亡,感染状态较为严重,一方面可能是由于该分离毒株的毒力较强,另一方面感染采用了4种途径联用,感染剂量也较大,也可能是造成临床症状严重的原因之一。在试验的后期,可以观察到有部分感染猪临床症状出现了一定程度的减轻。Barden等[14]报道,通过腹腔注射途径感染猪鼻支原体后试验猪在第7天出现临床症状,持续至1个月时症状出现减轻,感染时间至6个月时症状基本消失。猪场中大猪感染猪鼻支原体也较少发病或症状较轻[20]。这些数据提示机体自身的免疫系统有可能能够逐渐对猪鼻支原体产生一定的抵抗和清除[21]。在猪肺炎支原体的感染中也存在类似的情况,当猪感染254 d后,病原会被彻底清除[22]。由于本次试验周期较短,未能继续观察感染症状的转归。后续可以对感染猪进行长时间的症状观察和病原检测,猪肺炎支原体上的净化经验也可能为猪鼻支原体的净化提供参考。
猪鼻支原体在临床中常见于混合感染,为了防止试验猪存在其他病原的影响,本试验采用猪伪狂犬病病毒、猪繁殖与呼吸综合征病毒、猪鼻支原体、猪肺炎支原体多病原的阴性试验猪。同时,作者采集了试验猪组织对3种可引起猪鼻支原体感染类似症状的病原(即副猪嗜血杆菌、胸膜肺炎放线杆菌和链球菌),进行了PCR检测,结果均为阴性。菌株的再分离试验也进一步证实本次动物试验中试验猪的发病症状是由猪鼻支原体HEF16感染引发的。
4 结论从临床感染发病猪关节积液中分离得到一株猪鼻支原体,菌株经过纯化和鉴定后,采用多途径联用的方式感染1月龄三元SF-pCD猪,试验猪在感染后出现关节肿胀、跛行等临床症状,剖检可见典型的多发性浆膜炎和关节炎症状。强毒株的获得和发病模型的建立可为猪鼻支原体致病机理研究及疫苗研发奠定基础。
| [1] |
CLAVIJO M J, MURRAY D, OLIVEIRA S, et al. Infection dynamics of Mycoplasma hyorhinis in three commercial pig populations[J]. Vet Rec, 2017, 181(3): 68. DOI:10.1136/vr.104064 |
| [2] |
PILLMAN D, NAIR M S, SCHWARTZ J, et al. Detection of Mycoplasma hyorhinis and Mycoplasma hyosynoviae in oral fluids and correlation with pig lameness scores[J]. Vet Microbiol, 2019, 239: 108448. DOI:10.1016/j.vetmic.2019.108448 |
| [3] |
CHEN D J, WEI Y W, HUANG L P, et al. Synergistic pathogenicity in sequential coinfection with Mycoplasma hyorhinis and porcine circovirus type 2[J]. Vet Microbiol, 2016, 182: 123-130. DOI:10.1016/j.vetmic.2015.11.003 |
| [4] |
LEE J A, OH Y R, HWANG M A, et al. Mycoplasma hyorhinis is a potential pathogen of porcine respiratory disease complex that aggravates pneumonia caused by porcine reproductive and respiratory syndrome virus[J]. Vet Immunol Immunopathol, 2016, 177: 48-51. DOI:10.1016/j.vetimm.2016.06.008 |
| [5] |
BEKÖ K, FELDE O, SULYOK K M, et al. Antibiotic susceptibility profiles of Mycoplasma hyorhinis strains isolated from swine in Hungary[J]. Vet Microbiol, 2019, 228: 196-201. DOI:10.1016/j.vetmic.2018.11.027 |
| [6] |
白方方, 武昱孜, 靳蒙蒙, 等. 巢式PCR检测猪鼻支原体方法的建立及应用[J]. 中国兽医学报, 2013, 33(7): 1007-1010. BAI F F, WU Y Z, JIN M M, et al. Establishment and application of nested PCR assay for detection of Mycoplamsa hyorhinis[J]. Chinese Journal of Veterinary Science, 2013, 33(7): 1007-1010. (in Chinese) |
| [7] |
英聪. 应用PCR法检测生物制品中支原体污染[D]. 武汉: 华中农业大学, 2013. YING C. The polymerase chain reaction to detect Mycoplasma in biological products[D]. Wuhan: Huazhong Agricultural University, 2013. (in Chinese) |
| [8] |
TRVEB B, CATELLI E, LUEHRS A, et al. Genetic variability and limited clonality of Mycoplasma hyorhinis in pig herds[J]. Vet Microbiol, 2016, 191: 9-14. DOI:10.1016/j.vetmic.2016.05.015 |
| [9] |
韦艳娜, 熊祺琰, 刘茂军, 等. 不同因素对猪肺炎支原体颜色变化单位测定的影响[J]. 中国兽药杂志, 2012, 46(8): 8-10. WEI Y N, XIONG Q Y, LIU M J, et al. Effects of various factors on the color changing units assay of Mycoplasma hyopneumoniae[J]. Chinese Journal of Veterinary Drug, 2012, 46(8): 8-10. (in Chinese) |
| [10] |
王佳, 熊祺琰, 华利忠, 等. 猪鼻支原体血清抗体间接ELISA检测方法的建立[J]. 畜牧兽医学报, 2017, 48(10): 1932-1938. WANG J, XIONG Q Y, HUA L Z, et al. Establishment of an indirect ELISA detection method for Mycoplasma hyorhinis[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(10): 1932-1938. DOI:10.11843/j.issn.0366-6964.2017.10.016 (in Chinese) |
| [11] |
MAGNUSSON U, WILKIE B, MALLARD B, et al. Mycoplasma hyorhinis infection of pigs selectively bred for high and low immune response[J]. Vet Immunol Immunopathol, 1998, 61(1): 83-96. DOI:10.1016/S0165-2427(97)00132-3 |
| [12] |
FERRARINI M G, SIQUEIRA F M, MUCHA S G, et al. Insights on the virulence of swine respiratory tract mycoplasmas through genome-scale metabolic modeling[J]. BMC Genomics, 2016, 17(1): 353. DOI:10.1186/s12864-016-2644-z |
| [13] |
FRⅡS N F, FEENSTRA A A. Mycoplasma hyorhinis in the etiology of serositis among piglets[J]. Acta Vet Scand, 1994, 35(1): 93-98. DOI:10.1186/BF03548359 |
| [14] |
BARDEN J A, DECKER J L, DALGARD D W, et al. Mycoplasma hyorhinis swine arthritis. 3. Modified disease in Piney Woods swine[J]. Infect Immun, 1973, 8(6): 887-890. DOI:10.1128/iai.8.6.887-890.1973 |
| [15] |
GOIŠ M, KUKSA F, SKIŠÁK F. Experimental infection of gnotobiotic piglets with Mycoplasma hyorhinis and Bordetella bronchiseptica[J]. Zentralbl Veterinarmed B, 1977, 24(2): 89-96. |
| [16] |
LIN J H, CHEN S P, YEH K S, et al. Mycoplasma hyorhinis in Taiwan: diagnosis and isolation of swine pneumonia pathogen[J]. Vet Microbiol, 2006, 115(1-3): 111-116. DOI:10.1016/j.vetmic.2006.02.004 |
| [17] |
危艳武, 张志慧, 黄立平, 等. 猪鼻支原体的分离鉴定及其对巴马猪的致病性试验[J]. 中国兽医科学, 2014, 44(3): 227-234. WEI Y W, ZHANG Z H, HUANG L P, et al. Isolation and identification of Mycoplasma hyorhinis strain and its pathogenicity in Bama pigs[J]. Chinese Veterinary Science, 2014, 44(3): 227-234. (in Chinese) |
| [18] |
MARTINSON B, ZOGHBY W, BARRETT K, et al. Efficacy of an inactivated Mycoplasma hyorhinis vaccine in pigs[J]. Vaccine, 2018, 36(3): 408-412. DOI:10.1016/j.vaccine.2017.11.063 |
| [19] |
MARTINSON B, MINION F C, JORDAN D. Development and optimization of a cell-associated challenge model for Mycoplasma hyorhinis in 7-week-old cesarean-derived, colostrum-deprived pigs[J]. Can J Vet Res, 2018, 82(1): 12-23. |
| [20] |
ROOS L R, NAIR M S, RENDAHL A K, et al. Mycoplasma hyorhinis and Mycoplasma hyosynoviae dual detection patterns in dams and piglets[J]. PLoS One, 2019, 14(1): e0209975. DOI:10.1371/journal.pone.0209975 |
| [21] |
PALZER A, HAEDKE K, HEINRITZI K, et al. Associations among Haemophilus parasuis, Mycoplasma hyorhinis, and porcine reproductive and respiratory syndrome virus infections in pigs with polyserositis[J]. Can Vet J, 2015, 56(3): 285-287. |
| [22] |
PIETERS M, PIJOAN C, FANO E, et al. An assessment of the duration of Mycoplasma hyopneumoniae infection in an experimentally infected population of pigs[J]. Vet Microbiol, 2009, 134(3-4): 261-266. DOI:10.1016/j.vetmic.2008.08.016 |
(编辑 白永平)



