2. 山东省农业科学院畜牧兽医研究所, 济南 250100
2. Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Sciences, Jinan 250100, China
种蛋孵化过程中产生一定比例腐蛋,爆裂后会污染雏鸡,造成很大的经济损失。腐蛋是种蛋孵化时感染细菌所造成的,这些细菌多属假单胞菌属,主要是铜绿假单胞菌(Pseucdomonas aeruginosa,PA)[1]。目前,孵化场对于腐蛋的防治手段主要是对种蛋的消毒,即种蛋从鸡舍内捡出后立即用高锰酸钾、福尔马林熏蒸,此种方法会对人和雏鸡造成一定的危害[2-3],而且无法净化种鸡垂直传播到种蛋的病原菌。
铜绿假单胞菌是临床中常见的固有抗药性较强的条件致病菌,能够引起畜禽及人类较高的死亡率。铜绿假单胞菌固有抗药性机制包括外膜通透性低、多种药物的外排泵等[4-6]。近年来,随着抗生素的滥用,获得性抗药性机制导致的抗药率逐渐增加,抗药谱也越来越广[7],使用噬菌体控制铜绿假单胞菌重新受到重视。细菌抗药性最致命的问题是细菌发生变异,且抗药性可在细菌中相互传播,但是抗生素是无法随之变化的化学品[8-13]。相比于抗生素,噬菌体数量庞大,种类多,在体内可变异,资源丰富,容易解决抗药性问题;且对宿主菌特异性强,少量的噬菌体就能够在短期内大量繁殖,使宿主菌裂解死亡,在体内会随着宿主菌的清除而被机体代谢,有较高的安全性[14-21]。噬菌体的筛选比新型抗生素的研发要容易很多,使得噬菌体在治疗抗药性铜绿假单胞菌方面有很大的优势。
铜绿假单胞菌噬菌体在腐蛋防治上还未见相关研究。本研究分离了腐蛋中铜绿假单胞菌及其裂解性噬菌体,测定了噬菌体的生物学特性,处理了用铜绿假单胞菌感染的SPF种蛋,取得了噬菌体对腐蛋的较好防治效果。
1 材料与方法 1.1 试验材料1.1.1 主要试剂 血琼脂平板购自青岛海博生物公司;固体LB培养基、半固体LB培养基、液体LB培养基均购自MDBio公司;SM缓冲液等为本实验室保存。
1.1.2 菌株和噬菌体 铜绿假单胞菌PA-MH12分离自烟台某孵化场腐蛋,噬菌体MH12-Q是以PA-MH12为宿主菌分离自小清河济南段河水。
1.1.3 SPF鸡蛋 购自山东省农业科学院家禽研究所SPF鸡场。
1.2 噬菌体MH12-Q的基本生物学特性1.2.1 噬菌体MH12-Q的效价测定 将培养到指数期的细菌与噬菌体原液各1 mL混合,加入20 mL LB液体培养基中,37 ℃振荡培养过夜,10 000 r·min-1离心10 min。
取上清液,经0.22 μm滤膜过滤,取100 μL滤液用SM液进行10倍梯度稀释,分别将噬菌体滤液与指数期菌液各100 μL混匀后混入5 mL LB半固体琼脂,倾注并完整覆盖于的20 mL LB固体琼脂平板(9 cm直径)上,置于37 ℃温箱中倒置培养4~6 h,选择适当可数的平板,计数噬菌斑,计算噬菌体效价(pfu·mL-1)=噬菌斑个数×稀释倍数/所取样品体积(mL)[22]。
1.2.2 噬菌体MH12-Q的电镜形态 将噬菌体MH12-Q扩增后,在青岛大学附属医院进行电镜观察。
1.2.3 噬菌体MH12-Q的最适生长温度测定 将噬菌体原液10倍梯度到适合浓度,取100 μL与等量培养至指数期的菌液混匀后,再与45 ℃的5 mL LB半固体琼脂混合,倾倒固体琼脂平板(9 cm直径)上,分别置于20、30、37、40和50 ℃下培养4~6 h,计算噬菌体效价。
1.2.4 噬菌体MH12-Q的pH稳定性测定 用pH计将LB液体培养基的pH分别调整为3、4、5、6、7、8、9、10、11、12,高压灭菌,各取100 μL与等体积的噬菌体原液混合,置于37 ℃作用2 h,之后分别取100 μL与等量培养至指数期的菌液混合,用双层平板法测定效价。
1.2.5 噬菌体MH12-Q最佳感染复数测定 将培养至指数期的宿主菌菌液浓度调整为1.0×108 cfu·mL-1。设置MOI分别为0.001、0.01、0.1、1、10,将已测定效价的噬菌体液按照比例加入到菌液中(菌液和噬菌体液各500 μL),混匀,37 ℃,200 r·min-1振荡培养5 h。将混合培养物10 000 r·min-1离心10 min,测噬菌体效价最高的感染复数即为最佳感染复数[23]。
1.2.6 噬菌体MH12-Q的一步生长曲线 将噬菌体液与宿主菌液各500 μL以最佳感染复数需要的比例混合,37 ℃孵育15 min。10 000 r·min-1离心1 min,将沉淀用LB液体洗涤3次。加入10 mL 37 ℃预热的LB液体培养基,混匀后迅速置于37 ℃摇床中振荡培养。每隔10 min进行一次取样,测定噬菌体的效价[24]。
1.2.7 噬菌体MH12-Q的完全裂解效价(CLC)测定 将细菌浓度调整为105cfu·mL-1加入96孔板的一排9孔位中,用排枪吸取2 μL加于固体琼脂检测板上,短时晾干后,取等量于96孔板中将效价为1013pfu·mL-1噬菌体液横向10倍梯度稀释后,分别加于其上,培养12~18 h后观察结果。
1.3 噬菌体基因组测序分析使用E.Z.N.AⓇ DNA kit(OMEGA)提取噬菌体总DNA,采用Illumina TruSeqTM Nano DNA Sample Prep Kit方法构建文库(上海美吉生物技术公司),经过统计有效数据进行序列拼接后进行基因组序列分析。
在RAST网站上进行噬菌体基因组功能注释,之后利用Geneious软件将注释结果添加到基因组上,进行分析。
1.4 铜绿假单胞菌噬菌体对腐蛋的防治1.4.1 铜绿假单胞菌感染SPF鸡蛋 将铜绿假单胞菌划线于LB琼脂培养基,刮取菌落混于无菌生理盐水中,用无菌棉棒蘸取涂于蛋表面,共21枚蛋;对照组用生理盐水处理6枚蛋。每3个蛋1组,用灭菌报纸包裹防止交叉污染,置于孵化箱,铜绿假单胞菌处理组每隔2~3 d取出1组(3枚蛋),使用酒精棉擦净蛋壳表面,用无菌镊子打碎蛋壳,观察鸡蛋感染情况,同时取内容物接种于血琼脂平板观察细菌生长情况。
1.4.2 铜绿假单胞菌噬菌体防治腐蛋试验 将铜绿假单胞菌单菌落混于2 mL无菌生理盐水制成菌悬液;噬菌体培养液经PEG8000沉淀,测其效价为1013pfu·mL-1。试验分4组,每组20枚蛋:①铜绿假单胞菌处理组为取菌悬液涂于蛋表面;②噬菌体处理组为用噬菌体涂抹蛋表面;③防治组为用噬菌体与铜绿假单胞菌共同涂抹于蛋表面;④空白组无处理,无菌报纸包裹。置于孵化箱,20 d后观察鸡蛋状况。
1.4.3 噬菌体对不同浓度铜绿假单胞菌感染防治试验 将浓度为1011cfu·mL-1的铜绿假单胞菌菌液梯度稀释10个梯度,每个梯度设为1组,将梯度稀释的菌液分别涂于蛋表面,每组5枚蛋,1 h之内用效价为1013pfu·mL-1的噬菌体培养液喷涂于蛋表面,置于孵化箱,20 d后观察鸡蛋状况。
2 结果 2.1 噬菌体MH12-Q生物学特性测定2.1.1 噬菌体MH12-Q的效价 噬菌体与宿主菌接种于LB培养液中过夜振荡培养,用双层平板法测定效价为1.4×1013pfu·mL-1。
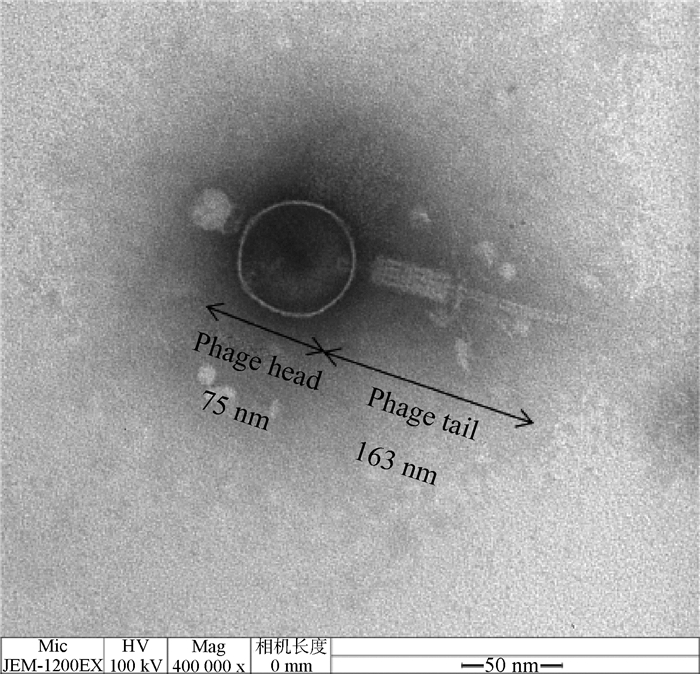
2.1.2 噬菌体MH12-Q的电镜形态观察 电镜结果显示(图 1),噬菌体MH12-Q为有尾目噬菌体,由二十面体头部与尾部组成,头部直径约为75 nm,整个噬菌体长度约163 nm。
|
图 1 噬菌体MH12-Q的电镜形态观察 Fig. 1 The transmission electron microscopy of phage MH12-Q |
2.1.3 噬菌体MH12-Q最适生长温度测定 噬菌体最适生长温度测定结果(图 2)显示,生长的温度在20~37 ℃时的效价会随温度上升而增高;30~40 ℃时的效价能达到1010pfu·mL-1以上,此时段的效价比较高;当温度超过40 ℃效价下降较明显;最适生长温度为37 ℃,此时能达到最高效价。

|
图 2 噬菌体MH12-Q最适生长温度 Fig. 2 Optimal temperature of phage MH12-Q |
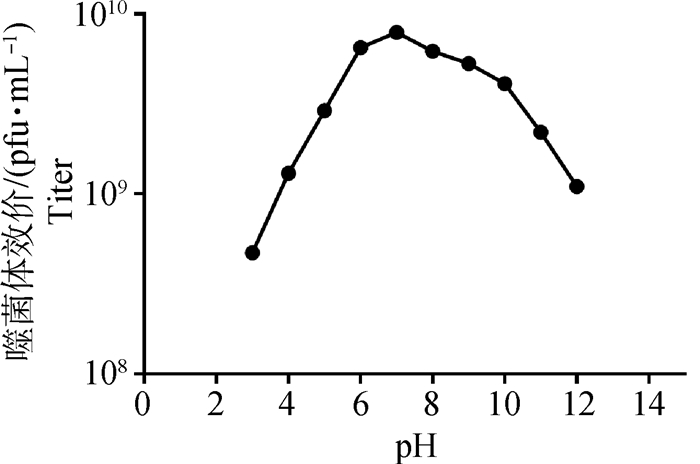
2.1.4 噬菌体MH12-Q的pH稳定性测定 噬菌体pH稳定性测定结果(图 3)显示,在pH2~7,效价会随pH增加而增高;在pH7~12有随pH增高而降低趋势;其最适pH在6~8,且其效价在pH4~10的效价都能维持较高的水平,均在109pfu·mL-1以上。
|
图 3 噬菌体MH12-Q的pH稳定性 Fig. 3 pH stability of phage MH12-Q |
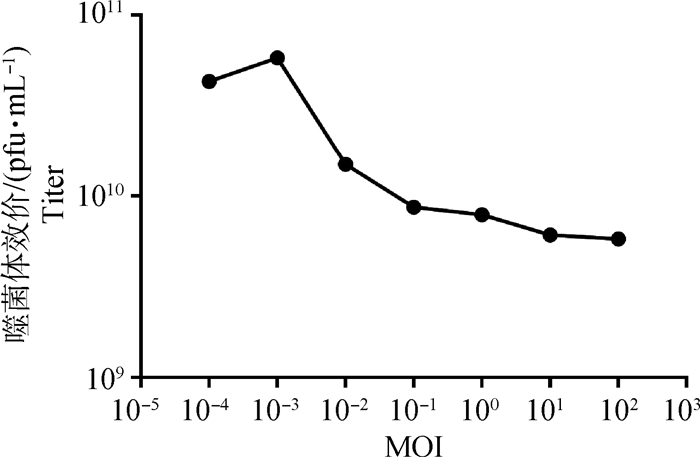
2.1.5 噬菌体MH12-Q的最佳感染复数测定 测定噬菌体最佳感染复数结果(图 4)显示,铜绿假单胞菌噬菌体的OMOI为0.001,噬菌体的效价有随MOI比例升高而降低的趋势。
|
图 4 噬菌体MH12-Q的OMOI Fig. 4 The OMOI of phage MH12-Q |
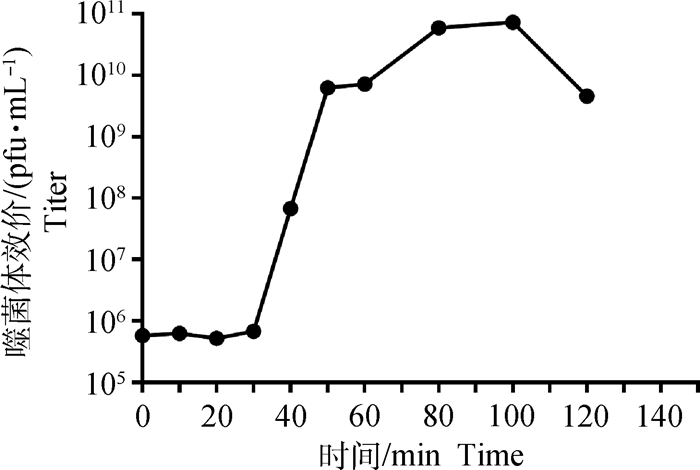
2.1.6 噬菌体MH12-Q一步生长曲线测定结果 噬菌体一步生长曲线测定结果(图 5)显示,噬菌体感染宿主菌30 min内,噬菌体数量无增加,这段时间称为潜伏期;感染宿主菌后的30~80 min,噬菌体数量急速增加,这个时期为噬菌体的爆发期,即噬菌体的爆发期约为60 min。
|
图 5 噬菌体MH12-Q一步生长曲线 Fig. 5 One step growth curve of phage MH12-Q |
2.1.7 噬菌体MH12-Q的完全裂解效价(CLC)测定 如图 6所示,在噬菌体浓度为1010pfu·mL-1的点位之后开始有细菌生长,故噬菌体MH12-Q的最小完全裂解效价为1010pfu·mL-1。

|
黄白色为细菌菌落,数字表示噬菌体浓度。噬菌体浓度为1010pfu·mL-1没有菌落生长,此浓度为最小完全裂解效价 Yellowish white indicates bacterial colonies and numbers represent phage concentration.There was no colony growth at phage concentration of 1010pfu·mL-1, which was the minimum complete lysis concentration 图 6 噬菌体MH12-Q的完全裂解效价(CLC) Fig. 6 CLC of phage MH12-Q |
测序结果显示,噬菌体MH12-Q的基因组大小为92.8 kb,GC含量为49.54%。将基因组序列于NCBI数据库中比对,与一株铜绿假单胞菌噬菌体YS35的相似度为97.6%,属肌尾噬菌体科(Myoviridae)[25-26]。噬菌体基因注释结果(图 7)所示,标签上标注的为该基因推测编码的蛋白质,该噬菌体基因组含有核糖、烟酰胺代谢相关基因,以及尾丝蛋白、结合蛋白、末端酶等基因。MH12-Q基因组中未发现抗药基因和毒力基因,保证了其使用的安全性。

|
图 7 噬菌体MH12-Q的基因注释 Fig. 7 Gene annotation of phage MH12-Q |
2.3.1 铜绿假单胞菌感染鸡蛋试验 处理第3天后,铜绿假单胞菌已侵入鸡蛋,此时蛋内容物未看出变化,但可从其中分离出铜绿假单胞菌。直至第21天,感染率(腐蛋率)为61.9%(13/21)。
2.3.2 铜绿假单胞菌噬菌体防治腐蛋试验 试验结果(图 8)显示,空白对照组及仅用噬菌体处理组都不会产生腐蛋,且鸡胚发育良好,说明对种蛋施用噬菌体的安全性高。铜绿假单胞菌处理组的腐蛋率为70%,防治组腐蛋率为40%,腐蛋率降低了30%,噬菌体对控制腐蛋具有较明显的效果。
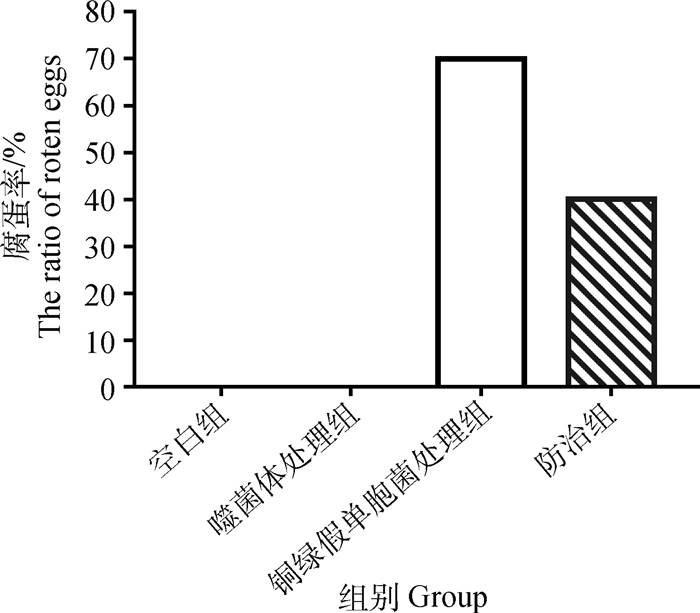
|
图 8 铜绿假单胞菌噬菌体防治腐蛋试验 Fig. 8 Pseudomonas aeruginosa phage control of rotten egg |
2.3.3 噬菌体对不同浓度铜绿假单胞菌感染防治试验 图 9显示,当铜绿假单胞菌浓度较小为102cfu·mL-1时,仍然会感染鸡蛋,形成腐蛋(图 9 a),但噬菌体处理组基本不形成腐蛋,活胚数显著提高(图 9 b)。细菌感染组与噬菌体处理组都存在鸡蛋不发育的情况(图 9 c),可能孵化条件未优化。总的来看(图 9 d),用噬菌体处理会显著降低腐蛋的产生,并且能显著提高铜绿假单胞菌感染鸡胚的成活率。

|
图 9d中进行配对T检验,腐蛋数中铜绿假单胞菌组与铜绿假单胞菌与噬菌体处理组P=0.024;未发育数中,P>0.99;活胚数中P=0.006 3。*. P < 0.05;**. P < 0.01 Paired T test is conducted in Figure 9d. In the number of rotten eggs, P=0.024 for Pseudomonas aeruginosa group and Pseudomonas aeruginosa and phage treatment group; P>0.99 for undeveloped number; P=0.006 3 for live embryo number. *. P < 0.05; **. P < 0.01 图 9 不同浓度铜绿假单胞菌感染鸡胚与噬菌体防治情况 Fig. 9 Infection of chicken embryos with different concentrations and phage therapy |
噬菌体对动物的铜绿假单胞菌感染的防治无论在实验室还是在商业领域都有研究验证中,而且对动物无明显副作用[27]。在小鼠皮肤表面接种铜绿假单胞(1.5×106cfu·mL-1),随后将噬菌体(1.2×107pfu·mL-1)施用于感染部位,发现噬菌体可以有效控制皮肤表面感染[28-29]。Khairnar等[30]构建铜绿假单胞菌感染的鱼模型,将噬菌体(1010pfu·mL-1)涂于皮肤表面,可治愈鱼皮肤的溃疡性损伤。临床病例报道也证实了铜绿假单胞菌噬菌体治疗的可行性和安全性。2006年,Marza等[31]用噬菌体成功治疗了烧伤患者的铜绿假单胞菌感染。2009年,Wright等[32]用噬菌体治疗了铜绿假单胞菌感染导致的慢性耳炎患者。本研究提供了将噬菌体应用于腐蛋防治的新思路和技术数据。
从河水中分离到铜绿假单胞菌噬菌体的效价可达到1013pfu·mL-1,且潜伏期和爆发期短,可以在短时间内降低宿主菌的数量,能够有效控制铜绿假单胞菌,且经过裂解谱测定,此株噬菌体裂解谱较宽,对本实验室分离保存的不同源的铜绿假单胞菌(120株)裂解率达到79.5%。此株噬菌体稳定性好,在20~40 ℃以及pH4~10的条件仍能保持较高的效价,适应于大规模的工业生产。
噬菌体可用于防治铜绿假单胞菌所致腐蛋,将腐蛋率降低30%,虽未达到更高疗效,分析来看是因为试验中所使用的细菌浓度远高于环境中的,且噬菌体是单株噬菌体单次施用,达到如此效果表明该方法是可行的。对各种浓度铜绿假单胞菌感染的种蛋都能显著降低腐蛋率,提高活胚率。此外,有研究表明,当抗生素和噬菌体联合使用时,对动物疾病的疗效会提高[33-34]。在后续研究中会探索鸡尾酒疗法及与抗生素联合施用及连续施用噬菌体等方法,以期获得更有效的防治方法。
4 结论噬菌体MH12-Q属肌尾噬菌体科,效价为1.4×1013pfu·mL-1,完全裂解效价(CLC)为1010pfu·mL-1,最适生长温度为37 ℃,最适pH在6~8范围内,且其效价在pH4~10的效价都能维持较高的水平。最佳感染复数(OMOI)为0.001,感染宿主的潜伏期为30 min,爆发期为70 min。噬菌体MH12-Q可使高浓度铜绿假单胞菌的感染率从70%降低到40%。铜绿假单胞菌噬菌体MH12-Q的生物学性质适合生产应用,可望用于孵化场的腐蛋防治。
| [1] |
刘凤荣. 孵化中臭蛋的产生及处理[J]. 中国禽业导刊, 1998, 14(2): 11.
LIU F R. Production and treatment of rotten eggs during incubation[J]. China Poultry Industry Guide, 1998, 14(2): 11. (in Chinese) |
| [2] |
鲍文龙, 李德福. 臭蛋在孵化室中的危害及预防方法[J]. 养禽与禽病防治, 1997(12): 15.
BAO W L, LI D F. The harm of rotten eggs in hatching chamber and prevention methods[J]. Poultry Husbandry and Disease Control, 1997(12): 15. (in Chinese) |
| [3] |
杨景满. 种蛋孵化过程中臭蛋产生的原因及防制[J]. 中国家禽, 2000, 22(7): 42.
YANG J M. Causes and control of rotten eggs during hatching of breeding eggs[J]. China Poultry, 2000, 22(7): 42. (in Chinese) |
| [4] | HARPER D R, ENRIGHT M C. Bacteriophages for the treatment of Pseudomonas aeruginosa infections[J]. J Appl Microbiol, 2011, 111(1): 1–7. |
| [5] |
魏光.铜绿假单胞菌耐药性分析及碳青霉烯类耐药铜绿假单胞菌外排泵MexAB-OprM的相关研究[D].合肥: 安徽医科大学, 2014.
WEI G. Analysis of antibiotics resistance among Pseudomonas aeruginosa and correlated study on efflux pump MexAB-OprM in carbapenem-resistant Pseudomonas aeruginosa[D]. Hefei: Anhui Medical University, 2014. (in Chinese) |
| [6] |
周小青.铜绿假单胞菌的耐药情况及基因同源性分析[D].南宁: 广西医科大学, 2014.
ZHOU X Q. Analysis of drug resistance and gene homology of Pseudomonas aeruginosa[D]. Nanning: Guangxi Medical University, 2014. (in Chinese) |
| [7] |
陈龙, 胡佳萍, 徐文刚, 等. 噬菌体治疗铜绿假单胞菌感染的初步应用研究[J]. 中国卫生检验杂志, 2016, 26(10): 1409–1411.
CHEN L, HU J P, XU W G, et al. Preliminary application of bacteriophages against Pseudomonas aeruginosa infection[J]. Chinese Journal of Health Laboratory Technology, 2016, 26(10): 1409–1411. (in Chinese) |
| [8] | OFIR G, SOREK R. Contemporary phage biology: from classic models to new insights[J]. Cell, 2018, 172(6): 1260–1270. DOI: 10.1016/j.cell.2017.10.045 |
| [9] | ABEDON S T, THOMAS-ABEDON C. Phage therapy pharmacology[J]. Curr Pharm Biotechnol, 2010, 11(1): 28–47. |
| [10] |
毛普加, 曾韦锟, 洪愉, 等. 宿主菌抗噬菌体机制的研究进展[J]. 病毒学报, 2015, 31(4): 474–479.
MAO P J, ZENG W K, HONG Y, et al. Advances of researches on anti-phage mechanisms of host[J]. Chinese Journal of Virology, 2015, 31(4): 474–479. (in Chinese) |
| [11] | CHAN B K, ABEDON S T. Phage therapy pharmacology: phage cocktails[J]. Adv Appl Microbiol, 2012, 78: 1–23. DOI: 10.1016/B978-0-12-394805-2.00001-4 |
| [12] | ABEDON S T. Phage therapy pharmacology: calculating phage dosing[J]. Adv Appl Microbiol, 2011, 77: 1–40. DOI: 10.1016/B978-0-12-387044-5.00001-7 |
| [13] | NILSSON A S. Phage therapy-constraints and possibilities[J]. Upsala J Med Sci, 2014, 119(2): 192–198. DOI: 10.3109/03009734.2014.902878 |
| [14] | CHATURONGAKUL S, OUNJAI P. Phage-host interplay: examples from tailed phages and Gram-negative bacterial pathogens[J]. Front Microbiol, 2014, 5: 442. |
| [15] | REHMAN S, ALI Z, KHAN M, et al. The dawn of phage therapy[J]. Rev Med Virol, 2019, 29(4): e2041. |
| [16] | JOŃCZYK-MATYSIAK E, ŁODEJ N, KULA D, et al. Factors determining phage stability/activity: challenges in practical phage application[J]. Exp Rev Anti-infective Ther, 2019, 17(8): 583–606. DOI: 10.1080/14787210.2019.1646126 |
| [17] | RYAN E M, GORMAN S P, DONNELLY R F, et al. Recent advances in bacteriophage therapy:how delivery routes, formulation, concentration and timing influence the success of phage therapy[J]. J Pharm Pharmacol, 2011, 63(10): 1253–1264. DOI: 10.1111/j.2042-7158.2011.01324.x |
| [18] | KORTRIGHT K E, CHAN B K, KOFF J L, et al. Phage therapy: a renewed approach to combat antibiotic-resistant bacteria[J]. Cell Host Microbe, 2019, 25(2): 219–232. DOI: 10.1016/j.chom.2019.01.014 |
| [19] | RYLOV V N. Bacteriophages of Pseudomonas aeruginosa: long-term prospects for use in phage therapy[J]. Adv Virus Res, 2014, 88: 227–278. DOI: 10.1016/B978-0-12-800098-4.00005-2 |
| [20] | VIERTEL T M, RITTER K, HORZ H P. Viruses versus bacteria-novel approaches to phage therapy as a tool against multidrug-resistant pathogens[J]. J Antimicrob Chemother, 2014, 69(9): 2326–2336. DOI: 10.1093/jac/dku173 |
| [21] | REINA J, REINA N. Phage therapy, an alternative to antibiotic therapy?[J]. Rev Esp Quimioter, 2018, 31(2): 101–104. |
| [22] | JAMALLUDEEN N, JOHNSON R P, FRIENDSHIP R, et al. Isolation and characterization of nine bacteriophages that lyse O149 enterotoxigenic Escherichia coli[J]. Vet Microbiol, 2007, 124(1-2): 47–57. DOI: 10.1016/j.vetmic.2007.03.028 |
| [23] |
王杰, 李璐璐, 张庆. 噬菌体RZⅢ-3的生物学特性分析及对鸡大肠杆菌的疗效[J]. 畜牧兽医学报, 2017, 48(11): 2166–2172.
WANG J, LI L L, ZHANG Q. Biological characteristics analysis of phage RZⅢ-3 to Escherichia coli and the therapeutic effect on chicken[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(11): 2166–2172. DOI: 10.11843/j.issn.0366-6964.2017.11.018 (in Chinese) |
| [24] |
商延.抗药性沙门氏菌及其噬菌体的相互作用关系[D].济南: 山东大学, 2018.
SHANG Y. Interaction relationship between antimicrobial—resistant Salmonella and their phages[D]. Ji'nan: Shandong University, 2018. (in Chinese) |
| [25] | JIANG Y H, LIU J Q, ZHAO C Y, et al. Isolation and genome sequencing of a novel Pseudomonas aeruginosa phage PA-YS35[J]. Curr Microbiol, 2020, 77(1): 123–128. DOI: 10.1007/s00284-019-01792-8 |
| [26] | YU S, HUANG H L, HAO Y C, et al. Complete genome sequence of the Myoviral bacteriophage YS35, which causes the lysis of a multidrug-resistant Pseudomonas aeruginosa strain[J]. Genome Announc, 2018, 6(6): e01395–17. |
| [27] |
BORYSOWSKI J, MIEDZYBRODZKI R, GÓRSKI A.噬菌体治疗-当前的研究和应用[M].王冉, 刘玉庆, 译.北京: 化学工业出版社, 2019.
BORYSOWSKI J, MIEDZYBRODZKI R, GORSKI A. Phage therapy - current research and applications[M]. WANG R, LIU Y Q, trans. Beijing: Chemical Industry Press, 2019. (in Chinese) |
| [28] | GOLKAR Z, BAGASRA O, JAMIL N. Experimental phage therapy on multiple drug resistant Pseudomonas aeruginosa infection in mice[J/OL]. J Antivir Antiretrovir, 2013, S10(6): S10-005.[2020-04-30]. https://www.longdom.org/open-access/experimental-phage-therapy-on-multiple-drug-resistant-pseudomonas-aeruginosa-infection-in-mice-jaa.S10-005.pdf. |
| [29] | MCVAY C S, VELÁSQUEZ M, FRALICK J A. Phage therapy of Pseudomonas aeruginosa infection in a mouse burn wound model[J]. Antimicrob Agents Chemother, 2007, 51(6): 1934–1938. DOI: 10.1128/AAC.01028-06 |
| [30] | KHAIRNAR K, RAUT M P, CHANDEKAR R H, et al. Novel bacteriophage therapy for controlling metallo-beta-lactamase producing Pseudomonas aeruginosa infection in catfish[J]. BMC Vet Res, 2013, 9(1): 264. DOI: 10.1186/1746-6148-9-264 |
| [31] | MARZA J A S, SOOTHILL J S, BOYDELL P, et al. Multiplication of therapeutically administered bacteriophages in Pseudomonas aeruginosa infected patients[J]. Burns, 2006, 32(5): 644–646. DOI: 10.1016/j.burns.2006.02.012 |
| [32] | WRIGHT A, HAWKINS C H, ÄNGGÅRD E E, et al. A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant; a preliminary report of efficacy[J]. Clin Otolaryngol, 2009, 34(4): 349–357. DOI: 10.1111/j.1749-4486.2009.01973.x |
| [33] | XIE H J, ZHUANG X L, KONG J, et al. Bacteriophage Esc-A is an efficient therapy for Escherichia COLI 3-1 caused diarrhea in chickens[J]. Gen Appl Microbiol, 2005, 51(3): 159–163. DOI: 10.2323/jgam.51.159 |
| [34] | HUFF W E, HUFF G R, RATH N C, et al. Therapeutic efficacy of bacteriophage and Baytril (enrofloxacin) individually and in combination to treat colibacillosis in broilers[J]. Poult Sci, 2004, 83(12): 1944–1947. DOI: 10.1093/ps/83.12.1944 |



