2. 动物生物技术中心, 成都 611130
2. Animal Biotechnology Center, Chengdu 611130, China
猪δ冠状病毒(porcine deltacoronavirus, PDCoV)是新发现的冠状病毒,属于δ冠状病毒属,为单链正股RNA病毒[1]。同α冠状病毒属的成员猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)和猪传染性胃肠炎病毒(transmissible gastroenteritis virus, TGEV)一样,PDCoV也可导致仔猪出现严重的腹泻或呕吐,并进一步引起仔猪脱水死亡,对养猪业造成一定的经济损失[2]。2012年中国香港学者首先报道了PDCoV,随后于2014年在美国多个州的猪场暴发由该病引起的疫病,目前,美国、韩国、中国、日本、东南亚(泰国、越南)等多个国家或地区报道了在发病猪群中检测出PDCoV[3-5]。在中国,多个省份报道了该病毒引起的疫病[6-8],然而四川省作为养猪大省,关于该病的详细调查报道却很少。目前,对于PDCoV感染的确定,主要是应用各种PCR方法来检测病毒核酸,而用于检测病毒抗体的血清学方法却很少[4],且暂无该病系统性的血清学调查,使得难以掌握疫病在四川的流行特点,因此,建立一种可靠的PDCoV血清学诊断方法是十分必要的。
PDCoV的基因组全长约25.4 kb,是冠状病毒中基因组长度最小的病毒。PDCoV基因组结构与PEDV相似,基因顺序为5′UTR-ORF1ab-S-E-M-NS6-N-NS7-3′UTR[1]。其中,S基因编码的S蛋白是病毒表面的糖蛋白,通过与宿主受体结合,在介导病毒进入宿主细胞中发挥重要作用[9];N基因可编码N蛋白,是在冠状病毒感染细胞中产生最多的蛋白之一,具有高度的保守型[10];M蛋白是由M基因编码的膜蛋白,冠状病毒的M蛋白在诱导机体保护和调解病程中发挥重要作用[11]。3种蛋白均是检测冠状病毒抗体和冠状病毒感染的理想抗原,且目前S、N、M蛋白已经被作为靶蛋白用于建立检测PDCoV感染IgG抗体的ELISA诊断方法[12-14]。但由于以往研究报道S基因变异性大,抗原表位不稳定[15];而N蛋白的高度保守性会导致PDCoV与PEDV发生双向抗体交叉反应[16]。故本研究以重组PDCoV M蛋白作为检测抗原,建立检测PDCoV IgG抗体的间接ELISA方法,并利用该方法对四川省不同地区猪场采集的430份猪血清进行检测,以期为PDCoV血清流行病学检测提供一种快速、灵敏的检测方法。
1 材料与方法 1.1 血清猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CFSV)、猪伪狂犬病病毒(PRV)阳性血清由本实验室保存。PDCoV抗体检测试剂盒由洛阳普莱生信息科技有限公司馈赠[17],该检测试剂盒是基于PDCoV重组N蛋白建立的间接ELISA检测方法,其生产批号为E191201。PDCoV阴性血清采自SPF猪群,为重庆市畜牧科学院馈赠。PDCoV阳性血清采自粪便样品经RT-PCR检测呈阳性的猪群,且用PDCoV抗体检测试剂盒检测确定均为PDCoV阳性血清。430份猪血清由2018年3月—2019年6月间四川省不同地区猪场送至本实验室,这些猪场血清包含健康和腹泻的仔猪、育肥猪以及母猪血清样本,其中不同地区的血清数量已注明(表 1)。
|
|
表 1 四川省不同地区猪场收集的血清数 Table 1 The number of sampled sera in different regions in Sichuan |
辣根过氧化物酶(HRP)标记的羊抗兔IgG、HRP标记的兔抗猪IgG、His标签纯化试剂盒均购自生工生物工程(上海)股份有限公司,TMB显色液购自索莱宝生物科技有限公司。
1.3 PDCoV M基因的合成、表达和鉴定参考PDCoV CHN/SC/2018株M基因全序列(GenBank登录号MK005882),并优化针对大肠杆菌具有偏嗜性的密码子,分别在优化后序列的5′和3′端加入SalⅠ和XhoⅠ两种酶切位点,人工合成PDCoV M核苷酸序列。合成的基因与原核表达载体pET-32a连接,构成重组质粒pET-32a-M,并转化至BL21(DE3)感受态细胞中,获得重组表达菌BL21-pET-32a-M。将重组表达菌1:100转接到新的LB培养基中,200 r·min-1 37 ℃震荡培养至OD600 nm为0.6,随后加入终浓度为1 mmol·L-1的IPTG诱导,同时设立含空载体pET-32的BL21菌诱导为对照进行SDS-PAGE检测以确定重组M蛋白的表达。
对IPTG终浓度、诱导温度和诱导时间等诱导条件进行优化,并用超声波破碎不同诱导条件下的菌液,收集破碎离心后的上清。采用His标签蛋白纯化试剂盒纯化上清中的重组蛋白,用含250 mmol·L-1的咪唑洗脱液洗脱重组蛋白。洗脱出的蛋白经SDS-PAGE后,使用稀释100倍的PDCoV阳性血清作为一抗,稀释3 000倍的兔抗猪IgG-HRP作为二抗,对上述获取的纯化蛋白进行抗原性鉴定。
1.4 间接ELISA方法的建立1.4.1 反应条件的优化 采用方阵滴定法确定最适抗原浓度和血清稀释倍数,具体为用包被液将纯化蛋白稀释为6个梯度,每孔100 μL加入至96孔酶标板中,在不同条件下进行包被(4 ℃过夜或37 ℃放置2 h再4 ℃过夜或4 ℃过夜再37 ℃放置2 h),每个稀释度设3个重复;使用5%的脱脂奶粉封闭后,阴、阳性血清作1:40、1:80、1:160、1:320、1:640稀释,100 μL每孔依次加入酶标板组成方阵,同时,设定不加血清的空白对照组(100 μL PBS)。按间接ELISA常规方法进行其余操作。利用酶标仪测定各处理组的OD450 nm值,以OD450 nm值为1.0左右,并且P/N(P=阳性血清处理OD450 nm-空白处理OD450 nm;N=阴性血清处理OD450 nm-空白处理OD450 nm)值最大所对应孔的抗原包被浓度及血清稀释度为最适抗原包被浓度和最佳血清稀释倍数。同时对包被抗原条件、封闭时间与条件、一抗作用时间与条件、酶标二抗作用条件与时间以及显色时间进行优化。
1.4.2 阴、阳性临界值的确定 按优化的反应条件,选取40份PDCoV阴性血清进行间接ELISA检测,每个样品设3个重复,并计算阴性样品OD450 nm的平均值(x)和标准差(s),确定样品的阴、阳性临界值,临界值的计算公式为x+3s。故根据统计学分析,当样品OD450 nm<x+2s时,判为阴性;当样品OD450 nm>x+3s时,判定为阳性;当x+2s≤样品OD450 nm≤x+3s,判定结果为可疑。
1.4.3 敏感性试验 按建立的PDCoV-rM-ELISA方法操作,将3份PDCoV阳性血清从1:160开始倍比稀释,同时设置阴性血清作为对照组。在酶标仪下测定各孔OD450 nm值,分析该ELISA方法的敏感性。
1.4.4 特异性与重复性试验 按建立的PDCoV-rM-ELISA方法检测已知的PEDV、TGEV、PRRSV、CFSV、PRV阳性血清,每份血清3个重复,同时设立PDCoV阴、阳性血清对照,验证该方法特异性。用同批次和不同批次纯化的重组蛋白包被酶标板,分别检测5份不同的PDCoV阳性血清,每份血清设3个重复,同时设立阴性血清作为对照,测定OD450 nm值,计算批内、批间的变异系数(CV)。
1.4.5 符合率试验 从“1.1”中收集到的临床样本血清中随机挑选48份,分别采用PDCoV-rM-ELISA方法和PDCoV抗体检测试剂盒对血清样品进行检测,以PDCoV抗体检测试剂盒测结果为标准计算PDCoV-rM-ELISA方法的阴、阳性符合率。
1.5 临床样品的检测与统计学分析在最佳条件下,使用本方法对“1.1”中的430份临床血清样品进行检测,同时加阴、阳血清作为对照。对于检测结果为可疑的样品,再次PDCoV-rM-ELISA方法检测,若样品OD450 nm<x+2s时,判为阴性,否则为阳性。另外使用Stata/SE 15.1软件的多元逻辑回归模型,根据年份、猪发育阶段以及地域分布3个分类变量对PDCoV感染进行分析,差异性显著设定为P<0.05,同时计算比值比(Odds ratio,OR)和95%置信区间(confidence intervals,CI)。
2 结果 2.1 重组M蛋白的表达、纯化及鉴定将重组表达菌BL21-pET-32a-M在37 ℃下经1 mmol·L-1的IPTG诱导,SDS-PAGE电泳分析。结果从凝胶上可清晰的看到:与未经诱导的菌液和含PET-32a空载菌液相比,诱导后的重组菌出现大小约42 ku的蛋白条带(图 1a),与目的条带相符。

|
a.重组蛋白的SDS-PAGE电泳分析(M. 10~250 ku的蛋白质分子质量标准;1~4.重组菌诱导4、3、2、1 h;5.重组菌诱导0 h;6. pET-32a(BL21)诱导4 h);b.重组蛋白Western blot鉴定(M.蛋白质分子质量标准;1~2. pET-32a(BL21)诱导16 h的蛋白样品;3.重组菌诱导16 h的沉淀样品;4.重组菌诱导16 h的上清样品) a. SDS-PAGE electrophoresis analysis of recombinant protein (M. protein marker of 10-250 ku; 1-4. Recombinant bacteria induced for 4, 3, 2, 1 h; 5. Recombinant bacteria induced 0 h; 7. pET-32a (BL21) induced 4 h); b. Identification of recombinant protein antigenicity (M. Protein marker; 1-2. Protein sample of pET-32a (BL21) induced 16 h; 3. Precipitation protein sample of recombinant bacteria induced 16 h; 4. Supernatant protein sample of recombinant bacteria induced 16 h) 图 1 重组M蛋白的SDS-PAGE电泳及Western blot鉴定 Fig. 1 SDS-PAGE electrophoresis and Western blot identification of recombinant M protein |
超声裂解不同诱导条件下的重组菌液,并将菌液上清和沉淀分别进行SDS-PAGE电泳,结果显示,在诱导条件为16 ℃、120 r·min-1且IPTG终浓度为0.1 mmol·L-1,重组菌在诱导16 h时表达的重组M蛋白大部分在上清中,以可溶性蛋白的形式存在。使用His标签纯化试剂盒纯化上清蛋白,使用PDCoV阳性血清作为一抗,兔抗猪IgG-HRP作为二抗,对纯化的上清蛋白进行Western bolt试验,结果显示在42 ku处出现一条清晰的反应条带,且含pET-32a的BL21菌诱导后的蛋白样品未出现反应条带(图 1b),表明重组M蛋白具有良好的抗原反应活性。
2.2 PDCoV M重组蛋白的间接ELISA方法的建立与优化经过方阵滴定和ELISA各步骤反应条件的优化,确定最佳的反应条件。最终反应条件见表 2,同时将建立的间接ELISA方法命名为PDCoV-rM-ELISA方法。
|
|
表 2 间接ELISA检测方法反应条件的优化 Table 2 The optimized conditions of the indirect ELISA |
应用PDCoV-rM-ELISA方法对40份PDCoV阴性血清样品进行检测,应用统计学软件分析测得的OD450 nm值,计算阴性样品的平均值x=0.201,标准差s=0.038。故当检测样品血清OD450 nm<x+ 2s=0.277时,判定结果为阴性;当检测样品血清OD450 nm>x+3s=0.315时,判定结果为阳性;当检测样品血清OD450 nm介于两者之间时,判定为可疑。
2.4 敏感性试验取3份PDCoV阳性血清用PBS从1:160稀释倍数开始倍比稀释,检测建立的ELISA方法的敏感性,结果显示3份阳性血清分别在稀释640倍、640倍、1 280倍时OD450 nm值与阴性血清OD450 nm值接近,表明稀释倍数可达1:640,说明建立的ELISA方法敏感性较好。
2.5 特异性试验应用PDCoV-rM-ELISA方法对已知的PEDV、TGEV、PRRSV、CFSV、PRV阳性血清进行检测,结果显示纯化的重组蛋白M蛋白仅能够与PDCoV阳性血清发生反应,而与PEDV等5种猪常见病原阳性血清反应均为阴性,结果表明建立的间接ELISA方法具有良好的特异性(表 3)。
|
|
表 3 间接ELISA的特异性试验结果 Table 3 The results of specificity evaluation of indirect ELISA |
随机选择5份PDCoV阳性血清样品分别进行批内和批间重复性试验,统计学分析结果显示批内重复变异系数(CV)在0.6%~1.3%,批间重复变异系数在1.0%~3.3%,变异范围均小于10%。表明本研究建立的间接ELISA方法重复性较好(表 4)。
|
|
表 4 间接ELISA的重复性试验结果 Table 4 The repeatability evaluation of the indirect ELISA |
随机挑取共48份临床血清,其中包括仔猪、母猪和育肥猪的血清各16份,分别采用PDCoV-rM-ELISA方法(M-ELISA)和PDCoV抗体检测试剂盒(N-ELISA)对血清样品进行检测。结果显示PDCoV-rM-ELISA方法检测阳性样品25份,阴性样品23份;而PDCoV抗体检测试剂盒检测结果为阳性样品26份,阴性样品22份。以PDCoV抗体检测试剂盒检测结果为标准计算PDCoV-rM-ELISA方法的阳性符合率为88.46%,阴性符合率为90.91%,总符合率为89.58%(表 5)。不同类型猪只抗体阴、阳性数和与符合率如表 6所示,总体来说本方法与商品化抗体检测试剂盒有较高的符合率,可用于检测临床血清样品。
|
|
表 5 两种ELISA方法对48份待检血清的检测结果 Table 5 The test results of two ELISA methods for 48 clinic serums |
|
|
表 6 不同类型猪的抗体阳性数和符合率 Table 6 The number of positive antibodies and coincidence rate of different types of pigs |
应用本研究建立的ELISA方法对430份临床猪血清进行检测,结果显示,血清样品的阳性率为11.86%(51/430),其中仔猪血清样品阳性率为9.57%(18/188);育肥猪血清样品阳性率为10.00%(15/150);母猪血清样品阳性率为19.57%(18/92)。如图 2B所示,2019年血清阳性率(15.67%)高于2018年血清阳性率(9.38%)。其次,未发生腹泻猪场的血清样本中的抗体阳性率为7.81%(10/128),发生腹泻猪场的血清样本中的抗体阳性率为13.58%(41/302)。
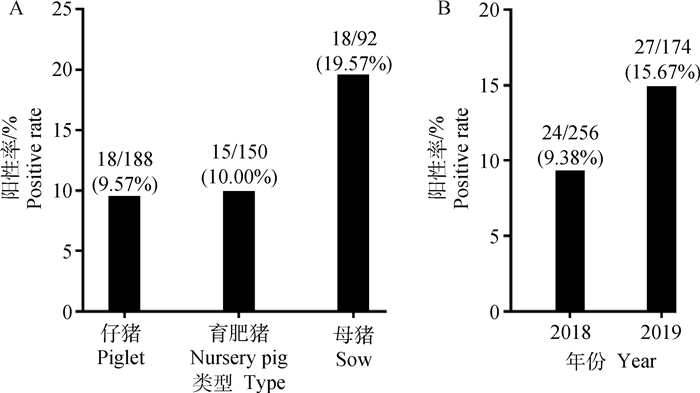
|
A.不同种类猪的抗体阳性率;B.不同年份的抗体阳性率 A. Antibody positive rate in different types of pigs; B. Antibody positive rate in different years 图 2 临床血清样品检测结果 Fig. 2 Detection results of clinical serum samples |
对四川各地区猪场PDCoV抗体阳性率分析,结果显示,四川13个地区均检测出PDCoV抗体阳性(图 3),表明PDCoV引起的疫病在四川地区广泛流行。
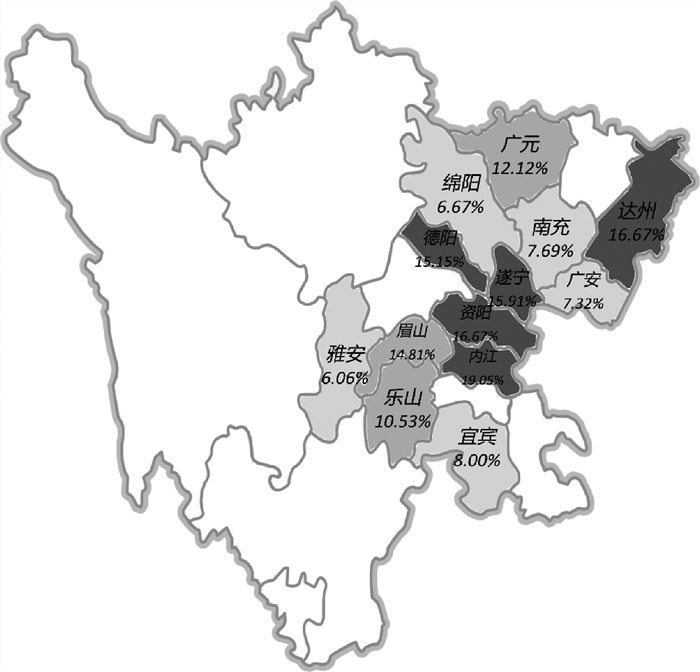
|
每个地区标记了PDCoV抗体阳性率;不同颜色代表不同的阳性率,深颜色代表抗体阳性率高 The antibody positive rates of PDCoV were labeled in the regions; The difierent color scales represent difierent positive rates and the regions with dark colors represent high positive rates 图 3 四川地区PDCoV抗体阳性率分布图 Fig. 3 Map of PDCoV antibody positive rates in Sichuan |
统计学分析显示PDCoV感染与变量猪发育阶段存在相关性,而与年份和地域分布无相关性(表 7)。
|
|
表 7 PDCoV感染的可能危险因素的逻辑回归模型分析 Table 7 Analysis of logistic regression models of possible risk factors associated with the PDCoV infection |
同时母猪比仔猪和育肥猪高2.25(OR)倍的PDCoV感染概率。
3 讨论猪δ冠状病毒(PDCoV)是近几年发现的一种冠状病毒,由于其引起的临床症状与PEDV、TGEV等其他腹泻类病毒相似,临床上很难准确判断致病病原[2]。同时,PDCoV易与PEDV发生混合感染,因此,目前对该病毒的诊断主要依靠实验室检测[18]。在病毒血清学检测上,ELISA具有快速、灵敏、简便等特点,且适用于较大样品量的检测,故建立一种可靠的ELISA方法,对于PDCoV血清学诊断是十分必要的。PDCoV的M蛋白是病毒包膜中相对丰富的蛋白,且相对保守[4]。虽然有研究报道以PEDV M蛋白为抗原构建的ELISA方法对PDCoV阳性血清进行抗体检测时会出现阳性结果,但未有PDCoV的M蛋白会与PEDV阳性血清发生交叉反应的报道[19]。故PDCoV M蛋白可作为靶蛋白用于建立检测PDCoV感染IgG抗体的ELISA诊断方法。Luo等[13]利用PDCoV的M蛋白作为检测抗原,建立了间接ELISA方法,该方法表达的M蛋白为不溶的包涵体,虽然包涵体表达外源蛋白有时具有产量较大、纯化方便等优势,但包涵体蛋白在生产、溶解等环节操作较繁琐,且包涵体蛋白活性比可溶性蛋白低,不利于该检测方法的普及与应用。因此,本研究通过对诱导条件的优化,降低诱导温度和转速,增加诱导时间原核表达出可溶性重组M蛋白,建立了检测PDCoV IgG抗体的间接ELISA方法。同时对比商品化检测试剂盒,本方法选取重组M蛋白作为包被抗原,其保守性较N蛋白低,难以与PEDV或其他冠状病毒阳性血清发生交叉反应[16],间接提高了方法的特异性。
本研究建立了基于重组PDCoV M蛋白的IgG抗体间接ELISA检测方法,并命名为PDCoV-rM-ELISA方法。在重组M蛋白纯化中,本研究采用多次过镍柱纯化方式,解决因原核表达外源蛋白时混有细菌蛋白干扰检测的问题。在敏感性试验中,本研究建立的间接ELISA方法可检测到稀释倍数达1:640的血清中PDCoV抗体,表明本方法敏感性较好;在特异性试验中,本方法对PEDV、TGEV、PRRSV、CFSV、PRV的阳性血清均不发生交叉反应,证明了该方法具有较高的特异性;在重复性试验中,本方法的批内、批间变异系数均小于标准规定的10%,表明该方法的重复性好,同时在符合率试验中,本研究建立的间接ELISA方法与成品化的PDCoV抗体检测试剂盒的总符合率为89.58%,表明该方法检测结果可信度高。
为了解四川地区PDCoV的IgG抗体分布及其感染情况,本研究使用建立的间接ELISA方法对2018年3月—2019年6月四川各地区猪场送至实验室的430份血清进行了检测。430份血清包含健康和腹泻的仔猪、育肥猪以及母猪血清样本,检测结果显示,血清样品中PDCoV IgG抗体阳性率为11.86%,与以往研究报道相似[20],提示需要进一步加强对PDCoV血清学的调查。由于目前无针对PDCoV的疫苗,故PDCoV的抗体阳性率代表PDCoV的感染率,而本研究在128份未发生过腹泻的猪血清样品中检测出10份PDCoV IgG抗体阳性,提示健康猪群中存在PDCoV隐性感染情况。事实上,母猪感染PDCoV一般无明显临床症状[21],导致母猪感染PDCoV的情况常被忽略,故在后续研究中将持续关注健康猪群中PDCoV的感染情况,进一步分析PDCoV在四川猪群中的流行情况。另外对四川各地区猪场PDCoV抗体阳性率分析后,结果显示,四川13个地区均检测出PDCoV抗体阳性,表明PDCoV在四川地区感染广泛,与以往研究结果一致[22]。同时,各地区猪场的都有不同程度的PDCoV感染,说明PDCoV在四川省不同地区的流行差异较大,且猪场防控该病措施不到位,仍需加强防控方面的研究。其次,ELISA检测结果发现各年龄段的猪血清均有PDCoV抗体阳性,提示PDCoV可感染不同年龄段的猪群,这与以往研究结果一致[21]。虽然PDCoV抗体阳性率在2019年高于2018年,但不能说明PDCoV的感染会逐年增加(P>0.05),需要检测更多的临床样品来判断PDCoV的感染是否与年份相关。Tohru等[23]研究报道母猪中PDCoV检出率(48.3%)远高于仔猪(7.3%)和育肥猪(10.5%),提示母猪比仔猪更容易感染PDCoV,且本研究结果显示,母猪比仔猪和育肥猪高2.25(OR)倍的PDCoV感染概率,这或许与母猪生存时间长有关。故在后续该病毒防控时,更需加强对母猪的监控与保护。
4 结论本研究利用体外原核表达系统获得大量高浓度的可溶性PDCoV重组M蛋白,建立了检测PDCoV IgG抗体的间接ELISA方法,该方法具有良好的敏感性、特异性和重复性,为临床猪血清PDCoV血清流行病学调查提供了技术手段。使用本方法对2018年3月—2019年6月临床血清样品检测结果表明PDCoV在四川地区感染广泛,且感染率与以往研究相似,对PDCoV进一步的流行病学调查提供了理论参考。
| [1] | HU H, JUNG K, VLASOVA A N, et al. Isolation and characterization of porcine deltacoronavirus from pigs with diarrhea in the United States[J]. J Clin Microbiol, 2015, 53(5): 1537–1548. DOI: 10.1128/JCM.00031-15 |
| [2] | JUNG K, HU H, EYERLY B, et al. Pathogenicity of 2 porcine deltacoronavirus strains in gnotobiotic pigs[J]. Emerg Infect Dis, 2015, 21(4): 650–654. DOI: 10.3201/eid2104.141859 |
| [3] | WOO P C Y, LAU S K P, LAM C S F, et al. Discovery of seven novel mammalian and avian coronaviruses in the genus deltacoronavirus supports bat coronaviruses as the gene source of Alphacoronavirus and Betacoronavirus and avian coronaviruses as the gene source of Gammacoronavirus and Deltacoronavirus[J]. J Virol, 2012, 86(7): 3995–4008. DOI: 10.1128/JVI.06540-11 |
| [4] | ZHANG J Q. Porcine deltacoronavirus:overview of infection dynamics, diagnostic methods, prevalence and genetic evolution[J]. Virus Res, 2016, 226: 71–84. DOI: 10.1016/j.virusres.2016.05.028 |
| [5] | AJAYI T, DARA R, MISENER M, et al. Herd-level prevalence and incidence of porcine epidemic diarrhoea virus (PEDV) and porcine deltacoronavirus (PDCoV) in swine herds in Ontario, Canada[J]. Transbound Emerg Dis, 2018, 65(5): 1197–1207. DOI: 10.1111/tbed.12858 |
| [6] | SONG D, ZHOU X, PENG Q, et al. Newly emerged porcine deltacoronavirus associated with diarrhoea in swine in China:identification, prevalence and full-length genome sequence analysis[J]. Transbound Emerg Dis, 2015, 62(6): 575–580. DOI: 10.1111/tbed.12399 |
| [7] | MAI K, FENG J, CHEN G, et al. The detection and phylogenetic analysis of porcine deltacoronavirus from Guangdong province in southern China[J]. Transbound Emerg Dis, 2017, 65(1): 166–173. |
| [8] | DONG N, FANG L R, ZENG S L, et al. Porcine deltacoronavirus in mainland China[J]. Emerg Infect Dis, 2015, 21(12): 2254–2255. DOI: 10.3201/eid2112.150283 |
| [9] | LI W T, HULSWIT R J G, KENNEY S P, et al. Broad receptor engagement of an emerging global coronavirus may potentiate its diverse cross-species transmissibility[J]. Proc Natl Acad Sci U S A, 2018, 115(22): E5135–E5143. DOI: 10.1073/pnas.1802879115 |
| [10] | MCBRIDE R, VAN ZYL M, FIELDING B C. The coronavirus nucleocapsid is a multifunctional protein[J]. Viruses, 2014, 6(8): 2991–3018. DOI: 10.3390/v6082991 |
| [11] | VENNEMA H, DE GROOT R J, HARBOUR D A, et al. Primary structure of the membrane and nucleocapsid protein genes of feline infectious peritonitis virus and immunogenicity of recombinant vaccinia viruses in kittens[J]. Virology, 1991, 181(1): 327–335. |
| [12] |
逄凤娇, 俞正玉, 何孔旺, 等. 猪丁型冠状病毒重组N蛋白间接ELISA抗体检测方法的建立[J]. 中国预防兽医学报, 2017, 39(6): 461–465.
PANG F J, YU Z Y, HE K W, et al. Development of an indirect ELISA for detection antibody to porcine deltacoronavirus using recombinant N protein[J]. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(6): 461–465. (in Chinese) |
| [13] | LUO S X, FAN J H, OPRIESSNIG T, et al. Development and application of a recombinant M protein-based indirect ELISA for the detection of porcine deltacoronavirus IgG antibodies[J]. J Virol Methods, 2017, 249: 76–78. DOI: 10.1016/j.jviromet.2017.08.020 |
| [14] |
侯林杉, 贾敬亮, 顾文源, 等. 基于猪丁型冠状病毒重组S1蛋白间接ELISA抗体检测方法的建立与应用[J]. 畜牧兽医学报, 2019, 50(8): 1642–1648.
HOU L S, JIA J L, GU W Y, et al. Establishment and application of an indirect ELISA based on recombinant S1 protein for the detection of antibodies against porcine deltacoronavirus[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(8): 1642–1648. (in Chinese) |
| [15] |
李成, 张雨迪, 黄小波, 等. 猪丁型冠状病毒S1基因的克隆、原核表达及多克隆抗体制备[J]. 畜牧兽医学报, 2018, 49(6): 1256–1264.
LI C, ZHANG Y D, HUANG X B, et al. Cloning and prokaryotic expression of porcine deltacoronavirus S1 gene and preparation of polyclonal antibody[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(6): 1256–1264. (in Chinese) |
| [16] | MA Y M, ZHANG Y, LIANG X Y, et al. Two-way antigenic cross-reactivity between porcine epidemic diarrhea virus and porcine deltacoronavirus[J]. Vet Microbiol, 2016, 186: 90–96. DOI: 10.1016/j.vetmic.2016.02.004 |
| [17] |
闫瑞杰, 张云飞, 刘玲玲, 等. 猪δ冠状病毒N蛋白的原核表达和间接ELISA检测方法的建立[J]. 西北农林科技大学学报:自然科学版, 2019, 47(10): 1–8, 17.
YAN R J, ZHANG Y F, LIU L L, et al. Prokaryotic expression of N protein and establishment of an indirect ELISA for antibody detection of porcine deltacoronaviru[J]. Journal of Northwest A & F University:Natural Science Edition, 2019, 47(10): 1–8, 17. (in Chinese) |
| [18] | ZHANG H L, LIANG Q Q, LI B X, et al. Prevalence, phylogenetic and evolutionary analysis of porcine deltacoronavirus in Henan province, China[J]. Prev Vet Med, 2019, 168: 8–15. |
| [19] | GIMENEZ-LIROLA L G, ZHANG J Q, CARRILLO-AVILA J A, et al. Reactivity of porcine epidemic diarrhea virus structural proteins to antibodies against porcine enteric coronaviruses:diagnostic implications[J]. J Clin Microbiol, 2017, 55(5): 1426–1436. DOI: 10.1128/JCM.02507-16 |
| [20] | SU M J, LI C Q, GUO D H, et al. A recombinant nucleocapsid protein-based indirect enzyme-linked immunosorbent assay to detect antibodies against porcine deltacoronavirus[J]. J Vet Med Sci, 2016, 78(4): 601–606. DOI: 10.1292/jvms.15-0533 |
| [21] | LI B X, ZHENG L L, LI H Y, et al. Porcine deltacoronavirus causes diarrhea in various ages of field-infected pigs in China[J]. Biosci Rep, 2019, 39(9): BSR20190676. DOI: 10.1042/BSR20190676 |
| [22] |
冯宇, 殷鑫欢, 徐雷, 等. 2017年~2018年四川省猪δ冠状病毒的检测与遗传进化分析[J]. 中国预防兽医学报, 2019, 41(10): 1059–1062, 1071.
FENG Y, YIN X H, XU L, et al. Detection and phylogenetic and evolutionary analysis of porcine deltacoronavirus in Sichuan from 2017 to 2018[J]. Chinese Journal of Preventive Veterinary Medicine, 2019, 41(10): 1059–1062, 1071. (in Chinese) |
| [23] | SUZUKI T, SHIBAHARA T, IMAI N, et al. Genetic characterization and pathogenicity of Japanese porcine deltacoronavirus[J]. Infect Genet Evol, 2018, 61: 176–182. DOI: 10.1016/j.meegid.2018.03.030 |



