随着国民经济的发展和生活水平的日益提高,人民对鲜奶及奶产品的需求量逐年增加。生产实践中为了提高奶畜的产奶量,养殖者往往饲喂以谷物淀粉等为主要能量饲料的高精料日粮,以满足奶畜泌乳的能量需求。但饲喂高精料日粮在提高生产性能的同时也大大增加了营养代谢疾病发生的风险,使得各类代谢疾病发生率高居不下,尤其是亚急性瘤胃酸中毒(subacute ruminal acidosis, SARA)、酮病、蹄叶炎、脂肪肝等[1-2]。研究表明,使用高精料诱导SARA发生时,瘤胃内会产生大量脂多糖(lipopolysaccharide, LPS),由于酸性环境和LPS的存在,使胃肠道黏膜上皮细胞屏障功能受损,LPS通过受损的上皮细胞进入血液,在全身运行,可与单核/巨噬细胞、内皮细胞等多种细胞膜受体结合,启动胞内信号转导系统,引起多种细胞因子和炎性介质合成和释放,造成血管通透性增加,体液渗出,淋巴细胞移行到炎症部位,并使动物机体处于免疫应激状态[3-6]。
肝是机体最大的消化腺,在胆汁生成、蛋白质合成、脂肪代谢和葡萄糖稳态等多个代谢过程中发挥重要作用。肝中有多种重要的固有免疫细胞,如枯弗氏细胞(Kupffer cell, KC)、树突状细胞(dendr itic cells, DC)、自然杀伤细胞(natural killer cells, NK)、NKT细胞、单核细胞、粒细胞等,这些细胞均表达一系列模式识别受体,通过识别病原相关分子模式(pathogen-associated molecular pattern, PAMP),对外源抗原或异物刺激产生应答[7]。脾作为外周免疫器官,在清除血液中的异物、细菌、病毒以及衰老死亡细胞等发面发挥重要功能[8]。Li等[9]给雏鸡腹腔注射LPS,发现雏鸡脾重量降低,脾细胞核浓缩并发生急性损伤。Nežić等[10]给Wistar大鼠腹腔注射LPS,发现LPS导致大鼠脾组织弥漫性窦状水肿、充血和血红素沉着;淋巴组织萎缩,淋巴细胞、浆细胞和巨噬细胞数量减少,生发中心的淋巴细胞坏死。目前关于饲喂高精料日粮对泌乳奶山羊肝、脾组织炎症的影响研究较少,本研究以泌乳期关中奶山羊为模型动物,对照组和试验组分别饲喂精粗料比35:65和65:35的日粮,通过检测乳脂率、粪便pH、肝和脾组织炎性变化和炎性因子及Toll样受体4(toll like receptor 4,TLR4)通路关键蛋白的表达,探究长期饲喂高精料日粮对泌乳期奶山羊肝、脾炎性细胞因子及TLR4通路关键蛋白表达的影响,旨在为奶山羊养殖中高精料的使用提供参考。
1 材料与方法 1.1 主要试剂苏木精染液,10 g·L-1伊红,2×SYBR Green qPCR Master mix,购自南京翼飞雪生物科技有限公司;TRIGene总RNA提取试剂盒,购自康润生物科技有限公司;Recombinant DNase I和Recombinant RNase inhibitor为宝生生物(中国)有限公司产品;ECL发光试剂和BCA蛋白浓度测定试剂盒,为生工生物工程(上海)股份有限公司产品;鼠抗-GAPDH多克隆抗体(Ptgcn, #60004-1),兔抗-JNK多克隆抗体(CST, #9252),兔抗-ERk1/2单克隆抗体(CST, #4695),兔抗-P-38多克隆抗体(CST, #9212),兔抗-NF-κB(p-65)单克隆抗体(CST, #8242),HRP标记的羊抗鼠多克隆抗体(abs20001)和HRP标记的羊抗兔多克隆抗体(abs20002)为Absin公司产品。
1.2 主要仪器Leica精密轮转石蜡切片机(德国,Leica,RM2235);Sony数码显微镜(日本,SONY);手持式快速组织研磨仪,天津市欧诺仪器仪表有限公司;FE20K Plus基础型台式pH计,METTLER TOLEDO,Zurich,Switzerland;Real-time PCR仪,天隆TL988,中国;电泳仪和转印仪,BIO-RAD,Kodak,USA;化学发光凝胶成像系统,BIO-RAD,Chemico MP,USA。
1.3 试验动物饲养14只健康且体重相近的泌乳初期关中奶山羊,随机分为试验组(experimental group, EG)和对照组(control group, CG),试验组8只,对照组6只,试验组饲喂精粗比为65:35的日粮,对照组饲喂精粗比为35:65的日粮,饲养期间所有奶山羊自由饮水。饲料营养配方见表 1。
|
|
表 1 奶山羊日粮组成 Table 1 Ingredients and composition of the experimental diets fed to dairy goats |
试验开始后,于0、1、4、8、12、15、16、18、19周每周日采集所有奶山羊的乳汁,送西安奶牛中心测定乳脂率,6~18周每周日上午采集每只羊粪便10 g低温带回实验室,用20 mL蒸馏水稀释并充分搅拌均匀后用FE20K Plus台式pH计测定pH,每份粪便样品测定3次并记录数据。试验结束当日,所有奶山羊颈静脉放血处死,采集肝、脾组织,一部分组织经液氮速冻后-80 ℃保存备用,一部分组织浸于4%多聚甲醛溶液中固定备用。
1.5 肝、脾组织形态学观察取适当大小4%多聚甲醛固定的肝、脾组织,流水冲洗12 h,参考文献[11]方法依次进行梯度酒精脱水、透明、浸蜡、包埋、修整、切片和捞片,常温晾干后,50 ℃烘片2 h,二甲苯脱蜡后梯度酒精复水,HE染色,中性树胶封片后使用光学显微镜观察肝、脾组织的形态学变化。
1.6 引物设计合成根据NCBI nucleotide中登录的奶山羊相关分子的基因序列,利用Primer premier 6.0和Primer express 3.0设计扩增目的基因的特异性引物,引物由生工生物工程(西安)有限公司合成,序列详见表 2。引物用DEPC处理水稀释成10 mmol·L-1,分装并-20℃保存备用。
|
|
表 2 引物信息 Table 2 Primers information |
取-80 ℃保存的肝、脾组织样品各50 mg,按照总RNA提取试剂盒说明书提取总RNA并反转录成cDNA,以cDNA为模板,采用荧光定量PCR检测肝、脾组织中炎症相关因子IL-1α、IL-1β、IL-6、IL-10、TNF-α、TNF-β和TLR4通路相关的TLR4、NF-κB1、NF-κB2、MyD88基因表达。反应体系10 μL:包括10倍稀释的cDNA模板2 μL,上游和下游引物(终浓度250 nmol·L-1),2×SYBR Premix Ex TaqII(Tli RNaseH Plus)5 μL,用无菌ddH2O水补足至10 μL。反应条件为95 ℃变性2 min;55 ℃退火20 s,72 ℃延伸30 s,40个循环。
1.8 Western blot检测取-80 ℃保存的肝、脾组织样品各50 mg,分别加入RIPA蛋白裂解液500 μL,用手持式快速组织研磨仪于4℃匀浆6 min,冰上静置20 min,4 ℃、12 000 g离心20 min后吸取上清,参照BCA蛋白浓度测定试剂盒说明书测定蛋白浓度。样品处理后进行100 g·L-1分离胶SDA-PAGE,以GAPDH作为内参,以相应的一抗和二抗采用Western blot技术检测JNK、ERK、P38和P65蛋白表达水平。一抗4 ℃孵育过夜,二抗室温孵育2 h,充分洗涤后使用ECL发光液显影,拍照并分析结果。
1.9 数据处理与分析试验数据采用Excel 2019整理,结果以“平均值±标准差”表示;组间差异性比较使用SPSS 20.0,P < 0.05确定为差异显著,P < 0.01确定为差异极显著。用GraphPad prism 5作图。
2 结果 2.1 高精料日粮对奶山羊乳脂水平影响在整个试验过程中,随时观察奶山羊临床表现,发现试验前期(1~15周)高精料组奶山羊的日采食量、精神状态、粪便形状等与对照组相比无明显差异,到试验后期(16~19周),高精料组奶山羊日采食量有所下降,精神状态不佳,粪便异常,呈扁平状。于试验的0、1、4、8、12、15、16、18和19周每周日采集所有奶山羊的乳汁,检测乳脂率发现,随着高精料日料饲喂时间的延长,试验组奶山羊乳汁中乳脂率不断降低,到试验的16、18和19周,与对照组相比差异显著(P < 0.05,图 1)。
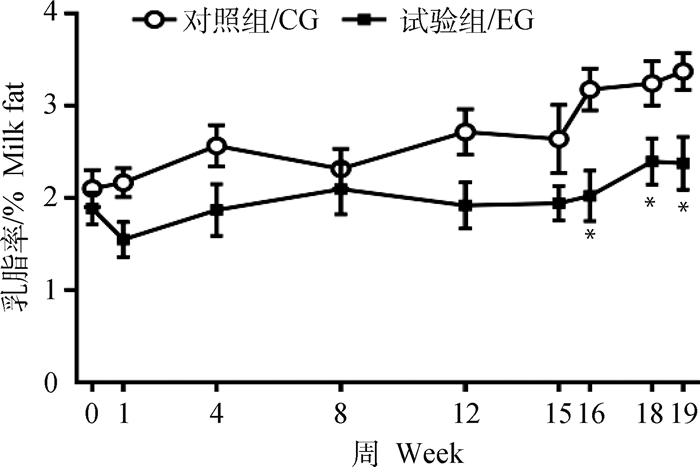
|
“*”表示P < 0.05,“**”表示P < 0.01。下同 "*" indicates P < 0.05, "**" indicates P < 0.01. The same as below 图 1 高精料日粮对泌乳奶山羊乳脂率的影响 Fig. 1 Effect of high concentrate diet on milk fat of lactating dairy goats |
于试验的6~18周每周日采集奶山羊粪便测定pH发现,试验组奶山羊粪便pH均值从第9周开始下降,13~18周与对照组相比差异显著(P < 0.05,图 2),说明长期饲喂高精料日料导致奶山羊粪便pH降低。

|
图 2 高精料日粮对泌乳奶山羊粪便pH的影响 Fig. 2 Effect of high concentrate diet on fecal pH of lactating dairy goats |
取4%多聚甲醛固定的对照组和试验组奶山羊新鲜的肝、脾组织制作组织切片,HE染色后在显微镜下观察(图 3)。可以看出,相较于对照组,试验组奶山羊肝小叶中央静脉有大量炎性细胞浸润(图 3A~D),其肝细胞有些呈蜂窝状,胞浆中出现大小不一的空泡(图 3D-a/b),有些细胞胞浆内出现微细的淡红色颗粒(图 3D-c/d),提示肝细胞有空泡变性或颗粒变性;与对照组相比,试验组奶山羊脾的白髓和红髓无明显变化,白髓生发中心和动脉周围淋巴鞘变化不明显(图 3E~H)。
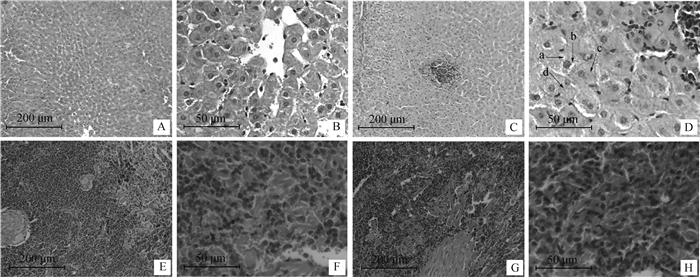
|
A、B、C、D.肝组织;E、F、G、H.脾组织;A、B、E、F.对照组;C、D、G、H.试验组。a和b显示肝细胞中出现大小不一的空泡,c和d显示肝细胞出现微细的淡红色颗粒物 A, B, C, D. Hepatic tissue; E, F, G, H. Spleen tissue; A, B, E, F. Control group; C, D, G, H. Experimental group. a and b show the appearance of vacuoles of different sizes in hepatocytes, c and d show the appearance of fine red particles in liver cells 图 3 高精料日粮对泌乳奶山羊肝、脾组织形态的影响 Fig. 3 Effect of high concentrate diet on hepatic and spleen histology of lactating dairy goats |
提取肝、脾组织总RNA并反转录为cDNA,采用荧光定量PCR检测肝、脾组织中IL-1α、IL-1β、IL-6、IL-10、TNF-α、TNF-β等炎性因子以及TLR4通路相关的TLR4、NF-κB1、NF-κB2、MyD88基因表达,检测结果如图 4所示。结果显示,长期饲喂高精料日粮,导致奶山羊肝组织中促炎细胞因子IL-6和TNF-β mRNA表达显著升高(P < 0.05,图 4A),肝组织中TLR4和NF-κB2基因表达显著升高(P < 0.05,图 4B);脾组织中促炎细胞因子TNF-β和抗炎细胞因子IL-10 mRNA表达水平显著升高(P < 0.05,图 4C),TLR4基因表达显著升高(P < 0.05),NF-κB2基因表达显著降低(P < 0.05),检测的其他基因的表达或升高或降低,但变化均不显著。
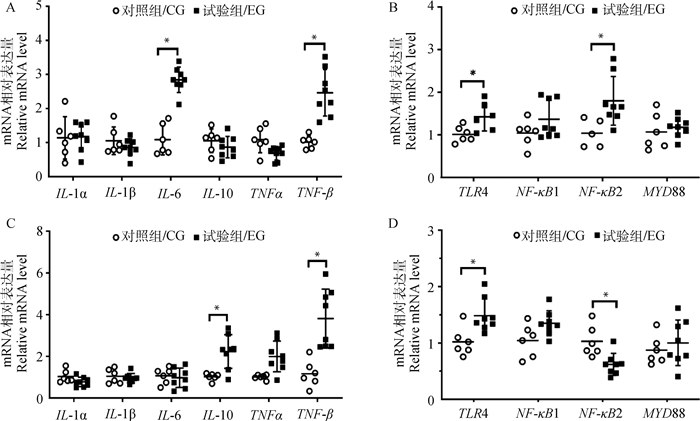
|
A、B.肝组织;C、D.脾组织 A, B. Hepatic tissue; C, D. Spleen tissue 图 4 高精料日粮对泌乳奶山羊肝、脾组织主要炎性因子和TLR4通路相关基因表达的影响 Fig. 4 Effect of high concentrate diet on inflammatory factors and TLR4 pathway related genes' expression of hepatic and spleen tissues of lactating dairy goats |
取保存的肝、脾组织样品用RIPA蛋白裂解液低温研磨处理后,离心取上清,以GAPDH为内参,采用Western blot技术检测p38、JNK、ERK和p65蛋白表达水平。结果发现,试验组肝组织中这4种蛋白的表达变化均不明显(图 5A、5B),脾组织JNK表达变化也不明显,但p38、ERK和p65表达与对照组相比虽差异不显著,但都呈现下降趋势(图 5C、5D)。
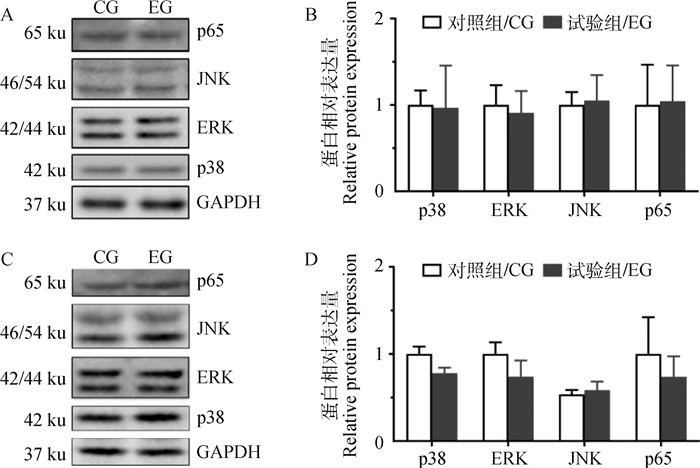
|
A、B.肝组织;C、D.脾组织 A, B. Hepatic tissue; C, D. Spleen tissue 图 5 高精料日粮对泌乳奶山羊肝、脾组织TLR4通路相关主要蛋白表达的影响 Fig. 5 Effect of high concentrate diet on key proteins of TLR4 pathway of hepatic and spleen tissues of lactating dairy goats |
为了提高奶畜的生产性能,养殖业中常通过饲喂高精料以满足奶畜的能量需求。饲喂高精料在短期内可以快速提升泌乳奶畜的产奶量,但可导致奶牛发生乳脂抑制,降低牛奶乳脂率[12-13]。乳脂率与瘤胃中乙酸/丙酸比例呈正相关关系,高精料日粮在瘤胃中发酵产生大量丙酸,导致乙酸/丙酸比例下降,引起乳脂率下降[14]。此外,饲喂高精料导致泌乳奶牛乳腺中参与脂肪酸合成的酶基因与蛋白表达水平显著下降,诱导了乳脂抑制的发生[15]。曹洋等[16]研究指出,长期饲喂高精料日粮导致奶牛肝内脂代谢发生显著改变,脂肪酸合成代谢减弱而分解代谢增强,引起肝内甘油三酯(triglyceride, TG)和游离脂肪酸(free fatty acid, FFA)发生重分配,肝TG和FFA净输出含量显著减少,从而导致乳脂前体物供应不足,最终引起奶牛乳脂率降低。Dong等[17]给泌乳奶山羊饲喂60:40高精料日粮,其乳汁中的乳脂和乳蛋白均显著降低,而且这种趋势随着饲喂高精料时间的延长愈加明显。本研究发现,试验组奶山羊乳脂率一直低于对照组,且从试验的16周开始,与对照组相比差异显著(P < 0.05)(图 1),说明高精料日粮可以通过下调乳汁中的乳脂率导致奶山羊乳品质下降。
动物胃肠道正常的pH,一则能维持正常的大肠菌群,二则能维持机体对水分和养分的吸收能力,也是减少腹泻的基本条件之一[18]。瘤胃内容物pH是评价瘤胃内环境的直观指标,不仅能反映瘤胃内的发酵情况,也可用于瘤胃酸中毒等疾病的诊断。收集瘤胃内容物样品进行pH测定可选用瘤胃穿刺法、口腔法或瘤胃瘘管法,各有优缺点[19]。通过对粪便pH的测定,也可以直接或间接地了解动物肠道健康和消化情况,粪便的形态、颜色、pH可以作为一种快速诊断动物消化生理情况的辅助手段[20]。本研究发现,试验组奶山羊粪便pH从9周开始下降,13~18周与对照组相比差异显著(P < 0.05)(图 2),说明长期饲喂高精料日粮导致奶山羊肠道pH降低,肠道pH降低提示奶山羊瘤胃内容物pH降低了,但由于条件所限,本次试验没有测定奶山羊瘤胃内容物pH,具体有待进一步研究。
肝是机体维持生命活动必不可少的重要器官之一,参与机体消化、代谢、解毒和免疫等过程。在奶牛和滩羊上的研究显示,精料含量过高使日粮中纤维含量减少会降低瘤胃发酵,导致瘤胃内挥发性脂肪酸积聚,造成瘤胃内pH降低。当瘤胃内pH降到一定程度会引发SARA,瘤胃内低pH还会造成瘤胃内革兰阴性菌增殖崩解,释放大量LPS,LPS经门静脉进入肝,当超过肝的清除能力时,会造成肝的炎性损伤[21-25]。郭峻菲[5]在荷斯坦奶牛上的研究发现,高精料(精粗比6:4)诱导的SARA导致奶牛肝组织发生炎性细胞浸润,肝细胞肿胀变性。Guo等[26]给奶牛饲喂高精料诱导SARA模型,发现SARA导致奶牛肝细胞肿大和肝组织炎性细胞浸润。本研究中,高精料组奶山羊肝小叶中有淋巴细胞浸润,肝细胞肿大,出现颗粒变性和空泡变性,表明肝组织有炎症反应,这可能是长期饲喂高精料导致奶山羊发生SARA,来源于瘤胃和肠道的LPS,通过门静脉进入肝,造成肝组织炎性损伤。脾是动物机体重要的外周免疫器官之一,也是免疫应答发生的重要场所。当受到病原微生物或异物刺激时,动物脾白髓淋巴小结中的B细胞和动脉周围淋巴鞘中的T细胞受抗原刺激活化、增殖并分化,使脾体积变大[8]。本研究中,高精料组奶山羊脾淋巴小结和动脉周围淋巴鞘均无明显变化(图 3E~H),提示试验期间无病原微生物或异物刺激奶山羊产生特异性免疫应答。
TLR4是识别内毒素/脂多糖的主要受体,在血清中,LPS由LPS结合蛋白运送至单核/巨噬细胞膜表面,与CD14分子结合形成复合体,再与TLR4/MD2相互作用,激活TLR4下游信号通路[27]。髓样分化因子88(myeloid differentiation factor 88, MyD88)是TLR4信号通路中的一个关键接头分子,与NF-κB构成炎症反应通路[28-29]。NF-κB是细胞内重要的核转录因子,参与机体的炎症反应、免疫应答等,该家族有5个成员,包括NF-κB1 (p50)、NF-κB2(p52)、RelA(p65)、RelB和c-Rel。通常所说的NF-κB蛋白,是指p65/p50亚单位形成的NF-κB1二聚体蛋白,RelB/p52亚单位形成NF-κB2二聚体蛋白[30]。Guo等[26]给奶牛饲喂高精料建立奶牛SARA模型,发现SARA奶牛肝中MAPK和NF-κB信号通路被激活,血液中的TNF-α、IL-1β和IL-6浓度均升高。李振富[31]指出,饲喂高精料日粮导致泌乳中期荷斯坦奶牛肝中组胺含量和组胺H1受体表达量均升高,组胺可能通过H1受体途径激活NF-κB信号通路,从而导致NF-κB、IL-1β、IL-6、TNF-α基因相对表达量均高于低精料组。郭峻菲[5]的研究结果显示,高精料日粮诱导的SARA导致试验组奶牛肝组织中IL-6和外周血中IL-1β、IL-6、TNF-α mRNA的相对表达均显著高于低精料组。王绍庆[32]长期用高精料饲喂泌乳期奶山羊,其肝组织中TLR4基因表达量显著升高。本研究中,试验组奶山羊肝组织中IL-6和TNF-β mRNA相对表达显著升高,脾组织中TNF-β和IL-10 mRNA相对表达显著升高,提示高精料日粮影响了奶山羊的免疫功能,引起促炎细胞因子与抗炎细胞因子的失衡,使奶山羊长期处于免疫应激状态。试验组奶山羊肝、脾组织中TLR4基因表达均显著升高,肝组织中NF-κB2基因表达显著升高,结合试验组奶山羊肝小叶中央静脉中有大量淋巴细胞浸润,推测长期饲喂高精料日粮通过激活TLR4通路导致奶山羊肝组织炎性损伤;脾组织中虽然TNF-β mRNA相对表达也显著升高,但IL-10 mRNA相对表达也显著升高,且脾组织形态结构变化不明显,说明长期饲喂高精料日粮对奶山羊脾的炎性损伤不明显。
采用Western blot技术检测TLR4通路中调控炎性细胞因子转录的p38、JNK、ERK和p65蛋白表达水平,发现试验组奶山羊肝组织中这4种蛋白的表达变化均不明显;脾组织JNK表达变化不明显,p38、ERK和p65表达均呈现下降趋势,但与对照组相比虽差异不显著。李振富[31]在泌乳中期荷斯坦奶牛上的研究显示,高精料日粮导致奶牛肝组织中NF-κB、p65和p-p65蛋白表达均升高,与本研究在奶山羊上获得的结果不一致,具体原因还需要对这些蛋白的活化形式进一步研究确定。
4 结论长期给奶山羊饲喂高精料日粮导致乳汁中乳脂率降低而影响乳品质;高精料日粮导致奶山羊粪便pH降低,通过上调NF-κB基因的表达诱导肝组织中IL-6和TNF-β基因表达升高,从而对肝造成炎性损伤。
| [1] |
孙燕勇, 徐明, 高民, 等. 亚急性瘤胃酸中毒对反刍动物瘤胃上皮及内环境影响的研究进展[J]. 动物营养学报, 2018, 30(4): 1253–1261.
SUN Y Y, XU M, GAO M, et al. Research progress of effects of subacute ruminal acidosis on rumen epithelium and internal environment of ruminants[J]. Chinese Journal of Animal Nutrition, 2018, 30(4): 1253–1261. DOI: 10.3969/j.issn.1006-267x.2018.04.007 (in Chinese) |
| [2] |
田平, 孙利利, 董海波, 等. 饲喂高精料日粮对泌乳期山羊泌乳性能及抗氧化能力的影响[J]. 草业学报, 2017, 26(4): 99–105.
TIAN P, SUN L L, DONG H B, et al. Effects of feeding high concentrate diets on lactation indicators and antioxidant levels in the mammary glands of lactating goats[J]. Acta Prataculturae Sinica, 2017, 26(4): 99–105. (in Chinese) |
| [3] |
韩帅.瘤胃内容物互换对健康和亚急性瘤胃酸中毒奶山羊脂多糖吸收的影响[D].泰安: 山东农业大学, 2019.
HAN S.Effects of rumen content exchange on absorption of lipopolysaccharide in dairy goats with health and subacute ruminal acidosis[D].Tai'an: Shandong Agricultural University, 2019.(in Chinese) |
| [4] |
杨游.高精料饲粮引起肉牛机体代谢组的变化及其营养调控效果研究[D].重庆: 西南大学, 2018.
YANG Y.A study on the metabolomics profiling alterations associated with the high-concentrate diet in beef cattle and the effects of nutritional modulations[D].Chongqing: Southwest University, 2018.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10635-1019818210.htm |
| [5] |
郭峻菲.亚急性瘤胃酸中毒(SARA)对反刍动物肝脏的炎性损伤与SARA的调控研究[D].南京: 南京农业大学, 2017.
GUO J F.Inflammatory injury in the liver of ruminants by subacute ruminal acidosis (SARA) and manipulation of SARA[D].Nanjing: Nanjing Agricultural University, 2017.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10307-1019134335.htm |
| [6] | TAO S Y, DUANMU Y Q, DONG H B, et al. A high-concentrate diet induced colonic epithelial barrier disruption is associated with the activating of cell apoptosis in lactating goats[J]. BMC Vet Res, 2014, 10: 235. DOI: 10.1186/s12917-014-0235-2 |
| [7] |
叶传涛, 魏欣, 张颖. 肝脏固有免疫系统研究现状[J]. 临床肝胆病杂志, 2014, 30(9): 846–850.
YE C T, WEI X, ZHANG Y. Current status of research on liver innate immunity[J]. Journal of Clinical Hepatology, 2014, 30(9): 846–850. DOI: 10.3969/j.issn.1001-5256.2014.09.003 (in Chinese) |
| [8] |
曹雪涛.
医学免疫学[M]. 7版. 北京: 人民卫生出版社, 2018.
CAO X T. Medical immunology [M]. 7th ed. Beijing: People's Medical Publishing House, 2018. (in Chinese) |
| [9] | LI N Y, ANSARI A R, SUN Z J, et al. Toll like receptor 4 signaling pathway participated in Salmonella lipopolysaccharide-induced spleen injury in young chicks[J]. Microb Pathog, 2017, 112: 288–294. DOI: 10.1016/j.micpath.2017.10.004 |
| [10] | NEŽIĆ L, AMIDŽIĆ L, ŠKRBIĆ R, et al. Simvastatin inhibits endotoxin-induced apoptosis in liver and spleen through Up-regulation of survivin/NF-κB/p65 expression[J]. Front Pharmacol, 2019, 10: 54. DOI: 10.3389/fphar.2019.00054 |
| [11] |
黄智南.日粮营养对前胃上皮生长和组织形态的影响[D].南京: 南京农业大学, 2010.
HUANG Z N.The effects of nutrition level on the growth and morphology of forestomach epithelial[D].Nanjing: Nanjing Agricultural University, 2010.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10307-1012268714.htm |
| [12] | STERK A, JOHANSSON B E O, TAWEEL H Z H, et al. Effects of forage type, forage to concentrate ratio, and crushed linseed supplementation on milk fatty acid profile in lactating dairy cows[J]. J Dairy Sci, 2011, 94(12): 6078–6091. DOI: 10.3168/jds.2011-4617 |
| [13] |
王建平, 王加启, 卜登攀. 精料和饱和脂肪酸对奶牛生产性能和乳中脂肪酸组成的影响[J]. 中国粮油学报, 2015, 30(1): 92–96.
WANG J P, WANG J Q, BU D P. Effects of concentrate and supplemental saturated fatty acid on milk production and milk fatty acid profile of dairy cow[J]. Journal of the Chinese Cereals and Oils Association, 2015, 30(1): 92–96. (in Chinese) |
| [14] | MAXIN G, GLASSER F, HURTAUD C, et al. Combined effects of trans-10, cis-12 conjugated linoleic acid, propionate, and acetate on milk fat yield and composition in dairy cows[J]. J Dairy Sci, 2011, 94(4): 2051–2059. DOI: 10.3168/jds.2010-3844 |
| [15] | DONG G Z, QIU M, AO C J, et al. Feeding a high-concentrate corn straw diet induced epigenetic alterations in the mammary tissue of dairy cows[J]. PLoS One, 2014, 9(9): e107659. DOI: 10.1371/journal.pone.0107659 |
| [16] |
曹洋, 李林, 谢正露, 等. 高精料日粮饲喂诱导泌乳奶牛发生乳脂抑制的机制[J]. 农业生物技术学报, 2016, 24(11): 1718–1725.
CAO Y, LI L, XIE Z L, et al. The mechanism of high concentrate diet fed induced milk fat depression in lactating dairy cows (Bos taurus)[J]. Journal of Agricultural Biotechnology, 2016, 24(11): 1718–1725. (in Chinese) |
| [17] | DONG H B, WANG S Q, JIA Y Y, et al. Long-term effects of Subacute Ruminal Acidosis (SARA) on milk quality and hepatic gene expression in lactating goats fed a high-concentrate diet[J]. PLoS One, 2013, 8(12): e82850. DOI: 10.1371/journal.pone.0082850 |
| [18] |
王洪荣. 反刍动物瘤胃酸中毒机制解析及其营养调控措施[J]. 动物营养学报, 2014, 26(10): 3140–3148.
WANG H R. Mechanism analysis and nutritional strategies for prevention of sub-acute ruminal acidosis in ruminants[J]. Chinese Journal of Animal Nutrition, 2014, 26(10): 3140–3148. DOI: 10.3969/j.issn.1006-267x.2014.10.028 (in Chinese) |
| [19] |
赵小伟, 王加启, 卜登攀, 等. 奶牛瘤胃pH不同测定方法的比较研究[J]. 中国畜牧兽医, 2013, 40(11): 213–216.
ZHAO X W, WANG J Q, BU D P, et al. Comparative study on two different test methods in rumen pH of dairy cows[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(11): 213–216. DOI: 10.3969/j.issn.1671-7236.2013.11.049 (in Chinese) |
| [20] |
梁雯霏. 猪粪便pH值现场测定及其意义[J]. 广东畜牧兽医科技, 2018, 43(6): 26–28.
LIANG W F. Field measurement of porcine feces pH and its significance[J]. Guangdong Journal of Animal and Veterinary Science, 2018, 43(6): 26–28. DOI: 10.3969/j.issn.1005-8567.2018.06.009 (in Chinese) |
| [21] |
郭峻菲.内源性LPS对奶牛肝脏的炎性损伤与机理研究[D].南京: 南京农业大学, 2014.
GUO J F.Research on inflammatory damage and mechanism od endogenous LPS on the liver of dairy cows[D].Nanjing: Nanjing Agricultural University, 2014.(in Chinese) http://d.wanfangdata.com.cn/Conference/8765404 |
| [22] |
马娇丽, 董国忠, 吴剑波. 高精料饲粮引起奶牛瘤胃液代谢组的变化及其对奶牛健康的影响[J]. 动物营养学报, 2016, 28(1): 27–34.
MA J L, DONG G Z, WU J B. High concentrate diets induces changes of rumen fluid metabolome and impacts on health of dairy cows[J]. Chinese Journal of Animal Nutrition, 2016, 28(1): 27–34. DOI: 10.3969/j.issn.1006-267x.2016.01.005 (in Chinese) |
| [23] |
唐志文, 孙福昱, 杨亮, 等. 不同饲粮条件下奶牛胃肠道中内毒素浓度与炎症反应相关关系研究进展[J]. 家畜生态学报, 2018, 39(5): 6–10.
TANG Z W, SUN F Y, YANG L, et al. Concentrations of endotoxin in gastrointestinal tract of dairy cows under different dietary conditions and the relationship with inflammation[J]. Acta Ecologiae Animalis Domastici, 2018, 39(5): 6–10. DOI: 10.3969/j.issn.1673-1182.2018.05.002 (in Chinese) |
| [24] |
闫佰鹏, 兰贵生, 李发弟, 等. 反刍动物亚急性瘤胃酸中毒变异性的机制解析[J]. 动物营养学报, 2018, 30(5): 1655–1661.
YAN B P, LAN G S, LI F D, et al. Mechanism analysis of the variation in subacute ruminal acidosis in ruminants[J]. Chinese Journal of Animal Nutrition, 2018, 30(5): 1655–1661. DOI: 10.3969/j.issn.1006-267x.2018.05.007 (in Chinese) |
| [25] |
王尧悦, 赵钊艳, 王兴涛, 等. 日粮营养水平对150~180日龄滩羊瘤胃相关微生物菌群数量、pH和VFA含量的影响[J]. 畜牧兽医学报, 2016, 47(10): 2060–2070.
WANG Y Y, ZHAO Z Y, WANG X T, et al. Effect of dietary nutrient levels on the number of related microbes, pH and VFA levels in rumen of tan sheep aged from 150 to 180 Days[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(10): 2060–2070. DOI: 10.11843/j.issn.0366-6964.2016.10.015 (in Chinese) |
| [26] | GUO J F, CHANG G J, ZHANG K, et al. Rumen-derived lipopolysaccharide provoked inflammatory injury in the liver of dairy cows fed a high-concentrate diet[J]. Oncotarget, 2017, 8(29): 46769–46780. DOI: 10.18632/oncotarget.18151 |
| [27] | MILLER S I, ERNST R K, BADER M W. LPS, TLR4 and infectious disease diversity[J]. Nat Rev Microbiol, 2005, 3(1): 36–46. DOI: 10.1038/nrmicro1068 |
| [28] | LU Y C, YEH W C, OHASHI P S. LPS/TLR4 signal transduction pathway[J]. Cytokine, 2008, 42(2): 145–151. |
| [29] |
胡红莲, 谢天宇, 杨淑青, 等. 亚急性瘤胃酸中毒对奶山羊血浆细胞因子和激素含量的影响[J]. 动物营养学报, 2015, 27(2): 418–425.
HU H L, XIE T Y, YANG S Q, et al. Effects of subacute ruminal acidosis on plasma cytokine and hormone contents in dairy goats[J]. Chinese Journal of Animal Nutrition, 2015, 27(2): 418–425. DOI: 10.3969/j.issn.1006-267x.2015.02.012 (in Chinese) |
| [30] | LAWRENCE T. The nuclear factor NF-κB pathway in inflammation[J]. Cold Spring Harb Perspect Biol, 2009, 1(6): a001651. |
| [31] |
李振富.高精料日粮条件下反刍动物瘤胃中产生的组胺对肝脏炎性信号通路的影响与调控[D].南京: 南京农业大学, 2016.
LI Z F.Effect and regulation of histamine produced in the rumen of a high concentrate diet on the inflammatory signal pathway of the liver[D].Nanjing: Nanjing Agricultural University, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10307-1017260104.htm |
| [32] |
王绍庆.亚急性瘤胃酸中毒(SARA)对山羊肝脏免疫机能的影响[D].南京: 南京农业大学, 2013.
WANG S Q.Effects of subacute ruminal acidosis (SARA) on immune function in liver of goats[D].Nanjing: Nanjing Agricultural University, 2013.(in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10307-1014216606.htm |



