宫内发育迟缓(intrauterine growth retardation,IUGR)是人类医学以及动物健康中的一个主要问题,通常被定义为妊娠期哺乳动物胎儿的生长发育受损[1]。其特点是出生体重较低,并且导致新生儿和幼畜,特别是经产动物(如猪)的高发病率和死亡率[2]。研究表明,IUGR会导致机体器官发育受损,包括器官大小和生理结构,引起相应器官功能障碍[3]。在畜牧业生产中,除了先天畸形和遗传缺陷外,IUGR的发生还受到多种因素的影响,包括环境污染、母体胎盘营养不良、疾病感染等[4-5]。除了高死亡率和发病率,IUGR已经被证实与仔猪肝发育受损和胰岛素抵抗有关[6-7]。He等[8]在哺乳仔猪中发现,IUGR导致机体发生了胰岛素抵抗。且Zhang等[9]在断奶仔猪中发现,IUGR对血糖和胰岛素浓度有不良影响,也导致了机体发生胰岛素抵抗。肝是参与机体营养代谢的主要器官,在妊娠期易受IUGR的影响,导致肝细胞出现空泡化,肝内各细胞器出现不同程度的损伤。因此,寻求一种有效且无毒的天然药物,对于预防和治疗IUGR导致的机体胰岛素抵抗和肝发育受损是非常重要的。
双氢青蒿素(C15H24O5,DHA)是青蒿素类药物在体内主要的代谢产物[10]。与青蒿素相比,DHA具有更好的水溶性,更易于吸收,排泄且代谢更快,效率更高,毒性更低[11]。除了抗疟作用外,DHA还可以预防肥胖和改善与肥胖相关的脂代谢紊乱[12]。另有研究表明,青蒿素类药物可以显著提高肝的重量并改善由四氯化碳诱导的肝组织形态学损伤[13]。李敏等[14]研究发现,双氢青蒿素可以显著改善由刀豆蛋白A诱导的肝损伤。猪是常见的多胎生家畜,在人类健康调节和动物营养方面都有着广泛的研究。在妊娠期由于营养不足,仔猪发生IUGR的几率较大[15]。然而目前关于DHA对IUGR断奶仔猪治疗作用的研究非常有限。因此,本试验选择IUGR断奶仔猪作为研究模型,探讨日粮添加80 mg·kg-1 DHA对IUGR断奶仔猪肝发育和胰岛素抵抗的影响。
1 材料与方法 1.1 试验材料双氢青蒿素购自南京道斯夫生物科技有限公司(江苏,中国),生产批号为180526R,化学物质登录号为7193950-50-9,纯度为99%。
1.2 试验动物与饲养管理试验在上海农场晚庄畜牧场(江苏大丰)进行,前期选择品种相同、体重相似、胎次和预产期相近的健康妊娠母猪30头,所有母猪均采用相同的妊娠期日粮进行喂养,日粮符合国家研究委员会(NRC)(2012年)规定的营养要求。在母猪分娩时,选择10窝新生仔猪(杜洛克×长白×约克夏)。每窝选择2头IUGR仔猪和1头正常出生体重(normal birth weight,NBW)仔猪。IUGR的选择标准参照Wang等[5],当仔猪出生体重低于平均出生体重的两个标准差时,则可被定义为IUGR。NBW仔猪出生重为(1.56±0.02) kg,IUGR仔猪出生体重为(0.99±0.03) kg。所有仔猪母乳至21日龄断奶。断奶后,将仔猪分为3个试验组(n=10),每组有10头断奶仔猪,公母各半。分别为:NBW组(正常出生重仔猪饲喂基础日粮)、IUGR组(宫内发育迟缓仔猪饲喂基础日粮)、IUGR-DHA(宫内发育迟缓仔猪饲喂基础日粮+80 mg·kg-1 DHA),饲喂至49日龄。基础日粮的配制根据NRC(2012)猪的营养需要而定。基础日粮的组成及营养成分见表 1。所有仔猪自由饮水和采食。猪圈清理、消毒、猪的免疫等程序都严格按照猪场饲养管理要求进行操作。
|
|
表 1 日粮配方和营养水平 Table 1 The composition and nutrient content of diets |
49日龄时,仔猪空腹12 h后,每组挑选8只最接近平均体重的仔猪进行颈静脉穿刺取血,在4 ℃条件下3 000 × g离心15 min,取血清分装好放置于-80 ℃冰箱保存待用。接着,所有仔猪电晕后颈静脉放血至死,剖开腹腔立即取出肝左叶部分样本,并在-80 ℃下保存以供进一步分析。在肝左叶相同部分取1 mm3并迅速用多聚甲醛固定用于肝组织切片制作,另取相同大小肝样本迅速浸入2.5%的戊二醛和1%的四氧化锇(V·V-1)中固定用于透射电镜观察。
1.4 测定指标及方法1.4.1 器官指数 仔猪屠宰后,将肝迅速分离并用生理盐水洗去表面血渍,用滤纸擦干净后称重,使用以下公式计算肝的器官指数:
器官指数(g·kg-1)=器官质量(g)/宰前体重(kg)。
1.4.2 血清胰岛素水平的测定 取-80 ℃冰箱保存的血清,使用上海易利生物技术有限公司的酶联免疫吸附试验(ELISA)试剂盒测定血清中空腹葡萄糖(fasting glucose,FBG),空腹胰岛素(fasting insulin,FINS)以及胰岛素生长因子(insulin-like growth factor-1,IGF-1)含量。并且通过胰岛素动态抵抗模型(homeostasis model assessment of insulin resistance,HOMA-IR)来评判胰岛素抵抗水平。
HOMA-IR=[FBG(mmol·L-1)×FINS(μU·mL-1)]/22.5。
1.4.3 肝组织形态切片的制作和观察 仔猪屠宰后,迅速取出肝,在肝左叶相同部分取1 mm3并迅速用多聚甲醛固定。经过石蜡包埋,切片机进行切片(6 μm),最后进行苏木精伊红染色(HE)。每组选择8张切片,使用带有数码相机(Nikon H550L,尼康公司,东京,日本)的倒置光学显微镜(Olympus BX5,奥林巴斯公司,东京,日本)对组织切片进行观察,并拍照。
1.4.4 肝的透射电镜观察 仔猪屠宰后,迅速取出肝,在肝左叶相同部分取1 mm3并迅速浸入2.5%的戊二醛和1%的四氧化锇(V·V-1)中固定4 h。用不同浓度梯度的乙醇和丙酮脱水后,用透射电子显微镜(H-7650;,日立公司,东京,日本)对肝超微结构进行观察评估。
1.4.5 肝中基因相对mRNA表达量测定测定 肝中IGF-1、INSR、PI3K、IRS1、AKT2的mRNA表达量的变化。取60 mg肝组织样品加入1 mL Trizol(试剂购自Invitrogen公司),按照说明书的步骤进行RNA提取。使用NanoDrop1000测定所提取的RNA的纯度和浓度,保证1.8≤OD260/OD280≤2.0。RNA的完整性通过10 g·L-1琼脂糖凝胶电泳确认。并用焦碳酸二乙酯处理(DEPC)水将提取好的RNA统一浓度至500 ng·μL-1。接着使用TaKaRa反转录试剂盒对已稀释的RNA进行反转录,反转录参数为:37 ℃反应15 min,3次循环;85 ℃变性5 s。反应体系为20 μL:14 μL超纯水、4 μL PrimeScript RT Enzyme Mix和2 μL RNA模板。其产物cDNA于-20 ℃冰箱保存待测。接着使用TaKaRa的SYBR® Premix Ex TaqTM定量试剂盒进行实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction, qRT-PCR),反应体系为20 μL:10 μL SYBR Premix Ex Taq, 0.4 μL ROX Reference Dye, 6.8 μL超纯水, 上下游引物各0.4 μL和2 μL cDNA模板。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40次循环。特异性引物见表 2。目的基因的相对表达含量以GAPDH为内参,采用比较2-ΔΔCt法进行计算目的基因相对表达量,以NBW组为对照组。
|
|
表 2 RT-PCR引物序列 Table 2 The primer sequences used in the real-time PCR |
试验数据经过Excel初步处理后,采用SPSS Statistics 20进行分析,结果以“平均值±标准误”表示。所有数据采用单因素方差分析中的Duncan’s法进行多重比较,以P<0.05作为差异显著性的判断标准。
2 结果 2.1 DHA对IUGR断奶仔猪肝重量以及器官指数的影响由表 3可以看出。与NBW组相比,IUGR显著降低了断奶仔猪肝重量(P < 0.05),显著升高了肝脏指数(P < 0.05)。日粮添加DHA后显著升高了IUGR断奶仔猪肝重量(P < 0.05)。
|
|
表 3 日粮添加DHA对IUGR断奶肝脏指数的影响 Table 3 Effects of dietary DHA supplementation on liver index of IUGR weaned piglets |
由表 4可以看出,与NBW组相比,IUGR组断奶仔猪血清FBG和IGF-1含量显著下降(P < 0.05),FINS含量和HOMA-IR显著升高(P < 0.05)。日粮添加DHA显著降低了IUGR断奶仔猪血清FINS含量和HOMA-IR(P < 0.05),提高了IGF-1含量(P < 0.05)。
|
|
表 4 日粮添加DHA对IUGR断奶仔猪血清胰岛素水平的影响 Table 4 Effects of dietary DHA supplementation on serum insulin levels of IUGR weaned piglets |
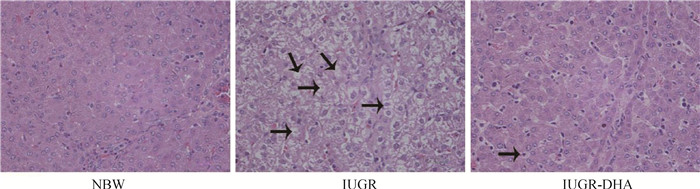
日粮添加DHA对IUGR断奶仔猪肝组织形态的影响见图 1。NBW组肝组织形态结构正常,胞浆保存良好,肝细胞分布均匀,细胞间隙紧密。与NBW组相比,IUGR组断奶仔猪肝细胞排列紊乱,细胞间隙较为疏松,出现明显的肝细胞空泡化和肝细胞结构溶解(箭头所示)。日粮添加DHA有效改善了IUGR导致的病变,缓解了IUGR断奶仔猪肝细胞空泡化和细胞结构溶解。
|
图 1 日粮添加DHA对宫内发育迟缓断奶仔猪肝组织形态的影响(200×) Fig. 1 Effects of dietary DHA supplementation on hepatic histology in IUGR piglets (200×) |
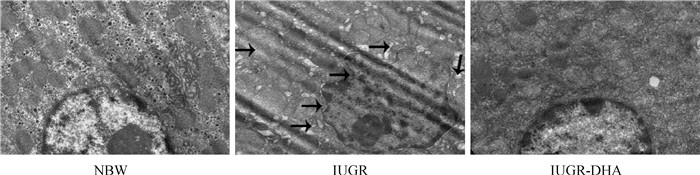
日粮添加DHA对IUGR断奶仔猪肝超微结构的影响见图 2。如图所示,NBW组肝细胞的超微结构未见异常。细胞质为正常的圆形细胞核、线粒体和粗面内质网。与NBW组相比,IUGR组肝细胞出现退行性改变。线粒体和内质网明显肿胀,细胞核严重变形,细胞核和细胞质周围出现间隙。日粮添加DHA有效的缓解了IUGR导致的肝超微结构的异常。
|
图 2 日粮添加DHA对IUGR断奶仔猪肝超微结构的影响(6 000×) Fig. 2 Effects of dietary DHA supplementation on hepatic ultrastructure in IUGR piglets under transmission electron microscopy (6 000×) |
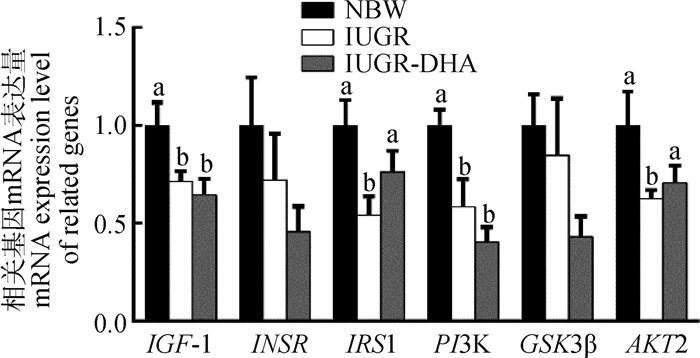
日粮添加DHA对IUGR断奶猪仔猪胰岛素水平相关基因表达量的影响见图 3。从图 3可以看出,与NBW组相比,IUGR断奶仔猪肝中IGF-1、IRS1、PI3K和AKT2的mRNA相对表达量显著下调(P < 0.05)。日粮添加DHA显著上调了IUGR断奶仔猪肝中IRS1和AKT2的mRNA相对表达量(P < 0.05)。
|
图 3 日粮添加DHA对IUGR断奶仔猪肝胰岛素水平以及糖代谢相关基因mRNA表达量的影响 Fig. 3 Effects of dietary DHA supplementation on insulin and glucose metabolism related genes mRNA expression in the liver of IUGR piglets |
IUGR可定义为哺乳动物在怀孕期间胚胎及其器官的生长发育受损。通常表现为出生重低,各组织器官发育不良[4]。研究发现,IUGR会导致仔猪发生胰岛素抵抗。临床研究中,HOMA-IR值被广泛用作胰岛素抵抗指数[16]。较高的葡萄糖和胰岛素水平以及HOMA-IR值提示了胰岛素抵抗的风险增加[17]。IGF-1具有促进物质代谢以及生长发育等作用,同时还可以调节机体免疫功能[18]。当机体出现生理疾病时,IGF-1水平变化超出其自身调节范围,就会导致机体出现异常情况。研究发现,低水平的IGF-1能反映胰岛素抵抗的程度[19]。另外Baker等[20]发现,低水平的IGF-1会导致IUGR。本试验结果显示,IUGR导致断奶仔猪血清FBG和IGF-1水平显著降低,胰岛素浓度升高。提示肝内糖代谢水平异常。进一步计算HOMA-IR值后,我们还发现IUGR发生了严重的胰岛素抵抗。在哺乳仔猪[8]和成年大鼠[21]中,IUGR增加了血糖和胰岛素浓度,增加了HOMA-IR值,表明IUGR导致了胰岛素抵抗。Zhang等[9]同样发现IUGR导致断奶仔猪出现了胰岛素抵抗。另一方面,Ying等[6]在105 d的仔猪中发现,IUGR导致血糖和胰岛素浓度随着HOMA-IR值的增加而增加。其结果都与本试验相似。而日粮添加80 mg·kg-1 DHA后,IUGR仔猪血清胰岛素水平恢复正常,IGF-1含量也得到了显著提高。提示DHA可能通过提高IGF-1的含量来缓解IUGR导致的胰岛素抵抗。
为了明确IUGR导致断奶仔猪发生胰岛素抵抗的确切机制,我们进一步测试了胰岛素以及糖代谢相关基因的mRNA相对表达量。胰岛素受体底物1(insulin receptor substrate 1,IRS1)是一种对接蛋白,磷酸化后能激活磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K),这是启动胰岛素一系列生理功能(如葡萄糖转运)的必要步骤[22]。Carvalho等[23]研究结果表明,肝中低表达的IRS1与胰岛素抵抗密切相关有关。当IRS1的表达较低时,可以明显观察到机体发生了胰岛素抵抗,另外IRS1的高表达可以激活PI3K对胰岛素的反应,进而促进机体葡萄糖的转运和摄取。本试验发现,IUGR导致断奶仔猪肝中IGF-1、IRS1、PI3K和蛋白激酶B(protein kinase B,AKT2)的mRNA相对表达量显著下降。Dominici等[24]发现,导致胰岛素抵抗的分子机制可能是由于IRS1的mRNA表达量下降。而PI3K途径是胰岛素信号传导通路的主要途径,可被IRS1激活。PI3K和AKT2表达量的降低进一步印证了上文中血清葡萄糖含量的降低。Ying等[6]研究发现,IUGR导致哺乳仔猪肝AKT2蛋白表达量显著降低,与本试验结果相似。且Zhang等[9]研究发现,IUGR导致断奶仔猪IRS1和PI3K的mRNA表达量显著下降,与本试验结果一致。日粮添加80 mg·kg-1 DHA显著提高了肝中IRS1和AKT2的mRNA表达量。Liao等[25]发现DHA可以显著提高AKT的mRNA表达量,与本试验结果相似。因此,本试验中DHA可能通过AKT基因调控来维持机体葡萄糖正常水平。这些结果表明,DHA在降低IUGR断奶仔猪胰岛素抵抗和维持肝糖原稳态方面具有一定的调节作用。
肝在营养物质以及其他饮食物质的代谢中起主要作用。越来越多的研究表明,IUGR对肝的代谢调节和生理功能具有一定的负面影响[26-27]。内脏器官的发育情况是评价机体能否正常发挥各器官生理功能的指标之一,器官指数也是动物试验中测定的基本指标之一,在一定程度上能够反映动物机体生长发育情况[28-29]。Bauer等[30]研究表明,新生仔猪的器官重量与体重呈正相关,与NBW仔猪相比,IUGR会导致仔猪的器官质量显著降低。本试验结果发现,IUGR显著降低了断奶仔猪肝重量,同时显著升高了肝脏指数。何进田等[31]发现,与NBW组相比,IUGR导致哺乳仔猪肝的重量降低了48.06%,但对肝脏指数没有影响,与本试验结果相似。肝脏指数升高表明肝发育快,代谢水平较高[32]。本试验发现,肝脏指数升高可能是因为IUGR导致断奶仔猪体重显著下降。另外,为了应对和补偿环境、营养和疾病等因素的制约,机体会进行补偿生长,在物质代谢和能量转化的动态变化中寻求达到一种相对动态平衡的反馈调节。冯程程等[33]研究表明,IUGR显著降低了肝的重量,同时显著升高了肝脏指数,与本试验结果一致。此外,IUGR断奶仔猪肝切片在光学显微镜中观察到肝细胞严重空泡化并且实质组织出现了溶解现象。在透射电镜观察中进一步显示,IUGR断奶仔猪肝细胞核发生严重变形,线粒体和内质网出现了不同程度肿胀,这些结果表明,IUGR导致断奶仔猪肝出现了严重的组织学损伤。He等[34]研究发现,与正常大鼠相比,IUGR大鼠肝细胞出现空泡化和水肿,脂肪细胞有轻度变性的迹象。Zhang等[35]也发现,IUGR导致断奶仔猪肝的组织形态发生损伤,局部出现水泡变性现象,与本试验结果相似。日粮添加DHA显著升高了IUGR断奶仔猪的肝的重量,说明DHA对肝的生长发育具有一定的促进作用。同时光镜和电镜的结果提示,DHA可减轻IUGR引起的肝组织形态学损伤。Zhao等[13]发现,青蒿素可以改善由四氯化碳诱导的肝组织形态学损伤,与本试验结果相似。以上结果表明,DHA可以缓解由IUGR导致的肝发育受损与形态学损伤。
4 结论本试验结果表明,IUGR可导致断奶仔猪肝发育受损,破坏肝组织结构,并且导致机体发生胰岛素抵抗,降低IGF-1水平。日粮添加80 mg·kg-1 DHA可显著改善肝发育,缓解IUGR导致的胰岛素抵抗,提高IGF-1水平。本研究首次将DHA应用于断奶仔猪,探究了DHA对IUGR导致的断奶仔猪肝损伤以及胰岛素抵抗的修复作用,为畜牧生产中对IUGR的早期治疗提供了一定的理论依据,但对于DHA的生产应用仍需进一步的研究与评价。
| [1] | RESNIK R. Intrauterine growth restriction[J]. Obstet Gynecol, 2002, 99(3): 490–496. |
| [2] | POLLACK R N, DIVON M Y. Intrauterine growth retardation:definition, classification, and etiology[J]. Clin Obstet Gynecol, 1992, 35(1): 99–107. |
| [3] | SANKARAN S, KYLE P M. Aetiology and pathogenesis of IUGR[J]. Best Pract Res Clin Obstet Gynaecol, 2009, 23(6): 765–777. DOI: 10.1016/j.bpobgyn.2009.05.003 |
| [4] | WU G, BAZER F W, WALLACE J M, et al. Board-invited review:intrauterine growth retardation:implications for the animal sciences[J]. J Anim Sci, 2006, 84(9): 2316–2337. DOI: 10.2527/jas.2006-156 |
| [5] | WANG Y X, ZHANG L L, ZHOU G L, et al. Dietary L-arginine supplementation improves the intestinal development through increasing mucosal Akt andmammalian target of rapamycin signals in intra-uterine growth retarded piglets[J]. Br J Nutr, 2012, 108(8): 1371–1381. DOI: 10.1017/S0007114511006763 |
| [6] | YING Z X, ZHANG H, SU W P, et al. Dietary methionine restriction alleviates hyperglycemia in pigs with intrauterine growth restriction by enhancing hepatic protein kinase b signaling and glycogen synthesis[J]. J Nutr, 2017, 147(10): 1892–1899. DOI: 10.3945/jn.117.253427 |
| [7] | MORTEZA A, ABDOLLAHI A, BANDARIAN M. Serum nitric oxide syntheses and lipid profile of the mothers with IUGR pregnancies uncomplicated with preeclampsia.Does insulin resistance matter?[J]. Gynecol Endocrinol, 2012, 28(2): 139–142. |
| [8] | HE J T, DONG L, XU W, et al. Dietary tributyrin supplementation attenuates insulin resistance and abnormal lipid metabolism in suckling piglets with intrauterine growth retardation[J]. PLoS One, 2015, 10(8): e0136848. DOI: 10.1371/journal.pone.0136848 |
| [9] | ZHANG J F, XU W, HAN H L, et al. Dietary leucine supplementation restores serum glucose levels, and modifying hepatic gene expression related to the insulin signal pathway in IUGR piglets[J]. Animals, 2019, 9(12): 1138. DOI: 10.3390/ani9121138 |
| [10] |
常明, 张相林, 刘晓, 等. 双氢青蒿素人体药动学及生物等效性研究[J]. 中国药房, 2006, 17(14): 1086–1088.
CHANG M, ZNANG X L, LIU X, et al. Study on pharmacokinetics and bioavailability of dihydroartemisinin in human body[J]. China Pharmacy, 2006, 17(14): 1086–1088. DOI: 10.3969/j.issn.1001-0408.2006.14.020 (in Chinese) |
| [11] |
喻婉莹, 阚伟娟, 于鹏霞, 等. 青蒿素和二氢青蒿素的抗炎作用及机制[J]. 中国中药杂志, 2012, 37(17): 2618–2621.
YU W Y, KAN W J, YU P X, et al. Anti-inflammatory effect and mechanism of artemisinin and dihydroar-temisinin[J]. China Journal of Chinese Materia Medica, 2012, 37(17): 2618–2621. (in Chinese) |
| [12] | LU P, ZHANG F C, QIAN S W, et al. Artemisinin derivatives prevent obesity by inducing browning of WAT and enhancing BAT function[J]. Cell Res, 2016, 26(10): 1169–1172. DOI: 10.1038/cr.2016.108 |
| [13] | ZHAO X Y, WANG L Q, ZHANG H, et al. Protective effect of artemisinin on chronic alcohol induced-liver damage in mice[J]. Environ Toxicol Pharmacol, 2017, 52: 221–226. DOI: 10.1016/j.etap.2017.04.008 |
| [14] |
李敏, 金晓琨, 李卫东. 双氢青蒿素保护刀豆蛋白A诱导的小鼠肝损伤及机制探讨[J]. 中国药理学通报, 2009, 25(5): 630–633.
LI M, JIN X K, LI W D. The protective effect of DQHS on ConA-induced liveRinjury in mice and its mechanism[J]. Chinese Pharmacological Bulletin, 2009, 25(5): 630–633. DOI: 10.3321/j.issn:1001-1978.2009.05.018 (in Chinese) |
| [15] | CHE L Q, XUAN Y, HU L, et al. Effect of postnatal nutrition restriction on the oxidative status of neonates with intrauterine growth restriction in a pig model[J]. Neonatology, 2015, 107(2): 93–99. DOI: 10.1159/000368179 |
| [16] | YIN J H, LI M, XU L, et al. Insulin resistance determined by Homeostasis Model Assessment (HOMA) and associations with metabolic syndrome amongChinese children and teenagers[J]. Diabetol Metab Syndr, 2013, 5(1): 71. |
| [17] |
曲晓洁, 白雪山, 吴秀英, 等. 葡萄糖转运蛋白2和4在自发高尿酸血症小鼠发生胰岛素抵抗中的作用[J]. 中华内分泌代谢杂志, 2018, 34(10): 862–866.
QU X J, BAI X S, WU X Y, et al. Role of glucose transporter 2 and 4 ininsulin resistance in spontaneous hyperuricemia mice[J]. Chinese Journal of Endo-crinology and Metabolism, 2018, 34(10): 862–866. DOI: 10.3760/cma.j.issn.1000-6699.2018.10.011 (in Chinese) |
| [18] |
邓兴照, 彭华, 刘福柱. 类胰岛素生长因子-Ⅰ及其营养调控[J]. 中国畜牧杂志, 2005, 41(3): 39–41.
DENG X Z, PENG H, LIU F Z. IGF-Ⅰ and nutrition modulation[J]. Chinese Journal of Animal Science, 2005, 41(3): 39–41. DOI: 10.3969/j.issn.0258-7033.2005.03.015 (in Chinese) |
| [19] | YAKAR S, LIU J L, FERNANDEZ A M, et al. Liver-specific igf-1 gene deletion leads to muscle insulin insensitivity[J]. Diabetes, 2001, 50(5): 1110–1118. DOI: 10.2337/diabetes.50.5.1110 |
| [20] | BAKER J, LIU J P, ROBERTSON E, et al. Role of insulin-like growth factors in embryonic and postnatal growth[J]. Cell, 1993, 75(1): 73–82. |
| [21] | NIU Y, HE J T, AHMAD H, et al. Curcumin atte-nuates insulin resistance and hepatic lipidaccumulation in a rat model of intra-uterine growth restriction through insulin signalling pathway and sterol regulatory element binding proteins[J]. Br J Nutr, 2019, 122(6): 616–624. DOI: 10.1017/S0007114519001508 |
| [22] | HARA K, YONEZAWA K, SAKAUE H, et al. 1-Phosphatidylinositol 3-kinase activity is required for insulin-stimulated glucose transport but not for RAS activation in CHO cells[J]. Proc Natl Acad Sci USA, 1994, 91(16): 7415–7419. DOI: 10.1073/pnas.91.16.7415 |
| [23] | CARVALHO E, JANSSON P A, AXELSEN M, et al. Low cellular IRS 1 gene and protein expression predict insulin resistance and NIDDM[J]. FASEB J, 1999, 13(15): 2173–2178. DOI: 10.1096/fasebj.13.15.2173 |
| [24] | DOMINICI F P, HAUCK S, ARGENTINO D P, et al. Increased insulin sensitivity and upregulation of insulin receptor, insulin receptor substrate (IRS)-1 and IRS-2 in liver of Ames dwarf mice[J]. J Endocrinol, 2002, 173(1): 81–94. |
| [25] | LIAO K, LI J, WANG Z L. Dihydroartemisinin inhi-bits cell proliferation via AKT/GSK3β/cyclinD1 pathway and induces apoptosis in A549 lung cancer cells[J]. Int J Clin Exp Pathol, 2014, 7(12): 8684–8691. |
| [26] |
何进田, 董丽, 白凯文, 等. 三丁酸甘油酯对宫内发育迟缓哺乳仔猪肝脏抗氧化和线粒体功能的影响[J]. 食品科学, 2016, 37(3): 191–196.
HE J T, DONG L, BAI K W, et al. Effect of tributyrin on liver antioxidant capacity and mitochondrial function of piglets with intrauterine growth retardation during sucking period[J]. Food Science, 2016, 37(3): 191–196. (in Chinese) |
| [27] |
赵永伟, 牛玉, 何进田, 等. 双氢青蒿素对脂多糖诱导的断奶仔猪肝氧化应激的影响[J]. 畜牧兽医学报, 2019, 50(10): 2139–2146.
ZHAO Y W, NIU Y, HE J T, et al. Effects of dihydroartemisinin on oxidative stress in liver of weaned piglets induced by lipopolysaccharide[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(10): 2139–2146. DOI: 10.11843/j.issn.0366-6964.2019.10.021 (in Chinese) |
| [28] |
程林, 谌俊, 韩景河, 等. 母猪妊娠和哺乳饲粮中硒源和维生素E水平对后代仔猪器官指数和血清激素水平的影响[J]. 动物营养学报, 2018, 30(3): 918–928.
CHENG L, CHAN J, HAN J H, et al. Effects of dietary selenium sources and vitamin e levels during sows' gestation and lactation on organ indices and serum hormone levels of their progeny[J]. Chinese Journal of Animal Nutrition, 2018, 30(3): 918–928. DOI: 10.3969/j.issn.1006-267x.2018.03.015 (in Chinese) |
| [29] |
周盟, 张乃锋, 董晓丽, 等. 益生菌对断奶仔猪生长性能、免疫器官指数及胃肠道pH的影响[J]. 动物营养学报, 2014, 26(2): 445–452.
ZHOU M, ZHANG N F, DONG X L, et al. Effects of probiotics on growth performance, immune organ indexes and gastrointestinal pH of Weaner Piglets[J]. Chinese Journal of Animal Nutrition, 2014, 26(2): 445–452. DOI: 10.3969/j.issn.1006-267x.2014.02.021 (in Chinese) |
| [30] | BAUER R, WALTER B, HOPPE A, et al. Body weight distribution and organ size in newborn swine (sus scrofa domestica)-A study describing an animal model for asymmetrical intrauterine growth retardation[J]. Exp Toxicol Pathol, 1998, 50(1): 59–65. |
| [31] |
何进田, 董丽, 张莉莉, 等. 三丁酸甘油酯对宫内发育迟缓哺乳仔猪肝脏发育和免疫功能的影响[J]. 南京农业大学学报, 2015, 38(5): 838–843.
HE J T, DONG L, ZHANG L L, et al. Effects of tri-butyrin on the development and immune function of the liver in the intrauterine growth restricted suckling piglets[J]. Journal of Nanjing Agricultural University, 2015, 38(5): 838–843. (in Chinese) |
| [32] |
封飞飞, 方伟, 王淑楠, 等. 茶树油对育肥猪生长性能、器官指数、胴体性状和肉品质的影响[J]. 动物营养学报, 2017, 29(10): 3620–3626.
FENG F F, FANG W, WANG S N, et al. Effects of tea tree oil on growth performance, organ indexes, carcass characteristics and meat quality of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2017, 29(10): 3620–3626. DOI: 10.3969/j.issn.1006-267X.2017.10.024 (in Chinese) |
| [33] |
冯程程, 白凯文, 王安谙, 等. 日粮添加二甲基甘氨酸钠对宫内发育迟缓断奶仔猪肝脏抗氧化能力及免疫指标的影响[J]. 南京农业大学学报, 2019, 42(2): 336–344.
FENG C C, BAI K W, WANG A A, et al. Effect of N, N-dimethylglycine sodium salt supplementation on hepatic antioxidant capacity and immune indices in intrauterine growth retardation weanling piglets[J]. Journal of Nanjing Agricultural University, 2019, 42(2): 336–344. (in Chinese) |
| [34] | HE J T, NIU Y, WANG F, et al. Dietary curcumin supplementation attenuates inflammation, hepatic injury and oxidative damage in a rat model of intra-uterinegrowth retardation[J]. Br J Nutr, 2018, 120(5): 537–548. DOI: 10.1017/S0007114518001630 |
| [35] | ZHANG H, SU W P, YING Z X, et al. N-acetylcysteine attenuates intrauterine growth retardation-induced hepatic damage in suckling piglets by improving glutathione synthesis and cellular homeostasis[J]. Eur J Nutr, 2018, 57(1): 327–338. |



