2. 贵州大学动物科学学院, 贵阳 550025
2. College of Animal Science, Guizhou University, Guiyang 550025, China
SMAD1基因是SMAD家族的成员之一,目前SMAD蛋白家族共有8个成员(SMAD1~SMAD8),按照结构和功能可分为3类[1]。第一类是特异性SMADs(主要有SMAD1、SMAD2、SMAD3、SMAD5、SMAD8),参与BMP通路,对成肌因子及分化过程起关键作用[2-3];第二类是共有型SMAD4,能与激活的R-SMADs形成异源的多聚复合物,转录到细胞核内调控下游基因;第三类是抑制型SMADs(主要有SMAD6、SMAD7),能抑制R-SMADs和C-SMAD复合物的活性[4-5]。有研究表明,山羊SMAD1蛋白与牛、绵羊、人、狗、猪上其蛋白质序列的相似性极高,均为99%;且牛和羊上SMAD1基因CDS区碱基序列都是1 398 bp,编码465个氨基酸[3]。然而SMAD蛋白家族是细胞内重要的信号转导蛋白,直接参与转化生长因子β(transforming growth factorβ, TGF-β)超家族成员TGF-β1、TGF-β2、TGF-β3以及骨形态发生蛋白、活化素等多个成员的信号传导[6];同时也参与调节多种细胞活动,包括细胞增殖、分化、迁移、凋亡,从而维持内环境的稳态[7]。SMAD1作为TGF-β/SMADs信号通路下游重要的转录因子,分布于不同组织中,并介导多种类型的生理过程[8],在促进骨骼形成方面有重要作用,是促骨形成、修复骨损伤作用的分子机制之一[9]。具有重叠功能的SMAD1能控制hepcidin的转录,而促红细胞生成素需要SMAD1抑制hepcidin的表达量,从而间接的为红细胞生成提供充足的铁[10],对血管再生、修复也是至关重要的[11]。有研究表明,SMAD1基因参与了卵巢中TGF-β家族配体对抑制素B产生的调节[12];对激素分泌(促卵泡素FSH和促黄体素LH)、胎盘和胚胎死亡率、卵泡发生和LH信号传导、排卵和促进卵泡成熟和生长有重要作用[13]。而FecB突变改变了携带FecB BB基因型母羊卵巢中BMPR1B和SMAD信号相关基因的表达[14]。抑制miR-10a后,可极显著增加SMAD1(P < 0.01)表达水平[15]。Pangas等[16]对雌性小鼠进行SMAD1和SMAD5基因共敲除,小鼠表现为不育。综上表明,SAMD1基因对繁殖具有重要的作用。
黔北麻羊是贵州省三大优良地方山羊品种之一,具有耐粗饲、抗病力强、适应性广、肉质鲜美细嫩、繁殖力高等特点,每胎产羔1~3只,产羔率达196%。而繁殖性状是羊的重要经济性状,研究羊繁殖性状的遗传机制是增加产羔数和提高养羊生产效益的重要基础,且一直是该领域研究的焦点。目前,关于SMAD1基因虽已有大量报道,但其mRNA在黔北麻羊不同组织中的表达以及对卵巢颗粒细胞的影响和对相关基因的调节作用鲜有报道,且与黔北麻羊产羔性状的关系尚待探究。因此,本试验基于卵巢转录组测序结果,以黔北麻羊为研究对象,对SMAD1基因在单羔组对多羔组表达上调进行验证,通过qRT-PCR技术检测SMAD1基因在黔北麻羊子宫、输卵管、垂体、下丘脑、卵巢5个组织中的表达,构建pEGFP-N3-SMAD1重组质粒,并将质粒转染到卵巢颗粒细胞中,通过检测培养基中雌二醇(E2)和孕酮(P4)的含量、细胞凋亡、繁殖相关基因的mRNA表达,探究SMAD1基因对卵巢颗粒细胞的影响,为产羔性状候选基因的研究提供理论基础。
1 材料与方法 1.1 试验样品试验动物来自贵州省习水县富兴畜牧业开发有限公司,根据产羔记录,选取体况健康、体重45 kg、4岁左右的单、多羔黔北麻羊母羊各3只,采用同期发情处理,待第二次自然发情4~5 h内进行屠宰,采集子宫、输卵管、垂体、下丘脑和卵巢5个组织,-80 ℃冰箱保存备用,卵巢颗粒细胞分离培养选择2岁左右健康的母羊,屠宰后4~5 h内分离细胞。
1.2 主要试剂限制性快速内切酶Xho I、BamH I及T4 DNA连接酶购自大连宝生物工程有限公司;PBS缓冲液、DMEM-F12培养基、澳洲源胎牛血清、0.25%胰蛋白酶、2×UltraSYBR Mixture、OPTI-MEM、无内毒素质粒提取试剂盒、培养瓶、培养板购自贵州西宝生物有限公司;氯仿、异丙醇购自贵州鼎国生物有限公司;LB培养基、TOP 10感受态细胞、T克隆试剂盒购自上海生物工程有限公司;ELISA试剂盒(E2、P4)购自上海基星生物科技有限公司;HiFi Seript cDNA第一链合成试剂盒、胶回收试剂盒购自北京康为世纪有限公司;Trizol试剂购自贵州绿盟英创生物科技;卡那霉素、氨苄青霉素购自贵州为莱科技有限公司;LipofectamineTM3000CD购自Invitrogen公司;Annexin V-FITC细胞凋亡检测试剂盒、CCK-8细胞增殖检测试剂盒购自上海碧云天生物技术有限公司。
1.3 黔北麻羊SMAD1基因CDS区克隆及qRT-PCR引物设计以β-actin为内参,根据GenBank中已公布的山羊SMAD1(登录号:XM_018061574.1)、BMP4(登录号:NM_001285646.1)、FSHR(登录号:NM_001285636.1)、GnRHR(登录号:XM_005681659.2)、TIMP3(登录号:XM_018048225.1)基因mRNA序列,采用Primer Premier5.0软件设计qRT-PCR引物,SMAD1基因CDS扩增引物上游加Xho I内切酶位点、下游加BamH I内切酶位点,引物序列的信息见表 1,引物由生工生物工程(上海)股份有限公司合成。
|
|
表 1 SMAD1基因克隆及qRT-PCR引物 Table 1 SMAD1 gene cloning and qRT-PCR primers |
按照Trizol试剂盒操作步骤提取黔北麻羊性腺轴(子宫、输卵管、垂体、下丘脑、卵巢)组织的总RNA,并采用HiFi Script cDNA第一链合成试剂盒进行逆转录。将提取的RNA与cDNA各吸取1 μL于超微量紫外分光光度计进行浓度和纯度检测,RNA -80 ℃保存,cDNA -20 ℃保存备用。
1.5 实时荧光定量PCR(qRT-PCR)检测SMAD1基因在黔北麻羊不同组织中表达水平以β-actin为内参基因,采用qRT-PCR技术检测SMAD1基因在黔北麻羊子宫、输卵管、垂体、下丘脑和卵巢5个组织中的表达量。qRT-PCR体系为(10 μL):2×UltraSYBR Mixture 5.5 μL;Forward Primer 0.5 μL;Reverse Primer 0.5 μL;cDNA 1 μL;ddH2O 2.5 μL。qRT-PCR程序:95 ℃预变性105 s;95 ℃变性15 s,62.7 ℃退火15 s,68 ℃延伸30 s,40个循环;95 ℃变性5 s;最后从60 ℃到95 ℃按0.5 ℃增值进行熔解曲线分析,荧光采集时间为5 s,每个组织样品及内参基因各设置3孔重复,采用2-△△Ct法处理分析数据。
1.6 pEGFP-N3-SMAD1真核表达载体构建以卵巢cDNA为模板,普通PCR扩增SMAD1基因CDS区。扩增体系:2×Taq PCR Master Mix 10 μL,10 pmol·L-1 SMAD1-Forward 1 μL,10 pmol·L-1 SMAD1-Reverse 1 μL,cDNA 2 μL,Nuclease Free Water 6 μL。扩增程序:95 ℃预变性5 min;(95 ℃变性30 s,62.7 ℃退火45 s,72 ℃延伸1 min)×35个循环;72 ℃终延伸7 min,4 ℃保存。胶回收PCR扩增产物,连接转化到TOP 10感受态细胞,涂布在含有氨苄青霉素的平板上,37 ℃培养过夜,挑选白色单个菌落于液体培养基中,37 ℃震荡培养8 h,进行PCR验证,筛选出有目的条带的菌液送至北京擎科生物有限公司测序;将测序正确菌液扩繁,提取质粒,双酶切,与pEGFP-N3连接转化,涂布在含卡那霉素的平板,挑菌扩繁,将菌液送北京擎科生物有限公司进行测序验证。
1.7 黔北麻羊卵巢颗粒细胞分离与鉴定1.7.1 卵巢颗粒细胞分离培养 卵巢颗粒细胞分离与鉴定参考文献[17],选取2岁母羊,将黔北麻羊母羊屠宰后迅速采集卵巢,按75%酒精-生理盐水-灭菌含双抗的PBS顺序冲洗3遍,放入预冷的灭菌含双抗的PBS中,低温运回实验室,4~5 h内分离卵巢颗粒细胞。将超净工作台用75%酒精棉球擦拭干净,放入所需器具灭菌30 min,酒精擦洗;取出卵巢,放入75%酒精中浸泡25 s,按75%酒精-生理盐水-PBS冲洗3遍,用DMEM-F12培养基将卵巢表面的酒精冲洗干净,放入10%完全培养基中,取无菌的注射器轻轻刺破卵巢表面的卵泡,用培养基反复冲洗,使颗粒细胞完全流入到培养基中;收集培养基于10 mL离心管中静置10 min,取上清于新离心管中,2 000 r·min-1离心10 min,去上清,沉淀为细胞;加入2 mL的PBS,2 000 r·min-1离心5 min,去上清,重复3次;加入适量的10%完全培养基,轻轻吹打混匀,分装于培养瓶中,37 ℃、5% CO2中培养,24 h更换培养基并观察细胞生长状态。
1.7.2 卵巢颗粒细胞的鉴定 取培养24 h的细胞,吸取培养基,PBS洗涤3次,每次2 min;4%多聚甲醛4 ℃固定90 min,PBS洗涤3次,每次2 min;加入5% BSA溶液封闭30 min,吸取封闭液,不洗;用1:100稀释的FSHR抗体,4 ℃孵育过夜;PBS洗涤3次,每次2 min,加入1:100稀释的生物素标记二抗,室温避光孵育30 min,PBS洗涤3次,每次2 min;加入1:200稀释的SABC-Cy3室温避光孵育30 min,PBS洗干净;在避光的条件下加入浓度为1 μg·μL-1的DAPI,37 ℃孵育15 min,PBS洗涤3次,每次2 min,拍照保存。
1.8 pEGFP-N3-SMAD1重组质粒的转染将细胞铺在6、96孔板中用于RNA提取、雌二醇(E2)含量、孕酮(P4)含量、细胞凋亡检测,待细胞生长到80%左右的汇合度,更换为无双抗的培养基培养24 h,将pEGFP-N3-SMAD1重组质粒A、B管转染到细胞,A管:LipofectamineTM3000 5 μL,OPTI-MEM 125 μL;B管:OPTI-MEM 125 μL,P3000 5 μL,质粒4 μg;两管分别混匀后,将B管加入到A管混匀,37 ℃、5%CO2培养箱中孵育15 min,十字交叉法加入到6孔板中,37 ℃、5% CO2培养箱中培养24 h,倒置荧光显微镜下观察转染情况。
1.9 超表达SAMD1基因后检测培养基中雌二醇、孕酮的含量收集转染12、24、48 h后吸取培养基,用于E2、P4含量的检测。加样分为:标准孔、空白孔、待测样品孔,先将标准品按120、60、30、15、7.5 pmol·L-1配制好;配好的标准品加入酶标板上并设置2个重复孔,2个空白孔(不加样品和酶标试剂),待测样品孔中加入40 μL样品稀释液,然后再加10 μL待测样品,轻轻混匀;加完样品后用封板膜封板,置于37 ℃孵育30 min,去液体,甩干,每孔加满洗涤液,静置30 s移去洗涤液,重复5次,拍干;每孔加入50 μL酶标试剂,空白孔不加,37 ℃孵育30 min,甩干,洗涤30 s,洗5次;拍干后加入50 μL显色剂A,轻轻震荡混匀,37 ℃避光显色10 min,再每孔加入50 μL终止液,在酶标仪上进行测定,在450 nm波长处依次测量各孔的吸光度(OD值),应在15 min内完成酶标仪测定。
1.10 检测超表达SMAD1基因对黔北麻羊卵巢颗粒细胞增殖、凋亡的影响1.10.1 CCK-8法检测超表达SMAD1基因对卵巢颗粒细胞增殖的影响 为检测SMAD1基因对卵巢颗粒细胞增殖的影响,本试验设计2个组(SMAD1基因组、空载体组),将细胞铺于96孔板中,待细胞生长到80%左右的汇合度,更换为无双抗的培养基培养24 h,将pEGFP-N3-SMAD1重组质粒转染到细胞,A管:LipofectamineTM 3000 2 μL,OPTI-MEM 50 μL;B管:OPTI-MEM 50 μL,P3000 2 μL,质粒1.5 μg;两管分别混匀后,将B管加入到A管混匀,37 ℃、5% CO2培养箱中分别孵育15 min,加入到96孔板中,37 ℃、5% CO2培养箱中培养24 h、48 h、72 h后吸取培养基,加入100 μL新培养基,然后再加入10 μL CCK-8试剂,37 ℃、5% CO2培养箱中培养3 h,于酶标仪上检测450 nm处吸光度(OD值),分析超表达SMAD1基因对细胞增殖的影响。
1.10.2 Annexin V-FITC法检测超表达SMAD1基因对卵巢颗粒细胞凋亡的影响 本试验采用Annexin V-FITC试剂检测细胞凋亡,将细胞培养基吸至合适离心管中,PBS洗涤一次,收集PBS,加入适量的无EDTA胰酶消化细胞,用培养细胞的培养基终止消化;将细胞和洗涤的PBS转移至离心管中,1 000 g离心5 min,弃上清,PBS悬浮并计数;取5~10万重悬细胞,1 000 g离心5 min,加入195 μL Annexin V-FITC结合液并轻轻重悬细胞;加入5 μL Annexin V-FITC,轻轻混匀;加入10 μL碘化丙啶染色液,轻轻混匀;室温孵育20 min,1 000 g离心5 min,取50 μL Annexin V-FITC结合液重悬细胞,涂片后,荧光显微镜下观察。
1.11 qRT-PCR检测SMAD1基因对黔北麻羊繁殖相关基因表达水平的影响将细胞铺于6孔板中,待细胞生长到90%左右的汇合度时,转染SMAD1基因,继续培养24 h后,提取细胞RNA,并逆转录为cDNA,采用qRT-PCR检测超表达SMAD1基因对SMAD1、BMP4、FSHR、GnRHR、TIMP3基因表达的影响,qRT-PCR体系及程序见1.5。
1.12 数据处理及分析采用2-△△Ct法分析SMAD1基因在黔北麻羊子宫、输卵管、垂体、下丘脑、卵巢中的差异表达量,用SPSS20.0软件对黔北麻羊腺性轴组织中各基因的表达进行单因素方差分析,P < 0.01表示差异极显著,P < 0.05表示差异显著。
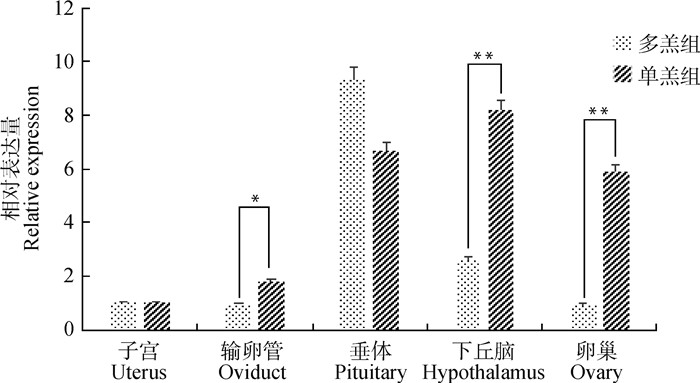
2 结果 2.1 SMAD1基因在黔北麻羊不同组织中的表达由图 1可知,SMAD1基因在黔北麻羊单、多羔各组织中均有表达,其中在多羔组中垂体表达量最高,输卵管表达量最低,其表达量依次为:垂体>下丘脑>子宫>卵巢>输卵管;在单羔组中下丘脑表达量最高,子宫表达量最低,其表达量依次为:下丘脑>垂体>卵巢>输卵管>子宫;单、多羔组间比较,卵巢和下丘脑在单羔组极显著高表达于多羔组(P < 0.01),符合转录组测序结果,输卵管在单羔组显著高表达于多羔组(P < 0.05),其他组织在单、多羔组间表达差异不显著(P>0.05)。
|
**表示差异极显著(P < 0.01),*表示差异显著(P < 0.05)。下同 ** indicates that the difference is extremely significant (P < 0.01), * indicates that the difference is significant (P < 0.05). The same as below 图 1 SMAD1基因在黔北麻羊单、多羔组羊不同组织表达水平 Fig. 1 SMAD1 gene expression level in varous tissues of Qianbei Ma goats in single and multiple lambs groups |
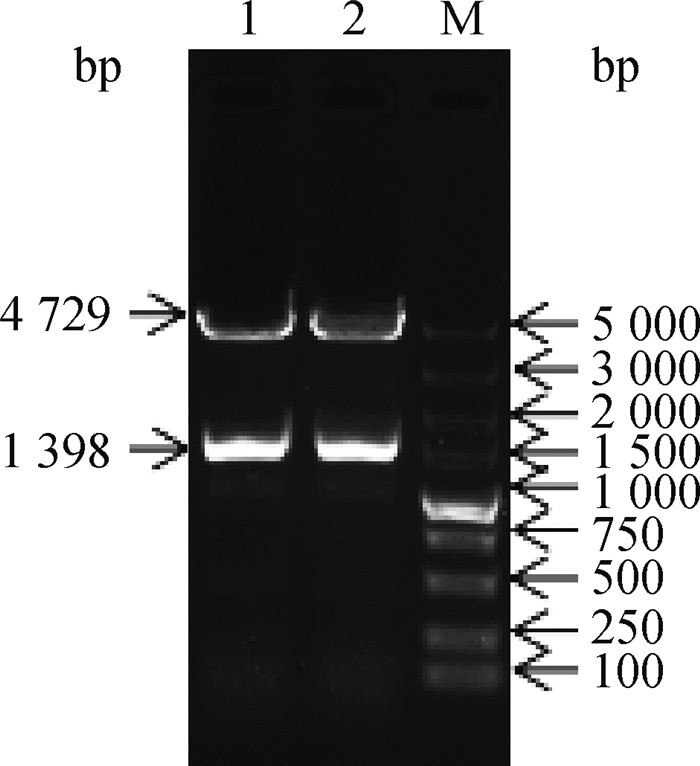
对SMAD1基因进行CDS区扩增,由图 2可知,其条带较暗,但扩增片段与目的片段大小一致,可进行下一步试验。重组pEGFP-N3-SMAD1质粒经限制性内切酶Xho I、BamH I双酶切,结果见图 3,获得约4 729和1 398 bp两条条带,分别为pEGFP-N3载体和SMAD1基因CDS区序列,初步说明真核表达载体构建成功。将提取的重组质粒进行测序,由图 4可知,SMAD1基因序列与NCBI上传的序列完全吻合,未发现突变碱基,表明SMAD1基因真核表达载体已构建成功。

|
M. DNA相对分子质量标准;1~6. SMAD1基因CDS区扩增结果 M. DL-12000 DNA marker; 1-6. The amplification result of CDS region of SMAD1 图 2 黔北麻羊SMAD1基因CDS区PCR扩增结果 Fig. 2 PCR amplification of CDS region of SMAD1 gene in Qianbei Ma goats |
|
M.DNA相对分子质量标准;1~2. pEGFP-N3-SMAD1酶切结果 M. DL-15000 DNA marker; 1-2. The digestion result of pEGFP-N3-SMAD1 图 3 黔北麻羊pEGFP-N3-SMAD1真核表达载体双酶切结果 Fig. 3 Qianbei Ma goats pEGFP-N3-SMAD1 eukaryotic expression vector digested by double enzymes |

|
图 4 黔北麻羊SMAD1基因部分测序图 Fig. 4 Partial sequence of SMAD1 gene in Qianbei Ma goats |
2.3.1 卵巢颗粒细胞的分离 取培养24、48、96 h细胞于倒置荧光显微镜下观察(图 5),24 h细胞呈神经元状生长,48 h细胞生长到90%以上的汇合度,96 h后细胞已长满培养瓶壁,可进行下一步的试验。

|
A.培养24 h的细胞;B.培养48 h的细胞;C.培养96 h的细胞 A. Cells cultured for 24 h; B. Cells cultured for 48 h; C. Cells cultured for 96 h 图 5 黔北麻羊卵巢颗粒细胞分离培养 Fig. 5 Isolation and culture of ovarian granulosa cells of Qianbei Ma goats |
2.3.2 卵巢颗粒细胞的鉴定 本试验采用免疫荧光鉴定卵巢颗粒细胞,结果见图 6,FSHR抗体已发生特异性结合,FSHR特异性受体标记阳性细胞呈红色(图 6A),所有细胞核在DAPI的染色下呈蓝色(图 6B),且A和B能完全重合(图 6C),表明培养的原代细胞为黔北麻羊卵巢颗粒细胞。

|
图 6 黔北麻羊卵巢颗粒细胞鉴定 Fig. 6 Ovarian granulosa cells identification of Qianbei Ma goats |
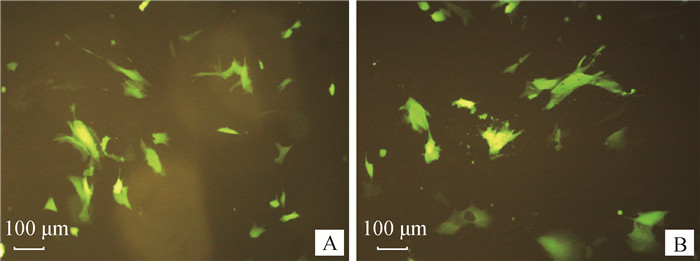
将细胞铺于6孔板中,转染培养24 h后,在倒置荧光显微镜下观察转染情况,结果见图 7,在蓝色光源的激发下卵巢颗粒细胞均发出大量绿色荧光蛋白,表明pEGFP-N3与重组质粒pEGFP-N3-SMAD1转染成功,且重组质粒与pEGFP-N3空载体转染效率基本一致,核发光不明显,说明SMAD1基因可能存在于细胞质内。
|
A.转染pEGFP-N3空载体对照组;B.转染重组SMAD1质粒试验组 A.Control group transfected with pEGFP-N3 empty vector; B. Test group transfected with recombinant SMAD1 plasmid 图 7 pEGFP-N3载体和SMAD1基因转染结果 Fig. 7 The results of pEGFP-N3 vector and SMAD1 gene transfection |
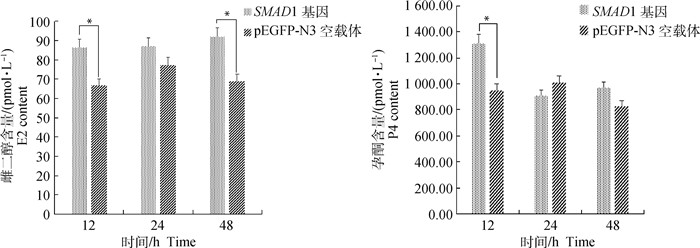
超表达SMAD1基因12、24、48 h后对培养液中E2、P4的浓度进行检测,结果见图 8,超表达SMAD1基因后对E2的分泌都有提高,随着时间加长,E2的生成也增加,24到48 h变化最大,且在12和48 h超表达SMAD1基因组显著高表达于pEGFP- N3空载体组(P < 0.05),24 h两组间未达到显著差异(P>0.05);P4含量在3个时间段成不规则波动,其中12到24 h变化大,24 h后较平缓,且在12 h超表达SMAD1基因组显著高表达于pEGFP-N3空载体组(P < 0.05),24、48 h两组间未达到显著差异(P>0.05)。
|
图 8 超表达SMAD1基因对E2、P4生成的影响 Fig. 8 Effects of SMAD1 overexpression on E2 and P4 production |
2.6.1 超表达SMAD1基因对卵巢颗粒细胞增殖的影响 由图 9可知,在24、48、72 h阶段,与对照组(pEGFP-N3空载体组)比较,超表达SMAD1基因对卵巢颗粒细胞增殖均具有一定促进作用,在24 h达到显著促进作用(P < 0.05),48、72 h达到了极显著促进作用(P < 0.01);初步证明SMAD1基因能促进细胞增殖。

|
图 9 超表达SMAD1基因对卵巢颗粒细胞增殖的影响 Fig. 9 Effects of SMAD1 overexpression on the proliferation of ovarian granulosa cells |
2.6.2 超表达SMAD1基因对颗粒细胞凋亡的影响 分别采用Vehicle和pEGFP-N3-SMAD1重组质粒进行细胞诱导,荧光检测结果见图 10,可知超表达SMAD1基因对卵巢颗粒细胞凋亡速率与pEGFP-N3组比,SMAD1基因可抑制卵巢颗粒细胞的凋亡,pEGFP-N3空载体促进卵巢颗粒细胞的凋亡。与SMAD1基因对卵巢颗粒细胞增殖具有促进结果相符。

|
A.凋亡诱导后细胞;B. Annexin V-FITC染色。A1、B1. Vehicle凋亡诱导组;A2、B2.超表达SMAD1基因试验组;A3、B3.转染pEGFP-N3空载体对照组。图中绿色为凋亡的细胞;红色为碘化丙啶染色;被绿色和红色双染色的为坏死的细胞;未被染色的为正常细胞 A.The cell after apoptosis induction; B. Annexin V-FITC staining. A1, B1. Vehicle apoptosis induction group; A2, B2. Overexpressing SMAD1 gene test group; A3, B3.Transfecting pEGFP-N3 empty vector control. Green is apoptotic cells in the picture; Red is propidium iodide staining; Necrotic cells are stained with green and red; Normal cells are unstained 图 10 超表达SMAD1基因对卵巢颗粒细胞凋亡的影响 Fig. 10 Effects of SMAD1 overexpression on apoptosis of ovarian granulosa cells |
转染培养24 h后,提取细胞RNA,并逆转录为cDNA,采用qRT-PCR技术检测SMAD1基因在卵巢颗粒细胞的表达,以及对BMP4、FSHR、GnRHR、TIMP3基因mRNA表达的影响。结果见图 11,转染SMAD1基因组mRNA的表达水平极显著高表达于pEGFP-N3空载体组(P < 0.01),表明转染成功。对BMP4、FSHR、GnRHR、TIMP3基因的mRNA表达水平检测发现,pEGFP-N3空载体组极显著高表达于转染SMAD1基因组(P < 0.01),说明超表达SMAD1基因对相关基因表达具有极显著抑制作用。
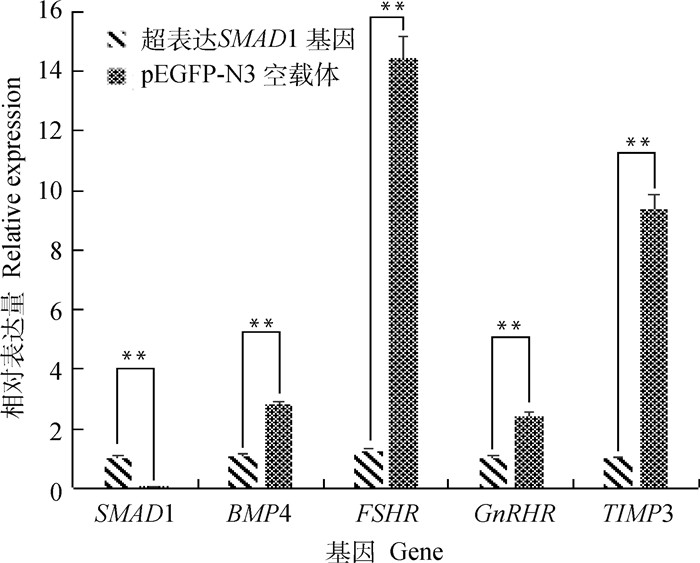
|
图 11 超表达SMAD1基因及对繁殖相关基因表达的影响 Fig. 11 Overexpression of SMAD1 gene and its effect on the expression of reproduction-related genes |
本课题组前期采用单、多羔黔北麻羊母羊的卵巢组织进行转录组测序,从单羔组对多羔组测序结果中筛选出了上调基因SMAD1,本研究对其在单、多羔卵巢组织中进行验证。并对其在各组织中的表达量进行检测,结果表明,SMAD1基因在下丘脑、卵巢组织中单羔组极显著高表达于多羔组(P < 0.01),在卵巢组织的表达与田志龙等[18]研究的小尾寒羊单羔群体卵巢的表达量极显著高于多羔群体(P < 0.01)结果一致。李兰兰等[19]研究发现,在敖汉细毛羊发情期的卵巢组织中SMAD1基因极显著高表达于其他时期(P < 0.01),且在不同发情时期SMAD1蛋白主要表达于乏情期原始卵泡、次级卵泡的颗粒细胞、发情间期次级卵泡的卵泡膜细胞,表明SMAD1基因对卵泡的生长发育具有重要作用。Wang等[20]研究发现,TGF-β/SMADs信号通路在哺乳动物的卵泡发育、卵泡的选择与闭锁过程中发挥极其重要的调控作用;该通路中的关键成员(配体、受体、信号分子等)在整个生殖系统中都有协调的时空表达模式、控制和调节卵巢的生理学功能[21];BMP15/SMAD信号通路可能与颗粒细胞凋亡有关[22]。有研究证明,颗粒细胞的发育与卵泡的发育成熟和排卵密切相关[23]。而雌二醇、孕酮、卵泡刺激素(FSH)和促黄体素(LH)通过与其它细胞因子互作影响颗粒细胞增殖[24-25],本试验检测了超表达SMAD1基因对雌二醇、孕酮、繁殖相关基因的影响,结果表明,超表达SMAD1基因在12 h能够显著(P < 0.05)提高雌二醇、孕酮的生成,此时孕酮含量最高,雌二醇最低,48 h也能显著提高雌二醇的生成(P < 0.05),且雌二醇含量最高,说明超表达SMAD1基因能提高雌二醇、孕酮的生成。对卵巢颗粒细胞增殖、凋亡进行检测,在12 h SMAD1基因显著促进卵巢颗粒细胞增殖(P < 0.05),随着时间延长,24和72 h达到了极显著促进作用(P < 0.01),且对细胞增殖的影响也更加明显。进行凋亡试验时,发现超表达SMAD1基因对卵巢颗粒细胞的凋亡具有抑制作用;与SMAD1基因对卵巢颗粒细胞增殖具有促进的结果是相符的,与前人研究雌二醇、孕酮含量增加能促进细胞增殖结果一致。
在检测繁殖相关基因mRNA表达时,发现超表达SMAD1基因对繁殖相关基因GnRHR、BMP4、FSHR、TIMP3的mRNA表达具有极显著抑制作用(P < 0.01),虽然超表达SMAD1基因对繁殖相关基因表达具有抑制作用,但对雌二醇、孕酮具有促进作用,有研究表明,雌二醇、孕酮对GnRHR基因mRNA的表达无显著影响[26];GnRHR的表达被抑制,LH和FSH的合成和分泌受到影响,而LH可调节卵巢中TIMP3基因的表达[27]。TIMP3基因的表达受E2作用时间的长短而变化,2 h TIMP3基因表达量会显著提高(P < 0.05),随着时间增加TIMP3基因表达量会降低[28],然而需要雌激素和同源盒转录因子BARX2共同作用才能显著增加TIMP3基因的表达[29]。而BMP4可以抑制P4的生成,不会抑制E2的生成[30],而体外培养时,在培养基中增加BMP4会促进卵泡的生长[31];在卵巢中发挥旁/自分泌调节作用,调节卵泡发育[32],也能够启动原始卵泡的形成和发育[33]。有研究表明,FSHR基因与山羊的双羔性状有关[34],在卵巢成熟过程中,FSHR在类固醇生成和卵泡增殖调控中起着重要作用,如FSHR不足的动物很可能会不育[35],而FSH可能通过上调FSHR表达激活cAMP/PKA信号传导通路,从而增加干细胞因子(SCF)分泌,进一步促进卵泡及卵母细胞的发育成熟[36];同时,E2和P4的浓度显著增加(P < 0.05)会导致FSHR mRNA水平显著降低(P < 0.05)[37]。这与本试验中超表达SMAD1基因增加雌二醇、孕酮的生成,抑制BMP4、FSHR、TIMP3基因的mRNA表达的结果一致。而转录组测序结果SMAD1基因在单羔组显著高表达于多羔组(P < 0.05),表达量验证结果与转录组测序结果趋势一致,且超表达SMAD1基因能够极显著抑制繁殖相关基因FSHR、GnRHR mRNA表达(P < 0.01),有研究表明,发情期的高产组山羊卵巢中FSHR的表达丰度显著高于低产组(P < 0.05)[38],而降低FSHR表达水平导致卵母细胞数量下降,卵泡减少[39];GnRHR转导来自细胞外配位体、下丘脑因子GnRH的信号,并调节LH和FSH的合成和分泌;促性腺释放激素(GnRH)对繁殖性能的调节就是通过与位于垂体促性腺细胞膜上的高亲和性GnRHR相互作用实现的[40];因此,GnRHR的表达被抑制,LH和FSH的合成和分泌受到影响,而LH可调节卵巢中TIMP3基因的表达[27]。说明SMAD1基因在黔北麻羊单羔组高表达会抑制繁殖相关基因的表达,间接减少了卵泡数量、抑制排卵以及LH和FSH的合成和分泌等,从而降低黔北麻羊受胎率,进而降低产羔数。
4 结论综上表明,SMAD1基因可提高E2、P4的生成,有助于黔北麻羊发情及妊娠的维持,促进细胞增殖,抑制细胞凋亡,也极显著抑制繁殖相关基因mRNA的表达,而这些繁殖相关基因能够调控卵泡数、卵泡的发育与形成以及排卵。SMAD1基因能够抑制这些基因的表达,致使黔北麻羊单羔组受胎率低,进而降低产羔数,这为产羔性状相关基因的研究提供了理论基础,初步认为,SMAD1基因可作为探究影响山羊产羔性状的候选基因。
| [1] |
乔虎军, 王国祥, 郝鑫. 转化生长因子β/Smad信号通路和骨关节炎研究进展[J]. 中国运动医学杂志, 2019, 38(2): 143–151.
QIAO H J, WANG G X, HAO X. Research progress of transforming growth factor β/Smad signaling pathway and osteoarthritis[J]. Chinese Journal of Sports Medicine, 2019, 38(2): 143–151. DOI: 10.3969/j.issn.1000-6710.2019.02.010 (in Chinese) |
| [2] | SAVAGE C, DAS P, FINELLI A L, et al. Caenorhabditis elegans genes sma-2, sma-3, and sma-4 define a conserved family of transforming growth factor beta pathway components[J]. Proc Natl Acad Sci U S A, 1996, 93(2): 790–794. DOI: 10.1073/pnas.93.2.790 |
| [3] |
宁越, 米雪, 陈星伊, 等. SMAD1基因的沉默和过表达及对秦川牛原代成肌细胞生肌的影响[J]. 中国农业科学, 2019, 52(10): 1818–1829.
NING Y, MI X, CHEN X Y, et al. Silencing and overexpressing SMAD family member 1(SMAD1) gene and its effect on myogenesis in primary myoblast ofQinchuan Cattle (Bos taurus)[J]. Scientia Agricultura Sinica, 2019, 52(10): 1818–1829. DOI: 10.3864/j.issn.0578-1752.2019.10.014 (in Chinese) |
| [4] | SHI Y G, MASSAGUÉ J. Mechanisms of TGF-β signaling from cell membrane to the nucleus[J]. Cell, 2003, 113(6): 685–700. DOI: 10.1016/S0092-8674(03)00432-X |
| [5] | DIJKE P T, HILL C S. New insights into TGF-β-Smad signalling[J]. Trends Biochem Sci, 2004, 29(5): 265–273. DOI: 10.1016/j.tibs.2004.03.008 |
| [6] | CHEN G Q, DENG C X, LI Y P. TGF-β and BMP signaling in osteoblast differentiation and bone formation[J]. Int J Biol Sci, 2012, 8(2): 272–288. DOI: 10.7150/ijbs.2929 |
| [7] |
陈兵, 易斌, 鲁开智. Smad蛋白家族调控细胞分化的研究进展[J]. 医学研究生学报, 2013, 26(5): 544–547.
CHEN B, YI B, LU K Z. Advances in researches on Smad proteins in cell differentiation[J]. Journal of Medical Postgraduates, 2013, 26(5): 544–547. DOI: 10.3969/j.issn.1008-8199.2013.05.024 (in Chinese) |
| [8] | MASSAGUÉ J, WOTTON D. Transcriptional control by the TGF-β/Smad signaling system[J]. EMBO J, 2000, 19(8): 1745–1754. DOI: 10.1093/emboj/19.8.1745 |
| [9] |
苟海昕, 詹红生, 赵咏芳, 等. 补肾中药对自然衰老雄性大鼠骨髓微环境中Smad1基因表达的影响[J]. 中国中医骨伤科杂志, 2007, 15(2): 26–28.
GOU H X, ZHAN H S, ZHAO Y F, et al. The Effect of invigorating-kidney herbs on Smad1 gene expre-ssion in bone marrow microenvironment of ageing male rat[J]. Chinese Journal of Traditional Medical Traumatology & Orthopeics, 2007, 15(2): 26–28. DOI: 10.3969/j.issn.1005-0205.2007.02.010 (in Chinese) |
| [10] | WANG C Y, CORE A B, CANALI S, et al. Smad1/5 is required for erythropoietin-mediated suppression of hepcidin in mice[J]. Blood, 2017, 130(1): 73–83. DOI: 10.1182/blood-2016-12-759423 |
| [11] | LIU P, LI X S, SONG F H, et al. Testosterone promotes tube formation of endothelial cells isolated from veins via activation of Smad1 protein[J]. Mol Cell Endocrinol, 2017, 446: 21–31. DOI: 10.1016/j.mce.2017.02.005 |
| [12] | BONDESTAM J, KAIVO-OJA N, KALLIO J, et al. Engagement of activin and bone morphogenetic protein signaling pathway Smad proteins in the induction of inhibin B production in ovarian granulosa cells[J]. Mol Cell Endocrinol, 2002, 195(1-2): 79–88. DOI: 10.1016/S0303-7207(02)00219-8 |
| [13] | XU S S, GAO L, XIE X L, et al. Genome-wideassociation analyses highlight the potential for different genetic mechanisms for litter size among sheep breeds[J]. Front Genet, 2018, 9: 118. DOI: 10.3389/fgene.2018.00118 |
| [14] | BAHIRE S V, RAJPUT P K, KUMAR V, et al. Quantitative expression of mRNA encoding BMP/SMAD signalling genes in the ovaries of Booroola carrier and non-carrier GMM sheep[J]. Reprod Domest Anim, 2019, 54(10): 1375–1383. DOI: 10.1111/rda.13535 |
| [15] | LV X Y, GAO W, JIN C Y, et al. Preliminary study on microR-148a and microR-10a in dermal papilla cells of Hu sheep[J]. BMC Genet, 2019, 20(1): 70. DOI: 10.1186/s12863-019-0770-8 |
| [16] | PANGAS S A, LI X H, UMANS L, et al. Conditional deletion of Smad1 and Smad5 in somatic cells of male and female gonads leads to metastatic tumor development in mice[J]. Mol Cell Biol, 2008, 28(1): 248–257. DOI: 10.1128/MCB.01404-07 |
| [17] |
孙洪新, 张英杰, 刘月琴, 等. 绵羊CYP19基因卵巢启动子的克隆及其表达活性研究[J]. 畜牧兽医学报, 2015, 46(9): 1540–1548.
SUN H X, ZHANG Y J, LIU Y Q, et al. Cloning and expression assay of sheep CYPl9 gene ovarian promoter[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(9): 1540–1548. (in Chinese) |
| [18] |
田志龙, 汤继顺, 孙庆, 等. 绵羊SMAD1基因组织表达及其多态性与产羔数关联分析[J]. 中国农业科学, 2019, 52(4): 755–766.
TIAN Z L, TANG J S, SUN Q, et al. Tissue expre-ssion and polymorphism of sheep SMAD1 gene and their association with litter size[J]. Scientia Agricultura Sinica, 2019, 52(4): 755–766. (in Chinese) |
| [19] |
李兰兰, 栾兆进, 刘开东, 等. Smad1基因在敖汉细毛羊发情不同时期卵巢中的表达规律研究[J]. 黑龙江畜牧兽医, 2017(11): 93–96, 294.
LI L L, LUAN Z J, LIU K D, et al. Study of expre-ssion pattern of Smad1 gene of ovary of Aohan fine-wool sheep in different oestrus periods[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(11): 93–96, 294. (in Chinese) |
| [20] | WANG W, WANG L, LI X X, et al. Effect of interrupted endogenous BMP/Smad signaling on growth and steroidogenesis of porcine granulosa cells[J]. J Zhejiang Univ Sci B, 2010, 11(9): 719–727. DOI: 10.1631/jzus.B1000079 |
| [21] | MOTTERSHEAD D G, PULKKI M M, MUGGALLA P, et al. Characterization of recombinant human growth differentiation factor-9 signaling in ovarian granulosa cells[J]. Mol Cell Endocrinol, 2008, 283(1-2): 58–67. DOI: 10.1016/j.mce.2007.11.007 |
| [22] | CUI X R, JING X, WU X Q, et al. Abnormal expre-ssion levels of BMP15/Smad1 are associated with granulosa cell apoptosis in patients with polycystic ovary syndrome[J]. Mol Med Rep, 2017, 16(6): 8231–8236. DOI: 10.3892/mmr.2017.7658 |
| [23] | MAKITA M, MIYANO T. Steroid hormones promote bovine oocyte growth and connection with granulosa cells[J]. Theriogenology, 2014, 82(4): 605–612. DOI: 10.1016/j.theriogenology.2014.05.020 |
| [24] | RIVAS R E C, NIETO M P C, KAMIYOSHI M. Effects of steroid hormone in avian follicles[J]. Asian Australas J Anim Sci, 2016, 29(4): 487–499. DOI: 10.5713/ajas.15.0310 |
| [25] | REGAN S L, MCFARLANE J R, O'SHEA T, et al. Flow cytometric analysis of FSHR, BMRR1B, LHR and apoptosis in granulosa cells and ovulation rate in merino sheep[J]. Reproduction, 2015, 150(2): 151–163. DOI: 10.1530/REP-14-0581 |
| [26] | LOOPER M L, VIZCARRA J A, WETTEMANN R P, et al. Influence of estradiol, progesterone, and nutrition on concentrations of gonadotropins and GnRH receptors, and abundance of mRNA for GnRH receptors and gonadotropin subunits in pituitary glands of beef cows[J]. J Anim Sci, 2003, 81(1): 269–278. DOI: 10.2527/2003.811269x |
| [27] |
彭甲银.奶山羊卵巢颗粒细胞中TIMP3基因的表达调控及功能研究[D].杨凌: 西北农林科技大学, 2016.
PENG J Y.Expressionregulation and function of TIMP3 in dairy goat ovarian granulosa cells[D]. Yangling: Northwest A & F university, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10712-1016157386.htm |
| [28] | PENG J Y, GAO K X, GAO T Y, et al. Expression and regulationof tissue inhibitors of metalloproteinases (TIMP1 and TIMP3) in goat oviduct[J]. Theriogenology, 2015, 84(9): 1636–1643. DOI: 10.1016/j.theriogenology.2015.09.003 |
| [29] | STEVENS T A, MEECH R. BARX2 and estrogenreceptor-α (ESR1) coordinately regulate the production ofalternatively spliced ESR1 isoforms and control breast cancer cell growth and invasion[J]. Oncogene, 2006, 25(39): 5426–5435. DOI: 10.1038/sj.onc.1209529 |
| [30] | SAKAGUCHI K, HUANG W P, YANG Y H, et al. Relationship between in vitro growth of bovine oocytes and steroidogenesis of granulosa cells cultured in medium supplemented with bone morphogenetic protein-4 and follicle stimulating hormone[J]. Theriogenology, 2017, 97: 113–123. DOI: 10.1016/j.theriogenology.2017.04.030 |
| [31] | DA CUNHA E V, MELO L R F, SOUSA G B, et al. Effect of bone morphogenetic proteins 2 and 4 on survival and development of bovine secondary follicles cultured in vitro[J]. Theriogenology, 2018, 110: 44–51. DOI: 10.1016/j.theriogenology.2017.12.032 |
| [32] | KNIGHT P G, GLISTER C. TGF-β superfamily members and ovarian follicle development[J]. Reproduction, 2006, 132(2): 191–206. DOI: 10.1530/rep.1.01074 |
| [33] | NILSSON E E, SKINNER M K. Bone morphogenetic protein-4 acts as an ovarian follicle survival factor and promotes primordial follicle development[J]. Biol Reprod, 2003, 69(4): 1265–1272. DOI: 10.1095/biolreprod.103.018671 |
| [34] | HATIF S A, AL-MUTAR H A K, HUSSAIN K A. Clinical study with investigation of polymorphism FSHR gene in twining goats in Iraq[J]. Adv Anim Vet Sci, 2017, 5(5): 192–195. |
| [35] | DE CASTRO F, RUIZ R, MONTORO L, et al. Role of follicle-stimulating hormone receptor Ser680Asn polymorphism in the efficacy of follicle-stimulating hormone[J]. Fertil Steril, 2003, 80(3): 571–576. DOI: 10.1016/S0015-0282(03)00795-7 |
| [36] |
郑梦雪.促卵泡刺激素通过调控颗粒细胞分泌干细胞因子促进卵泡发育成熟的研究[D].银川: 宁夏医科大学, 2017.
ZHENG M X.The research of follicle stimulating hormone regulates the expression of stem cell factor in granulosa cells to promote the follicular development[D].Yinchuan: Ningxia Medical University, 2017.(in Chinese) |
| [37] | SALEHNIA M, PAJOKH M, GHORBANMEHR N. Short term organ culture of mouse ovary in the medium supplemented with bone morphogenetic protein 15 and follicle stimulating hormone:a morphological, hormonal and molecular study[J]. J Reprod Infertil, 2016, 17(4): 199–207. |
| [38] |
唐杰.山羊促性腺激素及其受体mRNA丰度的研究[D].保定: 河北农业大学, 2007.
TANG J.The study on gonadotrophin and the mRNA's abundance of its receptor in goat[D].Baoding: Agricultural University of Hebei, 2007.(in Chinese) http://d.wanfangdata.com.cn/thesis/Y1162032 |
| [39] | CUI H X, ZHAO S M, CHENG M L, et al. Cloning and expression levels of genes relating to the ovulation rate of the Yunling black goat[J]. Biol Reprod, 2009, 80(2): 219–226. |
| [40] | NORWITZ E R, JEONG K H, CHIN W W. Molecular mechanisms of gonadotropin-releasing hormone receptor gene regulation[J]. J Soc Gynecol Investig, 1999, 6(4): 169–178. DOI: 10.1016/S1071-5576(99)00022-2 |



