血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)是2000年发现的一种糖蛋白,在大多数组织中都有表达[1]。ACE2可有效地将血管紧张素Ⅱ(AngⅡ)降解为血管紧张素1-7(Ang1-7),与Ang(1-7)和Mas受体共同构成ACE2-Ang(1-7)-MasR轴,成为肾素-血管紧张素系统(renin angiotensin system,RAS)的另一重要分支。该轴能与经典的ACE-AngⅡ-AT1轴相互拮抗,作为治疗高血压、糖尿病和心血管等许多疾病中的靶点,为开发新的治疗方案提供了可能性[2-3],多年的研究己证实,ACE2在心肌损伤、肺损伤、糖尿病肾损伤、肝损伤及肠道腹泻炎症等病理过程中具有抗损伤作用[4-8]。ACE2还在协同氨基酸转运载体转运、促进氨基酸吸收、维持肠道微生态平衡和对抗胃肠道炎症等方面发挥重要作用[9-10]。ACE2作为一个新的疾病标志物或药物治疗新靶点在人类医学上受到关注。
新型冠状病毒肺炎(corona virus disease 2019,COVID-19),简称“新冠肺炎”,是指2019新型冠状病毒感染导致的肺炎,经过对病毒基因组测序发现,COVID-19和已知的6个新型冠状病毒基因序列几乎一致,并且从同源性来看,与SARS-CoV的同源性最高,将其归为Beta型冠状病毒属[11]。冠状病毒是一类主要引起呼吸道、肠道疾病的病原体,除人类外,还可感染猪、牛、猫、犬、貂、骆驼、蝙蝠、老鼠、刺猬等多种哺乳动物及鸟类[12]。ACE2已被确定为SARS-CoV的功能受体和COVID-19的可能受体[3, 13],研究多种动物ACE2序列差异对于防控冠状病毒跨种族传播的重要性不言而喻。然而,目前在GenBank中,有关ACE2序列报告的物种主要集中在哺乳动物和啮齿动物,尚缺乏鸭等水禽动物ACE2的序列资料,相关的研究相对滞后,尚没有文献报道。
本研究以中国麻鸭为研究对象,得到中国麻鸭ACE2基因序列片段,利用生物信息学方法,对获得的中国麻鸭ACE2基因结构进行系统发育、ACE2蛋白理化性质、高级结构、磷酸化位点等的预测和解析。为ACE2在水禽方面的研究奠定基础。
1 材料与方法 1.1 试验材料随机选取8只14周龄市售健康中国麻鸭,颈部放血处死,迅速采集心、肝、肺、肾、十二指肠、空肠、盲肠、直肠、回肠、睾丸组织,用0.9%生理盐水冲洗干净后放于液氮中,后转移至-80 ℃冰箱。
1.2 主要仪器与试剂DYY-8C型电泳仪(美国);Biometra TAdvanced qPCR仪(德国);Tanon-3900全自动化学发光图像分析系统(美国);Polytron 1200CL匀浆器(瑞士);5804R低温离心机(Eppendorf,德国);Nandrop2000核酸蛋白分析仪(Eppendorf,德国);DOXVN立式压力蒸汽灭菌器(上海博讯实业有限公司)等。
Trizol购自诺唯赞生物科技有限公司(中国,南京);pMD-19T(含SolutionⅠ试剂)载体、DL5000 DNA Marker、Premix Taq酶购自宝生生物工程(中国,大连)有限公司;Trans Start Fast Pfu DNA Polymerse购自北京全式基因(中国,北京)公司;DNA快速琼脂糖回收试剂盒购自康为世纪生物公司(中国,北京);DH5α感受态细胞购自北京鼎国昌盛生物技术有限公司(中国,北京)等。ACE2、β-actin蛋白一抗及相应二抗(鼠抗、兔抗IgG)均购自南京巴奥德生物技术有限公司(中国, 南京)。
1.3 方法 1.3.1 ACE2在中国麻鸭体内的基因和蛋白表达1.3.1.1 中国麻鸭各组织中ACE2基因的表达检测 1) 组织总RNA提取及反转录产物合成。随机取约100 mg麻鸭各组织,彻底匀浆后参照Trizol (Invitrogen,USA)操作步骤分别提取麻鸭各组织总RNA,采用二步法反转录,反转录具体步骤按照反转录酶试剂盒说明书进行,-20 ℃保存所得cDNA。
2) 引物设计。利用Primer Premer5.0软件,根据GenBank中预测的绿头鸭ACE2基因序列(XM-013094461.3)设计RT-PCR引物,如表 1,引物由南京擎科生物科技有限公司合成。
|
|
表 1 RT-PCR引物序列及预期PCR产物长度 Table 1 RT-PCR primer sequences and expected product size |
3) PCR扩增。将RNA反转录成获得的cDNA,以cDNA为模板进行PCR扩增,反应体系(25 μL)。反应条件:95 ℃预变性1 min,95 ℃变性20 s,59 ℃退火20 s,72 ℃延伸1 min15 s,72 ℃彻底延伸5 min,32个循环。PCR反应结束后取10 μL PCR产物进行琼脂糖凝胶电泳检测。
1.3.1.2 中国麻鸭各组织中ACE2蛋白表达检测 ACE2蛋白在冠状病毒的跨物种传播中起重要作用,为检测ACE2基因在中国麻鸭体内是否表达为蛋白质,为后期研究该蛋白在鸭上的生理功能奠定基础,对已检测到ACE2基因的心、肝、肺、肾的组织蛋白进行提取,BCA法测定各组织蛋白浓度,将各组织蛋白稀释至统一浓度进行SDS-PAGE电泳,湿转法将凝胶上的相应条带转至PVDF膜上,转印条件为100 V, 90 min。转印后将条带在5%脱脂奶粉中室温封闭2 h,洗掉脱脂奶粉后,分别加入羊抗兔ACE2蛋白一抗(1:3 000倍稀释)和羊抗兔β-actin内参白蛋白一抗(1:10 000倍稀释),4 ℃过夜,洗膜后,转入辣根酶标记的山羊抗兔IgG二抗(1:10 000倍稀释),室温2 h,TBST洗涤,显色后于全自动成像发光系统中拍照。具体方法参照Wang等[14]方法。
1.3.2 ACE2 cDNA基因克隆1.3.2.1 ACE2引物的设计 根据GenBank公布的绿头鸭ACE2的预测序列(XM_013094461.3)设计一对全基因引物,上下游引物分别插入BamH I和Hind Ⅲ酶切位点(见表 2下划线处),引物序列见表 2,引物由南京擎科生物科技有限公司合成。
|
|
表 2 基因的引物序列 Table 2 Primer sequence |
1.3.2.2 中国麻鸭ACE2 cDNA基因扩增及扩增产物的回收 将RNA反转录成cDNA,以cDNA为模板进行PCR扩增,扩增体系(50 μL)。反应条件:95 ℃预变性1 min,95 ℃变性20 s,59℃退火20 s,72 ℃延伸1 min 15 s,72 ℃彻底延伸5 min,35个循环。扩增产物经1%琼脂糖凝胶电泳鉴定。
DNA琼脂糖凝胶回收纯化参照试剂盒说明书进行,纯化产物-20 ℃保存。
1.3.2.3 ACE2-pMD-19T重组质粒的构建 1) 目的基因的连接。取纯化产物5 μL,加5 μL Premix Taq酶于200 μL EP管中,在PCR仪72 ℃运行10 min后,依次加入0.5 μL pMD19-T载体,4.5 μL上步反应液和5 μL SolutionI,混匀,PCR仪上连接,连接条件:16 ℃,运行14 h。连接产物-20 ℃保存。参照DH5α感受态细胞说明书,将ACE2-pMD19-T重组质粒转化按DH5α感受态细胞,扩大培养后涂布在Amp/X-Gal/IPTG LB培养基平板。
2) 目的基因的菌液PCR和酶切验证。挑取阳性菌落到加有500 μL LB培养基的EP管里,37 ℃震荡培养6 h后取菌液进行PCR验证,具体步骤同“1.3.1.1”。
提取的质粒用HindⅢ单酶切进行验证,1%琼脂糖凝胶电泳。将鉴定的阳性质粒送上海英骏生物技术有限公司测序。
1.4 中国麻鸭ACE2基因的生物信息学分析使用NCBI网站的ORF Finder预测基因开放阅读框及编码蛋白质;DNAMAN和Mega5.0软件进行同源性比对和系统进化树构建; ExPasy在线软件(https://web.expasy.org/protparam/)分析蛋白质基本理化性质;TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM/)进行麻鸭ACE2基因编码蛋白跨膜结构分析;SignalP软件(http://www.cbs.dtu.dk/services/Signal-4.0/)进行麻鸭ACE2蛋白信号肽分析;NetPhos2.0Server在线软件对ACE2基因编码蛋白质进行磷酸化和糖基化位点预测。
2 结果 2.1 ACE2在中国麻鸭体内的基因和蛋白表达检测采用RT-PCR检测ACE2基因在中国麻鸭体内各组织的分布,检测结果如图 1A。由图 1A可知,在中国麻鸭心、肝、肺、肾组织中均有ACE2基因的单一条带(泳道1、2、3、4),条带大小为395 bp左右,与预期(395 bp)一致。取检测到ACE2基因分布的心、肝、肺、肾组织进行Western blot,由试验结果(图 1B)可知,在这些组织中有ACE2蛋白表达,说明ACE2在中国麻鸭体内存在并有蛋白表达。

|
A.中国麻鸭各组织中ACE2基因表达:M.DL2000;泳道1~13.依次为心、肝、肺、肾、十二指肠、空肠、盲肠、直肠、回肠、肌胃组织、睾丸组织、阴性对照1、阴性对照2和18S rRNA基因。B.心、肝、肺、肾中的ACE2蛋白表达(n=8) A. ACE2 gene expression in various tissues of the duck: M. DL2000; lane 1-13. heart, liver, lung, kidney, duodenum, jejunum, cecum, rectu, ileum, muscle stomach, testicular tissue, negative control 1, negative control 2 and 18S rRNA gene.B.The expression of ACE2 in heart, liver, lung and kidney (n=8) 图 1 CE2基因和蛋白在中国麻鸭组织的表达 Fig. 1 Expression of ACE2 gene and protein in China Sheldrake duck tissues |
结果如图 2,在中国麻鸭心和肝组织样品中均现单一条带,条带大小在2 000~4 000 bp之间,与预期大小(2 435 bp)一致。

|
M. DL10000;泳道1.中国麻鸭心ACE2扩增产物;泳道2.中国麻鸭肝ACE2扩增产物;泳道3.阴性对照 M.DNA maker DL10000; lane 1. PCR product of ACE2 in heart; lane 2. PCR product of ACE2 in liver; lane 3.Negative control 图 2 ACE2全基因PCR扩增产物 Fig. 2 The electrophoresis of PCR product of ACE2 gene fragments |
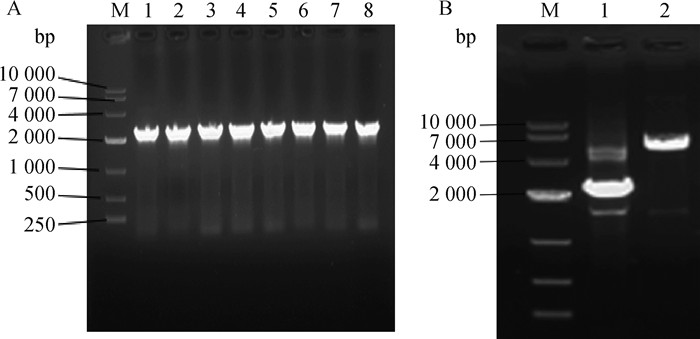
随机挑取8个阳性菌落的菌液进行PCR扩增,经1%琼脂糖凝胶电泳检测(图 3A),泳道1~8均出现单一条带,条带大小在2 000~4 000 bp之间,与预期2 435 bp一致。
|
A.ACE2-pMD19T转化后单克隆菌落:M.DL10000;泳道1~8为随机挑选的阳性菌落。B.阳性菌落验证电泳图:M.DL10000;泳道1.质粒;泳道2.单酶切 A. ACE2-pMD19T transformed monoclonal colonies: M. DL10000; lanes 1-8 are randomly selected positive colonies. B. positive colony verification electrophoresis map: M. DL10000; lane 1. plasmid; lane 2. Single enzyme digestion 图 3 麻鸭基因克隆验证结果 Fig. 3 ACE2-pMD19T plasmid verification results |
酶切验证结果如图 3B所示。HindⅢ单酶切后发现有1条5 127 bp左右的条带(泳道2和5),大小与pMD-19T载体(2 692 bp)和目的基因(2 435 bp)总和一致。因此本研究成功克隆了中国麻鸭ACE2基因的CDS序列。
2.4 中国鸭ACE2基因阳性质粒测序利用Sanger测序法对阳性质粒进行测序,结果本试验克隆得到的中国麻鸭ACE2基因cDNA全长为2 435 bp,共编码805个氨基酸(图 4),测序结果与预测结果大小一致,表明克隆成功,并将测定的中国麻鸭ACE2 mRNA基因序列提交到GenBank,获得序列号为MK836421。

|
图 4 中国麻鸭ACE2基因CDS区和编码氨基酸序列 Fig. 4 Nucleotide sequence and amino acid sequence of China Sheldrake duck ACE2 gene CDS region |
2.5.1 中国麻鸭ACE2基因序列同源性分析 通过NCBI在线网站对中国麻鸭ACE2与其他物种的ACE2核苷酸序列进行同源性分析,结果如表 3,该中国麻鸭与人的同源性为66.2%,与其它动物的同源性在60.0%~88.0%。与白羽肉鸡最高为88%。
|
|
表 3 中国麻鸭ACE2基因同源性分析结果 Table 3 Homology analysis of China Sheldrake duck ACE2 gene |
2.5.2 中国麻鸭ACE2氨基酸同源性和分子进化分析 利用在线软件(http://web.expasy.org/protparam/)对该蛋白质理化性质进行分析,结果该中国麻鸭ACE2基因编码蛋白质由805个氨基酸残基组成,其分子式C4 150H6 307N1 079O1 234S36。用DNAStar软件中MegAlign模块将克隆的中国麻鸭ACE2氨基酸序列与GenBank上收录的其他动物的氨基酸序列进行同源性分析并绘制遗传进化树,发现其与人ACE2基因编码氨基酸数量一致,均为805个氨基酸,同源性为66.4%,且处在不同分支,与其它动物的同源性在65.0%~86.9%(图 5A)。

|
A.中国麻鸭与不同物种ACE2氨基酸同源性分析;B.中国麻鸭与不同物种ACE2分子进化树 A.Homology analysis of ACE2 protein; B.Biological phylogenetic tree of ACE2 gene among different species 图 5 中国麻鸭ACE2氨基酸同源性和分子进化分析 Fig. 5 Homology analysis and biological phylogenetic tree of ACE2 |
2.5.3 中国麻鸭ACE2与冠状病毒连接相关氨基酸分析 ACE2和SARS冠状病毒上S蛋白相互作用晶体结构的研究表明,ACE2中有18个氨基酸残基直接同SARS-CoV S蛋白相连接,这些基团的改变会影响S蛋白同ACE2的结合效率[15]。有研究发现,大鼠ACE2第353位氨基酸是组氨酸, 很大程度上抑制病毒蛋白侵入细胞, 与之相比较,将大鼠ACE2的第353位的组氨酸替换为人相应的赖氨酸后,病毒蛋白能与大鼠受体有效结合[16]。因此,本实验室将获得的中国麻鸭的氨基酸序列与NCBI上人的序列对比,筛选出与SARS病毒有关的18个关键氨基酸残基(表 4),通过比较发现,中国麻鸭除第330和353位氨基酸与人的一样外,其他16个氨基酸均不一致。
|
|
表 4 与SARS-CoV S蛋白受体结合域(RBD)相连的ACE2氨基酸残基 Table 4 ACE2 amino acid residues linked to the SARS-CoV S RBD |
2.5.4.1 二级结构预测 利用JPred4在线软件对该中国麻鸭ACE2蛋白二级结构预测,结果发现该片段有39处α螺旋(39.3%),20处β-折叠(20.19%)和47处无规卷曲(47.44%)。在Gly399-Ieu443与Ile291-Ser317处出现较大α螺旋,在Val745-Ile758处出现最大β-折叠,在Gln249-Cys261与Met351-Asp355处有较大无规卷曲。
2.5.4.2 ACE2编码蛋白跨膜结构和信号肽分析 对ACE2基因编码蛋白跨膜结构分析,预测结果如图 6A。该蛋白属于I型跨膜蛋白,同已鉴定的人等ACE2蛋白跨膜类型一致。其中第1~739氨基酸为胞外部分,第740~762氨基酸之间有一个跨膜螺旋(图框处),第763~805氨基酸为胞内部分。

|
图 6 中国麻鸭ACE2编码蛋白质跨膜结构和信号肽预测 Fig. 6 The tertiary structure of ACE2 protein and ACE2 gene locus analysis of signal peptides in China Sheldrake duck |
麻鸭ACE2蛋白信号肽分析结果如图 6B:图框处C值最大,S值陡峭,Y值最高峰,在第17~18氨基酸之间存在潜在的裂解位点,该蛋白为分泌蛋白(此处D值为0,711,大于4.50-此为分泌蛋白的判断标准),信号肽区域在第1~17氨基酸之间,与跨膜区分析预测的结果一致。
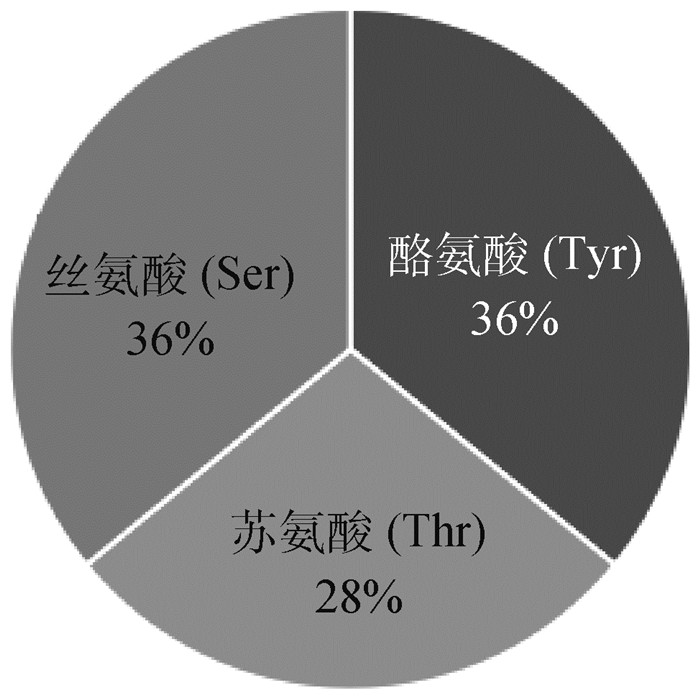
2.5.4.3 蛋白质磷酸化、糖基化位点分析 对ACE2基因编码蛋白质进行磷酸化和糖基化位点预测。统计结果如图 7,显示该麻鸭ACE2蛋白有39处磷酸化位点,其中11处Thr磷酸化位点(28%),14处Ser磷酸化位点(36%)和14处Tyr磷酸化位点(36%)。蛋白质糖基化预测发现蛋白质存在多处N-糖基化位点,无O-糖基化位点。
|
图 7 中国麻鸭ACE2基因编码蛋白质磷酸化位点分析 Fig. 7 Analysis of phosphorylation sites of ACE2 gene in China Sheldrake duck |
ACE2首次被发现是作为肾素-血管紧张素系统的重要成员参与机体心血管系统体液调节[17],其基因定位在人的X染色体上,是一种由805个氨基酸编码的I型跨膜糖蛋白,具有胞外催化结构域,分子量约为120 ku[4, 18],组织定位主要见于心、肾和睾丸,后发现在结肠、肺以及大脑等多种组织中也存在,但水平较低。早期研究表明,ACE2仅局限于血管内皮细胞,但进一步研究表明,ACE2在心肌细胞以及肾小管上皮细胞的管腔表面均有表达[19]。ACE2基因表达的改变会诱使动物产生多种疾病,如高血压、代谢和行为功能障碍以及影响血清素合成等[20]。
自2000年首次克隆了人ACE2全长cDNA并报道了其序列以来,多种动物的ACE2基因被相继克隆成功,有关ACE2序列报告的物种主要集中在人、小鼠等哺乳动物和啮齿动物,禽类方面研究相对滞后,尚缺乏鸭等禽类ACE2序列资料。本研究首先应用RT-PCR和Western blot检测ACE2在麻鸭上的表达,发现基因水平上,麻鸭的心、肝、肺、肾组织中均可以检测到ACE2,同时在这些组织上也有ACE2蛋白存在。根据NCBI上预测的绿头鸭ACE2基因mRNA序列设计引物,克隆中国麻鸭ACE2基因的完整ORF序列,其ACE2基因mRNA编码区共包括2 435个核苷酸,编码805个氨基酸残基。核苷酸序列和氨基酸序列同源性与人ACE2分别为为66.2%、66.4%,通过结构分析发现,麻鸭ACE2为I型跨膜蛋白,有一个信号肽区域,且存在多处磷酸化位点和N-糖基化位点,这些分析与ACE2在已有人或动物上的研究结果相符。
2002年SARS-CoV冠状病毒爆发,Li等[3]通过体外免疫共沉淀和质谱分析证实,ACE2是SARS冠状病毒的功能受体。ACE2和SARS冠状病毒上S蛋白相互作用晶体结构的研究表明,ACE2上有18个关键氨基酸可与S蛋白受体结合区域相结合,其中第24、27、34、37、238、82、83、90和325位氨基酸的变异并不影响与蛋白的相互作用,剩下的8个关键氨基酸31、41、42、45、79、440、353和354,特别是第41和353位氨基酸对冠状病毒侵染细胞起到关键作用[14]。研究证实,大鼠不能被SARS-CoV感染,但如果大鼠ACE2上第353位组氨酸被人ACE2相应位置的赖氨酸替代时,人SARS冠状病毒则可感染大鼠细胞。这些结果提示:关键氨基酸可能影响了SARS-CoV的跨物种和人与人之间的传播[15]。
2020年初,一种新型冠状病毒(COVID-19)在中国武汉出现,在人体中引起类似SARS-Cov的症状,而最新研究发现,COVID-19也以ACE2为受体[21],且COVID-19中的几个关键残基与人类ACE2产生了良好的相互作用,这些相互作用显示了ACE2(L 79,M 82)与RBD(F 486)之间的一种潜在的疏水相互作用以及一种阳离子-π相互作用ACE2(K 353)/ RBD(Y 492),这与COVID-19对人类细胞感染的能力一致,并使得COVID-19已经具备了一定的人际传播能力[22]。而且COVID-19也可能从多种物种(小鼠和大鼠除外)中识别出ACE2,这意味着很多动物物种可能是COVID-19感染的中间宿主或动物模型[23]。通过对比起关键作用的氨基酸发现,中国麻鸭第41位氨基酸谷氨酸与人、果子狸、大鼠、小鼠酪氨酸不一致;中国麻鸭第79位丙氨酸与人亮氨酸不一致;中国麻鸭第82位苯丙氨酸与人蛋氨酸不一致;中国麻鸭第353位氨基酸与人、果子狸一致,皆为赖氨酸,与大鼠、小鼠组氨酸不一致,这说明,虽然还没有发现冠状病毒传播与家禽有关系,但我们知道冠状病毒是一类主要引起呼吸道、肠道疾病的病原体,其危害性除人类外,还可感染猪、牛、禽类等多种动物,又因冠状病毒最初就是1937年从鸡上分离出来,其中以禽传染性支气管炎病毒(avian infectious bronchitis virus, IBV)引起的禽传染性支气管炎(avian infectious bronchitis, IB)是禽的一种发病迅速、高度接触传播的传染病,除主要引起呼吸道症状外,还感染禽类的其它组织和器官,如肾、生殖器官和消化道等许多组织,导致不同程度的病变,还会引起其它疾病的继发感染,给养殖产业带来重大经济损失[24],根据已有的研究,ACE2在人及多种动物体内的广泛分布性及其与冠状病毒之间的关系,仍要警惕其存在的风险,明确ACE2的结构及与冠状病毒侵入的确切机制意义重大。
4 结论本研究通过克隆等分子生物学技术获得中国麻鸭ACE2基因全长序列,并对其基因结构、核苷酸及氨基酸组成、蛋白特性等用不同生物软件进行了预测分析,得到了相应结果。所得基因序列已递交GenBank,基因序列号为MK836421,填补了缺乏鸭ACE2全长序列的空白,为ACE2在鸭上及水禽上的研究奠定了基础。
| [1] | HAMMING I, COOPER M E, HAAGMANS B L, et al. The emerging role of ACE2 in physiology and disease[J]. J Pathol, 2007, 212(1): 1–11. |
| [2] | DONOGHUE M, HSIEH F, BARONAS E, et al. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9[J]. Circ Res, 2000, 87(5): E1–E9. |
| [3] | LI W H, MOORE M J, VASILIEVA N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus[J]. Nature, 2003, 426(6965): 450–454. DOI: 10.1038/nature02145 |
| [4] | BASU R, POGLITSCH M, YOGASUNDARAM H, et al. Roles of angiotensin peptides and recombinant human ACE2in heart failure[J]. J Am Coll Cardiol, 2017, 69(7): 805–819. DOI: 10.1016/j.jacc.2016.11.064 |
| [5] | HE H L, LIU L, CHEN Q H, et al. Mesenchymal stem cells overexpressing angiotensin-converting enzyme 2 rescue lipopolysaccharide-induced lung injury[J]. Cell Transplant, 2015, 24(9): 1699–1715. DOI: 10.3727/096368914X685087 |
| [6] | TIKELLIS C, JOHNSTON C I, FORBES J M, et al. Characterization of renal angiotensin-converting enzyme 2 in diabetic nephropathy[J]. Hypertension, 2003, 41(3): 392–397. |
| [7] |
王凯, 王换换, 刘颖, 等. 利用CRISPR/Cas9系统靶向敲除猪肠上皮细胞(IPEC-J2)ace2基因及其功能分析[J]. 农业生物技术学报, 2019, 27(4): 656–665.
WANG K, WANG H H, LIU Y, et al. Targeted knockout of ace2 in porcine intestinal epithelialcells (IPEC-J2) by CRISPR/Cas9 system and its functional analysis[J]. Journal of Agricultural and Biotechno-logy, 2019, 27(4): 656–665. (in Chinese) |
| [8] |
王艳霞, 张伟, 韩东宁, 等. 血管紧张素转化酶2(ACE2)对大鼠肾氧化应激损伤的保护作用及其机制[J]. 农业生物技术学报, 2011, 19(5): 881–886.
WANG Y X, ZHANG W, HAN D N, et al. Protective effect and mechanism of Angiotensin Converting Enzyme 2(ACE2) on renal oxidative stress injury in rats[J]. Journal of Agricultural Biotechnology, 2011, 19(5): 881–886. DOI: 10.3969/j.issn.1674-7968.2011.05.014 (in Chinese) |
| [9] |
李志强, 闫书平, 纪晓霞, 等. 血管紧张素转换酶2在仔猪空肠中的分布表达及其与物质转运的关系[J]. 畜牧兽医学报, 2019, 50(8): 1676–1684.
LI Z Q, YAN S P, JI X X, et al. Distribution and expression of Angiotensin-Converting Enzyme 2(ACE2) in the jejunum of piglets and its relationship with substance transport[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(8): 1676–1684. (in Chinese) |
| [10] | HASHIMOTO T, PERLOT T, REHMAN A, et al. ACE2 links amino acid malnutrition to microbial eco-logy and intestinal inflammation[J]. Nature, 2012, 487(7408): 477–481. DOI: 10.1038/nature11228 |
| [11] | CHAN J F W, KOK K H, ZHU Z, et al. Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan[J]. Emerg Microbes Infect, 2020, 9(1): 221–236. DOI: 10.1080/22221751.2020.1719902 |
| [12] | WOO P C Y, LAU S K P, HUANG Y, et al. Coronavirus diversity, phylogeny and interspecies jumping[J]. Exp Biol Med (Maywood), 2009, 234(10): 1117–1127. DOI: 10.3181/0903-MR-94 |
| [13] | BAIG A M, KHALEEQ A, ALI U, et al. Evidence of the COVID-19 virus targeting the CNS:tissue distribution, host-virus interaction, and proposed neurotropic mechanisms[J]. ACS Chem Neurosci, 2020, 11(7): 995–998. DOI: 10.1021/acschemneuro.0c00122 |
| [14] | WANG K, LIU X Q, XIAO H, et al. The correlation between inflammatory injury induced by LPS and RAS in EpH4-Ev cells[J]. Int Immunopharmacol, 2017, 46: 23–30. DOI: 10.1016/j.intimp.2017.02.016 |
| [15] | LI F, LI W H, FARZAN M, et al. Structure of SARS coronavirus spike receptor-binding domain complexed with receptor[J]. Science, 2005, 309(5742): 1864–1868. DOI: 10.1126/science.1116480 |
| [16] | XU L L, ZHANG Y F, LIU Y, et al. Angiotensin-converting enzyme 2(ACE2) from raccoon dog can serve as an efficient receptor for the spike protein of severe acute respiratory syndrome coronavirus[J]. J Gen Virol, 2009, 90(11): 2695–2703. DOI: 10.1099/vir.0.013490-0 |
| [17] | SANTOS R A S, FERREIRA A J, SILVA A C S. Recent advances in the angiotensin-converting enzyme 2-angiotensin(1-7)-Mas axis[J]. Exp Physiol, 2008, 93(5): 519–527. DOI: 10.1113/expphysiol.2008.042002 |
| [18] | CRACKOWER M A, SARAO R, OUDIT G Y, et al. Angiotensin-converting enzyme 2 is an essential regulator of heart function[J]. Nature, 2002, 417(6891): 822–828. DOI: 10.1038/nature00786 |
| [19] | PATEL V B, ZHONG J C, GRANT M B, et al. Role of the ACE2/Angiotensin 1-7 axis of the renin-angiotensin system in heart failure[J]. Circ Res, 2016, 118(8): 1313–1326. DOI: 10.1161/CIRCRESAHA.116.307708 |
| [20] | ALENINA N, BADER M. ACE2 in brain physiology and pathophysiology:evidence from transgenic animal models[J]. Neurochem Res, 2019, 44(6): 1323–1329. DOI: 10.1007/s11064-018-2679-4 |
| [21] | XU X T, CHEN P, WANG J F, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission[J]. Sci China Life Sci, 2020, 63(3): 457–460. DOI: 10.1007/s11427-020-1637-5 |
| [22] | DONG N, YANG X M, YE L W, et al. Genomic and protein structure modelling analysis depicts the origin and infectivity of 2019-nCoV, a new coronavirus which caused a pneumonia outbreak in Wuhan, China[J]. bioRxiv, 2020, 20(1): 2998–2330. |
| [23] | WAN Y S, SHANG J, GRAHAM R, et al. Receptor recognition by the novel coronavirus from Wuhan:an analysis based on decade-long structural studies of SARS coronavirus[J]. J Virol, 2020, 94(7): e00127–20. |
| [24] | SHIRVANI E, PALDURAI A, MANOHARAN V K, et al. A Recombinant Newcastle Disease Virus (NDV) expressing S protein of Infectious Bronchitis Virus (IBV) protects chickens against IBV and NDV[J]. Sci Rep, 2018, 8(1): 11951. DOI: 10.1038/s41598-018-30356-2 |



