2. 贵州大学动物科学学院, 贵阳 550025
2. College of Anima. Science, Guizhou University, Guiyang 550025, China
视黄酸受体应答蛋白1(retinoic acid receptor responder 1, RARRES1)基因是视黄酸受体家族成员之一,主要存在于细胞质中,并在其中发挥作用,又被称为他扎罗汀诱导基因1(tazarotene-induced gene 1, TIG1)[1],山羊RARRES1基因位于1号染色体的第6个外显子上,是一种新的视黄酸受体调节基因,最初在人的皮肤培养中被鉴定出来。有数据显示,165种生物具有人类基因RARRES1的直向同源物[2-3];还有研究表明,RARRES1在代谢疾病中差异表达,是多种癌症中最常见的甲基化基因之一,同时,越来越多的证据表明,RARRES1是一种重要的肿瘤抑制基因,通过调节细胞增殖、分化和存活等参与多种细胞反应过程,也可作为细胞周期调控的相关因子[4-5]。此外,RARRES1能调节皮下脂肪组织来促进间充质干细胞(MSC)的分化,是减轻皮下脂肪中最常被调节的基因之一,也是体重维持期间下调最多的基因之一[6]。RARRES1基因还能够在肝脏[7]、肺脏[8]、肾脏[9]、细胞间质[10]、卵巢[11]等多个组织中表达。因以往的诸多研究发现其与疾病相关,故RARRES1被广泛研究于人的癌症以及恶性肿瘤等各类疾病中,在动物方面的研究较少。近年来,一些研究表明,RARRES1基因在中国美利奴羊卵巢中特异性表达,在发情期表达量升高[12]。RARRES1基因在高、低产从江香猪仔猪的卵巢中也存在差异表达[13]。但RARRES1基因mRNA在山羊不同组织中的表达及其功能研究却鲜有报道,且其与山羊产羔性状的关系仍需要进一步探讨。
本研究通过qRT-PCR技术检测RARRES1基因在单、多羔黔北麻羊不同组织中的表达量,并对克隆的黔北麻羊RARRES1基因编码序列进行生物信息学分析,构建pEGFP-N3-RAR RES1真核表达载体与pGPH1/GFP/Neo-RARRES1干扰载体,并导入黔北麻羊卵泡颗粒细胞,进而检测相关基因的表达水平。这为进一步探讨RARRES1基因功能以及其对山羊多胎性状的调控机制奠定了基础。
1 材料与方法 1.1 试验材料本试验的黔北麻羊由贵州省习水县富兴牧业有限公司提供,分别选取单、多羔黔北麻羊母羊各3只进行放血屠宰,羊只屠宰方法及其注意事项参考贵州省地方标准《羊屠宰操作规程》(DB22/T 2740-2017)进行,用高温灭菌后的剪刀、镊子分别采集下丘脑、垂体、子宫、输卵管和卵巢5个组织,用灭菌的锡箔纸包裹后贴好标签置于液氮中运回实验室,之后放置-80 ℃冰箱进行保存。
1.2 主要试剂与仪器TRIzol@Reagent RNA提取试剂盒、逆转录试剂盒、液氮、TAE缓冲液、异丙醇、无水乙醇、西班牙琼脂糖、氨苄青霉素、卡那霉素、PBS、Lipofectamine 2000转染试剂盒购自贵州艾瑞特生物有限公司;荧光定量试剂qPCR Mixture购自擎科生物科技有限公司;胶回收试剂盒、质粒提取试剂盒购自北京康为世纪生物科技有限公司;无内毒素质粒提取试剂盒购自天根生化科技(北京)有限公司;pMD-19T克隆载体、限制性核酸内切酶Bbs I、BgI II、BamH I、DNA marker 2000、DNA Marker 5000购自大连宝生物工程有限公司;DNA连接酶、LB Broth购自上海生工生物工程技术服务有限公司;pEGFP-N3载体由本实验室保存;pGPH1/GFP/Neo载体购自上海吉玛制药技术有限公司。37 ℃细胞培养箱、倒置荧光显微镜、超微量分光光度计、PCR扩增仪(C1000 TouchTM)、实时荧光定量PCR仪(型号为CFX 96 Real-Time System)均购自美国BIO-RAD有限公司。
1.3 试验方法1.3.1 引物的设计与合成 根据GenBank上发布的山羊RARRES1基因序列(登录号:XM_018048385.1),利用Primer软件分别设计1对荧光定量引物、1对克隆扩增引物,在克隆扩增引物的上、下游引入BgI II与BamH I酶切位点,以多胎性状候选基因BMPR-IB(登录号:NM_001285575.1)作为对照,引物信息见表 1。选取β-actin为荧光定量PCR的内参基因。引物交由生工生物(上海)工程技术服务股份有限公司合成。
|
|
表 1 引物序列信息 Table 1 Primer sequences information |
1.3.2 组织RNA提取以及cDNA第一链的合成 按照TRIzol@Reagent RNA试剂盒说明书提取单、多羔组黔北麻羊的下丘脑、垂体、子宫、输卵管、卵巢组织的总RNA。并使用超微量分光光度计测定所提RNA的浓度和纯度。将特异性好,纯度高的RNA进行反转录合成cDNA第一链,采用GenStar-StarScript II cDNA第一链合成试剂盒-II将提取的RNA反转录合成cDNA第一链。体系为20 μL:RNA模板1 μL、Oligo dT Primer 1 μL、DEPC-ddH2O 7 μL、2×Reaction mix 10 μL、StarScript II RT mix 1 μL。PCR反应条件:42 ℃孵育50 min,85 ℃孵育5 min,产物于-20 ℃冰箱保存。
1.3.3 实时荧光定量PCR检测RARRES1基因表达 采用SYBR Green I嵌合荧光法对cDNA第一链进行qRT-PCR反应。预混液反应体系为20 μL:cDNA模板0.8 μL,2×RealStar Green Fast Mixture 10 μL,正向引物与反向引物(10 μmol·L-1)各0.8 μL,补充灭菌水至20 μL。采用三步法进行扩增:95 ℃预变性2 min;95 ℃变性15 s,退火(温度见表 1)30 s,72 ℃延伸30s,40个循环,熔解曲线由机器自动设置。每个样品设置3个重复,并设置阴性对照,检测RARRES1基因在单、多羔黔北麻羊下丘脑、垂体、子宫、输卵管与卵巢5个组织的表达水平。所得Ct值经Excel处理分析后,使用2-ΔΔCt相对定量法计算基因表达量。SPSS 19.0软件对所得数据进行单因素方差分析与配对样本T检验,使用LSD法进行差异显著性检验,P<0.05表示差异显著,P<0.01表示差异极显著。
1.3.4 RARRES1基因真核表达载体的构建1.3.4.1 RARRES1基因的T克隆、连接、转化反应 普通PCR扩增RARRES1基因的CDS区序列,1%琼脂糖凝胶电泳检测PCR产物,经凝胶成像系统拍照后将目的条带切胶回收,按照北京康为世纪公司胶回收试剂盒进行胶回收试验,使用超微量分光光度计测定胶回收产物浓度。将胶回收产物与pMD19-T载体进行连接,16 ℃金属浴连接12 h。将连接反应产物从金属浴中取出,涂板转化至大肠杆菌感受态细胞DH5α中,经过夜培养后,筛选出平板上的白斑,过夜摇菌后进行菌液PCR验证,1%琼脂糖凝胶电泳检测PCR产物,筛选出有目的条带的阳性菌液送至生工生物工程(上海)股份有限公司进行测序验证。
1.3.4.2 RARRES1基因序列的生物信息学分析 测序产物经过DNA Star比对后,对所得序列进行生物信息学分析,利用软件Prot Param(http://expasy.org/tools/protparam.html)分析RARRES1蛋白质的理化性质;利用DNA Star软件对RARRES1基因编码区序列进行同源性分析;利用SOPMA(http://npsapbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)软件分析RARRES1的蛋白质二级结构;利用在线SWISS-mode软件预测蛋白质的三级结构;运用ProtScale程序分析RARRES1蛋白的疏水性;利用PSORT II Prediction在线网站(http://psort.hgc.jp/form2.html)对RARRES1蛋白进行亚细胞定位分析;最后使用MEGA6.0软件构建系统进化树。
1.3.4.3 RARRES1基因真核表达载体的连接、转化、鉴定 阳性菌液经测序比对后,利用北京康为世纪公司的小质粒提取试剂盒提取质粒,经双酶切鉴定与胶回收后,使用T4 DNA连接酶将胶回收产物与酶切后的pEGFP-N3真核表达载体置于金属浴中16 ℃,12 h进行连接反应,连接产物再次转入大肠杆菌感受态细胞DH5α中,经涂板、过夜培养后,挑选白色菌落进行菌液PCR验证,筛选阳性菌液送至生工生物工程(上海)股份有限公司测序,将测序比对正确的阳性菌液使用双酶切鉴定,使用天根公司的无内毒素质粒提取试剂盒提取质粒,于-20 ℃保存转染备用。
1.3.5 RNA干扰载体pGPH1/GFP/Neo-RARRES1的构建1.3.5.1 shRNA引物序列设计及合成 依据山羊RARRES1(登录号:XM_018048385.1)基因编码区序列,利用Thermo公司https://rnaidesigner.thermofisher.com/rnaiexpress网站,依据shRNA设计原则分别找出RARRES1基因效率相对较高的4个干扰靶序列与1个阴性对照序列:GACATGTACTCAGCTCATTAA、GCGCTGCACTTCTTCAACTTC、GGTGAGAAACGTCTGGGAACA、GCAGTCAGGATTCCTGATAGT与TTCTCCG-AACGTGTCACGT,选取上海吉玛制药技术有限公司的pGPH1/GFP/Neo载体。在干扰序列与阴性对照序列两端引入Bbs I与BamH I酶切位点,中间插入序列为TCAAGAG结构的Loop茎环,并在序列最后加上6个T作为RNA聚合酶III的转录终止子。设计4对shRNAs分别命名为shRNA-RARRES1-1~4,阴性对照命名为shRNA-NC,引物交由上海吉玛制药技术有限公司合成,引物信息见表 2。
|
|
表 2 shRNA信息 Table 2 shRNA primers information |
1.3.5.2 pGPH1/GFP/Neo载体的酶切与回收 将冻存的pGPH1/GFP/Neo空载体复苏,放入含有卡那霉素的液体培养基中扩大培养,培养基浑浊后,取10 μL pGPH1/GFP/Neo空载体、1 μL Bbs I内切酶、1 μL BamH I内切酶、5 μL 10× Green Cut Buffer、ddH2O补充至50 μL,于0.2 mL PCR管中进行酶切反应(37 ℃,1 h),使用1%琼脂糖凝胶电泳检测酶切产物,并对目的条带切胶回收,胶回收方法参照北京康为世纪公司胶回收试剂盒说明书。胶回收产物于-20 ℃冰箱保存,连接备用。
1.3.5.3 shRNA片段的退火与pGPH1/GFP/Neo连接 将单链shRNA上下游片段进行退火,形成双链的DNA片段,随后与载体pGPH1/GFP/Neo进行连接。将合成好的shRNA-RARRES1引物用灭菌后的超纯水稀释至100 μmol·L-1,shRNA退火体系为10 μL:shRNA-RARRES1上下游序列(100 μmol·L-1)各4 μL,5×退火缓冲液2 μL;PCR退火反应程序:95 ℃ 5 min,80 ℃ 2 min,70 ℃ 2 min,60 ℃ 2 min,50 ℃ 2 min,40 ℃ 2 min,37 ℃ 2 min,4 ℃保存,并将退火得到的shRNA片段用RNA无酶水稀释10倍用于后续的连接反应。连接反应体系10 μL:10×T4 Ligation Buffer 1 μL、T4 DNA连接酶0.1 μL、shRNA退火模板1 μL、酶切后pGPH1/GFP/Neo空载体3 μL、ddH2O补充至10 μL。连接反应条件:37 ℃ 2 h。将与pGPH1/GFP/Neo空载体连接好的shRNA序列和阴性对照序列分别命名为pGPH1/GFP/Neo-RARRES1-1~ 4和pGPH1/GFP/Neo-NC。
1.3.5.4 重组质粒pGPH1/GFP/Neo-RARRES1的转化与鉴定 将连接好的4个重组质粒pGPH1/GFP/Neo-RARRES1-1~4和1个阴性对照pGPH1/GFP/Neo-NC转化进入大肠杆菌感受态细胞,然后通过涂板进行筛选,在LB平板中挑取的白色菌落置于含有卡那霉素的LB液体培养基中,37 ℃,200 r·min-1摇16 h后进行菌液PCR反应,1%琼脂糖凝胶电泳检测PCR产物是否有目的条带,筛选阳性菌液送至上海生工生物工程股份有限公司进行测序验证。
1.3.6 黔北麻羊卵泡颗粒细胞的培养1.3.6.1 卵泡颗粒细胞的采集 将刚刚放血屠宰的黔北麻羊解剖后,立即用灭菌的剪刀镊子采集卵巢组织,先用75%酒精消毒液冲洗3次,尽可能的杀死卵巢组织表面细菌及真菌,再用灭菌后的PBS冲洗3次去除在卵巢组织表面残留的酒精液体,放在装有冰袋的PBS蓝瓶中带回实验室进行卵泡颗粒细胞的分离培养。
1.3.6.2 卵泡颗粒细胞的分离及培养 卵泡颗粒细胞的培养方法参照文献[14],在超净工作台中,再次使用75%的酒精消毒液与PBS对卵巢组织进行处理,用针头扎破卵巢表面,使其中的卵泡液流入培养液加青霉素与链霉素的DMEM-F12中,并用巴氏吸管吸取DMEM-F12,冲洗卵泡,然后将DMEM-F12培养液分装置于10 mL离心管中,静置10 min,缓慢弃除上清液,以1 000 r·min-1离心10 min,再次弃除上层液体。在离心管中重新加入DMEM-F12培养液反复冲洗、吹打使细胞悬浮,成为细胞悬液。在向10 mL离心管中加入5 mL含胎牛血清和青霉素、链霉素的DMEM-F12液体,吹打混匀之后转入蓝盖细胞培养瓶中,置于37 ℃,CO2培养箱中培养,及时观察细胞状态,每12 h更换培养液,待原代细胞贴壁生长密度至80%~90%左右时,进行细胞传代。
1.3.7 转染RARRES1基因真核表达载体与RNA干扰载体至黔北麻羊卵泡颗粒细胞 将细胞培养瓶中生长状况良好、细胞密度符合要求的卵泡颗粒细胞用胰酶消化后等体积、等比例的铺至细胞6孔板中进行培养,待细胞生长情况良好、密度大于80%时,将完全培养基更换为10%血清培养基(不含抗生素),使用Lipofectamine 2000转染试剂盒将超表达质粒pEGFP-N3-RARRES1、空载体pEGFP-N3与各干扰载体重组质粒pGPH1/GFP/Neo-RARRES1-1~4、阴性对照pGPH1/GFP/Neo-NC分别转染至黔北麻羊卵泡颗粒细胞中,37 ℃ 5% CO2细胞培养箱中进行培养,12 h后使用显微镜观察细胞转染情况。
1.3.8 实时荧光定量PCR技术检测细胞mRNA水平 将真核表达重组质粒与各干扰载体重组质粒转染至卵泡颗粒细胞后,利用TRIzol@Reagent RNA提取试剂盒提取黔北麻羊卵泡颗粒细胞中的总RNA,反转录为cDNA第一链,用于实时荧光定量反应,反应体系、程序、数据处理与1.3.3中方法相同。
2 结果 2.1 RARRES1基因荧光引物与克隆引物的PCR扩增将反转录的cDNA第一链结合RARRES1基因的荧光定量引物与克隆引物进行PCR扩增反应(图 1),由图 1可知,RARRES1基因PCR扩增克隆产物条带很亮,与目的片段大小一致,荧光引物无非特异性扩增,可用于下一步试验。

|
A. RARRES1基因克隆引物的PCR扩增:1~6. RARRES1基因克隆引物的扩增产物;B. RARRES1基因荧光引物的PCR扩增:7~11. RARRES1基因荧光引物的扩增产物。M. DNA相对分子质量标准 A. PCR amplification of the RARRES1 gene cloning primer: 1-6. the amplified products of the RARRES1 gene cloning primer; B. PCR amplification of the RARRES1 gene fluorescent primer: 7-11. the amplified products of the RARRES1 gene fluorescent primer. M. DNA marker 2000 图 1 RARRES1基因PCR扩增的琼脂糖凝胶电泳图 Fig. 1 Agarose gel electrophoresis of PCR amplification of RARRES1 gene |
由图 2可知,RARRES1基因mRNA在单、多羔黔北麻羊被检测的5个组织中均有表达,在卵巢组织中的表达量最高,在下丘脑中的表达量最低,两者之间差异极显著(P < 0.01);经组内比较可知,RARRES1基因mRNA在单羔组黔北麻羊被检测的5个组织中的表达顺序依次为:卵巢>输卵管>垂体>子宫>下丘脑;在多羔组黔北麻羊被检测的5个组织中的表达顺序依次为:卵巢>垂体>输卵管>子宫>下丘脑。组间比较可知,RARRES1基因mRNA在单羔组黔北麻羊输卵管与卵巢组织中的表达水平极显著高于多羔组(P < 0.01),但在多羔组垂体中的表达水平显著高于单羔组(P < 0.05)。

|
不同大写字母表示不同组织间的表达水平达到极显著差异(P < 0.01)。**表示不同组间的表达水平达到极显著差异(P < 0.01),*表示不同组间的表达水平达到显著性差异(P < 0.05) Different uppercase letters indicate the extremely significantly difference among tissues (P < 0.01). ** indicate the extremely significant differences between groups(P < 0.01), * indicate the significant differences between groups (P < 0.05) 图 2 RARRES1基因mRNA在单、多羔黔北麻羊不同组织中的表达水平 Fig. 2 The expression of RARRES1 gene mRNA in different tissues of monotocous and polytocous Qianbei Ma goats |
菌液PCR条带位置与PCR扩增CDS区目的条带位置相同且条带明亮(图 3)。将菌液PCR中筛选出来的阳性菌液送至上海生工生物工程有限公司测序后发现,扩增出的黔北麻羊RARRES1基因CDS区与原序列比对后正确率高达99.8%(图 4),菌液PCR及测序结果证实,黔北麻羊RARRES1基因亚克隆载体构建成功,可用于下一步研究。

|
图 3 黔北麻羊RARRES1基因菌液PCR验证结果 Fig. 3 PCR detection results of Qianbei Ma goat RARRES1 gene bacterial solution |

|
图 4 pMD-19T-RARRES1亚克隆载体部分测序结果 Fig. 4 Partial sequencing results of pMD-19T-RARRES1 subcloning vector |
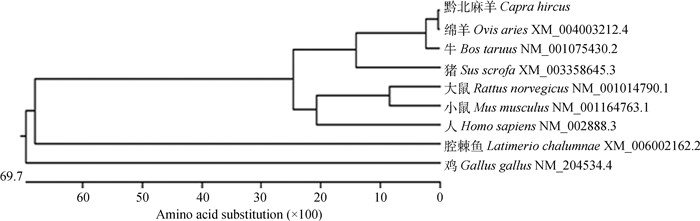
2.4.1 黔北麻羊RARRES1基因序列分析 阳性菌液测序后得到大小为949 bp的序列,包含黔北麻羊RARRES1基因CDS区全长以及部分5′UTR与3′UTR序列,本研究获得黔北麻羊RARRES1基因的CDS区序列,与山羊(Capra hircus)原序列相比,比对成功率达到99.8%,黔北麻羊RARRES1基因CDS区共发生两处突变,第一处为第662位A→G突变,第二处为第679位T→G突变,但两处突变均为同义突变,没有引起氨基酸的改变。随后,利用DNA Star软件对黔北麻羊RARRES1氨基酸编码序列与绵羊、牛、猪、大鼠、小鼠、鸡、腔棘鱼、人等8个物种进行同源性比较,结果显示,其编码序列与绵羊、牛、猪、大鼠、小鼠、鸡、腔棘鱼、人的同源性分别为99.7%、95.5%、76.0%、62.6%、62.9%、34.2%、35.6%、60.4%。利用MEGA 6.0软件构建不同物种RARRES1基因的系统进化树(图 5)发现,RARRES1基因在反刍动物中具有较高的保守性,黔北麻羊与绵羊、牛的遗传距离相对较近,与鸡、腔棘鱼的遗传距离相对较远,证实RARRES1基因具有良好的种属特异性。
|
图 5 黔北麻羊RARRES1基因系统进化树 Fig. 5 The system phylogenetic tree of Qianbei Ma goat RARRES1 gene |
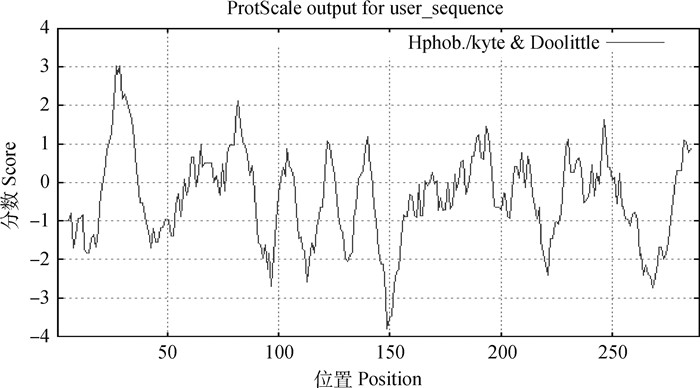
2.4.2 RARRES1蛋白质特性生物信息学分析 运用在线软件ExPASy分析RARRES1氨基酸序列,进一步得到其生物学信息,分析得出,RARRES1蛋白共编码289个氨基酸,分子式为C1481H2301N407O425S8,共包含4 622个原子,理化性质分析结果表明,RARRES1蛋白的理论分子量为32.864 ku,理论等电点为8.79,不稳定系数为51.90,将该蛋白视为不稳定蛋白;RARRES1蛋白包含20种氨基酸,其中亮氨酸(Leu)的含量最高,占据总氨基酸数的11.4%,甲硫氨酸(Met)与半胱氨酸(Cys)的含量最低,各占据总氨基酸数的1.4%。运用PSORT II Server在线网站分析RARRES1蛋白的亚细胞定位,得出RARRES1蛋白定位在线粒体、细胞质、高尔基体、内质网、细胞核、细胞空泡中的比例分别为39.1%、17.4%、17.4%、13.0%、8.7%、4.3%,说明黔北麻羊RARRES1蛋白主要分布在细胞质中。运用ExPASy-ProtScale程序对RARRES1蛋白进行疏水性与亲水性分析,得出图谱如图 6所示,横坐标代表RARRES1蛋白编码氨基酸位置,纵坐标代表RARRES1蛋白疏水性分数,0分以上代表疏水性区域,分数越高疏水性越强,0分以下代表亲水性区域,分数越低亲水性越强,由图 6可知,第27、29位氨基酸的疏水性分值最高为3.022分,第149位氨基酸亲水性分数最高为-3.811分,亲水性氨基酸数量大于疏水性氨基酸数量,故得出RARRES1蛋白为亲水性蛋白。
|
图 6 RARRES1蛋白疏水性图谱 Fig. 6 RARRES1 protein hydrophobicity map |
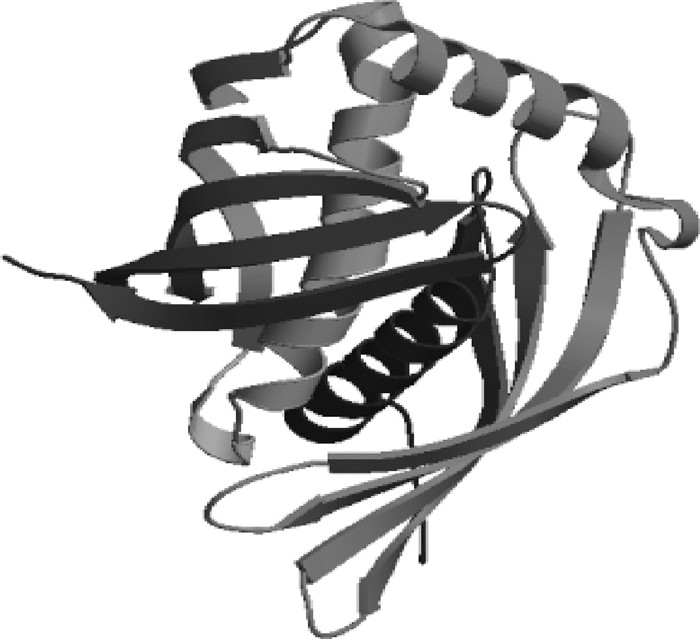
2.4.3 RARRES1蛋白质二级结构与三级结构分析 利用SOPMA在线软件分析黔北麻羊RARRES1蛋白质的二级结构,发现RARRES1蛋白质二级结构主要由103个α-螺旋、15个β-转角、130个无规则卷曲、41个延伸链4部分构成,其比例分别为35.64%、5.19%、44.98%、14.19%,进一步对黔北麻羊RARRES1蛋白质进行三级结构预测(SWISS-MODEL)发现,其主要是由无规则卷曲和α-螺旋构成(图 7),与二级结构预测相符,表明RARRES1蛋白结构具有高度保守性。
|
图 7 黔北麻羊RARRES1蛋白质三级结构预测图 Fig. 7 Tertiary structure prediction map of RARRES1 protein in Qianbei Ma goat |
将1.3.4.3中筛选出的阳性菌液经测序比对后发现,黔北麻羊RARRES1基因与NCBI预测的山羊RARRES1基因序列完全吻合,无碱基突变以及氨基酸的改变(图 8)。将阳性菌液提取质粒并进行双酶切(限制性内切酶BgI II、BamH I)检测后(图 9),可见酶切获得两个条带,4 729 bp代表pEGFP-N3空载体片段,869 bp代表RARRES1基因CDS区片段,与预测结果相符,测序及双酶切检验表明,黔北麻羊RARRES1基因真核表达载体构建成功。

|
图 8 pEGFP-N3-RARRES1部分测序结果 Fig. 8 Partial sequencing results of pEGFP-N3-RARRES1 |

|
A. pGPH1/GFP/Neo-RARRES1-1,B. pGPH1/GFP/Neo-RARRES1-2; C. pGPH1/GFP/Neo-RARRES1-3; D. pGPH1/GFP/Neo-RARRES1-4; E. pGPH1/GFP/Neo-NC 图 9 pEGFP-N3-RARRES1酶切电泳图 Fig. 9 The electrophoresis of pEGFP-N3-RARRES1 enzyme digestion |
将1.3.5.4中筛选出的阳性菌液送至生工生物工程(上海)股份有限公司测序发现(图 10),重组质粒pGPH1/GFP/Neo-RARRES1-1~4与阴性对照pGPH1/GFP/Neo-NC与靶序列以及shRNA模板序列完全一致,无碱基突变以及氨基酸的改变,证实RNA干扰载体pGPH1/GFP/Neo-RARRES1构建成功。
|
图 10 干扰载体pGPH1/GFP/Neo-RARRES1测序结果 Fig. 10 The sequencing results of interference vector pGPH1/GFP/Neo-RARRES1 |
黔北麻羊卵泡颗粒细胞形态变化如图 11所示,刚分离出的卵泡颗粒细胞呈“点”状且聚集较密,3 h后开始贴壁生长,到6 h时细胞以基本贴壁且“纺锤形”开始出现(图 11A),卵泡颗粒细胞培养12 h后完全贴壁生长,且“点”形与“纺锤”形开始变大(图 11B),到24 h时细胞密度增加,细胞形态与轮廓更加清晰,贴壁细胞数量已占细胞培养瓶面积的50%(图 11C),48 h后从显微镜下观察卵泡颗粒细胞可以发现较24 h时,细胞密度继续增加,形态与轮廓明显的贴壁细胞数量已占细胞培养瓶面积的90%(图 11D),可进行细胞传代试验。

|
A.细胞分离培养6 h(100×);B.细胞分离培养12 h(100×);C.细胞分离培养24 h(100×);D.细胞分离培养48 h(200×) A. Cell isolation and culture for 6 h(100×); B. Cell isolation and culture for 12 h(100×); C. Cell isolation and culture for 24 h(100×); D. Cell isolation and culture for 48 h(200×) 图 11 黔北麻羊卵泡颗粒细胞分离培养的形态变化 Fig. 11 Morphological changes of follicular granulosa cells from Qianbei Ma goat |
各重组质粒转染黔北麻羊卵泡颗粒细胞效率如图 12所示,空白对照细胞呈一片漆黑,无绿色荧光蛋白出现,相比于空白对照,pEGFP-N3空载体、pEGFP-N3-RARRES1超表达质粒、各干扰载体重组质粒pGPH1/GFP/Neo-RARRES1-1~4与阴性对照重组质粒pGPH1/GFP/Neo-NC均在转染后24 h内,在蓝光的激发下细胞中发出大量绿色荧光蛋白(图 12中的高亮部分),无大量漂浮的死细胞,阳性细胞占比80%以上,证实各重组载体转染成功,且转染效率良好,在黔北麻羊卵泡颗粒细胞内存在表达,可用于下一步研究。
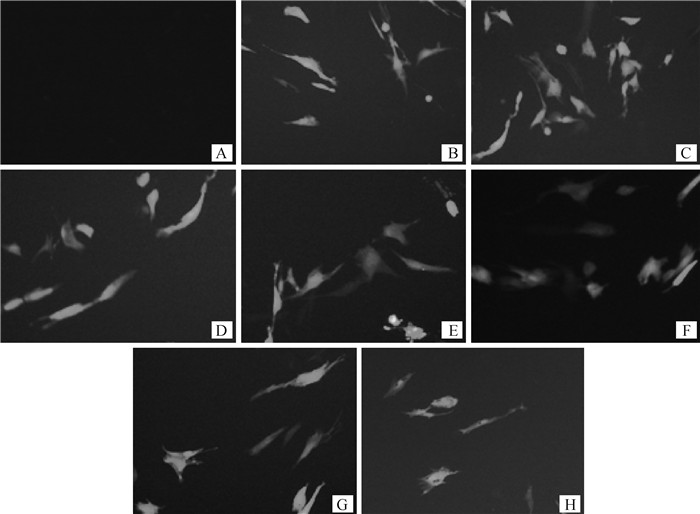
|
A.空白对照(Blank); B. pEGFP-N3; C. pEGFP-N3-RARRES1; D. pGPH1/GFP/Neo-RARRES1-1; E. pGPH1/GFP/Neo-RARRES1-2; F. pGPH1/GFP/Neo-RARRES1-3; G. pGPH1/GFP/Neo-RARRES1-4; H. pGPH1/GFP/Neo-NC 图 12 重组质粒转染效率检测(100×) Fig. 12 Detection of transfection efficiency of recombinant plasmids(100×) |
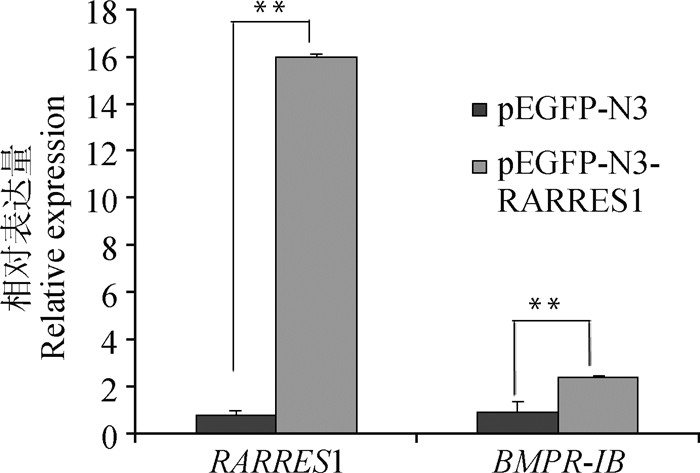
将各个重组质粒转染的黔北麻羊卵泡颗粒细胞提取RNA后,qRT-PCR结果如图 13、14所示,由图 13可知,与空载体pEGFP-N3相比,重组质粒pEGFP -N3-RARRES1能极显著提高RARRES1与BMPR-IB基因在黔北麻羊卵泡颗粒细胞中的表达量(P < 0.01),数据分析得出,重组质粒pEGFP-N3- RARRES1转染后颗粒细胞中RARRES1、BMPR-IB基因的表达量分别为空载体pEGFP-N3转染后的21.02和2.59倍。由图 14可知,相对于阴性对照NC,重组质粒pGPH1/GFP/Neo-RARRES1-1~2对RARRES1与BMPR-IB基因的表达均没有抑制作用,pGPH1/GFP/Neo-RARRES1-3对RARRES1基因的表达也不具有抑制作用,但却能极显著下调BMPR-IB基因的表达。pGPH1/GFP/Neo-RARRES1-4的抑制效率相对最好,能够显著与极显著下调RARRES1与BMPR-IB基因在黔北麻羊卵泡颗粒细胞中的表达量(P < 0.05;P < 0.01)。经计算得出,重组质粒pGPH1/GFP/Neo-RARRES1-4对 RARRES1、BMPR-IB基因的抑制效率分别为89.16%与76.83%。
|
“**”、“*”分别表示相对于空载体pEGFP-N3,重组质粒pEGFP-N3-RARRES1极显著(P < 0.01)、显著(P < 0.05)提高mRNA的表达量 "**" and "*" indicate that the recombinant plasmid pEGFP-N3-RARRES1 extremely significantly (P < 0.01) and significantly (P < 0.05) increased the expression of genes mRNA relative to the empty vector pEGFP-N3 图 13 pEGFP-N3-RARRES1转染颗粒细胞后的相关基因表达 Fig. 13 Related gene expression after transfecting pEGFP-N3-RARRES1 into granulosa cells |

|
不同大写字母表示与NC相比达到极显著差异(P < 0.01);不同小写字母表示与NC相比达到显著性差异(P < 0.05) Different uppercase letters indicate the extremely significant difference compared to NC (P < 0.01); different lowercase letters indicate the significant difference compared to NC (P < 0.05) 图 14 pGPH1/GFP/Neo-RARRES1转染颗粒细胞后的相关基因表达 Fig. 14 Related genes expression after transfecting pGPH1/GFP/Neo-RARRES1 into granulosa cells |
产羔性状是重要的繁殖性状,山羊产羔数的高低与广大养殖户的利益息息相关,故提高山羊产羔数对山羊养殖业的发展具有促进作用,而解析山羊繁殖性状的遗传机制是増加产羔数和提高生产效率的基础[15]。黔北麻羊是贵州优良地方山羊品种,具有繁殖力高,遗传稳定等特点,于2009年被批准为新遗传资源[16],可作为研究山羊繁殖性状调控机理的理想模型。
视黄醇(又名维生素A)对动物机体的生长发育十分重要,早期研究表明,视黄醇通过代谢为活性因子视黄酸(retinoic acid, RA)而调节细胞中RNA与蛋白质的表达[17],在哺乳动物生殖细胞(特别是卵巢)的发育中发挥重要作用[18]。研究表明,视黄酸可以诱导小鼠卵泡颗粒细胞的增殖分化,使卵泡表面FSH与LH发生反应并促进颗粒细胞的增殖排卵[19]。视黄酸的活性受视黄酸受体的调节,而视黄酸受体应答蛋白RARRES1、RARRES2与RARRES3是调节视黄酸活性的重要基因[20],贵州大学生理与生物学实验室前期以高、低产仔的从江香猪卵巢为模板进行了转录组测序工作,筛选鉴定发现,RARRES1基因在高、低产仔从江香猪卵巢中存在差异表达[13]。故推测,RARRES1基因能够提高颗粒细胞的发育与排卵,对产羔数具有一定的影响。本试验成功克隆了黔北麻羊RARRES1基因编码序列并进行了生物信息学分析,与山羊原序列一致性高达99.8%,存在的两处突变均为同义突变,不引起氨基酸的改变,且RARRES1蛋白质结构也具有高度保守性。研究显示,视黄酸受体家族的结构趋于稳定,氨基酸序列保守,不易发生突变[21],这与本研究结果的保守性一致。同源性分析及系统进化树的结果也表明,RARRES1基因符合遗传进化规律。本研究还发现,RARRES1蛋白分别可能定位在线粒体、细胞质、高尔基体、内质网、细胞核、细胞空泡等6种结构中,这与视黄酸受体广泛分布在动物机体内的结论相符[22],同时q-PCR技术检测到RARRES1基因mRNA在卵巢中的表达量最高,单羔组黔北麻羊卵巢的表达量极显著高于多羔组(P < 0.01),与林杉等[12]得出的RARRES1基因在绵羊卵巢中高表达的结论一致,但与阮亦麒等[13]通过甲基化方式研究从江香猪的高产仔率的结果不同,可能是由于前者为反刍动物,后者为典型的单胃动物,物种差异较大所致。
基因超表达与沉默表达是最常用且有效的基因功能研究方法之一,超表达是通过人工构建来实现基因产物的超表达[23],沉默表达是指由dsRNA诱导的同源性mRNA特异性降解的现象[24]。苑洪霞等[25]通过构建LYRM1基因超表达载体探明其可能是猪脂肪沉积的候选基因。刘同君等[26]通过构建Grp78基因超表达载体揭示了其能够参与免疫调控等新功能。王圆圆等[27]、龚云等[28]也通过构建相关基因的RNA干扰载体发现其在不同细胞或通路中的功能。本研究通过超表达与沉默表达载体两方面初步阐明了RARRES1基因的功能。为进一步探究其对山羊产羔性状的调控机理奠定基础。
转化生长因子β超家族成员众多,广泛分布于动物体内的各个组织器官,并广泛的参与动物体内各种生理、生化活动。其中骨形态发生蛋白(bone morphogenetic protein, BMPs)就是该家族的成员之一,而骨形态发生蛋白受体(bone morphogenetic protein receptor, BMPR)是骨形态发生蛋白成员中极为重要的一个,其具体又分为两种亚型,骨形态发生蛋白受体IB(bone morphogenetic protein receptor IB, BMPR-IB)就是最常见的一类亚型[29-30],存在于卵泡颗粒细胞中并参与表达,主要在卵泡发育、排卵等方面发挥其重要作用。有研究表明, BMPR-IB基因编码区第746 bp的错义突变,使谷氨酸变为精氨酸是导致山羊多胎性的主要原因,该突变又被称为FecB突变[31-33]。FecB突变已在印度地方山羊[34]、湖羊[35]、小尾寒羊[36]等多个品种中被检测到,BMPR-IB基因编码区的多个突变位点也被证实与多个品种绵(山)羊的产羔数、产羔性能等相关[37-40],故BMPR-IB基因现已被广大学者作为影响羊多胎性状的候选基因。故本研究选取BMPR-IB基因作为对照,将RARRES1基因真核表达载体与RNA干扰载体导入细胞后发现,超表达质粒pEGFP-N3-RARRES1能极显著提高RARRES1基因的表达,并能够显著提高多胎性状候选基因BMPR-IB的表达,表明超表达RARRES1基因对山羊的多胎性状具有促进作用,可以提高山羊的产仔数。干扰质粒中pGPH1/GFP/Neo-RARRES1-4能显著与极显著降低RARRES1以及BMPR-IB mRNA的表达。表明沉默RARRES1基因能降低山羊的多胎性能、降低山羊的产仔数,其余RNA干扰质粒pGPH1/GFP/Neo-RARRES1-1-3均不能降低RARRES1基因mRNA在颗粒细胞中的表达量,推测可能是筛选的shRNA靶序列干扰效率不高导致。
4 结论本研究成功扩增了黔北麻羊RARRES1基因CDS区,q-PCR显示, 其在卵巢中的表达量最高,在单羔黔北麻羊卵巢中的表达量极显著高于多羔。超表达RARRES1能极显著提高RARRES1和BMPR-IB基因在颗粒细胞中的表达,干扰质粒pGPH1/ GFP/Neo-RARRES1-4能显著与极显著降低RARRES1和BMPR-IB基因在颗粒细胞中的表达。本试验结果为深入研究RARRES1基因功能及黔北麻羊产羔性状的调控机制奠定了基础。
| [1] | ROY A, RAMALINGA M, KIM O J, et al. Multiple roles of RARRES1 in prostate cancer:autophagy induction and angiogenesis inhibition[J]. PLoS One, 2017, 12(7): e0180344. |
| [2] | DAMERON K M, VOLPERT O V, TAINSKY M A, et al. Control of angiogenesis in fibroblasts by p53 regulation of thrombospondin-1[J]. Science, 1994, 265(5178): 1582–1584. |
| [3] | NAGPAL S, PATEL S, ASANO A, et al. Tazarotene-induced gene 1(TIG1), a novel retinoic acid receptor-responsive gene in skin[J]. J Invest Dermatol, 1996, 106(2): 269–274. |
| [4] | YANATATSANEEJIT P, CHALERMCHAI T, KEREKHANJANARONG V, et al. Promoter hypermethylation of CCNA1, RARRES1, and HRASLS3 in nasopharyngeal carcinoma[J]. Oral Oncol, 2008, 44(4): 400–406. |
| [5] | COYLE K M, MURPHY J P, VIDOVIC D, et al. Breast cancer subtype dictates DNA methylation and ALDH1A3-mediated expression of tumor suppressor RARRES1[J]. Oncotarget, 2016, 7(28): 44096–44112. DOI: 10.18632/oncotarget.9858 |
| [6] | JOHANSSON L E, DANIELSSON A P H, PARIKH H, et al. Differential gene expression in adipose tissue from obese human subjects during weight loss and weight maintenance[J]. Am J Clin Nutr, 2012, 96(1): 196–207. |
| [7] | TEUFEL A, BECKER D, WEBER S N, et al. Identification of RARRES1 as a core regulator in liver fibrosis[J]. J Mol Med (Berl), 2012, 90(12): 1439–1447. |
| [8] | DAVIDSON B, STAVNES H T, RISBERG B, et al. Gene expression signatures differentiate adenocarcinoma of lung and breast origin in effusions[J]. Hum Pathol, 2012, 43(5): 684–694. |
| [9] | ZIMPFER A, DAMMERT F, GLASS A, et al. Expression andclinicopathological correlations of retinoid acid receptor responder protein 1 in renal cell carcinomas[J]. Biomark Med, 2016, 10(7): 721–732. |
| [10] | MAIMOUNI S, LEE M H, SUNG Y M, et al. Tumor suppressor RARRES1 links tubulin deglutamylation to mitochondrial metabolism and cell survival[J]. Oncotarget, 2019, 10(17): 1606–1624. |
| [11] | HUMMITZSCH K, HATZIRODOS N, IRVING-RODGERS H F, et al. Morphometric analyses and gene expression related to germ cells, gonadal ridgeepithelial-like cells and Granulosa cells during development of the bovine fetal ovary[J]. PLoS One, 2019, 14(3): e0214130. |
| [12] |
林杉, 陈磊, 张文祥, 等. 中国美利奴羊不同时期卵巢组织cDNA消减文库(SSH)的构建及序列分析[J]. 农业生物技术学报, 2014, 22(5): 642–650.
LIN S, CHEN L, ZHANG W X, et al. cDNA Suppression Subtractive Hybridization (SSH) library construction and sequence analysis of the ovary of Chinese merino sheep (Ovis aries) in different period[J]. Journal of Agricultural Biotechnology, 2014, 22(5): 642–650. (in Chinese) |
| [13] |
阮亦麒, 李大鹏, 冉雪琴, 等. 香猪卵巢RARRES1基因第1外显子CG位点的甲基化及其与基因差异表达的关联[J]. 中国畜牧兽医, 2018, 45(6): 1471–1478.
RUAN Y Q, LI D P, RAN X Q, et al. The methylation in the exon1 of RARRES1 gene and its association with gene differential expression of Xiang Pig Ovary[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(6): 1471–1478. (in Chinese) |
| [14] |
陈虹.牦牛卵巢Label-free蛋白组学分析及相关蛋白在生殖系统的表达[D].兰州: 甘肃农业大学, 2018.
CHEN H.Analysis of label-free quantification proteomics in Yak's ovary and expression of related proteins in the reproductive system[D].Lanzhou: Gansu Agricultural University, 2018.(in Chinese) https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CDFD&dbname=CDFD&filename=1018710939.nh |
| [15] |
孙振梅.黔北麻羊BMP4和BMPR-IB基因克隆表达及其多态性与繁殖性状的关联分析[D].贵阳: 贵州大学, 2017.
SUN Z M.Cloning expression and polymorphisms analysis of BMP4 and BMPR-IB genes associated with reproductive traits in Qianbei Ma goat[D].Guiyang: Guizhou University, 2017.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10657-1017877334.htm |
| [16] |
罗卫星, 张启林, 穆林, 等. 黔北麻羊的肉用性能和肉质特性研究[J]. 西南农业学报, 2010, 23(5): 1706–1710.
LUO W X, ZHANG Q L, MU L, et al. Studies on mutton performance and quality of Qianbei Ma Goat[J]. Southwest China Journal of Agricultural Sciences, 2010, 23(5): 1706–1710. (in Chinese) |
| [17] |
南韦肖, 司华哲, 娄玉杰, 等. 维生素A对动物毛囊发育影响的研究进展[J]. 动物营养学报, 2019, 31(9): 3968–3975.
NAN W X, SI H Z, LOU Y J, et al. Research process of effects of vitamin a on hair follicle development[J]. Journal of Animal Nutrition, 2019, 31(9): 3968–3975. (in Chinese) |
| [18] | KAWAI T, YANAKA N, RICHARDS J S, et al. De novo-synthesized retinoic acid in ovarian Antral follicles enhances FSH-mediated ovarian follicular cell differentiation and female fertility[J]. Endocrinology, 2016, 157(5): 2160–2172. |
| [19] |
杨言昭, 张艳敏, 刘颖, 等. 视黄醇在卵巢发育中的作用研究进展[J]. 中国畜牧杂志, 2019, 55(5): 1–5.
YANG Y Z, ZHANG Y M, LIU Y, et al. Research progress on the role of retinol in ovary development[J]. Chinese Journal of Animal Science, 2019, 55(5): 1–5. (in Chinese) |
| [20] | HUEBNER H, HARTNER A, RASCHER W, et al. Expression and regulation of retinoic acid receptor responders in the human placenta[J]. Reprod Sci, 2018, 25(9): 1357–1370. |
| [21] | DI MASI A, LEBOFFE L, DE MARINIS E, et al. Retinoic acid receptors:from molecular mechanisms to cancer therapy[J]. Mol Aspects Med, 2015, 41: 1–115. |
| [22] | MINKINA A, LINDEMAN R E, GEARHART M D, et al. Retinoic acid signaling is dispensable for somatic development and function in the mammalian ovary[J]. Dev Biol, 2017, 424(2): 208–220. |
| [23] |
李君君, 廖佩, 文锋, 等. 携带TFPI-2基因的真核表达载体对SHI-1细胞生长的抑制作用[J]. 中国实验血液学杂志, 2019, 27(6): 1812–1819.
LI J J, LIAO P, WEN F, et al. Inhibitory effect of eukaryotic expression vector bearing TFPI-2 gene on SHI-1 Cell growth[J]. Journal of Experimental Hematology, 2019, 27(6): 1812–1819. (in Chinese) |
| [24] | IMAEDA A, TOMOIKE F, HAYAKAWA M, et al. N6-methyl adenosine in siRNA evades immune response without reducing RNAi activity[J]. Nucleosid, Nucleot Nucleic Acids, 2019, 38(12): 972–979. |
| [25] |
苑洪霞, 骆金红, 冯文武, 等. 猪LYRM1基因对脂肪沉积的影响研究[J]. 畜牧兽医学报, 2019, 50(4): 677–687.
YUAN H X, LUO J H, FENG W W, et al. Study on the effect of LYRM1 gene on the fat deposition of pig[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(4): 677–687. (in Chinese) |
| [26] |
刘同君, 赵盼, 赵敏孟, 等. 内质网应激标记基因Grp78参与鹅肥肝免疫/炎症状态的调控[J]. 畜牧兽医学报, 2019, 50(4): 727–737.
LIU T J, ZHAO P, ZHAO M M, et al. Endoplasmic reticulum stress marker gene Grp78 is involved in regulation of immune/inflammatory state of goose fattyliver[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(4): 727–737. (in Chinese) |
| [27] |
王圆圆, 许厚强, 陈伟, 等. 从江香猪PHKG2基因超表达载体和RNA干扰载体的构建及其表达[J]. 畜牧兽医学报, 2018, 49(9): 1818–1829.
WANG Y Y, XU H Q, CHEN W, et al. Construction and expression of PHKG2 gene overexpression vector and RNA interference vector in Congjiang Pig[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(9): 1818–1829. (in Chinese) |
| [28] |
龚云, 乔树叶, 林浪, 等. 水牛YY1基因克隆及其shRNA片段的筛选[J]. 畜牧兽医学报, 2014, 45(1): 62–68.
GONG Y, QIAO S Y, LIN L, et al. Cloning of buffalo YY1 gene and screening its shRNA fragments[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(1): 62–68. (in Chinese) |
| [29] | ROSENZWEIG B L, IMAMURA T, OKADOME T, et al. Cloning and characterization of a human type II Receptor for bone morphogenetic proteins[J]. Proc Natl Acad Sci U S A, 1995, 92(17): 7632–7636. |
| [30] | DRUMMOND A E. TGFβ signalling in the development of ovarian function[J]. Cell Tissue Res, 2005, 322(1): 107–115. |
| [31] | KUMAR S, RAJPUT P K, BAHIRE S V, et al. Differential expression of BMP/SMAD signaling and ovarian-associated genes in the granulosa cells of FecB introgressed GMM sheep[J]. Syst Biol Reprod Med, 2020, 18: 1–17. DOI: 10.1080/19396368.2019.1695977 |
| [32] | QI M Y, XU L Q, ZHANG J N, et al. Effect of the Booroola fecundity (FecB) gene on the reproductive performance of ewes under assisted reproduction[J]. Theriogenology, 2020, 142: 246–250. |
| [33] |
刘亚成.西藏绒山羊多胎性状候选基因BMP15、GDF9、BMPR1B多态性分析[D].雅安: 四川农业大学, 2017.
LIU Y C.Polymorphisms of Candidate Genes BMP15, GDF9, BMPR1B and its association with fecundity in Tibetan cashmere goat[D].Ya'an: Sichuan Agricultural University, 2017.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10626-1018025467.htm |
| [34] | AHLAWAT S, SHARMA R, ROY M, et al. Genotyping of novel SNPs in BMPR1B, BMP15, and GDF9 genes for association with prolificacy in seven Indian goat breeds[J]. Anim Biotechnol, 2016, 27(3): 199–207. |
| [35] |
祝振硕.湖羊多胎性状候选基因BMPR-IB多态性研究及检测技术优化[D].杨凌: 西北农林科技大学, 2016.
ZHU Z S.Study of BMPR-IB gene as candidate gene for prolificacy in Hu sheep Andoptimization of mole-cular detection methods for it[D].Yangling: Northwest A & F University, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10712-1016157664.htm |
| [36] | LA Y F, TANG J S, HE X Y, et al. Identification and characterization of mRNAs and lncRNAs in the uterus of polytocous and monotocous Small Tail Han sheep (Ovis aries)[J]. PeerJ, 2019, 7: e6938. |
| [37] |
杜丽, 张利平, 张筱艳, 等. 三个绵羊品种BMPR-IB基因CDS区1113位点的多态性与产羔数的相关性分析[J]. 农业生物技术学报, 2017, 25(12): 1989–1997.
DU L, ZHANG L P, ZHANG X Y, et al. The correlation analysis between polymorphism and fecundity of 1113 locus in BMPR-IB gene CDS area of three sheep (Ovis aries) varieties[J]. Journal of Agricultural Biotechnology, 2017, 25(12): 1989–1997. (in Chinese) |
| [38] |
杨媛, 翁恺麒, 李拥军, 等. BMPR-IB基因多态性与湖羊产羔性能的关系[J]. 安徽农业科学, 2017, 45(26): 113–115.
YANG Y, WENG K Q, LI Y J, et al. Relationship between polymorphism of BMPR-IB gene and lambing performance of Hu Sheep[J]. Journal of Anhui Agricultural Sciences, 2017, 45(26): 113–115. (in Chinese) |
| [39] |
贾建磊, 张利平, 丁强, 等. 绵羊BMPR-IB基因第7外显子多态性与产羔性状的相关性研究[J]. 西北农林科技大学学报:自然科学版, 2016, 44(1): 7–13.
JIA J L, ZHANG L P, DING Q, et al. Study on the correlation between polymorphism of sheep BMPR-IB gene exon 7 and lamb traits[J]. Journal of Northwest A & F University:Natural Science Edition, 2016, 44(1): 7–13. (in Chinese) |
| [40] |
史洪才, 牛志刚, 白杰, 等. BMPR-IB基因突变对策勒黑羊产羔数的影响及其遗传规律的研究[J]. 中国畜牧杂志, 2012, 38(3): 14–17.
SHI H C, NIU Z G, BAI J, et al. Effect of BMPR-IB gene mutation on lamb size and genetic law of Celle black goat[J]. Chinese Journal of Animal Science, 2012, 38(3): 14–17. (in Chinese) |



