2. 江苏省动物重要疫病与人兽共患病防控协同创新中心, 扬州 225009
2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China
流行性乙型脑炎(Japanese encephalitis,JE)是由乙型脑炎病毒(Japanese encephalitis virus,JEV)引起的一种经蚊虫传播的人兽共患病[1]。JEV感染可引起妊娠母猪流产、死胎、木乃伊胎和公猪睾丸炎等临床症状[2],猪是JEV的重要储存和扩增宿主。人感染JEV后可引发严重的中枢神经系统疾病甚至是急性致死性脑炎,致死率达25%左右[3-4]。目前,仍无可治疗JE的有效药物,接种疫苗仍是控制JE的主要方式,而其流行区域的扩大及JEV优势基因型的改变为我国JE的防控带来了新的挑战[5]。
JEV现有5个基因型[6-8]。中国在1970年之前流行的JEV主要为基因Ⅲ型,1979年在云南发现了基因Ⅰ型JEV,而后基因Ⅰ型JEV逐渐替代基因Ⅲ型JEV成为中国流行优势基因型[9-10]。目前,我国使用的JEV弱毒疫苗及灭活疫苗均属于基因Ⅲ型JEV[5]。不同基因型毒株之间的抗原差异可能影响了现有基因Ⅲ型商品化JEV疫苗对部分基因Ⅰ型和基因Ⅴ型JEV流行毒株攻毒保护的免疫效果[11-13]。鉴于我国流行性乙型脑炎防控形势的紧迫性,针对基因Ⅰ型JEV研制安全高效、成本低廉的猪用JEV疫苗是切断JEV传播的有效策略。
病毒样颗粒(virus-like particles, VLPs)与天然病毒粒子结构相同或相似,不含病毒核酸,不能进行自主复制,没有毒力返强的可能,因其作为疫苗具有免疫效果好、生产周期短、稳定性好、不具有感染性和不易失活等优点,使其成为研发新型亚单位疫苗的热点[14]。本研究以编码基因Ⅰ型JEV VLPs组成蛋白的prME基因表达盒为靶标,利用杆状病毒昆虫细胞表达系统制备基因Ⅰ型JEV VLPs,通过免疫小鼠初步评价其免疫原性,以期为研制安全高效的猪用新型JEV疫苗奠定基础。
1 材料与方法 1.1 材料杆状病毒表达载体pFastBacTM、基因Ⅰ型JEV GS株和基因Ⅲ型乙脑减毒活疫苗株SA14-14-2、大肠杆菌DH10BacTM菌株、Sf9昆虫细胞均保存于中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室;CellfectinR Ⅱ Reagent、PureLinkTM HiPure Plasmid Midiprep Kit试剂盒、SuperSignalTM West Pico PLUS Chemiluminescent Substrate购自赛默飞世尔科技(中国)有限公司;乙型脑炎病毒prM蛋白和E蛋白兔源特异性多克隆抗体购自北京欣生科科技有限公司。Grace’s Insect Medium (1×)培养基、Sf-900TMⅡSFM(1×)培养基均购自Gibco公司;Alexa Fluor 488标记的山羊抗兔IgG购自Abcam公司。
1.2 PCR引物设计参照GenBank中JEV DH10M978参考序列,利用PremierPrimer 5.0生物学软件设计用于扩增prME基因表达盒的引物:JEV-VLPF:5′-GCGGAATTCATGAGAGGAGGGAATGAGAGCTC-GA-3′ (EcoRⅠ)和JEV-VLPR:5′-GCGTCTAG-ATTAGTCGGCATGCBACATTAGTCGCTAA-3′ (XbaⅠ)。
1.3 Bac-prME重组杆状病毒的制备在T25细胞培养瓶中培养BHK-21细胞,待细胞长至铺满单层,接种1 MOI基因Ⅰ型JEV GS株,24 h后收集细胞,TRIzol法提取RNA,用PrimScriptTM RT- PCR Kit反转录为一链cDNA,以其为模板PCR扩增prME基因。经EcoRⅠ和XbaⅠ酶切位点插入到pFastBacTM载体,得到pFastBac-prME重组质粒,测序验证后,将阳性重组质粒转化感受态细胞DH10BacTM,通过蓝白斑筛选获得重组杆状病毒穿梭质粒Bacmid-prME,进一步PCR鉴定(引物M13F:5′-TGTAAAACGACGGCCAGT-3′和EⅢR:5′-AGCTTTGTGCCAGTGA-3′)。将重组杆粒DNA提纯后转染生长状态最佳的Sf9细胞后,经传代培养病毒扩增后,获得病毒滴度较高的Bac-prME重组杆状病毒。
1.4 鉴定prME蛋白的表达情况1.4.1 间接免疫荧光 于6孔细胞培养板内传代培养Sf9细胞,27 ℃细胞恒温培养箱中培养,至细胞生长对数期时达到(1.5~2.5)×106·mL-1的细胞密度。用重组杆状病毒Bac-prME感染Sf9细胞,同时设空白Sf9细胞作为对照组,48 h后,用JEV E蛋白兔源多克隆抗体(1:200)作为一抗37 ℃孵育1 h,二抗采用Alexa Flour 488标记的羊抗兔IgG(1:1 000)进行37 ℃孵育1 h,倒置荧光显微镜下观察特异性绿色荧光的产生情况。
1.4.2 Western blot鉴定 用Bac-prME感染Sf9细胞,同时设Sf9细胞为空白对照组。72 h后,Western blot分析细胞沉淀中prM蛋白和E蛋白的表达情况。1:1 000稀释的兔抗prM蛋白和E蛋白多克隆抗体作为一抗37 ℃孵育1 h,1:5 000稀释HRP标记的山羊抗兔IgG作为二抗37 ℃孵育1 h,加入化学发光试剂,避光显色3~10 min,拍照,保存图片。
1.5 JEV-VLPs的电镜观察将5 MOI的Bac-prME感染Sf9细胞72 h后,大量收集去除细胞碎片的澄清细胞培养上清,经PEG8 000沉淀和100 ku超滤管浓缩之后,10%~50%蔗糖密度梯度离心纯化JEV VLPs,取纯化后的JEV VLPs适当稀释后吸附在铜网上约2 min,经磷钨酸染色后电镜观察VLPs的形态[15-16]。
1.6 动物免疫试验将24只4~6周龄的BALB/c小鼠随机分成3组,每组8只,设置杆状病毒免疫的小鼠为对照组。用PBS重悬收集的Bac-prME感染的Sf9细胞沉淀,细胞密度为5×107·mL-1,超声破碎后,4 ℃,9 000 g·min-1离心30 min,取上清。分别以含有病毒样颗粒2和3 μg的200和300 μL细胞裂解上清(VLP200和VLP300)免疫剂量进行后腿肌肉或皮下注射免疫,分别在第0、14和28天各免疫1次,共3次。分别在第0、14、28、42和63天通过尾尖采血制备血清,-80 ℃保存备用。免疫后第42天,各免疫组随机选取5只小鼠收集的血清用于基因Ⅰ型JEV和基因Ⅲ型JEV中和抗体滴度测定。
1.6.1 特异性抗体动态水平检测 将本实验室表达的基因Ⅰ型JEV的EⅢ蛋白[17]进行组氨酸镍柱亲和层析纯化,获得JEV EⅢ重组蛋白,以0.5 μg·孔-1重组JEV EⅢ蛋白的抗原包被量建立的间接ELISA方法检测免疫小鼠诱导产生的JEV特异性抗体效价,每孔加入免疫小鼠分离制备的血清作为一抗,按照1:100起始浓度进行2倍倍比梯度稀释的方法处理一抗,1:2 500稀释的HRP标记的山羊抗小鼠IgG作为二抗进行特异性抗体水平监测,酶标仪测定OD450 nm值,以P/N>2.1的最大稀释倍数判定为该血清的JEV特异性抗体效价。
1.6.2 JEV中和抗体效价的滴定 分离制备第42天采集的免疫小鼠血清,采用噬斑减少中和试验方法(plaque reduction neutralization test, FRNT)测定JEV中和抗体效价。用MEM将灭活的免疫小鼠分离制备的血清从1:10开始2倍倍比连续梯度稀释,稀释的血清与含有100 PFU JEV的病毒液等体积混合,以能减少杆状病毒免疫小鼠血清处理病毒对照组50%空斑数的最高血清稀释倍数为该血清的JEV中和抗体效价(FRNT50)[18]。
1.7 数据分析使用GraphPad Prism (Version 5)软件进行统计学分析。利用单因素方差分析或 t检验分析组间差异。不同免疫组间P<0.05被认为在统计学意义上差异显著,P<0.01,差异极显著。
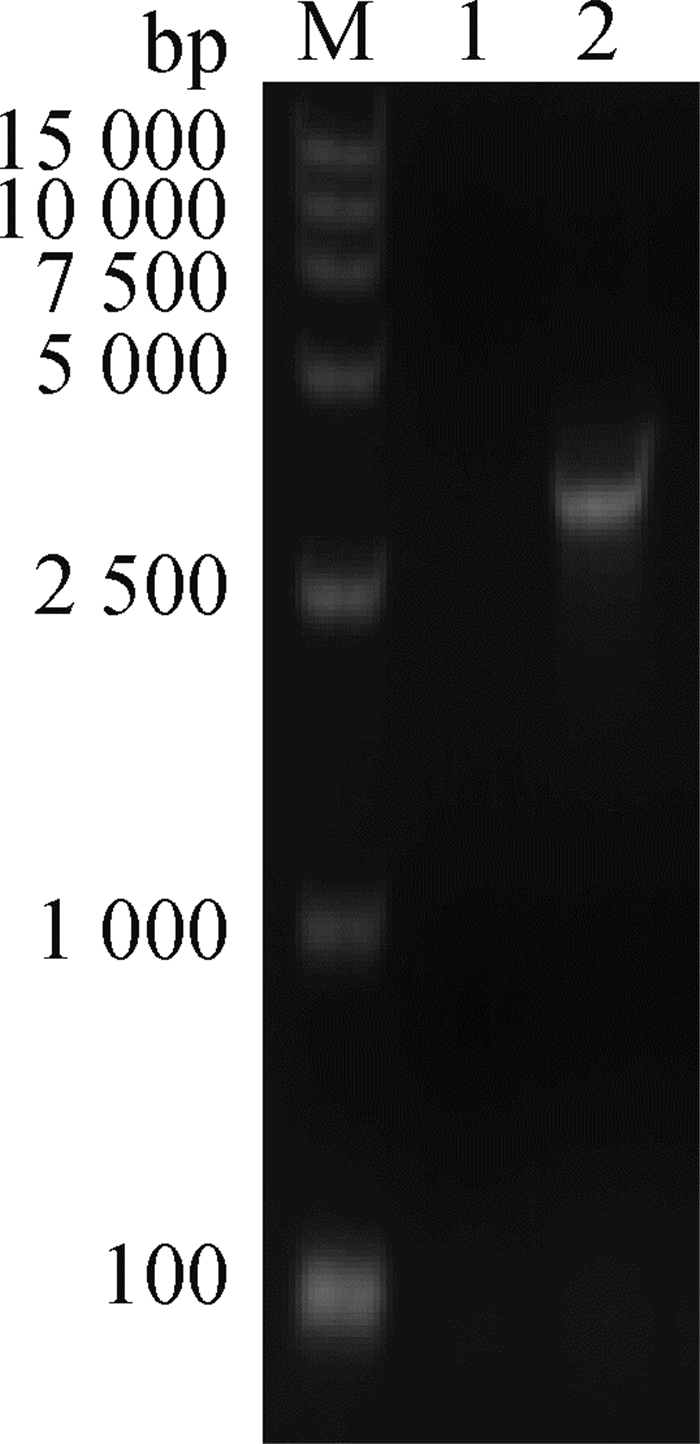
2 结果 2.1 重组杆状病毒Bac-prME的制备对重组Bacmid利用M13F和JEV特异EⅢR引物进行PCR鉴定,可扩增得到4 420 bp (2 560 bp +1 860 bp)的目的条带(图 1),与预期片段长度一致,说明重组Bacmid构建成功。将重组Bacmid转染Sf9细胞后,获得重组杆状病毒Bac-prME,收集的上清感染Sf9细胞48 h后出现典型的细胞病变(图 2)。
|
M. DNA相对分子质量标准;1.空白对照;2.杆粒DNA M. DL2000 DNA marker; 1. Blank control; 2. Recombinant Bac-prME bacmid DNA 图 1 PCR鉴定Bacmid-prME重组杆状病毒穿梭质粒 Fig. 1 PCR identification of Bacmid-prME DNA |

|
A.正常Sf9细胞;B. Sf9细胞被Bac-prME感染后的病变 A. Sf9 cells; B. The cytopathic effect of Sf9 cells infected by Bac-prME 图 2 典型的细胞病变 Fig. 2 The cytopathic effect of Sf9 cells infected by Bac-prME |
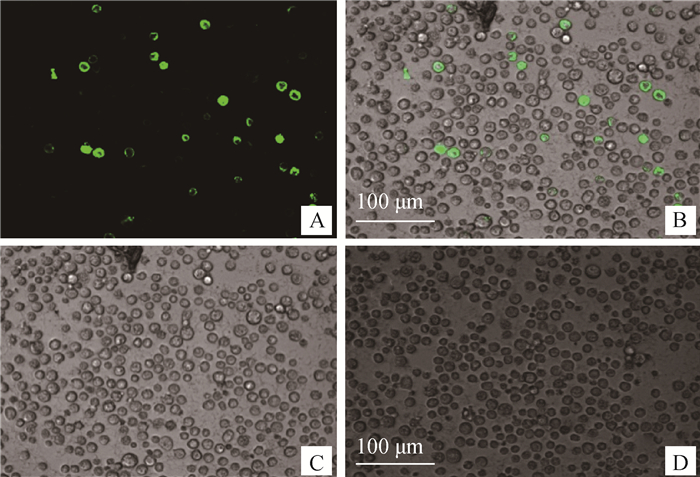
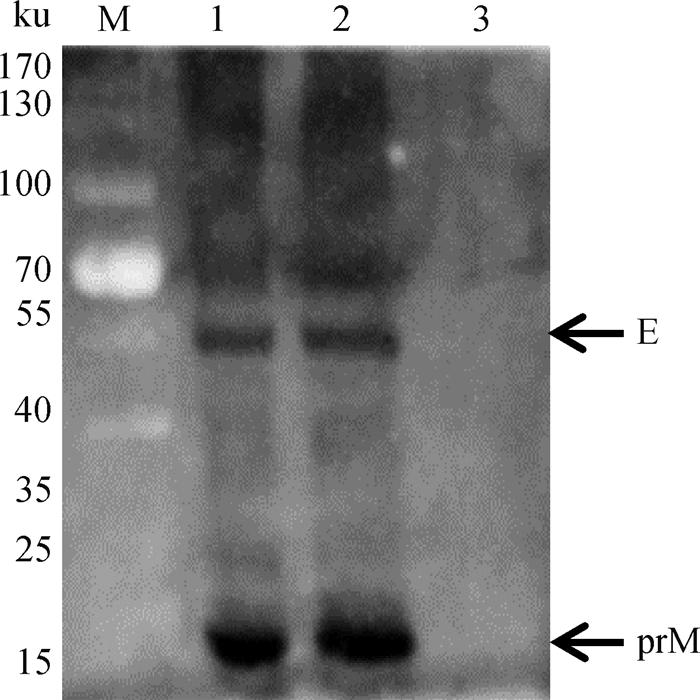
重组杆状病毒Bac-prME感染Sf9细胞后,在倒置荧光显微镜下有特异性的绿色荧光出现,而空白细胞对照组无荧光(图 3)。免疫印迹结果显示,重组杆状病毒Bac-prME感染的Sf9细胞裂解上清作为抗原与兔抗prM和E蛋白多克隆抗体反应后,出现了蛋白相对分子质量约为19和53 ku的特异性条带,说明重组杆状病毒Bac-prME感染Sf9细胞能正确表达prM蛋白和E蛋白(图 4)。
|
A. Bac-prME感染的Sf9细胞的荧光图像; B.图A和图C的叠加图;C. Bac-prME感染的Sf9细胞;D.正常Sf9细胞 A. Fluorescence image of Sf9 cells infected by Bac-prME; B. The merged image of Fig.A and Fig.C; C.Sf9 cells infected by Bac-prME; D. Normal Sf9 cells 图 3 Bac-prME感染Sf9细胞的间接免疫荧光结果 Fig. 3 Indirect immunofluorescence analysis of Sf9 cells infected by Bac-prME |
|
M.预染蛋白质相对分子质量标准;1.第二代Bac-CprME感染Sf9细胞裂解上清;2.第三代Bac-prME感染的Sf9细胞裂解上清;3. Sf9细胞裂解上清 M. prestained protein marker; 1. The supernatant of Sf9 cells infected by P2 Bac-prME; 2. The supernatant of Sf9 cells infected by P3 Bac-prME; 3. The supernatant of normal Sf9 cells 图 4 prME蛋白表达的免疫印迹分析 Fig. 4 Western blot analysis of supernatant of Sf9 cells infected by recombinant baculovirus Bac-prME |
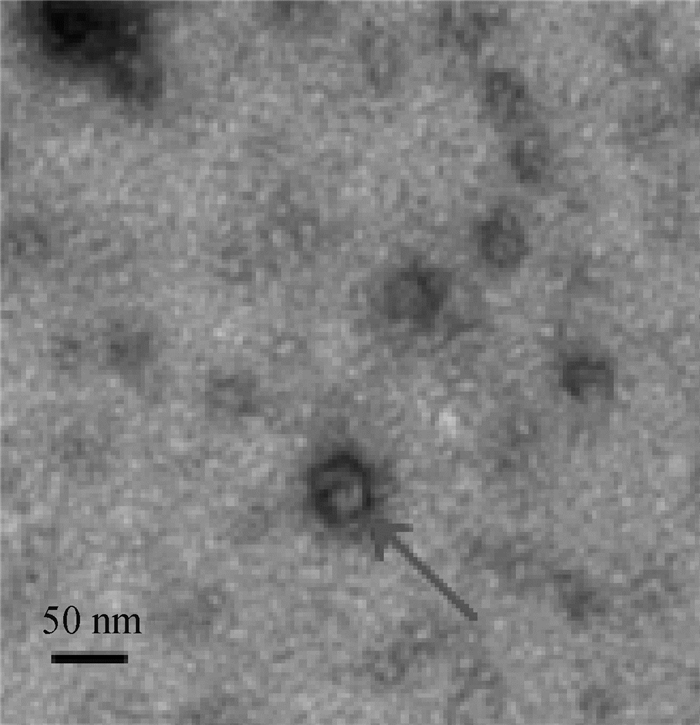
收集Bac-prME重组杆状病毒感染Sf9细胞72 h后的培养上清,经浓缩纯化获得JEV VLPs,经磷钨酸负染后,电镜下可见直径30~50 nm形态均一的球形颗粒(图 5)。
|
图 5 JEV VLPs的电镜图像 Fig. 5 The TEM image of JEV VLPs |
2.4.1 特异性抗体水平动态监测 间接ELISA测定免疫小鼠第0、14、28、42和63天血清的JEV特异性抗体效价的结果显示(图 6),与对照组相比,JEV VLPs免疫小鼠诱导产生了JEV特异性抗体,免疫小鼠后VLP300和VLP200免疫组间第28 (P=0.013 2)、42 (P=0.003 1)和63 (P=0.003 1)天诱导产生的抗体水平差异显著,且第42天VLP300免疫组的平均抗体效价是VLP200免疫组的8倍。

|
*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01) * indicate significant difference (P < 0.05), ** indicate extremely significant difference (P < 0.01) 图 6 JEV VLPs诱导的抗体水平动态曲线 Fig. 6 The dynamic curve of antibody induced by JEV VLPs |
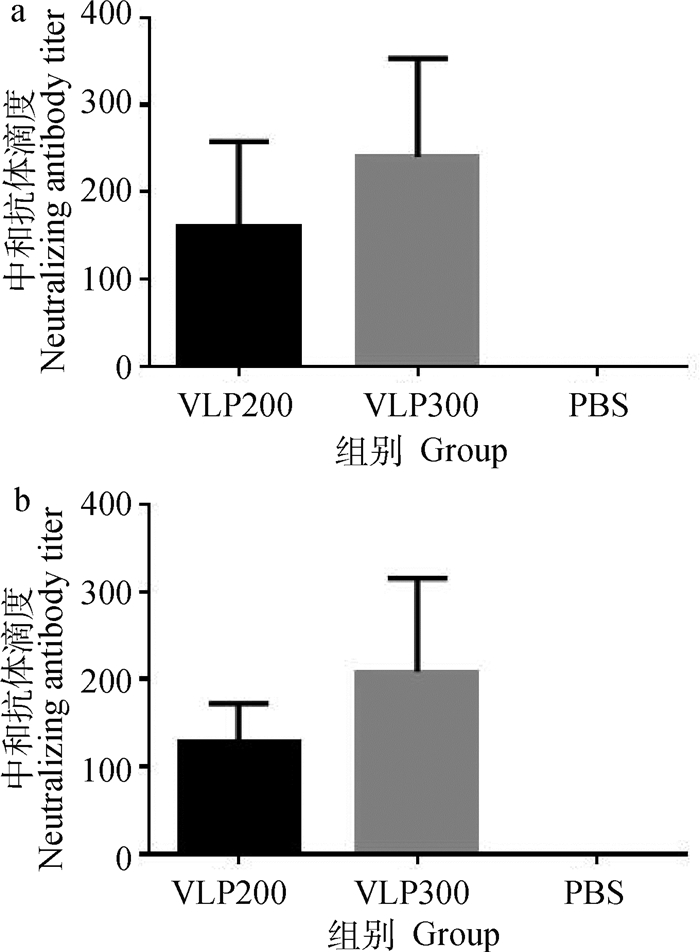
2.4.2 中和抗体滴度测定 噬斑减少中和试验(FRNT)测定免疫后第42天分离制备的各免疫组小鼠血清的JEV中和抗体效价,结果显示,本研究制备的JEV VLPs在不加免疫佐剂的情况下免疫小鼠能够诱导产生针对基因Ⅰ型JEV高滴度的中和抗体(图 7a),VLP200免疫组的平均中和抗体效价为1:160,而VLP300免疫组为1:240。此外,针对基因Ⅲ型JEV疫苗毒株的中和抗体效价分别为1:128和1:208 (图 7b)。
|
a.基因Ⅰ型JEV;b.基因Ⅲ型JEV a. Genotype Ⅰ JEV (GI JEV); b. Genotype Ⅲ JEV (GⅢ JEV) 图 7 JEV VLPs诱导产生的JEV中和抗体滴度 Fig. 7 Neutralizing antibody titers induced by JEV VLPs |
疫苗接种是预防人和猪流行性乙型脑炎的最有效方法,减毒JEV疫苗对于怀孕母猪的安全性存在争议[19],福尔马林灭活改变了E蛋白的抗原结构,影响了灭活JEV疫苗的免疫效力[20-21]。尽管现有疫苗存在一定问题,但目前仍是预防JEV感染的首选[22]。因此,研制安全、高效和成本低廉的JEV新型疫苗势在必行。JEV VLPs与以E蛋白或表位为基础的疫苗相比,其空间结构更接近于成熟的病毒粒子,在诱发构象型表位中和抗体方面更具优势[23]。本研究通过杆状病毒昆虫细胞表达系统成功获得了基因Ⅰ型JEV VLPs,Western blot和间接免疫荧光试验鉴定结果表明,Bac-prME重组杆状病毒在Sf9细胞中prME蛋白能够正确表达,电镜观察结果显示,表达的蛋白能够包装形成30~50 nm的病毒样颗粒,将制备的基因Ⅰ型JEV VLPs免疫小鼠可诱导产生高滴度的JEV特异性中和抗体,该研究可为JEV亚单位疫苗和诊断试剂的研发提供优质抗原。
以往的JEV VLPs研究结果表明:哺乳动物细胞真核表达系统中表达的JEV VLPs可大量分泌到细胞培养上清中,但存在分泌的VLPs对哺乳动物细胞二次感染,引起表达细胞的病变性融合,细胞活力下降,严重影响了JEV VLPs的产量[24-26];尽管采用基因突变的方式降低JEV VLPs对哺乳动物细胞的二次感染和活力影响,提高哺乳动物细胞系中VLPs的产量,但同时产生不成熟病毒样颗粒比例大幅增加的弊端,这严重影响了JEV VLPs的免疫保护效果[27-29]。采用杆状病毒昆虫细胞表达系统制备JEV VLPs,分泌到昆虫细胞培养上清中的VLPs极少,对表达细胞的活力影响不大,有研究资料表明:基因Ⅲ型JEV VLPs在杆状病毒昆虫细胞表达系统中的表达水平高于在CHO-K1细胞中的表达水平[27]。因此,本研究尝试采用杆状病毒昆虫细胞表达系统制备基因Ⅰ型JEV VLPs。本研究结果表明:基因Ⅰ型JEV VLPs可在杆状病毒表达系统获得高效表达。JEV VLPs组成蛋白主要在细胞内表达,而分泌到细胞培养上清中的极少。病毒中和试验结果进一步表明,本研究中的基因Ⅰ型JEV VLPs免疫小鼠可产生针对基因Ⅲ型JEV疫苗毒株的高效价中和抗体,该疫苗的交叉免疫保护的广谱性更有利于我国猪场流行性JE的防控。
在猪体上使用JEV疫苗的主要目的是预防怀孕母猪流产和死产,降低猪和人的JE发病率[22, 30]。通过JEV VLPs疫苗的接种,可降低JEV从猪传播到其他宿主或蚊子的概率。未来的研究还需要优化生产工艺以及开展对其他基因型JEV的免疫保护效果评价,尽可能获得具有广谱交叉保护特征且能够满足规模化生产需求的JEV VLPs疫苗,降低疫苗的生产成本,扩大免疫猪场范围,降低猪场的流产率,阻断JEV的流行。
4 结论通过杆状病毒昆虫细胞表达系统, 本研究获得了基因Ⅰ型JEV VLPs,可诱导免疫小鼠产生有效的抗JEV中和抗体,为我国研制具有广谱交叉保护特征的猪用JEV新型疫苗奠定了基础。
| [1] | CAMPBELL G L, HILLS S L, FISCHER M, et al. Estimated global incidence of Japanese encephalitis:a systematic review[J]. Bull World Health Organ, 2015, 89(10): 766–774E. |
| [2] | VAN DEN HURK A F, RITCHIE S A, JOHANSEN C A, et al. Domestic pigs and Japanese encephalitis virus infection, Australia[J]. Emerg Infect Dis, 2014, 14(11): 1736–1738. |
| [3] | MIN J G, XUE M. Progress in studies on the overwintering of the mosquito Culex tritaeniorhynchus[J]. Southeast Asian J Trop Med Public Health, 1996, 27(4): 810–817. |
| [4] | SOLOMON T, VAUGHN D W. Pathogenesis and clinical features of Japanese encephalitis and West Nile virus infections[J]. Curr Top Microbiol Immunol, 2002, 267: 171–194. |
| [5] | HEGDE N R, GORE M M. Japanese encephalitis vaccines: Immunogenicity, protective efficacy, effectiveness, and impact on the burden of disease[J]. Hum Vaccin Immunother, 2017, 13(6): 1320–1337. DOI: 10.1080/21645515.2017.1285472 |
| [6] |
成依依, 周红宁. 我国流行性乙型脑炎病毒基因型研究进展[J]. 中国病原生物学杂志, 2018, 13(12): 1413–1419.
CHENG Y Y, ZHOU H N. Advances in the study of Japanese encephalitis virus genotyping in China[J]. Journal of Pathogen Biology, 2018, 13(12): 1413–1419. (in Chinese) |
| [7] | PARANJPE S, BANERJEE K. Phylogenetic analysis of the envelope gene of Japanese encephalitis virus[J]. Virus Res, 1996, 42(1-2): 107–117. DOI: 10.1016/0168-1702(96)01306-8 |
| [8] | GAO X Y, LIU H, LI M H, et al. Insights into the evolutionary history of Japanese encephalitis virus (JEV) based on whole-genome sequences comprising the five genotypes[J]. Virol J, 2015, 12: 43. DOI: 10.1186/s12985-015-0270-z |
| [9] | GAO X Y, LIU H, WANG H Y, et al. Southernmost Asia is the source of Japanese encephalitis virus (genotype 1) diversity from which the viruses disperse and evolve throughout Asia[J]. PLoS Negl Trop Dis, 2013, 7(9): e2459. DOI: 10.1371/journal.pntd.0002459 |
| [10] | PAN X L, LIU H, WANG H Y, et al. Emergence of genotype I of Japanese encephalitis virus as the dominant genotype in Asia[J]. J Virol, 2011, 85(19): 9847–9853. DOI: 10.1128/JVI.00825-11 |
| [11] | LIU X Y, YU Y X, LI M G, et al. Study on the protective efficacy of SA14-14-2 attenuated Japanese encephalitis against different JE virus isolates circulating in China[J]. Vaccine, 2011, 29(11): 2127–2130. DOI: 10.1016/j.vaccine.2010.12.108 |
| [12] | WEI J C, WANG X, ZHANG J J, et al. Partial cross-protection between Japanese encephalitis virus genotype Ⅰ and Ⅲ in mice[J]. PLoS Negl Trop Dis, 2019, 13(8): e0007601. DOI: 10.1371/journal.pntd.0007601 |
| [13] | CAO L, FU S H, GAO X Y, et al. Low protective efficacy of the current Japanese encephalitis vaccine against the emerging genotype 5 Japanese Encephalitis virus[J]. PLoS Negl Trop Dis, 2016, 10(5): e0004686. DOI: 10.1371/journal.pntd.0004686 |
| [14] | DONALDSON B, LATEEF Z, WALKER G F, et al. Virus-like particle vaccines:immunology and formulation for clinical translation[J]. Expert Rev Vaccines, 2018, 17(9): 833–849. DOI: 10.1080/14760584.2018.1516552 |
| [15] |
张艳芳, 杜瑞坤, 黄少梅, 等. 乙型脑炎病毒样颗粒疫苗的制备及其免疫保护效率的初步评价[J]. 病毒学报, 2016, 32(2): 150–155.
ZHANG Y F, DU R K, HUANG S M, et al. Generation of Japanese encephalitis virus-like particle vaccine and preliminary evaluation of its protective efficiency[J]. Chinese Journal of Virology, 2016, 32(2): 150–155. (in Chinese) |
| [16] | HUA R H, LI Y N, CHEN Z S, et al. Generation and characterization of a new mammalian cell line continuously expressing virus-like particles of Japanese encephalitis virus for a subunit vaccine candidate[J]. BMC Biotechnol, 2014, 14: 62. DOI: 10.1186/1472-6750-14-62 |
| [17] |
于瑞明, 田占成, 独军政, 等. 基因Ⅰ型乙脑病毒EDⅢ结构域蛋白的原核表达及其抗体制备与鉴定[J]. 中国兽医科学, 2017, 47(12): 1475–1480.
YU R M, TIAN Z C, DU J Z, et al. Identification of EDⅢ protein from the genotype Ⅰ Japanese encephalitis virus[J]. Veterinary Science in China, 2017, 47(12): 1475–1480. (in Chinese) |
| [18] |
周亚红, 田占成, 于瑞明, 等. IFN-λ1作为乙型脑炎病毒DNA疫苗佐剂的免疫效应研究[J]. 中国兽医科学, 2019, 49(7): 841–846.
ZHOU Y H, TIAN Z C, YU R M, et al. Immune effect of IFN-λ1 as adjuvant for Japanese encephalitis virus DNA vaccine[J]. Chinese Veterinary Science, 2019, 49(7): 841–846. (in Chinese) |
| [19] | HSU S T, CHANG L C, LIN S Y, et al. The effect of vaccination with a live attenuated strain of Japanese encephalitis virus on stillbirths in swine in Taiwan[J]. Bull World Health Organ, 1972, 46(4): 465–471. |
| [20] | FAN Y C, CHIU H C, CHEN L K, et al. Formalin inactivation of Japanese encephalitis virus vaccine alters the antigenicity and immunogenicity of a neutralization epitope in envelope protein domain Ⅲ[J]. PLoS Neg Trop Dis, 2015, 9(10): e0004167. DOI: 10.1371/journal.pntd.0004167 |
| [21] |
冯瑶, 岳辉喜, 刘洪明, 等. 基因Ⅰ型猪乙型脑炎灭活疫苗免疫原性评价[J]. 畜牧兽医学报, 2017, 48(5): 889–895.
FENG Y, YUE H X, LIU H M, et al. The immunogenicity evaluation of inactivated vaccines of swine Japanese encephalitis virus genetype I[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(5): 889–895. (in Chinese) |
| [22] | MANSFIELD K L, HERNÁNDEZ-TRIANA L M, BANYARD A C, et al. Japanese encephalitis virus infection, diagnosis and control in domestic animals[J]. Vet Microbiol, 2017, 201: 85–92. DOI: 10.1016/j.vetmic.2017.01.014 |
| [23] | ZLATKOVIC J, STIASNY K, HEINZ F X. Immunodominance and functional activities of antibody responses to inactivated West Nile virus and recombinant subunit vaccines in mice[J]. J Virol, 2011, 85(5): 1994–2003. DOI: 10.1128/JVI.01886-10 |
| [24] | KOJIMA A, YASUDA A, ASANUMA H, et al. Stable high-producer cell clone expressing virus-like particles of the Japanese encephalitis virus e protein for a second-generation subunit vaccine[J]. J Virol, 2003, 77(16): 8745–8755. DOI: 10.1128/JVI.77.16.8745-8755.2003 |
| [25] | HEINZ F X, ALLISON S L. Structures and mechanisms in flavivirus fusion[J]. Adv Virus Res, 2000, 55: 231–269. DOI: 10.1016/S0065-3527(00)55005-2 |
| [26] | KONISHI E, FUJII A, MASON P W. Generation and characterization of a mammalian cell line continuously expressing Japanese encephalitis virus subviral particles[J]. J Virol, 2001, 75(5): 2204–2212. DOI: 10.1128/JVI.75.5.2204-2212.2001 |
| [27] | YAMAJI H, SEGAWA M, NAKAMURA M, et al. Production of Japanese encephalitis virus-like particles using the baculovirus-insect cell system[J]. J Biosci Bioeng, 2012, 114(6): 657–662. DOI: 10.1016/j.jbiosc.2012.06.012 |
| [28] | GASTAMINZA P, DRYDEN K A, BOYD B, et al. Ultrastructural and biophysical characterization of hepatitis C virus particles produced in cell culture[J]. J Virol, 2010, 84(21): 10999–11009. DOI: 10.1128/JVI.00526-10 |
| [29] | KUHN R J, ZHANG W, ROSSMANN M G, et al. Structure of dengue virus: implications for flavivirus organization, maturation, and fusion[J]. Cell, 2002, 108(5): 717–725. DOI: 10.1016/S0092-8674(02)00660-8 |
| [30] | REN X J, FU S H, DAI P F, et al. Pigsties near dwellings as a potential risk factor for the prevalence of Japanese encephalitis virus in adult in Shanxi, China[J]. Infect Dis Poverty, 2017, 6(1): 100. DOI: 10.1186/s40249-017-0312-4 |



