2. 中国农业科学院北京畜牧兽医研究所, 动物营养学国家重点实验室, 北京 100193;
3. 经济作物遗传改良与综合利用湖南省重点实验室, 湘潭 411201
2. State Key Laboratory of Animal Nutrition, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3. Hunan Key Laboratory of Economic Crops Genetic Improvement and Integrated Utilization, Xiangtan 411201, China
生物胺是动物肠道中普遍存在的一类碱性含氮物质,在动物体内可参与体温和肠道pH调节、胃酸分泌及免疫应答等多个生理过程,对微生物与肠道的相互作用也具有重要的调节作用。过量的生物胺会导致动物的生理机能发生障碍,影响动物机体的健康,甚至会危及生命[1-3]。因此,采取适当的方法测定动物机体不同肠道段的生物胺,获得在不同生理条件下生物胺在肠道中的含量和种类变化,对进一步解释生物胺参与肠道功能调节、微生物与宿主之间的互作关系,以及肠道内氨基酸代谢规律和氨基酸平衡具有重要意义。
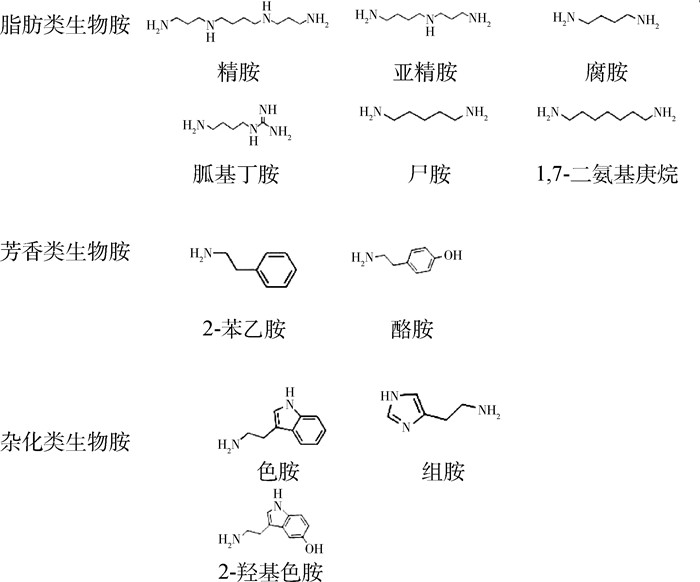
根据生物胺的结构组成可将其分为脂肪族、杂环族和芳香族三类[4],其化学结构如图 1所示。采用液相色谱法对样品中的生物胺进行分离时,由于脂肪族生物胺的极性很强,导致其在C18色谱柱上难以保留。尽管使用亲水色谱柱或氨基色谱柱可实现有效保留,但是经常会出现色谱峰形拖尾的现象,导致定量准确性和重现性不如C18色谱柱稳定[5]。其次,脂肪族生物胺在紫外区和可见光区没有光吸收,无法使用紫外检测器和荧光检测器进行检测[6]。质谱检测器是一类测定化合物质量的检测器,可有效测定无紫外和荧光吸收的化合物,并且灵敏度远高于紫外和荧光检测器。质谱检测器还可以和液相色谱联用,实现化合物的二维分离检测(保留时间和质荷比),可有效避免色谱共流出化合物的干扰[7-8]。为了提高猪肠道食糜样品中生物胺的检测通量和准确性,本研究通过优化食糜中生物胺的提取方法、DNS衍生条件和液质联用(liquid chromatography mass spectrometry,LC-MS)检测参数,实现对11种生物胺的同步检测,为深入研究生物胺参与体内调节机制,揭示不同肠道段生物胺代谢规律提供依据。
|
图 1 生物胺的化学结构 Fig. 1 The chemical structure of biogenic amines |
11种生物胺标准品、DNS购自Sigma公司;乙腈、丙酮购自Thermo Fisher公司;甲酸、浓氨水、碳酸氢钠、碳酸钠、乙酸乙酯、二氯甲烷、乙醚、盐酸购自Aladdin公司;三重四级杆液质联用仪(Xevo TQ,美国Waters公司);离心机(Centrifuge 5810R,德国Eppendorf公司);真空冻干机(LABCONCO);电子天平、pH计购自上海梅特勒托利多有限公司;0.22 μm水相针式滤膜购自上海安谱试验科技有限公司。
1.2 试验方法1.2.1 标准品储备液和衍生剂的配制 准确称取各生物胺标准品,用1 mL 0.1 mol·L-1的HCl配成浓度为1 mg·mL-1的标准储备液,各个标准储备液用0.1 mol·L-1的HCl稀释成1 μg·mL-1的工作液,4 ℃冰箱保存备用。准确称取DNS 10 mg,以丙酮为溶剂配制成10 mg·mL-1工作液。
1.2.2 生物胺与DNS衍生条件优化 分别取0.1 mL酪胺、精胺、组胺、尸胺、苯乙胺和胍基丁胺6种标准品工作液,加入0.4 mL的碳酸钠-碳酸氢钠缓冲液(0.5 mol·L-1 Na2CO3-NaHCO3,pH 9.4),按照0.2、1、2、4、8、16 mg·mL-1的比例加入DNS工作液,分别在40、60和80 ℃条件下进行衍生,衍生时间分别为30、60、90、120 min,衍生结束后加入200 μL的浓氨水,黑暗半小时以终止未反应的DNS。最后反应液使用真空旋干仪旋干,并用1 mL的乙腈重悬,过0.22 μm滤膜后进行LC-MS/MS检测。
1.2.3 LC-MS/MS检测条件和参数 将制备好的样品使用Waters xevo TQ三重四级杆液质联用仪进行检测。色谱柱型号为ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm,130 Ả);流速为0.3 mL·min-1;流动相A为0.1%的甲酸水,流动相B为0.1%的甲酸乙腈,柱温45 ℃;梯度洗脱程序见表 1。质谱离子源温度为500 ℃,脱溶剂气体流速为550 L·h-1,离子源电压为2.8 kV,不同生物胺衍生产物的锥孔电压和碰撞能量见表 2。
|
|
表 1 流动相洗脱梯度 Table 1 Mobile phase elution gradient |
|
|
表 2 生物胺DNS衍生物的质谱多反应监测(multiple reaction monitoring, MRM)参数 Table 2 MRM parameters for biogenic amine DNS derivatives |
1.2.4 食糜样品的来源 选取28日龄体重(7.25±0.21) kg的健康杜长大断奶仔猪6头,屠宰后立即结扎回肠、盲肠、结肠和直肠,并在各肠道中段采集食糜。将所得的食糜样品放入-80 ℃冰箱中保存待用。
1.2.5 食糜中生物胺的提取条件优化 称取冷冻干燥后的结肠食糜15 mg,加入1 mL 0.1 mol·L-1的HCl并充分涡旋混匀,再加入1 mL提取溶剂进行提取,收集水相;向水相中加入1 mL 0.5 mol·L-1 Na2CO3-NaHCO3,pH 9.4的缓冲液后,再加入300 μL 8 mg·mL-1的丹磺酰氯丙酮溶液,40 ℃避光反应90 min;加入200 μL浓氨水,黑暗半小时以终止反应,加入1 mL萃取溶剂进行萃取,并收集有机相,采用真空旋干仪旋干。旋干后的样品用1 mL乙腈充分溶解后,过0.22 μm滤膜后进行LC-MS/MS检测。各组提取溶剂和萃取溶剂组合见表 3。
|
|
表 3 各组提取溶剂和萃取溶剂组合 Table 3 Extraction solvent and extraction solvent combination of each group |
1.2.6 数据处理和统计分析 采集后的数据经过MassLynx 4.1软件处理获得生物胺的定量结果矩阵,采用Microsoft Excel 2013软件进行图形处理。采用SPSS 23.0软件对不同肠段食糜生物胺含量数据进行单因素方差分析,处理间均值的差异采用Duncan氏法进行多重比较,结果以“平均值±标准差”表示,以P<0.05作为差异显著性判断标准。
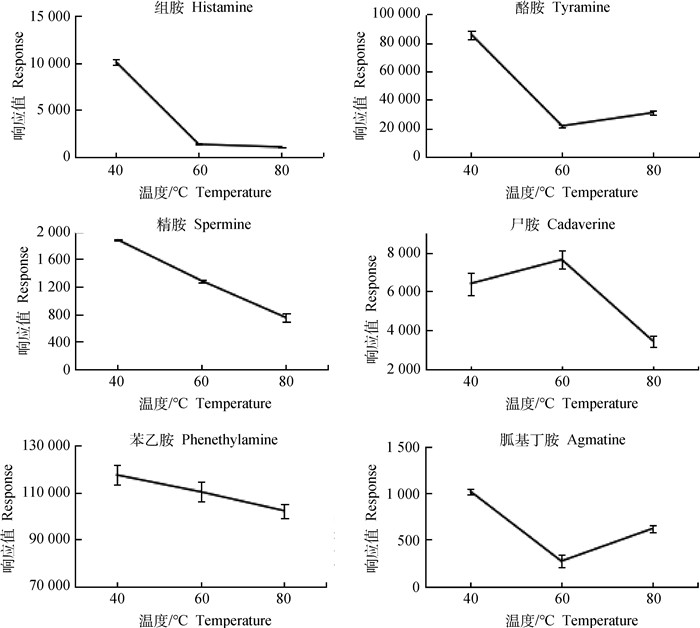
2 结果 2.1 衍生温度对衍生效果的影响试验采用DNS作为衍生剂对组胺、酪胺、苯乙胺、精胺、尸胺和胍基丁胺6种具有代表性的生物胺进行衍生条件的优化,通过比较生物胺衍生产物的峰面积的响应值确定最优的衍生参数。由图 2可知,除尸胺外,其他5种生物胺在40 ℃衍生时衍生效果最好,并且除酪胺和胍基丁胺外,衍生效果随温度增加而逐渐降低。
|
图 2 不同温度对6种生物胺衍生效果的影响 Fig. 2 Effects of different temperatures on the derivatization of 6 biogenic amines |
试验考察了20、40、60、90、150 min共5个衍生时间下的衍生效果。由图 3可知,6种生物胺衍生产物的含量随着衍生时间的延长而增加,在90 min时生物胺的衍生产物量逐渐达到平台期,除精胺和苯乙胺外,延长反应时间并不会明显增加其他4种生物胺衍生物的含量,且尸胺和组胺略呈下降的趋势。

|
图 3 不同衍生时间对6种生物胺衍生效果的影响 Fig. 3 Effect of different time on the derivatization of 6 biogenic amines |
为确定采用质谱检测器时的最优底物和衍生剂比例,在保持6种生物胺浓度一致的条件下,分别加入终浓度为0.2、1、2、4、8、16 mg·mL-1的DNS衍生剂300 μL,在40 ℃条件下反应90 min,比较各生物胺在不同衍生剂浓度条件下的峰面积响应值的大小(图 4)。结果显示,组胺、酪胺和苯乙胺在浓度为4 mg·mL-1时衍生产物含量最高,且浓度在8 mg·mL-1时相比4 mg·mL-1衍生产物含量有所下降,但是下降幅度不明显;而精胺和尸胺在衍生剂浓度8 mg·mL-1时衍生产物含量最高,衍生产物含量相比4 mg·mL-1时呈显著增加的趋势。

|
图 4 不同衍生剂浓度对6种生物胺衍生效果的影响 Fig. 4 Effect of different derivatizing agent concentrations on the derivatization of 6 biogenic amines |
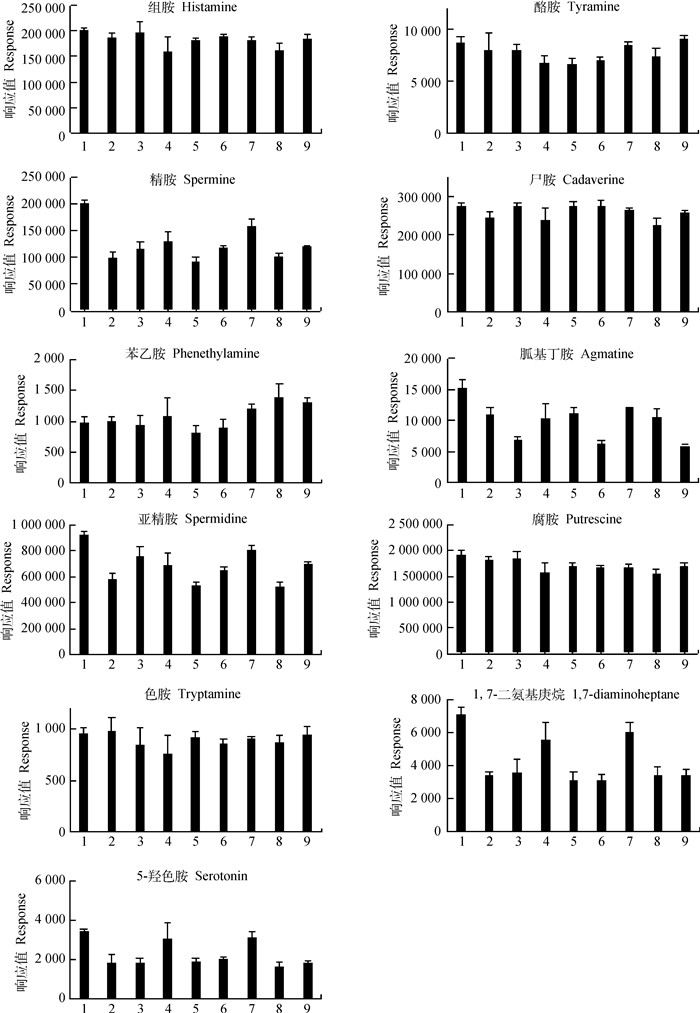
本试验先使用0.1 mol·L-1的盐酸处理结肠食糜样品,随后分别使用乙酸乙酯、二氯甲烷和乙醚对样品进行提取,衍生后再分别用3种试剂进行萃取。由图 5可知,选用乙酸乙酯先进行提取,再用乙酸乙酯进行萃取的组合方式提取生物胺的效果最好。
|
横坐标中,数字1~9为提取方法组合,详见表 3 In the abscissa, numbers 1-9 are the combination of extraction methods, see Table 3 for details 图 5 不同提取方法对11种生物胺衍生效果的影响 Fig. 5 Effects of different extraction methods on the derivatization of 11 biogenic amines |
综合比较分析衍生和提取生物胺的结果,本文最终确定衍生温度40 ℃,衍生时间90 min,衍生剂浓度为8 mg·mL-1时最优,萃取净化溶剂为乙酸乙酯+乙酸乙酯最优。在此条件下,我们对确定好的衍生条件和提取方法的稳定性、LC-MS/MS精密度和检测限进行整体评估。首先对5、10、20、25、50、100、200、500、1 000 μg·L-1生物胺混标工作液进行衍生和萃取,计算标准曲线的回归方程及相关系数(表 4),在5~1 000 μg·L-1浓度范围内11种生物胺线性关系良好,线性相关系数均大于0.99,符合本试验的检测要求。11种生物胺的检出限与定量限分别为0.01~0.23 μg·L-1和0.03~0.76 μg·L-1。日内相对标准偏差在0.73% ~ 7.92%,日间相对标准偏差在0.07% ~ 8.67%范围内。
|
|
表 4 本方法的回归方程、相关系数和标准偏差 Table 4 Regression equation, correlation coefficient and standard deviation of the method |
由表 5可知,在本试验条件下,除苯乙胺和色胺未检出外,其余生物胺在不同肠道食糜中的含量存在一定差异。回肠食糜中组胺和胍基丁胺的含量显著高于结肠、盲肠和直肠食糜中含量(P<0.05),但精胺、尸胺、亚精胺、腐胺和5-羟色胺的含量则显著低于其余3个肠段食糜中的含量(P<0.05);除苯乙胺、色胺和1,7-二氨基庚烷外,其余生物胺在回肠食糜和结肠食糜中的含量均存在显著差异(P<0.05)。在大肠部位,除未检出的苯乙胺和色胺外,结肠和盲肠食糜中的生物胺含量差异并不显著(P>0.05);结肠、盲肠和直肠食糜中的组胺、精胺、胍基丁胺、亚精胺、腐胺、5-羟色胺的含量也无显著差异(P>0.05)。此外,4个肠段食糜中生物胺含量最高的均为亚精胺。
|
|
表 5 不同肠道食糜中生物胺含量的差异(干物质基础) Table 5 Differences in biogenic amine content in different intestinal chyme (dry matter basis) |
目前研究建立的生物胺分离、检测的方法主要有高效液相色谱法[5]、超高液相色谱法、毛细管电泳法[7]、薄层色谱法[9]和气相色谱法[10],其中高效液相色谱结合质谱检测方法是生物胺的最主要也是最为合适的手段[7]。测定肠道内生物胺的主要难点在于脂肪族生物胺属于强极性化合物,反相分离条件下难以在C18色谱柱上保留[11];其次是不同生物胺在肠道含量的动态范围大,如腐胺和1, 7-二氨基庚烷在直肠中含量相差2 000多倍;三是肠道样品基质高度复杂,严重干扰生物胺的测定。现有测定生物胺使用最多的方法是参考DNS对氨基酸衍生的条件,采用DNS作为衍生剂,在生物胺连接上紫外吸收基团后,使用高压液相色谱检测生物胺-DNS衍生产物。由于生物胺属于多氨基化合物,如精胺和亚精胺除带有2个伯胺外还分别带有1个和2个仲胺,若反应条件不合适则会导致衍生不充分(只衍生一个胺基)或过度衍生(衍生在仲胺位)的现象,导致定量结果出现偏差[12-13]。因此,该方法不能完全适用于生物胺的衍生[14]。在此背景下,本试验分别对DNS衍生时间、衍生温度、DNS浓度、肠道中生物胺的提取方法进行系统性的研究,以提高生物胺检测的准确性、稳定性和检测通量,并用优化后的方法检测了仔猪不同肠段内各种生物胺的含量。
采用DNS对生物胺进行衍生时,衍生温度是影响衍生效果的重要因素,但很多学者所选取的反应温度也并不一致[15-16]。Dugo等[17]选取的反应温度为55 ℃,Hernández-Borges等[18]、Yečin和Üren[19]选取65 ℃作为反应温度。本试验采用DNS为衍生剂对组胺、酪胺、苯乙胺、精胺、尸胺和胍基丁胺6种具有代表性的生物胺进行衍生条件的优化,结果显示除尸胺外,在其他5种生物胺在40 ℃衍生时衍生效果最好,并且衍生效果随温度增加而逐渐降低。衍生剂DNS的浓度也会对衍生效果产生影响。杨贤庆等[20]采用液相色谱法结合荧光检测器研究生物胺的最适衍生条件,结果显示DNS浓度在10 mg·mL-1时衍生效果最好。本试验在液质联用分析环境下,保持6种生物胺浓度一致在40 ℃条件下反应90 min。结果显示,组胺、酪胺和苯乙胺在浓度为4 mg·mL-1时衍生产物含量最高,且浓度在8 mg·mL-1时相比4 mg·mL-1衍生产物含量有所下降,但是下降幅度不明显;而精胺和尸胺在衍生剂浓度8 mg·mL-1时衍生产物含量最高,衍生产物含量相比4 mg·mL-1时呈显著增加的趋势。分析环境,尤其是液相检测器的差异可能是导致本试验结果与上述报道存在差异的原因之一。由于不同检测器对生物胺检测的灵敏度不同,质谱检测器的灵敏度显著高于紫外检测器和荧光检测器[5, 10]。此外,样品中生物胺的浓度、组成以及衍生温度、时间和衍生剂浓度参数组合的不同也是结果存在差异的重要原因。一般而言,增加反应物浓度能增加单位体积内活化分子的数目,增加有效碰撞,从而影响最终的衍生效果。样品来源不同,其生物胺组成也不同,理化性质也存在一定差异。本试验结果显示,生物胺不同,衍生时所需的最适衍生剂浓度也不一致,导致本试验优化的衍生参数与以往报道存在差异。
由于DNS除了和生物胺发生反应外,还可与食糜中其他含有伯胺基团的化合物进行反应,在一定程度上影响生物胺的衍生[9];此外,基质内其他化合物也会干扰后续的LC-MS/MS测定[21]。因此,可以在衍生前和衍生后对样品进行纯化,以减少基质的干扰。由于肠道内容物中含有蛋白质和脂肪等成分,在生物胺衍生化过程中会形成竞争,影响测定结果,所以在检测样品时需进行纯化预处理,将这些杂质去除。常用的去除上述杂质的溶剂有盐酸、高氯酸、甲醇以及三氯乙酸等[22],本试验使用0.1 mol·L-1的盐酸处理结肠食糜样品后,分别使用乙酸乙酯、二氯甲烷和乙醚对样品进行提取,去除提取液内的蛋白和一些非极性化合物;衍生后分别用3种试剂进行萃取,进一步除去DNS不能衍生的极性化合物。由试验结果可知,选用乙酸乙酯先进行提取,再用乙酸乙酯进行萃取的组合方式提取生物胺的效果最好。
动物肠道内的生物胺主要由食糜中的氨基酸通过肠道微生物的脱羧作用转变而来[23]。动物机体内微量的生物胺可促进机体组织器官中DNA、RNA以及蛋白质的合成,促进动物机体的生长发育[24-26]。但当机体内生物胺含量过高时,亚精胺、精胺、尸胺和腐胺等生物胺通过肠道微生物的作用,与亚硝酸盐发生化学反应,生成具有破坏肠道形态结构与功能作用的挥发性亚硝胺,从而影响机体健康[27-30]。腐胺与尸胺是食糜中常见的生物胺,腐胺来自于精氨酸的脱羧和转氨基反应及鸟氨酸的脱羧反应,而尸胺主要由赖氨酸脱羧生成[31]。本试验中猪的日粮为玉米-豆粕型日粮,且对猪而言赖氨酸和精氨酸均是其限制性氨基酸,因而会在日粮中补充精氨酸和赖氨酸,故日粮中精氨酸和赖氨酸的含量比较高,可能为食糜中腐胺和尸胺的生成提供了丰富的底物。研究表明,猪盲肠、结肠内的主要优势菌群为厚壁菌门和拟杆菌门,在厚壁菌门中的主要菌群为梭菌,厚壁菌门喜好高脂日粮而拟杆菌门喜好高纤维日粮[32],故盲肠和结肠中的尸胺和腐胺的含量较回肠高,本试验也证实了这一结果。微生物进行的氨基酸代谢类型决定着生物胺的种类,食糜中的色胺和苯乙胺的含量未检出可能是由于微生物的种类和微生物进行氨基酸代谢的类型决定着生物胺的种类。而食糜中产生的色胺和苯乙胺的氨基酸含量较低。
4 结论本研究建立了一种使用三重四级杆分析仪实现对肠道食糜样品中11种生物胺进行分析的液相色谱-质谱联用新方法。经过衍生条件优化,确定衍生剂浓度为8 mg·mL-1,衍生温度为40 ℃的条件下衍生90 min为最佳。通过提取方法优化,确定使用乙酸乙酯先进行提取,衍生结束后再用乙酸乙酯进行萃取的组合方式提取生物胺的效果最好。利用确定好的衍生条件和提取方法进行了方法验证,结果表明,在5~1 000 μg·L-1浓度范围内11种生物胺测定结果线性关系良好,线性相关系数均大于0.99,检出限与定量限分别为0.01~0.23 μg·L-1和0.03~0.76 μg·L-1。日内相对标准偏差和日间相对标准偏差均在10%以下。通过对仔猪回肠、盲肠、结肠和直肠中的食糜样品进行检测发现,食糜中的生物胺主要为亚精胺、腐胺、尸胺、精胺和组胺,酪胺、1, 7-二氨基庚烷、5-羟色胺和胍基丁胺4种生物胺也被检测到有极少的含量,但没有检测到色胺和苯乙胺。
| [1] |
慕春龙.日粮蛋白质水平对大鼠和仔猪机体代谢和肠道微生物的影响[D].南京: 南京农业大学, 2016.
MU C L.Effects of dietary protein content on host metabolism and gut microbioto in rats and piglets[D]. Nanjing: Nanjing Agricultural University, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10307-1017259906.htm |
| [2] | BLACHIER F, DAVILA A M, BENAMOUZIG R, et al. Channelling of arginine in NO and polyamine pathways in colonocytes and consequences[J]. Front Biosci, 2011, 16: 1331–1343. |
| [3] | BODMER S, IMARK C, KNEUBÜHL M. Biogenic amines in foods:histamine and food processing[J]. Inflamm Res, 1999, 48(6): 296–300. |
| [4] | MOHAMMED G I, BASHAMMAKH A S, ALSIBAAI A A, et al. A critical overview on the chemistry, clean-up and recent advances in analysis of biogenic amines in foodstuffs[J]. Trac Trends Anal Chem, 2016, 78: 84–94. |
| [5] | KELLY M T, BLAISE A, LARROQUE M. Rapid automated high performance liquid chromatography method for simultaneous determination of amino acids and biogenic amines in wine, fruit and honey[J]. J Chromatogr A, 2010, 1217(47): 7385–7392. |
| [6] |
杨姗姗.食品中生物胺液相色谱检测方法的建立及应用[D].天津: 天津科技大学, 2016.
YANG S S.The development and application of high performance liquid chromatographic of biogenic amines in foods[D]. Tianjin: Tianjin University of Science & Technology, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10057-1017058211.htm |
| [7] | SWANN L M, FORBES S L, LEWIS S W. A capillary electrophoresis method for the determination of selected biogenic amines and amino acids in mammalian decomposition fluid[J]. Talanta, 2010, 81(4-5): 1697–1702. |
| [8] |
温永柱, 范文来, 徐岩. GC-MS法定性白酒中的多种生物胺[J]. 酿酒, 2013, 40(1): 38–41.
WEN Y Z, FAN W L, XU Y. Identification of a variety of biogenic amines by GC-MS method in China's liquor[J]. Liquor Making, 2013, 40(1): 38–41. (in Chinese) |
| [9] | CELANO G V, CAFARCHIA C, BUJA F, et al. Biogenic amines determination in cheese[J]. Ind Aliment, 1992, 31(3): 764–768. |
| [10] | HUANG J, GAN N, LV F Y, et al. Environmentally friendly solid-phase microextraction coupled with gas chromatography and mass spectrometry for the determination of biogenic amines in fish samples[J]. J Separat Sci, 2016, 39(22): 4384–4390. |
| [11] |
曾立威, 蔡翔宇, 吴玉杰, 等. 超高效液相色谱法同时快速测定多种动物源食品中9种生物胺的含量[J]. 食品安全质量检测学报, 2017, 8(3): 968–974.
ZENG L W, CAI X Y, WU Y J, et al. Rapid and simultaneous determination of 9 kinds of biogenic amines in various animal-derived foodstuffs by ultra performance liquid chromatography[J]. Journal of Food Safety & Quality, 2017, 8(3): 968–974. (in Chinese) |
| [12] |
刘辰麒, 丁卓平, 王锡昌. 生物胺的检测方法评价[J]. 现代科学仪器, 2006(4): 89–91.
LIU C Q, DING Z P, WANG X C. Appraisal of biogenic amines determination[J]. Modern Scientific Instruments, 2006(4): 89–91. (in Chinese) |
| [13] | CASAL S, OLIVEIRA M B P P, FERREIRA M A. Determination of biogenic amines in coffee by an optimized liquid chromatographic method[J]. J Liq Chromatogr Relat Technol, 2002, 25(16): 2535–2549. DOI: 10.1081/JLC-120014273 |
| [14] | PALEOLOGOS E K, KONTOMINAS M G. On-line solid-phase extraction with surfactant accelerated on-column Derivatization and Micellar liquid chromatographic separation as a tool for the determination of biogenic amines in various food substrates[J]. Anal Chem, 2004, 76(5): 1289–1294. |
| [15] | CHEN H C, HUANG Y R, HSU H H, et al. Determination of histamine and biogenic amines in fish cubes (Tetrapturus angustirostris) implicated in a food-borne poisoning[J]. Food Control, 2010, 21(1): 13–18. |
| [16] | ANLI R E, VURAL N, YILMAZ S, et al. The determination of biogenic amines in Turkish red wines[J]. J Food Compost Anal, 2004, 17(1): 53–62. |
| [17] | DUGO G M, VILASI F, LA TORRE G L, et al. Reverse phase HPLC/DAD determination of biogenic amines as dansyl derivatives in experimental red wines[J]. Food Chem, 2006, 95(4): 672–676. DOI: 10.1016/j.foodchem.2005.07.001 |
| [18] | HERNÁNDEZ-BORGES J, D'ORAZIO G, ATURKI Z, et al. Nano-liquid chromatography analysis of dansylated biogenic amines in wines[J]. J Chromatogr A, 2007, 1147(2): 192–199. |
| [19] | YEČIN S, ÜREN A. Biogenic amine content of boza:a traditional cereal-based, fermented Turkish beverage[J]. Food Chem, 2008, 111(4): 983–987. DOI: 10.1016/j.foodchem.2008.05.020 |
| [20] |
杨贤庆, 翟红蕾, 郝淑贤, 等. 高效液相色谱法测定生物胺衍生条件的优化研究[J]. 南方水产科学, 2012, 8(1): 49–53.
YANG X Q, ZHAI H L, HAO S X, et al. Optimization for determining derivative conditions of biogenic amines by HPLC[J]. South China Fisheries Science, 2012, 8(1): 49–53. (in Chinese) |
| [21] |
丁涛, 吕辰, 柳菡, 等. 高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测葡萄酒中8种生物胺[J]. 分析测试学报, 2014, 33(1): 27–32.
DING T, LÜ C, LIU H, et al. Determination of eight biogenic amines in red wines by liquid chromatography-quadrupole/electrostatic field orbit trap mass spectrometry[J]. Journal of Instrumental Analysis, 2014, 33(1): 27–32. (in Chinese) |
| [22] |
程卫, 王艳伟, 陈培云, 等. HPLC测定虾皮中不同类型的生物胺[J]. 食品工业, 2016, 37(2): 293–296.
CHENG W, WANG Y W, CHEN P Y, et al. Determination of different species of biogenic amines in shrimps by HPLC[J]. The Food Industry, 2016, 37(2): 293–296. (in Chinese) |
| [23] | KUNG H F, LEE Y C, HUANG Y R, et al. Biogenic amines content, histamine-forming bacteria, and adulteration of pork and poultry in tuna dumpling products[J]. Food Control, 2010, 21(7): 977–982. |
| [24] | IGARASHI K, KASHIWAGI K. Modulation of cellular function by polyamines[J]. Int J Biochem Cell Biol, 2010, 42(1): 39–51. DOI: 10.1016/j.biocel.2009.07.009 |
| [25] | SHAH P, SWIATLO E. A multifaceted role for polyamines in bacterial pathogens[J]. Mol Microbiol, 2008, 68(1): 4–16. DOI: 10.1111/j.1365-2958.2008.06126.x |
| [26] | MOUILLÉ B, MOREL E, ROBERT V, et al. Metabolic capacity for L-citrulline synthesis from ammonia in rat isolated colonocytes[J]. Biochim Biophys Acta Gen Sub, 1999, 1427(3): 401–407. |
| [27] | WEI F S, XU X L, ZHOU G H, et al. Irradiated Chinese Rugao ham:changes in volatile N-nitrosamine, biogenic amine and residual nitrite during ripening and post-ripening[J]. Meat Sci, 2009, 81(3): 451–455. DOI: 10.1016/j.meatsci.2008.09.005 |
| [28] | GLORIOSO J M, MAO S A, RODYSILL B, et al. Pivotal preclinical trial of the spheroid reservoir bioartificial liver[J]. J Hepatol, 2015, 63(2): 388–398. DOI: 10.1016/j.jhep.2015.03.021 |
| [29] |
王光强, 俞剑燊, 胡健, 等. 食品中生物胺的研究进展[J]. 食品科学, 2016, 37(1): 269–278.
WANG G Q, YU J S, HU J, et al. Progress in research on biogenic amines in foods[J]. Food Science, 2016, 37(1): 269–278. (in Chinese) |
| [30] |
余苗, 李贞明, 王刚, 等. 黑水虻幼虫粉对育肥猪盲肠食糜主要微生物数量和代谢产物的影响[J]. 畜牧兽医学报, 2020, 51(2): 299–310.
YU M, LI Z M, WANG G, et al. Effects of Hermetia illucens larvae meal on the number of main microbes and metabolites in the cecal digesta of finishing pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(2): 299–310. (in Chinese) |
| [31] | YEN G C, KAO H H. Antioxidative effect of biogenic amine on the peroxidation of linoleic acid[J]. Biosci Biotechnol Biochem, 1993, 57(1): 115–116. |
| [32] | YANG H, HUANG X, FANG S, et al. Uncovering the composition of microbial community structure and metagenomics among three gut locations in pigs with distant fatness[J]. Sci Rep, 2016, 6: 27427. |



