2. 福建农林大学, 福建省中兽药卫生重点实验室, 福州 350002
2. Fujian Key Laboratory of Traditional Chinese Veterinary Medicine and Animal Health, Fujian Agriculture and Forestry University, Fuzhou 350002, China
L-精氨酸是家禽的必需氨基酸[1-2],不仅能提高禽类生产性能[3-4],还能影响家禽的免疫功能。L-精氨酸被一氧化氮酶(nitric-oxide synthase, NOS)分解成一氧化氮(nitric-oxide,NO)和瓜氨酸。NOS分为3种:神经型(neuronal nitric-oxide synthase, nNOS)、内皮型(endothelial nitric-oxide synthase, eNOS)和诱导型(inducible nitric-oxide synthase, iNOS)[5]。iNOS能分解L-精氨酸产生大量的NO,NO的产生是免疫系统细胞(如NK细胞、吞噬细胞、树突状细胞等)以及其他细胞(如上皮细胞、肝细胞、雪旺氏细胞等)真正参与免疫反应的特征[6]。NO可以直接抑制DNA的修复和合成,或抑制蛋白的合成等达到抗菌的效果,并且具有抑制肿瘤生长和促进细胞凋亡的功能,还能在动物自身免疫过程和慢性退行性疾病的发病机理和控制中起作用[5],因此精氨酸特有的iNOS代谢途径在免疫调节中发挥重要作用[7-9]。
Jahanian[10]研究表明,当日粮精氨酸缺乏时,肉鸡胸腺和脾的重量会显著降低。谭玲芳等[11]研究表明,饲粮添加适量精氨酸能显著增加蛋鸭血清中免疫球蛋M(IgM)的含量。Han等[12]发现,添加0.5%精氨酸的饲粮对断奶仔猪的血清IL-2浓度有提升效果。由于精氨酸通过其特有的NO途径参与机体免疫调节,近年来成为动物营养研究的热点。但关于禽类精氨酸的研究较少,且有关的研究多以免疫相关的表观指标为研究对象,少有用病毒模型研究精氨酸与免疫功能的关系,因此,本文以禽腺病毒I群4型(fowl adenovirus serotype 4,FAdV-4)为模型进行研究。该病引起的鸡心包积液综合征(hydropericardium syndrome, HPS)自2015年以来对全球养禽业造成了严重的影响[13-14]。FAdV-4的靶器官之一是肝,肉仔鸡感染后肝会出现肿大、出血、坏死并伴有心包淡黄色胶冻状积液[15]。因此,肉鸡感染FAdV-4会使肝形成精氨酸代谢的屏障。有研究表明,肝脏会吸收大量的精氨酸[16],调节禽类的免疫功能,所以人们猜想FAdV-4会对鸡肝脏精氨酸的免疫代谢造成影响,从而破坏机体的免疫功能。
本试验用0.96%、1.20%、1.44%、1.68%和1.92%饲粮精氨酸水平饲喂肉鸡,探究精氨酸对肉仔鸡相对免疫器官指数、血清免疫蛋白及细胞因子水平的影响,并以FAdV-4为疾病模型,研究肝脏精氨酸免疫代谢与该病毒的复制关系,为精氨酸提高机体免疫功能和抗病毒能力的研究提供理论基础。
1 材料与方法 1.1 试验设计选取300只1日龄罗斯(Ross)308白羽肉鸡公雏,随机分为5组,每组5个重复,每个重复12只,重复之间初重无显著差异(P>0.05)。试验以中国鸡饲养标准NY/T33—2004推荐精氨酸量水平为100%,采用等间距梯度水平设计,包含精氨酸缺乏组、正常组和精氨酸增加量组。设置5个精氨酸水平,分别为80%、100%、120%、140%和160%,即日粮中精氨酸水平为0.96%、1.20%、1.44%、1.68%和1.92%。试验鸡饲养至21日龄,各重复随机选取4只翼静脉采血测定血清免疫指标和测定免疫相对器官指数。随后在各重复随机选取6只分为感染组和对照组。试验组肌肉注射FAdV-4 NP毒株0.2 mL(tissue culture infected dose 50% [TCID50]=10-6.23/0.01 mL),对照组肌肉注射等量灭菌生理盐水,感染2 d后,统计死亡率,随后扑杀,解剖观察体内病症情况统计发病率,并在无菌条件下收集肝测定其iNOS mRNA表达量及病毒载量。饲粮参照NY/T33—2004营养需要配制粉状配合饲料,基础饲粮组成及营养水平见表 1。试验鸡采用笼养,试验期自由采食、饮水,按常规免疫程序进行免疫接种。
|
|
表 1 1~3周基础饲粮组成及营养水平(风干基础) Table 1 Basal diets composition and nutrient levels of 1 to 3 weeks (air-dry basis) |
FAdV-4 NP毒株(TCID50=10-6.23/0.01 mL)由本实验室分离鉴定并保存、TransZol UP Plus RNA Kit RNA提取试剂盒(北京全式金生物技术有限公司)、Reverse Transcription System kit反转录试剂盒(普洛麦格(北京)生物技术有限公司)、Go Taq® qPCR Master Mix荧光定量试剂盒(普洛麦格(北京)生物技术有限公司);酶标仪(iMarkTM microplate reader,Bio-Rad),PCR仪(T100TM PCR thermal cycler,Bio-Rad),荧光定量PCR仪(CFX96 ConnectTM Optics Module Real-Time PCR System,Bio-Rad)。
1.3 检测指标 1.3.1 血清免疫指标试验第21天,断料12 h,各重复随机选取4只肉仔鸡翼静脉采血并制备血清(3 000 r·min-1,离心10 min取上清液),采用ELISA(酶联免疫试剂盒,购自上海酶联生物科技有限公司,详细步骤参考说明书)测定血清总蛋白(total protein, TP)、白蛋白(albumin, ALB)、球蛋白(globulin, GLO)、免疫球蛋白G(immunoglobulins G, IgG)、白细胞介素-1β(interleukin-1β, IL-1β)、α-肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、γ-干扰素(interferon-γ, IFN-γ)、诱导性一氧化氮酶(inducible nitric-oxide synthase, iNOS)和一氧化氮(nitric oxide, NO)。
1.3.2 免疫相对器官指数试验第21天,断料12 h,各重复随机选取4只肉仔鸡记录活体重,处死后取胸腺、脾和法氏囊,用滤纸吸去器官上的血液,剥离脂肪,称重。免疫相对器官指数(g·kg-1)=免疫器官重量(g) /活体重(kg)
1.3.3 发病率和死亡率测定肉鸡肌肉注射FAdV-4 NP毒株,感染2 d后,观察肉鸡死亡情况,计算死亡率;处死并解剖观察体内病症,计算发病率。死亡率(%)=死亡鸡数/总鸡数×100;发病率(%)=发病鸡数/总鸡数×100。
1.3.4 感染FAdV-4肉仔鸡肝iNOS含量测定Bradford蛋白定量试剂盒测定各组肝蛋白浓度(购自上海酶联生物科技有限公司,详细步骤参考说明书)后,采用ELISA(酶联免疫试剂盒,购自上海酶联生物科技有限公司,详细步骤参考说明书)测定肝组织诱导性一氧化氮酶(inducible nitric-oxide synthase, iNOS)。
1.3.5 肝iNOS mRNA表达水平和病毒载量测定荧光定量PCR(real-time fluorescence quantitative PCR,qPCR)测定肝iNOS mRNA表达水平,用RNA提取试剂盒提取肝总RNA并用反转录试剂盒进行反转录(详细步骤参考说明书)。qPCR反应体系20 μL:qPCR mix 10 μL、上下游引物各0.2 μL、模板DNA 1.5 μL,ddH2O补齐剩余量。反应条件:95 ℃ 5 min;95 ℃ 15 s,退火温度60 ℃ 30 s,72 ℃ 30 s,共41个循环;65 ℃ 5 s;95 ℃ 30 s共41个循环。iNOS引物(由上海生物工程股份有限公司合成)序列:F:5′-GAAGTGGTATGCTCTGCCTGCTG-3′,R:5′-GTCTCGCACTCCAATCTCTG-TTCC-3′。β-actin为内参,采用△△CT法计算基因的相对表达量[17-18],并根据FAdV-4 hexon基因标准曲线y=-4.349 3lgx+40.54(R2=0.993 1)(由本实验室计算、制作并保存)计算肝的FAdV-4病毒载量。
1.4 数据统计分析试验数据采用SPSS 20.0软件进行统计分析,使用one-way ANOVA对数据进行方差分析,并用LSD进行多重比较,试验数据用“平均值±标准差(Mean±SD)”表示,P < 0.05为差异显著。
2 结果 2.1 饲粮精氨酸水平对肉仔鸡免疫器官指数的影响由表 2可知,饲粮精氨酸水平为0.96%时会显著降低肉仔鸡的脾脏指数、胸腺指数和法氏囊指数均(P < 0.05),而1.44%、1.68%和1.92% 3个高精氨酸水平组均可显著性提高脾脏指数(P < 0.05)。精氨酸水平为1.20%、1.44%、1.68%、1.92%与0.96%组比较胸腺指数均显著提高(P < 0.05),其中以1.68%组胸腺指数最高。正常组1.20%和高水平1.44%、1.68%、1.92%组法氏囊指数差异均不显著(P>0.05),与低水平0.96%比较差异均显著(P < 0.05)。
|
|
表 2 饲粮精氨酸水平对21日龄肉鸡免疫器官指数的影响 Table 2 Effect of dietary arginine levels on immune organ index of 21-day-old broilers |
由表 3可知,0.96%低水平精氨酸显著降低肉仔鸡血清GLO和IgG水平(P < 0.05),而精氨酸水平为1.68%对血清GLO、IgG水平和G/A比值均有显著提高(P < 0.05)。精氨酸水平为1.20%、1.44%、1.68%、1.92%与0.96%组比较,血清GLO和IgG水平均显著提高(P < 0.05),其中以1.68%组GLO和IgG水平最高。正常组1.20%和高水平1.44%、1.92%组GLO、IgG水平差异均不显著(P>0.05),与低水平0.96%比较差异显著(P < 0.05)。精氨酸水平对血清TP和ALB水平影响不显著(P>0.05)。
|
|
表 3 饲粮精氨酸水平对21日龄肉鸡血清蛋白的影响 Table 3 Effect of dietary arginine levels on serum proteins of 21-day-old broilers |
由表 4可知,精氨酸水平为0.96%时,试验鸡血清IL-1β、TNF-α、iNOS和NO水平均显著降低(P < 0.05),1.68和1.92%两组对血清IL-1β、TNF-α和IFN-γ水平有显著提高(P < 0.05)。1.44%、1.68%和1.92% 3个高精氨酸水平组均能显著提高血清iNOS水平(P < 0.05),其中1.68%能显著提高血清NO含量(P < 0.05)。精氨酸水平为1.20%、1.44%、1.68%、1.92%与0.96%组比较,血清IL-1β、TNF-α、iNOS和NO水平均显著提高(P < 0.05),其中以1.68%组效果最佳。正常组1.20%和高水平1.68%、1.92%组相比,血清IL-1β、TNF-α、IFN-γ和iNOS水平均显著下降(P < 0.05),正常组1.20%和高水平1.44%、1.92%组相比,血清NO水平差异不显著(P>0.05)。
|
|
表 4 饲粮精氨酸水平对21日龄肉鸡血清免疫因子的影响 Table 4 Effect of dietary arginine levels on serum immune factors of 21-day-old broilers |
由表 5可知,饲粮精氨酸水平对肉仔鸡感染FAdV-4后的死亡率有显著影响(P < 0.05)。0.96%低水平精氨酸组的死亡率显著高于1.44%、1.68%、1.92% 3个高水平组(P < 0.05),而高水平组的死亡率和1.20%(正常组)比较有下降的趋势但未达显著水平(P>0.05)。1.20%组的死亡率虽低于0.96%组但也未达显著水平(P>0.05)。通过解剖观察,我们发现肉仔鸡均被感染FAdV-4且发病率均为100%(均出现不同程度的心包积液和肝炎)。
|
|
表 5 饲粮精氨酸水平对肉鸡感染FAdV-4死亡率的影响 Table 5 Effects of dietary arginine levels on the mortality rate of FAdV-4 infected broilers |
由表 6可知,肉仔鸡感染FAdV-4后,各组的肝的iNOS水平均明显下降,其中0.96%低水平精氨酸组的肝iNOS水平显著低于1.20%(正常组)和1.44%、1.68%、1.92% 3个高水平组(P < 0.05)。1.44%、1.68%、1.92% 3组与正常组比较,肝iNOS水平显著提高(P < 0.05),但1.44%、1.68%和1.92% 3组的iNOS水平无显著差异(P>0.05)。
|
|
表 6 饲粮精氨酸水平对感染FAdV-4肉仔鸡肝iNOS含量的影响 Table 6 Effect of dietary arginine levels on liver iNOS concentration of FAdV-4 infected broilers |
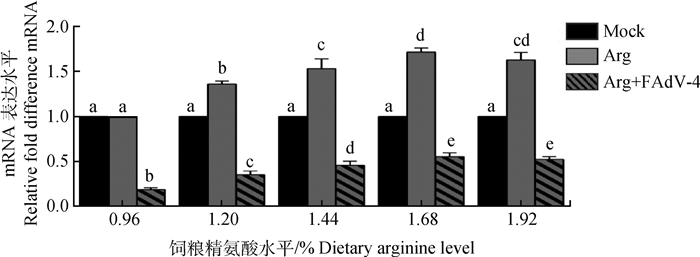
在酶联免疫分析试剂盒测定肝组织的iNOS水平基础上,通过qPCR测定肝的iNOS mRNA表达水平。由图 1可知,1.44%、1.68%和1.92%高精氨酸水平组均能显著提高肝iNOS mRNA的表达水平(P < 0.05)。肉仔鸡感染FAdV-4后,肝iNOS mRNA的表达水平均显著下降(P < 0.05),而1.44%、1.68%和1.92%组能显著提高感染后肝iNOS mRNA的表达(P < 0.05),其中效果最好的是1.68%和1.92%组。
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。图 2同 Value columns with different small letters mean significant difference (P < 0.05). The same as Figure 2 图 1 qPCR测定iNOS的mRNA水平 Fig. 1 The mRNA levels of iNOS were determined by real time qPCR |
|
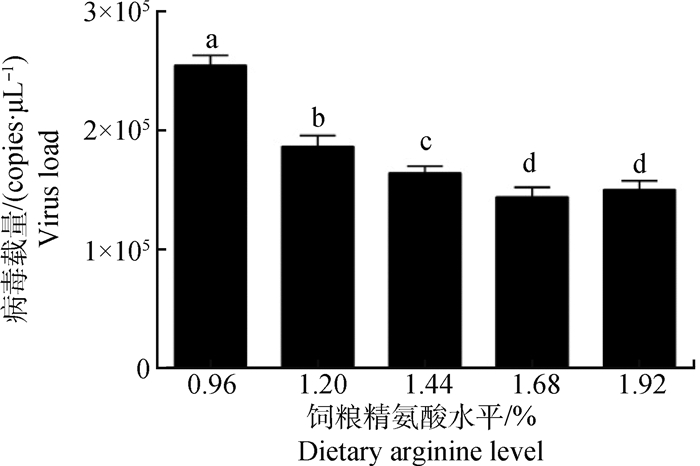
图 2 肝组织的FAdV-4的病毒载量 Fig. 2 The viral load of FAdV-4 in liver |
由图 2可知,精氨酸水平为0.96%(精氨酸缺乏组)的肝FAdV-4病毒载量显著高于1.20%和1.44%、1.68%和1.92%(高水平精氨酸组)(P < 0.05)。1.44%、1.68%和1.92%高精氨酸组与1.20%正常组相比,肝病毒载量显著降低(P < 0.05),其中1.68%和1.92%组的效果最好。
3 讨论 3.1 饲粮精氨酸水平对肉鸡免疫器官指数的影响动物免疫器官是实现免疫功能的基础。初级和次级淋巴器官的重量通常被作为衡量免疫系统发育和功能的指标[19]。研究表明精氨酸可通过促进生长激素和胰岛素样生长因子的释放[20],促进动物的中枢免疫器官如胸腺和法氏囊(禽类)的发育,也可促进动物外周免疫器官如脾的发育[21-22]。本试验结果表明,饲粮精氨酸缺乏会显著降低肉鸡的脾脏指数、胸腺指数和法氏囊指数,与Jahanian[10]的报道相一致。饲料高水平精氨酸对脾脏指数和胸腺指数有显著性提高与Kwak等[19]研究结果相似。由此可以说明饲粮精氨酸水平能影响禽类免疫器官的发育,从而达到提高机体免疫功能的作用。
3.2 饲粮精氨酸水平对肉鸡血清蛋白水平的影响精氨酸在前B细胞的成熟中扮演重要角色,可有效地增强体液免疫机能,促进免疫球蛋白的产生[23]。球蛋白主要由免疫球蛋白组成,其含量上升可能会提高动物机体的抗病力[24],球蛋白与白蛋白的比值(G/A)与动物体的免疫呈正相关,比值升高,则证明动物机体处于一个较好的免疫状态[25]。本试验结果表明,饲粮精氨酸缺乏降低肉仔鸡血清球蛋白和G/A比值,而高水平的精氨酸能提高血清球蛋白和G/A比值,这表明高水平精氨酸能提高机体的免疫功能,相反,缺乏精氨酸则不利于机体的免疫状态。IgG是血清主要的抗体成分,约占Ig的75%,在机体免疫中起保护作用,能抗菌、抗病毒。柏美娟等[26]研究发现,饲粮中添加1%的精氨酸能增加育肥猪血清免疫球蛋白G(IgG)的含量。本试验结果表明,饲粮精氨酸水平能影响肉仔鸡的血清IgG水平,其中高水平的精氨酸能有效提高机体血清IgG水平。因此,笔者认为缺乏精氨酸不利于机体的免疫功能,而适量的精氨酸能提高机体免疫功能,加强其抗病毒能力。
3.3 饲粮精氨酸水平对肉鸡血清免疫因子的影响研究表明,精氨酸可以显著提高淋巴细胞对有丝分裂源的反应性,从而刺激T淋巴细胞的增殖[27-28], 调节免疫细胞中细胞因子的产生[29-30]。IFN-γ具有光谱抗病毒作用,能影响细胞生长分化以及调节免疫功能,并分泌IL-1、IL-6和TNF-α等细胞因子,其中IL-1可以促进B细胞增殖和分泌抗体,而TNF-α则是启动抗菌炎症反应的关键细胞因子[31]。韩杰[32]报道,日粮中添加精氨酸升高了仔猪IFN-γ水平。Kirk等[33]研究发现,细胞在体外培养时缺乏精氨酸,细胞产生的IFN-γ会减少。本试验结果表明,缺乏精氨酸均会显著降肉仔鸡低血清IFN-γ、IL-1β和TNF-α水平,高水平精氨酸显著提高了血清IFN-γ、IL-1β和TNF-α水平,与上述研究有类似的结果。笔者发现精氨酸会通过提高血清对机体免疫因子来达到提升机体免疫功能,加强其抗病毒的能力。
3.4 饲粮精氨酸水平对血清iNOS、NO水平,肝iNOS mRNA表达量以及及其抗FAdV-4能力的影响研究表明,血清NO水平与肝功能状态有关[34]。此外,一系列研究报道iNOS / NO系统可能通过扩张血管在肝炎和肝硬化中发挥重要作用[35-37]。iNOS可以产生大量的NO,这些NO参与传染病、肿瘤、自身免疫过程和慢性退行性疾病的发病机制和调控[5],并能抑制DNA病毒(例如单纯疱疹病毒,牛痘病和EB病毒)和RNA病毒(例如水疱性口炎病毒和柯萨奇病毒)的感染[38-40]。Sharara等[41]研究表明,NO水平与肝损害程度呈负相关,推测NO对肝损害具有保护作用。本试验结果表明,饲粮缺乏精氨酸会显著降低机体血清iNOS和NO含量以及肝iNOS mRNA的表达水平。相反高水平精氨酸能显著提高血清iNOS和NO含量以及肝iNOS mRNA的表达水平。因此,笔者认为精氨酸不仅通过提高免疫器官指数、血清蛋白和免疫因子水平,还通过精氨酸特有的iNOS/NO途径提高机体免疫功能和抗病毒的能力。
研究表明,精氨酸可能具有抗病毒作用。本试验结果显示,在FAdV-4攻毒后,高水平精氨酸组肉仔鸡的死亡率低于低水平精氨酸组,与Munir等[42]研究发现,在进行心包积水综合症(hydropericardial syndrome virus, HPSV)攻毒后精氨酸添加组成活率高于对照组的结果相似。Lee等[43]研究发现,饲粮精氨酸会影响蛋鸡感染传染性支气管炎病毒(infectious bronchitis virus, IBV)后的细胞反应以及目标组织中白细胞亚群的分布。谭建庄[44]研究发现,日粮精氨酸能通过提高肉鸡外周血淋巴细胞比例以及细胞因子表达量缓解由传染性法氏囊病病毒(infectious bursal disease virus, IBDV)攻毒引起的免疫抑制。本试验结果表明,肉仔鸡感染FAdV-4后,该病毒会抑制肝的iNOS mRNA的表达水平,从而破坏机体的免疫功能,加强病毒复制,而高水平精氨酸能有效地恢复感染病毒后肝iNOS mRNA的表达水平,加强机体免疫功能和抗病毒能力,从而抑制FAdV-4的复制,与上述试验有类似的结果。因此我们认为添加适量的精氨酸可以抑制FAdV-4的复制。
4 结论肉仔鸡饲粮中精氨酸的不足会降低其机体的免疫功能及抗FAdV-4病毒能力。提高肉仔鸡饲粮中精氨酸水平可提高免疫器官指数、血清免疫因子水平及肝iNOS mRNA表达量,降低肝的病毒载量,从而提高机体免疫功能和抗病毒能力。
| [1] | LUIKING Y C, POEZE M, RAMSAY G, et al. The role of arginine in infection and sepsis[J]. J Parenter Enteral Nutr, 2005, 29(1S): S70–S74. |
| [2] | STECHMILLER J K, CHILDRESS B, COWAN L. Arginine supplementation and wound healing[J]. Nutr Clin Pract, 2005, 20(1): 52–61. DOI: 10.1177/011542650502000152 |
| [3] |
方勇军.精氨酸对肉鸭生长性能、免疫机能、胴体品质和血液脂质的影响[D].武汉: 武汉工业学院, 2009.
FANG Y J.Influence of arginine on growth performance, immune action, carcass characteristics and blood lipid of meat duck[D].Wuhan: Wuhan Polytechnic University, 2009.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10496-2009203492.htm |
| [4] |
刘凤菊, 呙于明, 王磊. 1~3周龄雌性肉仔鸡精氨酸需要量[J]. 动物营养学报, 2011, 23(4): 571–577.
LIU F J, GUO Y M, WANG L. Arginine requirement for female broiler chicks aged from 1 to 3 weeks[J]. Chinese Journal of Animal Nutrition, 2011, 23(4): 571–577. DOI: 10.3969/j.issn.1006-267x.2011.04.007 (in Chinese) |
| [5] | BOGDAN C. Nitric oxide and the immune response[J]. Nat Immunol, 2001, 2(10): 907–916. DOI: 10.1038/ni1001-907 |
| [6] | BOGDAN C.The function of nitric oxide in the immune system[M]//MAYER B.Nitric Oxide.Berlin: Springer, 2000: 443-492. |
| [7] | CAPUANO G, RIGAMONTI N, GRIONI M, et al. Modulators of arginine metabolism support cancer immunosurveillance[J]. BMC Immunol, 2009, 10(1): 1. DOI: 10.1186/1471-2172-10-1 |
| [8] | OCHOA J B, STRANGE J, KEARNEY P, et al. Effects of L-arginine on the proliferation of T lymphocyte subpopulations[J]. J Parenter Enteral Nutr, 2001, 25(1): 23–29. DOI: 10.1177/014860710102500123 |
| [9] | WU G Y, BAZER F W, DAVIS T A, et al. Arginine metabolism and nutrition in growth, health and disease[J]. Amino Acids, 2009, 37(1): 153–168. DOI: 10.1007/s00726-008-0210-y |
| [10] | JAHANIAN R. Immunological responses as affected by dietary protein and arginine concentrations in starting broiler chicks[J]. Poult Sci, 2009, 88(9): 1818–1824. DOI: 10.3382/ps.2008-00386 |
| [11] |
谭玲芳, 王安, 李越, 等. 精氨酸对笼养生长期蛋鸭生长性能及免疫功能的影响[J]. 中国饲料, 2013(7): 15–18.
TAN L F, WANG A, LI Y, et al. Effects of dietary arginine level on growth performance and immunity of caged growing laying ducks[J]. China Feed, 2013(7): 15–18. (in Chinese) |
| [12] | HAN J, LIU Y L, FAN W, et al. Dietary L-arginine supplementation alleviates immunosuppression induced by cyclophosphamide in weaned pigs[J]. Amino Acids, 2009, 37(4): 643–651. DOI: 10.1007/s00726-008-0184-9 |
| [13] | XIA J, YAO K C, LIU Y Y, et al. Isolation and molecular characterization of prevalent fowl adenovirus strains in southwestern China during 2015-2016 for the development of a control strategy[J]. Emerg Microbes Infect, 2017, 6(11): e103. |
| [14] | ZHAO J, RUAN S F, GUO Y, et al. Serological and phylogenetic analysis indicating prevalence of fowl adenovirus in China[J]. Vet Rec, 2018, 182(13): 381. DOI: 10.1136/vr.104517 |
| [15] | SCHACHNER A, MATOS M, GRAFL B, et al. Fowl adenovirus-induced diseases and strategies for their control-a review on the current global situation[J]. Avian Pathol, 2018, 47(2): 111–126. |
| [16] | GRIMBLE G K. Adverse gastrointestinal effects of arginine and related amino acids[J]. J Nutr, 2007, 137(6): 1693S–1701S. DOI: 10.1093/jn/137.6.1693S |
| [17] | WANG Q X, WU Y J, CAI Y L, et al. Spleen transcriptome profile of Muscovy ducklings in response to infection with Muscovy duck reovirus[J]. Avian Dis, 2015, 59(2): 282–290. |
| [18] | WANG Q X, LIU M X, XU L H, et al. Transcriptome analysis reveals the molecular mechanism of hepatic fat metabolism disorder caused by Muscovy duck reovirus infection[J]. Avian Pathol, 2018, 47(2): 127–139. DOI: 10.1080/03079457.2017.1380294 |
| [19] | KWAK H, AUSTIC R, DIETERT R. Influence of dietary arginine concentration on lymphoid organ growth in chickens[J]. Poult Sci, 1999, 78(11): 1536–1541. DOI: 10.1093/ps/78.11.1536 |
| [20] |
王恬. 精氨酸对免疫机能的影响及调节作用[J]. 上海体育学院学报, 2006, 30(2): 76–79.
WANG T. Effect and regulatory action of arginine on immune function[J]. Journal of Shanghai University of Sport, 2006, 30(2): 76–79. DOI: 10.3969/j.issn.1000-5498.2006.02.017 (in Chinese) |
| [21] | NIRGIOTIS J G, HENNESSEY P J, ANDRASSY R J. The effects of an arginine-free enteral diet on wound healing and immune function in the postsurgical rat[J]. J Pediatr Surg, 1991, 26(8): 936–941. DOI: 10.1016/0022-3468(91)90840-P |
| [22] | MA Q Y, HOPER M, ANDERSON N, et al. Effect of supplemental L-arginine in a chemical-induced model of colorectal cancer[J]. World J Surg, 1996, 20(8): 1087–1091. DOI: 10.1007/s002689900165 |
| [23] | LEBIEN T W. Arginine:an unusual dietary requirement of pre-B lymphocytes?[J]. J Clin Invest, 2002, 110(10): 1411–1413. DOI: 10.1172/JCI0217210 |
| [24] |
李春松, 戴晋军, 李彪. 日粮中添加禽免疫增强剂对肉鸡免疫功能的影响[J]. 国外畜牧学-猪与禽, 2012, 32(9): 73–75.
LI C S, DAI J J, LI B. Effects of dietary addition of avian immune enhancer on immune function of broilers[J]. Pigs and Poultry, 2012, 32(9): 73–75. DOI: 10.3969/j.issn.1001-0769.2012.09.030 (in Chinese) |
| [25] |
翟明, 李妍, 李岩. 多肽菌素对肉鸡血清生化指标、血清抗体水平及免疫器官指数的影响[J]. 中国家禽, 2018, 40(7): 23–26.
ZHAI M, LI Y, LI Y. Effects of polypeptide on serum biochemical index, serum antibody level and immune organ index of broilers[J]. China Poultry, 2018, 40(7): 23–26. (in Chinese) |
| [26] |
柏美娟, 孔祥峰, 印遇龙, 等. 日粮添加精氨酸对肥育猪免疫功能的调节作用[J]. 扬州大学学报:农业与生命科学版, 2009, 30(3): 45–49.
BAI M J, KONG X F, YIN Y L, et al. Regulation of dietary supplemental arginine on immune response in fattening pigs[J]. Journal of Yangzhou University:Agricultural and Life Science Edition, 2009, 30(3): 45–49. (in Chinese) |
| [27] |
陈亚军, 齐玉梅. 精氨酸免疫营养作用的研究进展[J]. 中国临床营养杂志, 2007, 15(5): 310–314.
CHEN Y J, QI Y M. Research advancement of arginine in immunonutrition[J]. Chinese Journal of Clinical Nutrition, 2007, 15(5): 310–314. DOI: 10.3760/cma.j.issn.1674-635X.2007.05.010 (in Chinese) |
| [28] |
李玉庆, 张小平, 程爱国. 精氨酸的免疫调理作用[J]. 中国煤炭工业医学杂志, 2007, 10(2): 121–122.
LI Y Q, ZHANG X P, CHENG A G. Immune conditioning of arginine[J]. Chinese Journal of Coal Industry Medicine, 2007, 10(2): 121–122. DOI: 10.3969/j.issn.1007-9564.2007.02.009 (in Chinese) |
| [29] | MAYER B, HEMMENS B. Biosynthesis and action of nitric oxide in mammalian cells[J]. Trends Biochem Sci, 1997, 22(12): 477–481. DOI: 10.1016/S0968-0004(97)01147-X |
| [30] | ALDERTON W K, COOPER C E, KNOWLES R G. Nitric oxide synthases:structure, function and inhibition[J]. Biochem J, 2001, 357(3): 593–615. DOI: 10.1042/bj3570593 |
| [31] |
郭祎玮.精氨酸对肉仔鸡生长性能和免疫功能的影响及其机理研究[D].呼和浩特: 内蒙古农业大学, 2014.
GUO Y W.Effects of arginine on growth performance and immune function in broilers and the underlying mechanism[D].Hohhot: Inner Mongolia Agricultural University, 2014.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2600811 |
| [32] |
韩杰.精氨酸对脂多糖和环磷酰胺刺激仔猪免疫功能的影响[D].武汉: 武汉工业学院, 2009.
HAN J.Effect of arginine on immune function of piglets after lipopolysaccharide and cyclophosphamide challenge[D].Wuhan: Wuhan Polytechnic University, 2009.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10496-2009203535.htm |
| [33] | KIRK S J, REGAN M C, BARBUL A. Cloned murine T lymphocytes synthesize a molecule with the biological characteristics of nitric oxide[J]. Biochem Biophys Res Commun, 1990, 173(2): 660–665. DOI: 10.1016/S0006-291X(05)80086-5 |
| [34] | WIEST R, GROSZMANN R J. The paradox of nitric oxide in cirrhosis and portal hypertension:too much, not enough[J]. Hepatology, 2002, 35(2): 478–491. DOI: 10.1053/jhep.2002.31432 |
| [35] | FENG D Y, CHENG R X, ZHENG H, et al. Effect of hepatitis C virus NS3 protein on expression of iNOS mRNA in hepatocarcinogenesis[J]. Bulletin of Hunan Medical University, 2001, 26(3): 192–194. |
| [36] | TACHE D E, STǍNCIULESCU C E, BANIŢǍ, et al. Inducible nitric oxide synthase expression (iNOS) in chronic viral hepatitis and its correlation with liver fibrosis[J]. Rom J Morphol Embryol, 2014, 55(S2): 539–543. |
| [37] | FU P, ZHANG Q, YI D Y, et al. Dehydrocavidine attenuates D-galactose induced learning and memory impairment in rats[J]. Neurosci Lett, 2018, 665: 200–205. DOI: 10.1016/j.neulet.2017.12.004 |
| [38] | LOWENSTEIN C J, HILL S L, LAFOND-WALKER A, et al. Nitric oxide inhibits viral replication in murine myocarditis[J]. J Clin Invest, 1996, 97(8): 1837–1843. DOI: 10.1172/JCI118613 |
| [39] | MANNICK J B. The antiviral role of nitric oxide[J]. Res Immunol, 1995, 146(9): 693–697. DOI: 10.1016/0923-2494(96)84920-0 |
| [40] | MANNICK J B, ASANO K, IZUMI K, et al. Nitric oxide produced by human B lymphocytes inhibits apoptosis and Epstein-Barr virus reactivation[J]. Cell, 1994, 79(7): 1137–1146. DOI: 10.1016/0092-8674(94)90005-1 |
| [41] | SHARARA A I, PERKINS D J, MISUKONIS M A, et al. Interferon (IFN)-α activation of human blood mononuclear cells in vitro and in vivo for nitric oxide synthase (NOS) type 2 mRNA and protein expression:possible relationship of induced NOS2 to the anti- hepatitis C effects of IFN-α in vivo[J]. J Exp Med, 1997, 186(9): 1495–1502. DOI: 10.1084/jem.186.9.1495 |
| [42] | MUNIR K, MUNEER M A, MASAOUD E, et al. Dietary arginine stimulates humoral and cell-mediated immunity in chickens vaccinated and challenged against hydropericardium syndrome virus[J]. Poult Sci, 2009, 88(8): 1629–1638. DOI: 10.3382/ps.2009-00152 |
| [43] | LEE J E, AUSTIC R E, NAQI S A, et al. Dietary arginine intake alters avian leukocyte population distribution during infectious bronchitis challenge[J]. Poult Sci, 2002, 81(6): 793–798. DOI: 10.1093/ps/81.6.793 |
| [44] |
谭建庄.日粮精氨酸对不同疾病模型肉鸡免疫功能的调节作用与机理研究[D].北京: 中国农业大学, 2014.
TAN J Z.Effects of dietary L-Arginine supplementation on immune functions in broiler chickens challenged with different pathogens[D].Beijing: China Agricultural University, 2014.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10019-1014221314.htm |



