口蹄疫(foot-and-mouth disease, FMD)是一种由口蹄疫病毒(FMDV)引起的高度传染性病毒性疾病,严重危及牛、猪、羊等偶蹄动物,给畜牧业带来巨大的经济损失,世界动物卫生组织(OIE)将其列为需报告传染病[1-2]。FMDV属于微RNA病毒科口蹄疫病毒属的单股正链RNA病毒,基因组大约由8 500个核苷酸组成,包括5′-UTR、开放阅读框(ORF)和3′-UTR[3]。其ORF可以翻译成一个约为250 ku的多聚蛋白,随后被病毒自身蛋白酶和宿主细胞蛋白酶切割,从而产生四种结构蛋白和八种非结构蛋白(Lpro、2A、2B、2C、3A、3B、3Cpro和3Dpol)[4]。FMDV衣壳由VP1、VP2、VP3和VP4四种结构蛋白各60分子组成,VP1、VP2、VP3暴露在病毒表面,而VP4位于内部[5]。FMDV共有7个血清型,分别为O、A、C、Asia1、SAT1、SAT2及SAT3等型,每个血清型都可以感染动物,且不同血清型之间不存在交叉保护[6-7],因此可能会出现多个血清型口蹄疫病毒同时流行的情形,从而使口蹄疫的防控任务面临更大的难题。目前,口蹄疫主要通过口蹄疫疫苗来预防疾病的发生,虽效果显著,但作用相对有限[8]。因此,需要开发新的抗病毒药物来协助控制FMDV的暴发以及传播。
细胞表面最大的受体家族是G蛋白偶联受体(G-protein-coupled receptors, GPCRs)。GPCRs的信号需要通过异源三聚体鸟嘌呤核苷酸结合蛋白(G-proteins)传递到下游的效应蛋白。异三聚体G蛋白依据其α亚基分为四个亚家族:GS、Gi、Gq和G12。G12亚家族由Gα12和Gα13组成,并且在各种细胞和组织中表达[9]。Gα12第一个被鉴定的功能是致癌转化[10],据报道,Gα12在各种生理过程中调节多种细胞反应,包括生长、极性、迁移和凋亡,例如胚胎发育、血管生成、血小板活化以及免疫和神经元调节作用[11-13]。含有G蛋白信号结构域的Rho鸟嘌呤核苷酸交换因子(RGS-RhoGEFs)的调节因子将异源三聚体G蛋白α亚基的G12家族的活化形式与小GTP酶Rho直接连接[14]。G蛋白偶联受体(GPCRs)与异源三聚体G蛋白α亚单位Gα12和Gα13的Gα12家族成员相连,调节Rho GTPases的激活,从而促进许多关键的生物学过程[15]。Gα12介导的信号反应主要通过RhoGEF对小GTP酶Rho的激活作用,RhoGEF与肌动蛋白应力纤维的调节和转录活性的诱导有关[16]。除RhoGEF外,已发现超过20种蛋白质作为Gα12的效应分子,如钙黏蛋白、Hsp90和BTK等[17]。这意味着Gα12可以通过不同组织中的不同机制起作用。最近研究发现Gα12的表达与致癌的信号转导途径密切相关[18-19],其参与溶血磷脂酸诱导的高血压反应的分子机制[20],在饮食诱导的关于脂肪组织扩张和重塑的肥胖中起到重要作用[21]。目前,Gα12在抗病毒方面的研究尚未见报道,我们的研究发现FMDV的感染可上调Gα12的表达,过表达Gα12抑制FMDV的复制,说明Gα12具有抗FMDV的作用。
1 材料与方法 1.1 材料 1.1.1 细胞、病毒和质粒HEK293T细胞、PK-15细胞、Vero细胞和BHK-21细胞均由本实验室保存。
FMDV/O/HN/93株由国家口蹄疫参考实验室分离并保存。SeV由本实验室保存。IFN-Luc、NF-κB-Luc和pRL-TK质粒由舒红兵教授(武汉大学)馈赠。pcDNA3.1/myc-His(-)载体由本实验室保存。
1.1.2 主要试剂大肠杆菌感受态Trans5α购自全式金生物技术有限公司;M-MLV、Trizol、LA Taq酶、SYBR premix Ex Taq (TLi RNaseH PLus)均购自宝生物(大连)有限公司;蛋白Marker、ECL显色液购自赛默飞世尔科技有限公司(中国);转染试剂JetPEI-Polyplus购自达科为生物技术有限公司;Np-40细胞裂解液和蛋白酶抑制剂PMSF购于碧云天生物技术有限公司;NheⅠ-HF(R3131S)、BamHⅠ-HF(#R3136S)和Cutsmart buffer (B7204S,10×Concentrate)购于BioLabs公司(英国)。小鼠抗Gα12单抗、小鼠抗myc单抗、小鼠抗β-actin单抗、山羊抗鼠IgG和山羊抗豚鼠IgG二抗均购于Santacruz公司,抗O型FMDV豚鼠血清由本实验室制备。Alexa Fluor 488-conjugated anti-mouse IgG secondary antibody购自Invitrogen公司;DAPI购自罗氏公司。双荧光素酶检测试剂盒购自Promega公司。
1.2 方法 1.2.1 总RNA的提取及Gα12基因的克隆Trizol裂解法提取PK-15细胞(1×106)总RNA:细胞中分别加入1 mL Trizol,反复吹打至透明状,用移液器吸至1.5 mL无RNase Eppendorf管中,再加入250 μL氯仿,剧烈振荡15 s,使Trizol与氯仿充分混合,4 ℃冰箱放置10 min后,4 ℃ 12 000 r·min-1离心15 min,用移液器慢慢吸取透明上清(不要吸到中间的蛋白层)至无RNase的离心管中,加入等体积的异丙醇上下颠倒7~10次,在-20 ℃放置30 min以上,沉淀RNA。4 ℃ 12 000 r·min-1离心10 min,弃上清,加入用DEPC水配制的75%乙醇1 mL上下轻轻颠倒8~9次,4 ℃ 7 500 r·min-1离心5 min,弃掉上清,将含有RNA的EP管放在超净台中,晾干,加入20 μL的DEPC水溶解RNA,测浓度,备用。
反转录反应体系(20 μL):4 μL的5×First buffer,2 μL的0.1 mol·L-1 DDT,1 μL的RNA酶抑制剂RRI,1 μL的80 μmol·L-1 oligo dT,1 μL的M-MLV反转录酶,0.5 μL的100 μmol·L-1 Random primer,1 μL的10 mmol·L-1dNTPs,4.5 μL的DEPC无RNase水,5 μL的RNA。程序为25 ℃ 10 min,37 ℃ 60 min,72 ℃ 15 min,16 ℃保存。
1.2.2 Gα12质粒的构建设计并合成Gα12上、下游引物(表 1),分别引入NheⅠ和BamHⅠ-HF双酶切位点,从猪体内扩增Gα12基因序列,构建到真核表达质粒pcDNA3.1/myc-His(-)上。以RNA反转录成的cDNA为模板,扩增Gα12片段,双酶切,将片段连接于pcDNA3.1/myc-His(-)载体上,构建pcDNA3.1-Gα12-myc重组质粒。
|
|
表 1 本试验中用到的引物序列 Table 1 The primers used in this study |
将pcDNA3.1-Gα12-myc质粒用NheⅠ和BamHⅠ双酶切鉴定。采用10 μL体系:500 ng pcDNA3.1-Gα12-myc质粒,0.5 μL NheⅠ酶,0.5 μL BamHⅠ酶,1 μL Cut Smart Buffer,加ddH2O至体系为10 μL。37 ℃酶切3 h,1%琼脂糖凝胶电泳。送金唯智生物科技有限公司测序,证实构建正确。
1.2.3 Western blot制备PK-15细胞蛋白样品:细胞接种35 mm的培养皿,待密度为70%~80%进行转染。培养一定时间收集样品,加1×SDS loading buffer裂解样品,95 ℃煮样10 min,12 000 r·min-1,离心10 min。
SDS-PAGE蛋白凝胶电泳及转印:配制12%聚丙烯酰胺凝胶,将制备好的蛋白样品加样,同时加指示Marker,电泳时先调80 V电压跑30 min,再将电压调为120 V跑至结束;电泳结束后,100 V 1 h转印至NC膜上;用5%脱脂奶粉溶液封闭1.5 h(室温)后;一抗孵育,4 ℃过夜;用TBST洗3次,每次10 min;二抗(山羊抗鼠IgG、山羊抗豚鼠IgG)室温孵育2 h后,用TBST洗3次,每次10 min;最后采用蛋白发光印迹仪进行ECL显影、曝光。
1.2.4 实时荧光定量PCR用Trizol裂解法提取PK-15细胞总RNA,将RNA反转录为cDNA,用对应的引物进行检测。采用20 μL体系:10 μL SYBR Green,0.4 μL上游引物,0.4 μL下游引物,1 μL cDNA,8.2 μL DEPC水。反应程序:95 ℃ 3 min;95 ℃10 s,60 ℃ 34 s共40循环(95 ℃ 15 s,60 ℃ 1 min),95 ℃ 1 s。扩增引物见表 1。
1.2.5 间接免疫荧光试验HEK293T细胞接种于35 mm共聚焦培养皿,待密度为70%~80%转染。24 h后弃掉培养液,用PBS洗两次;4%多聚甲醛组织固定液固定30 min,PBS洗两次,每次8 min;0.3%Triton通透25 min,PBS洗三次,每次10 min;5%脱脂奶粉溶液4 ℃封闭4 h;小鼠抗myc单抗(1:300,300 μL)孵育,4 ℃孵育过夜,PBST洗三次;山羊抗鼠IgG抗体(1:300,300 μL)孵育,常温孵育1 h (或者4 ℃孵育4 h),PBST洗三次,每次5 min;DAPI染色10~15 min,PBST洗三次,每次5 min,共聚焦显微镜观察,拍照。
1.2.6 病毒感染及病毒滴度测定病毒感染:PK-15细胞接种于细胞培养皿,待细胞密度70%~80%,用JetPEI-PolyPlus转染试剂分别转染0、1和2 μg的 pcDNA3.1-Gα12-myc,转染24 h后,弃掉细胞培养液,用PBS洗一次,然后接种FMDV,12 h后收取样品,冻融3次。
病毒毒价的测定(TCID50):在96孔板中加入消化吹打混匀的BHK-21细胞(100 μL),12 h后,弃上清,用无血清DMEM培养基洗一次,用DMEM以10倍倍比稀释病毒,将不同稀释度的病毒分别加入96孔板(50 μL),同时设置一列阴性对照孔,培养48 h后,记录每一稀释度产生CPE的细胞孔数目,根据Reed-Muench法计算TCID50。重复试验三次。
1.2.7 Gα12 SiRNA干扰试验将PK-15细胞接种于六孔板,待密度为70%~80%时分别转染150 nmol·L-1的NC siRNA (5′-UUCUCCGAAC-GUGUCACGUTT-3′)和Gα12 siRNA(5′- CGUGA-AGGGCCUAAAGUUU-3′),转染24 h后,分别感染FMDV,在0、12、24、36 h不同时间点收取样品。用实时荧光定量PCR和Western blot检测。
1.2.8 双荧光素酶报告试验将293T细胞(1×105·mL-1)接种到24孔板中,12 h后分别转染100 ng报告质粒、20 ng pRL-TK和相应浓度的Gα12质粒,24 h后用SeV感染,12 h后用双荧光素酶检测试剂盒(Promega,美国)检测荧光素酶活性。
2 结果 2.1 Gα12真核表达质粒的鉴定利用引物对Gα12基因进行扩增后,进行1%琼脂糖凝胶电泳,检测到1 023 bp扩增条带(图 1A),大小与预测相符。将经NheⅠ和BamHⅠ双酶切的片段与pcDNA3.1/myc-His(-)载体连接,转化Trans5α大肠杆菌感受态细胞,提取质粒,进行NheⅠ与BamHⅠ双酶切鉴定,如图 1B所示,可见两条带,大小与预期相符,说明Gα12真核表达质粒构建成功。

|
A. Gα12 PCR扩增;B.真核表达质粒pcDNA3.1-Gα12-myc的NheⅠ与BamHⅠ双酶切鉴定 A. Amplification of Gα12 sequence by PCR; B. NheⅠ and BamHⅠ enzymatic digestion of pcDNA3.1-Gα12-myc plasmid 图 1 Gα12真核表达质粒pcDNA3.1-Gα12-myc的构建与鉴定 Fig. 1 Construction and identification of pcDNA3.1-Gα12-myc eukaryotic expression plasmid |
将pcDNA3.1-Gα12-myc真核表达质粒和pcDNA3.1/myc-His(-)对照质粒分别转染PK-15细胞,36 h收取细胞样品,用小鼠抗myc单抗进行Western blot检测,检测到40 ku条带,大小与预测相符合,表明质粒Gα12-myc在PK-15细胞中成功表达(图 2A),并且,利用间接免疫荧光试验检测到Gα12-myc质粒成功表达,且定位于细胞质中(图 2B)。

|
A.蛋白质印迹法检测pcDNA3.1-Gα12-myc质粒的表达;B.间接免疫荧光试验检测pcDNA3.1-Gα12-myc质粒的表达及其细胞定位 A. The identification of expression of pcDNA3.1-Gα12-myc plasmid by Western blot; B. The identification of expression and subcellular localization of pcDNA3.1-Gα12-myc plasmid by indirect fluorescence assay 图 2 pcDNA3.1-Gα12-myc质粒的表达 Fig. 2 The identification of expression of pcDNA3.1-Gα12-myc plasmid |
将PK-15细胞接种于35 mm的培养皿,待细胞长满后,感染FMDV (MOI=0.5),不同时间点收取细胞样品(0、4、8、12 h),进行相对实时荧光定量PCR检测,以GAPDH为内参。结果显示,随着感染时间延长,FMDV mRNA的量逐渐呈现上升趋势,且Gα12 mRNA的量也呈现上升趋势(图 3A)。但是不接毒的Mock细胞Gα12 mRNA水平没有明显的变化(图 3B)。同时,用Western blot方法检测内源性Gα12蛋白的变化,如图 3C所示,感染FMDV之后,随着病毒蛋白的增加,内源性Gα12的蛋白水平也逐渐升高。

|
A.实时荧光定量检测FMDV感染细胞后FMDV和Gα12 mRNA的变化(**.P < 0.01);B.实时荧光定量PCR检测未接毒的Mock细胞中Gα12 mRNA的变化;C. Western blot检测FMDV感染细胞后Gα12和FMDV蛋白水平变化 A. The mRNA level of FMDV and Gα12 were detected by qPCR in FMDV-infected cells(**.P < 0.01); B. The mRNA level of Gα12 was detected by qPCR in mock cells; C. Gα12 and FMDV proteins were detected by Western blot in FMDV-infected cells 图 3 FMDV感染上调Gα12 Fig. 3 FMDV infection upregulates Gα12 |
综上所述,FMDV感染后上调Gα12在基因和蛋白水平的表达。
2.4 过表达Gα12抑制FMDV的复制为了验证Gα12过表达对FMDV复制的影响,将pcDNA3.1-Gα12-myc真核质粒以不同剂量(0、1和2 μg)转染PK-15细胞,转染24 h后接FMDV(MOI= 0.5),24 h后收取细胞样品。如图 4A所示,随着Gα12蛋白表达量的升高,FMDV的蛋白量逐渐下降;实时荧光定量PCR结果显示,随着Gα12 mRNA水平的升高(图 4B左),FMDV mRNA水平逐渐下降(图 4B右)。同时,TCID50结果显示,随着Gα12表达量的升高,FMDV的病毒滴度呈逐渐下降的趋势,而且存在显著差异(图 4C),这些结果说明过表达Gα12抑制FMDV的复制。随后我们又做了病毒复制曲线,检测Gα12对FMDV在BHK-21、PK-15和Vero细胞中复制的影响,如图 4D~F所示,不管是在BHK-21、PK-15还是在Vero细胞上Gα12都能显著抑制FMDV复制,说明Gα12在多种细胞上都能抑制FMDV复制。

|
A. Western blot检测Gα12和FMDV蛋白在PK-15细胞表达(**.P < 0.01);B.实时荧光定量PCR检测Gα12和FMDV转录水平变化(**.P < 0.01);C. TCID50方法检测口蹄疫病毒滴度;D~F. RT-qPCR检测FMDV在BHK-21、PK-15和Vero细胞中不同时间点的复制水平并绘制病毒复制曲线 A. Verification the expression of Gα12 and FMDV proteins by Western blot in PK-15 cell(**.P < 0.01); B. The mRNA level of Gα12 and FMDV was detected by qPCR(**.P < 0.01); C. Detection of viral titers by TCID50 assay; D-F. RT-qPCR was used to detect the replication levels of FMDV in BHK-21, PK-15 and Vero cells at different time points, and the viral replication curve was drawn 图 4 过表达Gα12抑制口蹄疫病毒复制 Fig. 4 Overexpression of Gα12 suppresses FMDV replication |
为了进一步验证Gα12对FMDV复制的影响,笔者做了Gα12的干扰试验。首先合成三条Gα12 SiRNA引物,为了验证干扰效率,将150 nmol·L-1的Gα12 SiRNA-1、Gα12 SiRNA-2、Gα12 SiRNA-3和NC SiRNA分别转染PK-15细胞,转染36 h后分别用实时荧光定量PCR和Western blot方法从RNA和蛋白水平分别检测对Gα12的干扰效率,结果显示,Gα12 SiRNA-3的干扰效率最高(图 5A)。
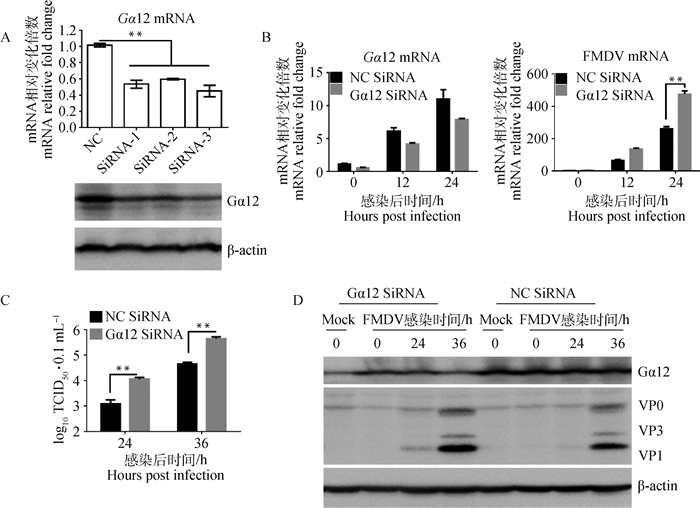
|
A.实时荧光定量和Western blot分别检测Gα12转录水平和蛋白水平变化;B.实时荧光定量PCR检测Gα12和FMDV转录水平变化;C. TCID50方法检测口蹄疫病毒滴度;D. Western blot检测Gα12和FMDV蛋白水平变化; **.P < 0.01 A. Detection of Gα12 mRNA level and protein level by qPCR and Western blot; B. The mRNA level of Gα12 and FMDV was detected by qPCR; C. Detection of viral titers by TCID50 assay; D. Gα12 and FMDV proteins were detected by Western blot; **.P < 0.01 图 5 下调Gα12促进口蹄疫病毒复制 Fig. 5 Downregulation of Gα12 enhances the FMDV replication |
将150 nmol·L-1 Gα12 SiRNA-3与NC SiRNA分别转染PK-15细胞,24 h后感染FMDV(MOI=0.5),分别在0、12、24 h收取样品,用实时荧光定量PCR分别检测Gα12和FMDV的mRNA水平。结果显示,敲低和不敲低Gα12的两组比较,敲低Gα12之后,FMDV的mRNA水平有显著升高(图 5B)。
将150 nmol·L-1 Gα12 SiRNA-3与NC SiRNA分别转染PK-15细胞,24 h后感染FMDV,分别在0、24和36 h收取样品,分别测定病毒滴度并进行Western blot检测,敲低和不敲低Gα12的两组比较,敲低Gα12之后,FMDV的病毒滴度和蛋白水平都升高(图 5C和D)。结果显示,敲低Gα12之后,FMDV的mRNA水平、蛋白水平及病毒滴度都有所升高。
2.6 Gα12促进NF-κB信号通路众所周知,Ⅰ型干扰素启动一系列信号级联反应,发挥重要抗病毒作用,SeV是一种激活Ⅰ型干扰素信号传导的模式病毒。为探讨Gα12是否影响SeV诱导的Ⅰ型IFN信号转导,将载体质粒或pcDNA3.1-Gα12-myc质粒分别与IFN-Luc或NF-κB-Luc荧光素酶报告质粒及pRL-TK共转染HEK-293T细胞,然后用SeV感染HEK-293T细胞。结果表明,Gα12蛋白的过表达以剂量依赖的方式增加了SeV诱导的NF-κB基因启动子活性(图 6B),但是对SeV诱导的β-IFN基因启动子活性没有影响(图 6A),表明Gα12蛋白促进NF-κB信号传导,这可能与Gα12介导的抗病毒作用有关。

|
A. Gα12对SeV诱导的β-IFN基因启动子活性的影响;B. Gα12对SeV诱导的NF-κB基因启动子活性的影响 A. Effect of Gα12 on SeV-induced promoter activation of β-IFN; B. Effect of Gα12 on SeV-induced promoter activation of NF-κB 图 6 Gα12促进NF-κB信号通路 Fig. 6 Gα12 enhanced the NF-κB signaling pathway |
口蹄疫是一种具有高度传染性且对经济具有重要影响的疾病[22]。FMDV通过操控宿主蛋白的表达以利于自身复制,同时其生命周期也受不同宿主蛋白的影响[23]。已发现一些宿主蛋白与FMDV蛋白发生相互作用并且影响FMDV的复制。例如,宿主蛋白DNAJA3与口蹄疫病毒VP1相互作用抑制口蹄疫病毒的复制[24]。PCBP2与VP0相互作用,促进病毒复制[25]。DCTN3可以与3A相互作用,并且该互作对于病毒在牛体内的复制至关重要[26]。Vimentin是2C的特异性宿主结合配体,2C和Vimentin之间的相互作用对于病毒复制至关重要[27]。Beclin1也是2C的天然配体,其参与自噬途径对FMDV复制很重要[28]。Sam68与FMDV非结构蛋白3C和3D共定位并共沉淀,突出该宿主因子对FMDV感染过程的重要性[29]。VP1诱导的Ⅰ型干扰素抑制是通过与sorcin的相互作用介导的[23],并且FMDV 2B与RIG-Ⅰ相互作用并诱导RIG-Ⅰ的减少[30]。总之,宿主蛋白在口蹄疫病毒的复制过程中起到很重要的作用。
鸟嘌呤核苷酸结合蛋白(G蛋白)调节并参与多种跨膜信号转导系统[31],异三聚体G蛋白将多种细胞外信号传递给细胞内的效应分子,其由鸟嘌呤核苷酸结合α-亚基、β-亚基和γ-亚基组成,基于其α亚基的序列相似性分为四个亚家族。由α亚基Gα12和Gα13组成的G12亚家族在细胞中可发生变异,并且这种变异与细胞的极性、生长、黏附、迁移、侵袭以及肿瘤的发生密切相关[32]。有研究发现Gα12信号通路与肿瘤发生密切相关[33],并且也发现Gα12启动子的甲基化与子痫早期发作有关[34]。然而Gα12目前在口蹄疫病毒方面的研究还未见报道,笔者的相关研究表明,Gα12与FMDV在PK-15细胞中的复制密切相关,通过FMDV感染PK-15细胞发现,内源性Gα12在转录水平和蛋白水平均上调,进一步通过过表达Gα12和利用干扰RNA敲低Gα12的表达试验表明,上调Gα12可以抑制口蹄疫病毒的mRNA水平、蛋白水平和病毒滴度,而下调Gα12可以促进口蹄疫病毒的复制,说明Gα12具有抑制FMDV复制的作用。进一步研究表明Gα12促进NF-κB信号通路,但是Gα12促进NF-κB信号通路的具体机制尚不明确,还需要进一步研究。
4 结论本研究成功构建Gα12真核表达质粒,且在真核细胞中成功表达并定位于细胞质中,用FMDV感染PK-15细胞后可上调Gα12,说明FMDV与Gα12之间存在一定的关联,通过过表达和干扰试验发现:过表达Gα12可明显抑制FMDV在PK-15细胞中的复制,而下调Gα12则促进FMDV在PK-15细胞中的复制。综上所述,Gα12在PK-15细胞中能够抑制口蹄疫病毒的复制。进一步研究发现,Gα12促进NF-κB信号传导,这可能与Gα12介导的抗FMDV作用有关。
| [1] | SUN P, ZHANG S M, QIN X D, et al. Foot-and-mouth disease virus capsid protein VP2 activates the cellular EIF2S1-ATF4 pathway and induces autophagy via HSPB1[J]. Autophagy, 2018, 14(2): 336–346. DOI: 10.1080/15548627.2017.1405187 |
| [2] | ZHU Z X, YANG F, CAO W J, et al. The pseudoknot region of the 5' untranslated region is a determinant of viral tropism and virulence of foot-and-mouth disease virus[J]. J Virol, 2019, 93(8): e02039–18. |
| [3] | LIU H S, ZHU Z X, XUE Q, et al. Foot-and-mouth disease virus antagonizes NOD2-mediated antiviral effects by inhibiting NOD2 protein expression[J]. J Virol, 2019, 93(11): e00124–19. |
| [4] | GAO Y, SUN S Q, GUO H C. Biological function of foot-and-mouth disease virus non-structural proteins and non-coding elements[J]. Virol J, 2016, 13(1): 107. DOI: 10.1186/s12985-016-0561-z |
| [5] | JAMAL S M, BELSHAM G J. Foot-and-mouth disease:past, present and future[J]. Vet Res, 2013, 44: 116. DOI: 10.1186/1297-9716-44-116 |
| [6] | NAGENDRAKUMAR S B, HONG N T T, GEOFFREY F T, et al. A Malaysia 97 monovalent foot-and-mouth disease vaccine (>6PD50/dose) protects pigs against challenge with a variant FMDV A SEA-97 lineage virus, 4 and 7 days post vaccination[J]. Vaccine, 2015, 33(36): 4513–4519. DOI: 10.1016/j.vaccine.2015.07.014 |
| [7] | GRUBMAN M J, BAXT B. Foot-and-mouth disease[J]. Clin Microbiol Rev, 2004, 17(2): 465–493. DOI: 10.1128/CMR.17.2.465-493.2004 |
| [8] | ZHAO F R, XIE Y L, LIU Z Z, et al. Lithium chloride inhibits early stages of foot-and-mouth disease virus (FMDV) replication in vitro[J]. J Med Virol, 2017, 89(11): 2041–2046. DOI: 10.1002/jmv.24821 |
| [9] | SPICHER K, KALKBRENNER F, ZOBEL A, et al. G12 and G13 α-subunits are immunochemically detectable in most membranes of various mammalian cells and tissues[J]. Biochem Biophys Res Commun, 1994, 198(3): 906–914. DOI: 10.1006/bbrc.1994.1129 |
| [10] | RUIZ V, MIGNAQUI A C, NUÑEZ M C, et al. Comparison of strategies for the production of FMDV empty capsids using the baculovirus vector system[J]. Mol Biotechnol, 2014, 56(11): 963–970. DOI: 10.1007/s12033-014-9775-8 |
| [11] | MU G G, DING Q S, LI H Y, et al. Gastrin stimulates pancreatic cancer cell directional migration by activating the Gα12/13-RhoA-ROCK signaling pathway[J]. Exp Mol Med, 2018, 50(5): 59. |
| [12] | YASUDA D, KOBAYASHI D, AKAHOSHI N, et al. Lysophosphatidic acid-induced YAP/TAZ activation promotes developmental angiogenesis by repressing Notch ligand Dll4[J]. J Clin Invest, 2019, 130: 4332–4349. |
| [13] | LEE H J, LEE E J, SEO M R. Galpha12 protects vascular endothelial cells from serum withdrawal-induced apoptosis through regulation of miR-155[J]. Yonsei Med J, 2016, 57(1): 247–253. DOI: 10.3349/ymj.2016.57.1.247 |
| [14] | BHATTACHARYYA R, BANERJEE J, KHALILI K, et al. Differences in Gα12-and Gα13-mediated plasma membrane recruitment of p115-RhoGEF[J]. Cell Signal, 2009, 21(6): 996–1006. DOI: 10.1016/j.cellsig.2009.02.010 |
| [15] | MIKELIS C M, PALMBY T R, SIMAAN M, et al. PDZ-RhoGEF and LARG are essential for embryonic development and provide a link between thrombin and LPA receptors and Rho activation[J]. J Biol Chem, 2013, 288(17): 12232–12243. DOI: 10.1074/jbc.M112.428599 |
| [16] | SONG M K, PARK C, LEE Y D, et al. Gα12 regulates osteoclastogenesis by modulating NFATc1 expression[J]. J Cell Mol Med, 2018, 22(2): 849–860. |
| [17] | KELLY P, CASEY P J, MEIGS T E. Biologic functions of the G12 subfamily of heterotrimeric G proteins:growth, migration, and metastasis[J]. Biochemistry, 2007, 46(23): 6677–6687. DOI: 10.1021/bi700235f |
| [18] | UDAYAPPAN U K, CASEY P J. c-Jun contributes to transcriptional control of GNA12 expression in prostate cancer cells[J]. Molecules, 2017, 22(4): 612. DOI: 10.3390/molecules22040612 |
| [19] | CERVANTES-VILLAGRANA R D, COLOR-APARICIO V M, REYES-CRUZ G, et al. Protumoral bone marrow-derived cells migrate via Gβγ-dependent signaling pathways and exhibit a complex repertoire of RhoGEFs[J]. J Cell Commun Signal, 2019, 13(2): 179–191. DOI: 10.1007/s12079-018-00502-6 |
| [20] | KANO K, MATSUMOTO H, INOUE A, et al. Molecular mechanism of lysophosphatidic acid-induced hypertensive response[J]. Sci Rep, 2019, 9(1): 2662. DOI: 10.1038/s41598-019-39041-4 |
| [21] | YANAGIDA K, IGARASHI H, YASUDA D, et al. The Gα12/13-coupled receptor LPA4 limits proper adipose tissue expansion and remodeling in diet-induced obesity[J]. JCI Insight, 2018, 3(24): e97293. DOI: 10.1172/jci.insight.97293 |
| [22] | MAHDY S E, LIU S J, SU L, et al. Expression of the VP1 protein of FMDV integrated chromosomally with mutant Listeria monocytogenes strain induced both humoral and cellular immune responses[J]. Appl Microbiol Biotechnol, 2019, 103(4): 1919–1929. DOI: 10.1007/s00253-018-09605-x |
| [23] | LI X Y, WANG J C, LIU J, et al. Engagement of soluble resistance-related calcium binding protein (sorcin) with Foot-and-Mouth Disease Virus (FMDV) VP1 inhibits type Ⅰ interferon response in cells[J]. Vet Microbiol, 2013, 166(1-2): 35–46. DOI: 10.1016/j.vetmic.2013.04.028 |
| [24] | ZHANG W, YANG F, ZHU Z X, et al. Cellular DNAJA3, a Novel VP1-interacting protein, inhibits foot-and-mouth disease virus replication by inducing lysosomal degradation of VP1 and attenuating its antagonistic role in the beta interferon signaling pathway[J]. J Virol, 2019, 93(13): e00588–19. |
| [25] | LI D, ZHANG J, YANG W P, et al. Poly (rC) binding protein 2 interacts with VP0 and increases the replication of the foot-and-mouth disease virus[J]. Cell Death Dis, 2019, 10(7): 516. DOI: 10.1038/s41419-019-1751-6 |
| [26] | GLADUE D P, O'DONNELL V, BAKER-BRANSETTER R, et al. Interaction of foot-and-mouth disease virus nonstructural protein 3A with host protein DCTN3 is important for viral virulence in cattle[J]. J Virol, 2014, 88(5): 2737–2747. DOI: 10.1128/JVI.03059-13 |
| [27] | GLADUE D P, O'DONNELL V, BAKER-BRANSTETTER R, et al. Foot-and-mouth disease virus modulates cellular vimentin for virus survival[J]. J Virol, 2013, 87(12): 6794–6803. DOI: 10.1128/JVI.00448-13 |
| [28] | GLADUE D P, O'DONNELL V, BAKER-BRANSTETTER R, et al. Foot-and-mouth disease virus nonstructural protein 2C interacts with Beclin1, modulating virus replication[J]. J Virol, 2012, 86(22): 12080–12090. DOI: 10.1128/JVI.01610-12 |
| [29] | RAI D K, LAWRENCE P, KLOC A, et al. Analysis of the interaction between host factor Sam68 and viral elements during foot-and-mouth disease virus infections[J]. J Virol, 2015, 12(1): 224. DOI: 10.1186/s12985-015-0452-8 |
| [30] | ZHU Z X, WANG G Q, YANG F, et al. Foot-and-Mouth Disease Virus viroporin 2B antagonizes RIG-I-mediated antiviral effects by inhibition of its protein expression[J]. J Virol, 2016, 90(24): 11106–11121. DOI: 10.1128/JVI.01310-16 |
| [31] | KRAKSTAD B F, ARDAWATIA V V, ARAGAY A M. A role for Gα12/Gα13 in p120ctn regulation[J]. Proc Natl Acad Sci U S A, 2004, 101(28): 10314–10319. DOI: 10.1073/pnas.0401366101 |
| [32] | JUNEJA J, CASEY P J. Role of G12 proteins in oncogenesis and metastasis[J]. Br J Pharmacol, 2009, 158(1): 32–40. DOI: 10.1111/j.1476-5381.2009.00180.x |
| [33] | CHIA C Y, KUMARI U, CASEY P J. Breast cancer cell invasion mediated by Gα12 signaling involves expression of interleukins-6 and -8, and matrix metalloproteinase-2[J]. J Mol Signal, 2014, 9(1): 6. |
| [34] |
马颖, 郭永平, 张雅丽, 等. 子痫前期与GNA12启动子甲基化的相关性分析[J]. 中国医刊, 2018, 53(9): 1019–1021.
MA Y, GUO Y P, ZHANG Y L, et al. Correlative analysis of methylation of GNA12 promoter in pre-eclampsia[J]. Chinese Journal of Medicine, 2018, 53(9): 1019–1021. DOI: 10.3969/j.issn.1008-1070.2018.09.019 (in Chinese) |




 GCTAGCGACATCGACGCGCTGCTGGCCCGC(NheⅠ)
GCTAGCGACATCGACGCGCTGCTGGCCCGC(NheⅠ) GGATCCCTGCAGCATGATATCTTTCAGGTT(BamHⅠ)
GGATCCCTGCAGCATGATATCTTTCAGGTT(BamHⅠ)