2. 定州市农业农村局, 定州 073000;
3. 邯郸市畜牧技术推广站, 邯郸 056000
2. Dingzhou Bureau of Agricultural and Rural Affairs, Dingzhou 073000, China;
3. Handan Animal Husbandry Technology Promotion Station, Handan 056000, China
星状病毒是星状病毒科(Astroviridae)中的唯一成员,该科分为两个属,即哺乳动物星状病毒属(Mamastrovirus)和禽星状病毒属(Avastrovirus)[1]。该病毒分布广泛且宿主众多,包括人、狗、牛、猪、猫、鸭、火鸡、蝙蝠、貂等[2]。其中猪星状病毒(porcine astrovirus,PAstV)可引起仔猪腹泻,食欲减退,且常与其他肠道病毒混合感染,对养殖业造成一定的经济损失。
PAstV基因组由3′UTR、5′UTR和三个开放性阅读框(ORF)构成, 分别是ORF1a、ORF1b和ORF2。PAstV共分为5个基因型,分别为PAstV1、PAstV2、PAstV3、PAstV4、PAstV5。不同基因型之间全基因的相似性仅在40%~46.6%[3]。ORF1a具有基因型内相对保守,而基因型间差异较大的特点,因此可利用该基因建立特异性检测星状病毒不同基因型的检测方法。
有研究报道在欧洲、美国和韩国的4型星状病毒是主要的流行毒株[4-6]。目前国内已报道的基因型有1型、2型、4型和5型[7-10]。2018年本实验室于河北省内采集的病料中陆续检测到猪星状病毒4型,表明本地区猪星状病毒4型具有一定的流行趋势。因此本研究依据相对保守基因ORF1a设计了一对特异性引物,建立了荧光定量PCR检测方法,为猪星状病毒4型的临床检测提供了快速和定量的检测方法。
1 材料与方法 1.1 病毒和病料猪星状病毒4型(PAstV4,GenBank登录号为MK613068)、猪流行性腹泻病毒(PEDV)、猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)和猪丁型冠状病毒(PDCoV)均由河北农业大学动物医学院动物传染病实验室分离并保存。临床病料采集自2018—2019年河北省各猪场。
1.2 主要试剂和仪器TRIzol Reagent/RNA提取试剂、反转录试剂盒TaKaRa PrimeScriptTM RT-Kit购自TaKaRa生物工程有限公司(北京);Super GelRed®核酸凝胶染料购自US Everbright®Inc(苏州)。罗氏96型荧光定量PCR仪为罗氏诊断产品(上海)有限公司产品。
1.3 引物参考GenBank登录号为MK613068的猪星状病毒序列,用Primer 5.0设计了一对目的片段为215 bp的荧光定量PCR引物PAstV-F/R,由上海生工生物工程技术服务有限公司合成。猪星状病毒4型的检测引物P4-F/R由本实验室设计并保存。
PAstV-F:5′-GCTGCTCCTGCTACACCACCTCCA-3′;PAstV-R:5′-CGTCCACCACCATGT-CTCCTCCCA-3′。P4-F:5′-GATTTACATCCAA-GGTTGATTCAGC-3′;P4-R:5′-CCAGGACCA-TTTTGCTCCAG-3′。
1.4 病毒RNA的提取和反转录通过TRIzol法提取病毒RNA。将得到的病毒RNA按照TaKaRa反转录试剂盒说明书操作得到病毒cDNA,并于-80 ℃保存。
1.5 标准质粒的制备以获取的cDNA为模板,用PAstV-F/R引物进行扩增,回收目的片段并进行连接转化及测序,经比对测序结果无误后,测定质粒浓度并转换成拷贝数,作为标准品。
1.6 荧光定量PCR方法的建立 1.6.1 反应体系和条件参考Fast Super EvaGreen® qPCR Master Mix荧光定量试剂盒的说明书,对引物终浓度、模板浓度、反应条件以及体系进行优化。
1.6.2 标准曲线的建立将构建的重组质粒做10倍比稀释(10-1~10-10),并选用浓度为108~102拷贝·μL-1的重组质粒作为模板,按照优化的反应体系条件进行荧光定量PCR的扩增, 绘制标准曲线和熔解曲线。
1.6.3 敏感度试验以8个不同浓度(108~101拷贝·μL-1)的重组质粒为模板,用已确定的最佳反应条件进行荧光定量PCR,并设置阴性对照。同时进行普通PCR反应。比较两种方法的结果。
1.6.4 特异性试验以PAstV、CSFV、PRRSV、PRV、PEDV、PDCoV的核酸以及构建的质粒为模板,按确定的反应条件进行荧光定量PCR,同时设置阴性对照,评价该方法的特异性。
1.6.5 重复性试验选取3个不同浓度的重组质粒(106~104拷贝·μL-1)为模板,按照已确定的反应程序和体系,进行3次荧光定量PCR扩增,每个浓度进行3个重复。计算变异系数,评估重复性。
1.7 临床样品的检测将2018—2019年收集自河北省各猪场的43份病料分别用本研究建立的荧光定量PCR方法和本实验室之前建立的普通PCR方法进行检测,比较两种方法的检测结果。
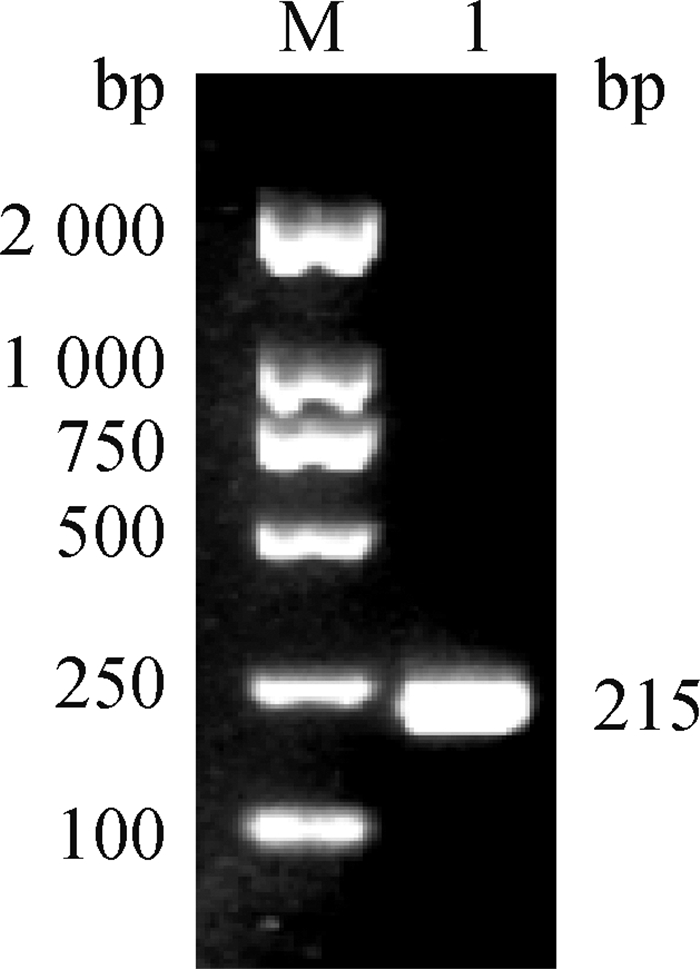
2 结果 2.1 标准品的制备及反应体系的优化以cDNA为模板,用特异性引物进行PCR扩增,扩增出大小约215 bp的目的条带,与预期的片段大小相符(图 1)。通过测序验证,确定为猪星状病毒4型。构建的重组质粒经测定浓度为160.3 ng·μL-1。经转化拷贝数为5.03×1010拷贝·μL-1。
|
M. DNA DL2000相对分子质量标准; 1. PCR扩增产物 M. DL2000 DNA marker; 1. PCR product 图 1 PAstV的PCR扩增结果 Fig. 1 PCR product of PAstV |
经反应体系及条件的优化,最终确定的反应体系为15 μL,其中qPCR Master Mix 7.5 μL,上下游引物各0.8 μL(10 μmol·L-1), 模板1.0 μL,用水补至15 μL,同时设置阴性对照。反应程序为:95 ℃ 5 min;95 ℃ 5 s,59 ℃ 20 s,72℃ 20 s,40个循环。
2.3 标准曲线的建立以浓度为5.03×108~5.03×102拷贝·μL-1的7个重组质粒作为扩增的模板,进行SYBR Green Ⅰ荧光定量PCR扩增。通过软件分析,可以得到以Cq值为纵坐标,拷贝数的对数值为横坐标绘制的标准曲线,标准曲线方程为:y=-3.352 6x+38.24,相关系数R2=1.00,构建的标准曲线呈现出良好的线性关系。熔解曲线只有一个峰,没有杂峰,其熔解温度约为83.5 ℃。
2.4 敏感度试验结果以8个稀释度的标准质粒为模板,进行敏感度分析。结果表明,本次试验中最低检出量为50.3拷贝·μL-1, 是普通PCR灵敏度的100倍(图 2)。

|
M. DNA DL2000相对分子质量标准; 1~9.浓度依次为5.03×108 ~5.03×100拷贝·μL-1的标准品质粒;10.阴性对照 M. DL2000 DNA marker; 1-9. The plasmid concentrations from 5.03×108 to 5.03×100 copies·μL-1, respectively; 10. Negative control 图 2 qPCR与常规PCR敏感性试验结果 Fig. 2 Sensitivity tests of the qPCR and PCR |
用本研究中的荧光定量PCR方法对CSFV、PRRSV、PRV、PEDV、PDCoV的核酸进行检测。结果表明,除了重组质粒和阳性病料的核酸为阳性外,其他病毒均为阴性,表明建立的方法具有较好的特异性(图 3)。
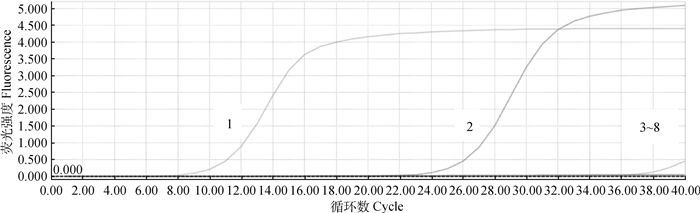
|
1.重组质粒;2. PAstV;3~7. CSFV,PRRSV, PRV, PEDV, PDCoV;8.阴性对照 1.Recombinant plasmid; 2. PAstV; 3-7. CSFV, PRRSV, PRV, PEDV, PDCoV; 8. Negative control 图 3 SYBR Green Ⅰ荧光定量PCR的特异性检测 Fig. 3 Specificity analysis of the SYBR Green Ⅰ fluorescence quantitative PCR |
以3个不同浓度的重组质粒为模板,进行重复性试验,结果显示,组内变异系数小于1%,组间变异系数小于2%,表明本试验建立的荧光检测方法重复性良好。
2.7 临床样品检测结果应用建立的方法,对收集的43份临床病料进行检测。结果显示,荧光定量PCR检测出8份为阳性,阳性率为18.6%,普通PCR测出5份为阳性。上述两种方法检测符合率为62.5%。本试验建立的检测方法更为敏感,可应用于临床检测。
3 讨论猪星状病毒是一种肠道致病性病原,自1980年首次发现以来,已在多个国家流行,并且有研究指出该病毒可以与人星状病毒发生基因重组[9, 11-15]。研究表明,我国不仅存在猪星状病毒,并且具有一定的流行趋势。因此建立灵敏度高、特异性强的猪星状病毒检测方法对养殖场的疾病预防控制和人类公共卫生安全都有重要意义。
用于检测病原的实验方法有电镜观察,免疫荧光,间接酶联免疫吸附试验,传统PCR,荧光定量PCR等。其中荧光定量PCR因其灵敏度高,特异性好,省时省力,操作简单等优点,已经广泛应用于病毒的临床检测[16-18]。
目前检测猪星状病毒的方法较少,罗璋等[8]建立了检测猪星状病毒的普通PCR方法。
商晓桂[7]根据猪星状病毒1型的ORF2基因建立了SYBR Green Ⅰ荧光定量PCR方法,但ORF2基因有变异巨大的缺点。目前尚无特异性检测猪星状病毒4型的方法,本研究建立的SYBR Green I的荧光定量PCR方法与罗璋等建立的普通PCR方法比较起来灵敏度更高,特异性更好。与商晓桂建立的方法相比较,本方法基于具有基因型内相对保守,基因型间变异较大特点的ORF1a基因设计引物,检测结果更为准确。
4 结论根据猪星状病毒4型保守的ORF1a基因设计引物建立了SYBR Green Ⅰ荧光定量PCR方法。标准曲线显示良好的线性关系,灵敏性试验表明该方法最低检测限可达50.3拷贝·μL-1,并且与CSFV、PRRSV、PRV、PEDV、PDCoV等病毒核酸无交叉反应。临床样品检测显示,与普通PCR相比,该方法更为准确、省时,可用于临床检测,为猪星状病毒4型的临床监测提供了技术手段。
| [1] | BRNIĆ D, JEMERŠIĆ L, KEROS T, et al. High prevalence and genetic heterogeneity of porcine astroviruses in domestic pigs[J]. Vet J, 2014, 202(2): 390–392. DOI: 10.1016/j.tvjl.2014.08.015 |
| [2] | LUO Z Y, ROI S, DASTOR M, et al. Multiple novel and prevalent astroviruses in pigs[J]. Vet Micr obiol, 2011, 149(3-4): 316–323. DOI: 10.1016/j.vetmic.2010.11.026 |
| [3] | SHAN T L, LI L L, SIMMONDS P, et al. The fecal virome of pigs on a high-density farm[J]. J Virol, 2011, 85(22): 11697–11708. DOI: 10.1128/JVI.05217-11 |
| [4] | SALAMUNOVA S, JACKOVA A, MANDELIK R, et al. Molecular detection of enteric viruses and the genetic characterization of porcine astroviruses and sapoviruses in domestic pigs from Slovakian farms[J]. BMC Vet Res, 2018, 14(1): 313. DOI: 10.1186/s12917-018-1640-8 |
| [5] | LEE M H, JEOUNG H Y, PARK H R, et al. Phylogenetic analysis of porcine astrovirus in domestic pigs and wild boars in South Korea[J]. Virus Genes, 2013, 46(1): 175–181. DOI: 10.1007/s11262-012-0816-8 |
| [6] | MOR S K, CHANDER Y, MARTHALER D, et al. Detection and molecular characterization of Porcine astrovirus strains associated with swine diarrhea[J]. J Vet Diagn Invest, 2012, 24(6): 1064–1067. DOI: 10.1177/1040638712458781 |
| [7] |
商晓桂.猪星状病毒的分离鉴定和荧光定量PCR检测方法的建立[D].呼和浩特: 内蒙古农业大学, 2010.
SHANG X G. Isolation and identification of porcine astrovirus and develoment of a SYBR green I real time quantitative PCR method[D]. Hohhot: Inner Mongolia Agricultural University, 2010. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10129-2010150266.htm |
| [8] |
罗璋, 罗季委, 李海锦, 等. 猪星状病毒2型PCR检测分型方法的建立及初步应用[J]. 湖南畜牧兽医, 2016(2): 39–41.
LUO Z, LUO J W, LI H M, et al. Establishment and preliminary application of PCR detection and typing method for Porcine astrovirus 2[J]. Hunan Journal of Animal Science & Veterinary Medicine, 2016(2): 39–41. DOI: 10.3969/j.issn.1006-4907.2016.02.019 (in Chinese) |
| [9] | ZHAO C X, CHEN C, LI Y, et al. Genomic characterization of a novel recombinant porcine astrovirus isolated in northeastern China[J]. Arch Virol, 2019, 164(5): 1469–1473. DOI: 10.1007/s00705-019-04162-8 |
| [10] | QIN Y F, FANG Q L, LIU H, et al. Construction of a reverse genetic system for porcine astrovirus[J]. Arch Virol, 2018, 163(6): 1511–1518. DOI: 10.1007/s00705-018-3771-4 |
| [11] | BRIDGER J C. Detection by electron microscopy of caliciviruses, astroviruses and rotavirus-like particles in the faeces of piglets with diarrhoea[J]. Vet Rec, 1980, 107(23): 532–533. |
| [12] | CAI Y H, YIN W Q, ZHOU Y C, et al. Molecular detection of Porcine astrovirus in Sichuan Province, China[J]. Virol J, 2016, 13: 6. DOI: 10.1186/s12985-015-0462-6 |
| [13] | PADMANABHAN A, HAUSE B M. Detection and characterization of a novel genotype of porcine astrovirus 4 from nasal swabs from pigs with acute respiratory disease[J]. Arch Virol, 2016, 161(9): 2575–2579. DOI: 10.1007/s00705-016-2937-1 |
| [14] | LEE S, JANG G, LEE C. Complete genome sequence of a porcine astrovirus from South Korea[J]. Arch Virol, 2015, 160(7): 1819–1821. DOI: 10.1007/s00705-015-2436-9 |
| [15] | ULLOA J C, GUTIÉRREZ M F. Genomic analysis of two ORF2 segments of new porcine astrovirus isolates and their close relationship with human astroviruses[J]. Can J Microbiol, 2010, 56(7): 569–577. DOI: 10.1139/W10-042 |
| [16] | ZHOU H L, LEI Y, WANG P, et al. Development of SYBR Green real-time PCR and nested RT-PCR for the detection of Potato Mop-top Virus (PMTV) and viral surveys in Progeny tubers derived from PMTV infected Potato tubers[J]. Mol Cell Probes, 2019, 47: 101438. DOI: 10.1016/j.mcp.2019.101438 |
| [17] | CHEN G H, TANG X Y, SUN Y, et al. Development of a SYBR green-based real-time quantitative PCR assay to detect PCV3 in pigs[J]. J Virol Methods, 2018, 251: 129–132. DOI: 10.1016/j.jviromet.2017.10.012 |
| [18] | CHENG W Y, HE X B, JIA H J, et al. Development of a SYBR Green I real-time PCR for detection and quantitation of orthopoxvirus by using Ectromelia virus[J]. Mol Cell Probes, 2018, 38: 45–50. DOI: 10.1016/j.mcp.2017.12.001 |



