2. 昆明理工大学生命科学与技术学院, 昆明 650500;
3. 重庆市荣昌区农业技术推广站, 重庆 402460;
4. 重庆纳比威特检测技术服务有限公司, 重庆 402460;
5. 重庆市永川区动物疫病预防控制中心, 重庆 402160
2. Faculty of Life Science and Technology, Kunming University of Science and Technology, Kunming 650500, China;
3. Chongqing Rongchang Agricultural Technical Extension Station, Chongqing 402460, China;
4. Chongqing Nabiweit Testing Technology Service Co. LTD, Chongqing 402460, China;
5. Yongchuan Center for Animal Disease Prevention and Control, Chongqing 402160, China
蓝舌病(bluetongue, BT)是蓝舌病病毒(bluetongue virus, BTV)引起的媒介昆虫传播的一种血源性非接触性传染病,绵羊和北美白尾鹿是临床上最易受BTV感染而发病致死的宿主,而其他家养和野生反刍动物通常是BTV的携带者[1-4]。该病主要在南纬40°与北纬53°之间的广大区域流行,迄今为止,全球已鉴定28种BTV血清型[5-8]。BTV粒子呈二十面体对称,圆形,由7种结构蛋白(VP1、VP2、VP3、VP4、VP5、VP6、VP7)和5种非结构蛋白(NS1、NS2、NS3、NS3A、NS4)组成[9-10]。在BTV感染的细胞中,由VP1、VP3和VP7及dsRNA组成的核心粒子在VP1蛋白作用下转录得到10个基因组片段的正链RNA,病毒mRNA作为合成病毒蛋白的模板在宿主细胞核糖体中翻译产生7种结构蛋白(VP1~VP7)和5种非结构蛋白(NS1、NS2、NS3、NS3a、NS4)[9, 11]。我国于1979年在云南省师宗县首次发现BT,到目前已在广东、广西、内蒙古等29个省份均检测到BTV血清阳性动物;已经鉴定出BTV-1、BTV-2、BTV-3等16种不同的血清型[8, 12-14]。研究表明,牛接种BTV-8疫苗后,抗体在血清中可持续5~8年,加强疫苗接种可明显延长疫苗诱导抗体的免疫保护力[15-17]。目前,BTV感染的诊断方法主要是RT-PCR、ELISA检测和BTV型特异性血清中和试验。但是RT-PCR技术操作复杂、成本高,容易污染,而ELISA以其简易和高通量的优点仍被广泛使用。目前市面上还没有可区分BTV疫苗免疫和野毒感染的以非结构蛋白为包被抗原的商品化ELISA试剂盒。研究发现,BTV NS4基因编码77~79个氨基酸,高度保守的N端富含碱性氨基酸,C端有亮氨酸拉链;NS4蛋白在IFN-α/β受体缺陷(IFNAR-/-)的小鼠中表达量低,而在一定剂量干扰素(interferon,IFN)处理的细胞中可促进BTV的复制,是细胞内干扰素信号通路的拮抗剂,同时也是BTV毒力因子,可促进BTV在绵羊体内的复制等[18-19]。本研究利用大肠杆菌表达系统制备的BTVNS4重组蛋白作为包被抗原,建立了一种基于非结构蛋白抗体的间接ELISA检测方法,为蓝舌病病毒血清流行病学监测及预防控制提供依据。
1 材料与方法 1.1 质粒及试剂pGEM-T-NS4载体、pMAL-c5x质粒(由本实验保存);TransT1细胞株、BL21(DE3)购自全式金生物技术有限公司;EZ-ladder DNA Marker (200~4 500 bp)购自上海万生昊天生物技术有限公司;NdeⅠ、HindⅢ、IPTG购自TaKaRa公司;Spectra多色宽范围蛋白分子量标准购自ThermoFisher公司;DNA胶回收试剂盒、质粒提取试剂盒购自Axygen公司;0.22 μm无菌滤器和透析袋购自Millipore公司,Ni-IDA亲和层析胶及蛋白纯化试剂盒购自Novagen公司;HRP标记兔抗牛IgG二抗购自US Biological公司;酶标板购自Costar公司,蓝舌病病毒cELISA抗体检测试剂盒购自云南省畜牧科学院畜牧兽医研究所,其他试剂均为国产或进口分析纯。
1.2 血清样本1.2.1 对照血清 牛BTV阴阳性对照血清购自云南畜牧科学院畜牧兽医研究所,阳性血清抗体效价为1:1 024,阴性血清抗体为阴性。
1.2.2 试验血清 对2018年重庆市部分地区采集的牛血清,筛选经蓝舌病病毒cELISA抗体检测试剂盒检测及BTV病毒VP7和NS4基因核酸检测,结果均为阳性的血清10份,结果均为阴性的血清10份由重庆市兽医科学工程中心提供。牛口蹄疫病毒、小反刍兽疫病毒、牛病毒性腹泻病毒阳性和阴性血清,由重庆永川动物疫病预防控制中心及重庆市兽医科学工程中心提供。
1.2.3 田间样品 76份牛血清,2019年从重庆永川、荣昌等地采集,经蓝舌病病毒cELISA抗体检测试剂盒检测,52份为BTV血清阳性,24份为阴性。
1.3 引物设计与合成参照pGEM-T-NS4-simple载体NS4基因序列设计并合成引物NS4 F和NS4 R,在上下游引物5′端分别加入NdeⅠ和HindⅢ酶切位点,并加入保护性碱基(下划线部分)。引物NS4 F:5′-GGAATTCCATATGATGGTGAGGGGACAC AACAGA-3′,NS4 R:5′-CCCAAGCTTCTACCCATCCTCCTCTGCTCG -3′,目的基因大小为246 bp。以上引物由北京华大基因科技有限公司合成。
1.4 NS4基因原核表达载体的构建以NS4 F和NS4 R为引物,以重组克隆质粒pGEM-T-NS4为模板,进行PCR扩增,PCR反应条件:94 ℃ 5 min;94 ℃ 45 s,58 ℃ 30 s,72 ℃延伸30 s,35个循环;最后72 ℃再延伸5 min。PCR产物于0.01 g·mL-1的琼脂糖凝胶中电泳后,按AxygenQuick Gel Extraction Kit的说明书进行纯化,并将纯化产物及pMAL-c5x表达载体用NdeⅠ和HindⅢ双酶切,酶切产物经鉴定正确后进行纯化并用T4 DNA连接酶于16 ℃过夜连接,NS4与pMAL-c5x连接后转入TransT1克隆菌株,挑取阳性质粒进行双酶切鉴定后送华大基因重庆公司测序;经双酶切及测序鉴定正确后获得重组表达载体,命名为pMAL-c5x-NS4。
1.5 NS4重组蛋白诱导表达分别取pMAL-c5x及pMAL-c5x-NS4重组质粒转入BL21(DE3)ply表达菌株,涂布于含100 μg·mL-1 Amp的LB平板,37 ℃倒置培养过夜;分别挑取平板上的单克隆接种于含100 μg·mL-1 Amp的3 mL LB培养液的试管中,37 ℃ 220 r·min-1摇振过夜。取pMAL-c5x及pMAL-c5x-NS4菌液20 μL加入2 mL含有Amp的LB培养基后,37 ℃ 180 r·min-1培养12 h。取出培养后的菌液500 μL加入20 mL的LB液体培养基,当菌液OD600 nm在0.6~0.8时加入浓度为0.6 mmol·L-1 IPTG进行诱导,11 ℃ 220 r·min-1诱导过夜,同时设pMAL-c5x空载体诱导和pMAL-c5x-NS4重组质粒未诱导两个对照组。收集菌液,8 000×g离心5 min,弃上清,用15 mL的PBS(pH7.4)重悬沉淀,8 000×g离心5 min,弃上清,加入1 mL PBS重悬沉淀,冰上超声破碎,分别收集上清和沉淀进行SDS-PAGE蛋白电泳鉴定分析。
1.6 重组蛋白纯化与Western blot鉴定将上述处理好的蛋白样品进行Ni-NTA His层析柱纯化,按照His Bind Purification Kit说明书来操作。纯化后的重组蛋白利用BCA蛋白浓度检测试剂盒作蛋白质浓度分析。经SDS-PAGE后转印至PVDF膜上,5%脱脂奶粉4 ℃过夜后加入BTV阳性血清(1:500),37 ℃作用1 h,加入HRP标记兔抗牛IgG抗体(1:5 000),37 ℃作用1 h,ECL显色分析。
1.7 间接ELISA方法的建立1.7.1 抗原最佳包被量和血清最佳稀释度的确定 将NS4重组蛋白用pH 9.6碳酸盐缓冲液从每孔6.0 μg·mL-1按2×倍比稀释到0.187 5 μg·mL-1,加入96孔板,每孔100 μL,4 ℃包被12 h;用包被液洗涤1次,每次2 min,振荡;加0.25 %的PVA溶液每孔300 μL,37 ℃封闭2 h;PBS洗涤2次,每次2 min,振荡;加5 %脱脂奶粉,每孔200 μL,37 ℃封闭30 min,用洗涤液洗涤3次,每次2 min;阳性与阴性血清用PBS按1:50、1:100、1:200、1:400稀释,每孔100 μL,37 ℃反应45 min;洗涤液洗涤3次,每次2 min,振荡;加入PBS稀释HRP标记兔抗牛IgG,每孔100 μL,37 ℃孵育30 min;洗涤液洗涤3次,每次2 min;避光加入TMB底物显色液100 μL,室温避光显色15 min;加入终止液50 μL,酶标仪测定OD450 nm值。
1.7.2 最佳封闭液的确定 包被后用包被液(pH 9.6碳酸盐缓冲液)洗涤1次,每次2 min,振荡;选用0.25% PVA溶液、5%脱脂奶粉、2%明胶、1% BSA、0.25% PVA溶液+5%脱脂奶粉(先用0.25% PVA溶液37 ℃封闭2 h,后用5%脱脂奶粉37 ℃封闭30 min)、2%海藻糖,每孔300 μL,37 ℃封闭2 h。其他条件同“1.6.1”中最佳条件。
1.7.3 酶标抗体工作浓度的确定 将HRP标记兔抗牛IgG抗体分别按照1:1 000、1:2 000、1:4 000、1:8 000稀释,其余按上述间接ELISA反应测定,筛选出最佳酶标抗体工作浓度。
1.7.4 反应临界值的确定 取BTV阴性血清10份,进行间接ELISA检测。每份样品重复3孔,结果取平均值,计算样本OD450 nm值的平均值(x)和标准方差(s)。根据统计学原则,样本的OD450 nm≥阴性样本OD450 nm值的平均值(x)+2s时,可以在99.9%的水平上判为阳性。因此,将x+2s所得值定为阴阳性血清的界限。再按照公式x±3s(±2s)计算阴阳性临界值及确定判断标准,x±3s为样品上限临界值,x±2s为下限临界值,界于两数值之间的则认为是可疑。
1.7.5 敏感性试验 按上述最佳反应条件,将效价为1:512的BTV阳性血清按1:50、1:100、1:200、1:400、1:800、1:1 600、1:3 200、1:6 400、1:12 800稀释,检测不同稀释倍数的阳性血清,根据检测最高血清稀释度来评价所建NS4抗体间接ELISA检测方法的敏感性。
1.7.6 重复性试验 按上述最佳反应条件,用同一批次包被的酶标板检测10份阳性血清,10份阴性血清,每份血清进行5次重复检测,以评价NS4抗体间接ELISA检测方法的批内重复性;用5个不同批次包被的酶标板检测10份阳性血清,10份阴性血清,计算x和s,根据变异系数来评价所建NS4抗体间接ELISA检测方法的批内和批间重复性。
1.7.7 特异性试验 分别将牛口蹄疫病毒、小反刍兽疫病毒、牛病毒性腹泻病毒和牛轮状病毒阳性和阴性血清按照1:50稀释,用上述建立的NS4蛋白间接ELISA检测方法进行检测,确定方法的特异性。
1.8 临床样品符合率检测利用“1.7”建立的间接ELISA方法及云南省畜牧科学院畜牧兽医研究所co-ELISA检测试剂盒同时检测76份重庆市牛血清样品,比较两种试剂盒的检测效果。
2 结果 2.1 NS4原核表达载体的构建与表达将NdeⅠ和HindⅢ双酶切的NS4基因与双酶切后的pMAL-c5x质粒连接,重组质粒经限制性内切酶NdeⅠ和HindⅢ双酶切后,获得约246 bp的NS4目的基因片段,重组质粒经测序后比对分析,表明成功构建了重组质粒pMAL-c5x-NS4(图 1A)。经SDS-PAGE蛋白电泳鉴定结果显示,重组质粒pMAL-c5x-NS4转化大肠杆菌BL21(DE3)Plys感受态细胞,0.6 mmol·L-1 IPTG诱导蛋白表达,经12% SDS-PAGE分析检测到相对分子质量约为52 ku的部分上清形式表达的NS4重组蛋白,与目的蛋白预期大小相符(图 1B)。
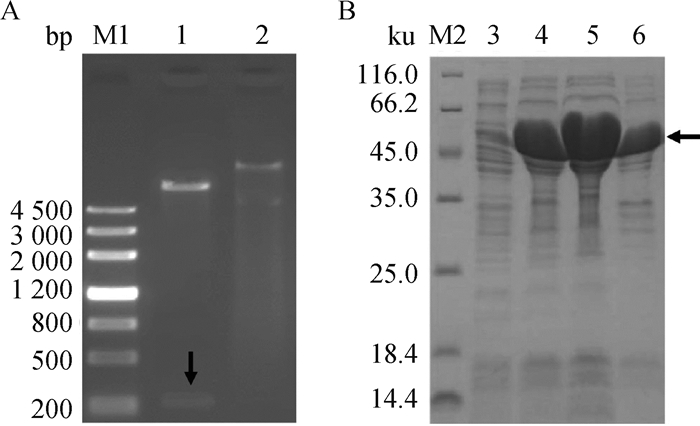
|
M1. DNA相对分子质量标准;1.NdeⅠ/HindⅢ酶切后质粒;2.酶切前质粒;M2.蛋白质相对分子质量标准;3.诱导的pMal-c5x空载体;4.诱导的pMal-c5x-NS4;5.诱导pMal-c5x-NS4破碎后上清;6.诱导pMal-c5x-NS4破碎后沉淀 M1.DNA marker; 1. Plasmid digested with NdeⅠ and HindⅢ; 2. Preenzymatic plasmid; M2. Protein molecular weight marker; 3. Induced pMal-c5x; 4.Induced pMal-c5x-NS4;5. Supernatant of ultrasonication with induced pMal-c5x-NS4; 6. Inclusion body of ultrasonication with induced pMal-c5x-NS4 图 1 重组质粒酶切鉴定(A)及重组融合蛋白SDS-PAGE分析(B) Fig. 1 Double enzyme digestion identification (A) and SDS-PAGE analysis (B) of recombinant fusion protein |
通过Ni柱亲和纯化获得目标蛋白,经12% SDS-PAGE分析,NS4重组蛋白分别在52 ku处出现较为单一的蛋白质条带(图 2A),SDS-PAGE后转印至PVDF膜上,纯化后的蛋白能与BTV阳性血清特异性反应(图 2B),说明重组蛋白NS4在大肠杆菌中正确表达并具有良好的抗原性。
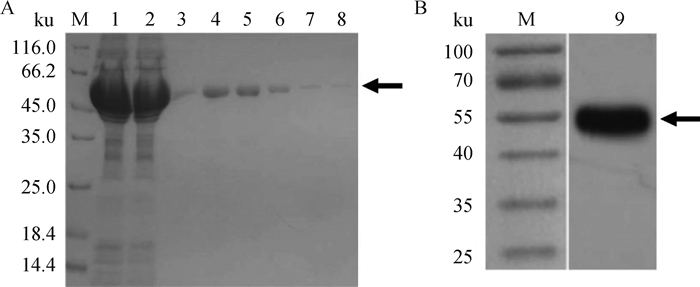
|
M.蛋白质相对分子质量标准;1.破碎处理后样品;2.镍柱纯化流出样品;3~8. 250 mmol·L-1咪唑洗脱NS4蛋白样品;9.纯化的NS4蛋白 M. Protein molecular weight marker; 1. Sample after ultrasonication; 2. Purified effluent sample of Ni-sepharose purification; 3-8. NS4 protein samples of 250 mmol·L-1 imidazole eluting; 9. Expressed NS4 protein 图 2 纯化蛋白SDS-PAGE分析(A)及Western blot鉴定分析(B) Fig. 2 SDS-PAGE (A) and Western blot analysis (B) of purified fusion protein |
2.3.1 抗原最佳包被量和血清最佳稀释度的确定 将蓝舌病病毒NS4蛋白稀释为6.000 0、3.000 0、1.500 0、0.750 0、0.375 0、0.187 5 μg·mL-1 6个梯度,血清按1:50、1:100、1:200、1:400 4个稀释度稀释,方阵滴定结果见表 1所示。阳性血清OD450 nm与阴性血清OD450 nm的P/N值(阳性血清OD450 nm值/阴性血清OD450 nm值)见表 2。选取阳性与阴性血清P/N值最高的孔,同时要求阳性血清OD450 nm值在1.0左右,因此,确定NS4蛋白最佳包被量为3.0 μg·mL-1,血清最佳稀释度均为1:200。
|
|
表 1 方阵法确定NS4蛋白包被量与血清稀释度(OD450 nm) Table 1 Determination of NS4 protein coating and serum dilution by square matrix method(OD450 nm) |
|
|
表 2 NS4蛋白P/N值 Table 2 The P/N values of the NS4 |
2.3.2 最佳封闭液的确定 以0.25%的PVA溶液+5%脱脂奶粉为封闭液时,NS4 P/N比值最大,为15.27,因此,确定0.25%的PVA溶液+5%脱脂奶粉为最佳封闭液。
2.3.3 酶标抗体工作浓度的确定 当酶标抗体分别按照1:1 000、1:2 000、1:4 000、1:8 000稀释时,前3个梯度P/N值无明显差异,当稀释到1:8 000时,P/N值下降较多,因此,酶标抗体最佳工作浓度为1:4 000。
2.3.4 临界值的确定 通过对10份蓝舌病病毒阴阳性血清进行ELISA检测,10份阴性血清OD值x为0.165,s为0.062 9,按照公式x±3 s(±2s)计算阴阳性临界值及确定判断标准,x±3s为样品上限临界值,x±2s为下限临界值,界于两数值之间的则认为是可疑。由以上判定条件可知NS4蛋白构建的间接ELISA检测方法阴阳性的判定标准为待检血清OD450 nm值≥0.35时判断为阳性,待检血清OD450 nm值≤0.29时判断为阴性,待检血清OD450 nm值界于0.29~0.35时则认为可疑。待检血清样品S/P值>0.35时判定为阳性,待检血清样品S/P值< 0.29时判定为阴性,当0.29≤待检血清样品S/P值≤0.35时判定为可疑。
2.3.5 敏感性试验 用建立的ELISA方法对倍比稀释的BTV阳性血清进行检测,结果显示,当效价为1:512的阳性血清稀释1 600倍时,OD450 nm值仍在临界值以上,说明所建立的NS4抗体间接ELISA方法具有较好的灵敏度。
2.3.6 重复性试验 同一批次包被的ELISA酶标板对10份阳性血清,10份阴性血清进行5次重复检测,批内变异系数均<10%;用5个不同批次包被的酶标板检测10份阳性血清和10份阴性血清,批间变异系数均<10%。说明所建立的NS4抗体间接ELISA检测方法具有良好的批内和批间重复性。
2.4 特异性试验用上述建立的ELISA检测方法进行特异性试验,结果显示牛口蹄疫病毒、小反刍兽疫病毒、牛病毒性腹泻病毒和牛轮状病毒阳性和阴性血清按照1:50稀释,S/P值均小于0.29,说明建立的ELISA方法特异性良好。
2.5 临床样品符合率检测用建立的间接ELISA方法分别对76份临床牛血清样品进行了NS4抗体检测分析。结果显示,52份阳性血清样品中NS4抗体阳性51份(51/52),1份可疑,0份阴性,抗体阳性符合率为98%。24份阴性血清样品中NS4抗体阴性24份(24/24),0份可疑(0/24),阴性样品检测符合率为100%;上述结果表明,本研究建立的间接ELISA方法可对临床牛血清样品进行NS4抗体检测。
3 讨论自从1979年BT在云南省师宗县首次发现以来,在我国流行的不同血清型的BTV以隐性感染为主,但是多种血清型BTV具有感染同一动物的能力和不同BTV基因组不同节段基因的重组对易感动物临床感染的风险仍然无法预测[12-13, 20-21]。因此,研发操作简单、快速、敏感性高,便于商品化、适用于检测大规模样品检测的ELISA诊断方法具有重要意义。迄今为止,基于BTV病毒群特异性抗体、病毒抗原捕获ELISA检测方法及VP7重组蛋白ELISA方法已有报告,已经开发了许多基于BTV非结构蛋白NS1、NS2基因核酸检测的PCR方法[22-25]。大量的研究表明,在病毒疫苗免疫的情况下,利用结构蛋白抗体的ELISA检测技术难以区分免疫动物与感染动物;而非结构蛋白抗体检测技术已成为公认的鉴别口蹄疫等灭活疫苗免疫动物与自然感染动物的有效方法[26]。本研究构建了BTV NS4基因原核表达载体pMAL-c5x-NS4,在大肠杆菌中获得了可溶性表达的融合蛋白,初步建立了NS4蛋白间接ELISA方法。
研究也表明,BTV非结构蛋白基因高度保守且在BTV病毒感染细胞内高表达,是参与BTV病毒复制及毒力的重要因子[27-28]。研究发现,BTV高度保守的NS4非结构蛋白,拮抗宿主细胞干扰素免疫应答,促进BTV病毒在绵羊体内复制等重要功能[18]。本研究初步建立的BTV NS4蛋白间接ELISA方法,具有较好的灵敏度、良好的批内和批间重复性,且对部分临床样品检测符合率较高,下一步笔者将通过BTV核酸检测及本研究中建立的ELISA检测方法,对BTV感染血清及BTV疫苗免疫动物血清进行进一步的研究,以进一步研发能区分灭活疫苗免疫与BTV野毒感染的ELISA试剂盒,为BTV流行病学调查、诊断和净化提供技术支持。
4 结论利用体外原核表达系统获得大量高浓度的蓝舌病病毒(BTV)重组NS4蛋白,建立了以纯化的NS4蛋白为包被抗原的间接ELISA方法,该方法具有良好的敏感性、重复性。使用本方法对2019年重庆市临床血清样品检测符合率高,对BTV感染血清抗体检测及进一步流行病学调查研究具有参考价值。
| [1] | AMBAGALA A, PAHARI S, FISHER M, et al. A rapid field-deployable reverse transcription-insulated isothermal polymerase chain reaction assay for sensitive and specific detection of bluetongue virus[J]. Transbound Emerg Dis, 2017, 64(2): 476–486. |
| [2] | FALCONI C, LÓPEZ-OLVERA J R, GORTAZÁR C. BTV infection in wild ruminants, with emphasis on red deer: a review[J]. Vet Microbiol, 2011, 151(3-4): 209–219. |
| [3] | WATHES D C, OGUEJIOFOR C F, THOMAS C, et al. Importance of viral disease in dairy cow fertility[J]. Engineering, 2020, 6(1): 26–33. |
| [4] | VERONESI E, DARPEL K, GUBBINS S, et al. Diversity of transmission outcomes following Co-infection of sheep with strains of bluetongue virus serotype 1 and 8[J]. Microorganisms, 2020, 8(6): 851. |
| [5] | BELBIS G, ZIENTARA S, BRÉARD E, et al. Chapter seven-bluetongue virus: from BTV-1 to BTV-27[J]. Adv Virus Res, 2017, 99: 161–197. |
| [6] | BUMBAROV V, GOLENDER N, JENCKEL M, et al. Characterization of bluetongue virus serotype 28[J]. Transbound Emerg Dis, 2020, 67(1): 171–182. |
| [7] | NIEDBALSKI W. Bluetongue in Europe and the role of wildlife in the epidemiology of disease[J]. Pol J Vet Sci, 2015, 18(2): 455–461. |
| [8] | DUAN Y L, BELLIS G, LI L, et al. Potential vectors of bluetongue virus in high altitude areas of Yunnan Province, China[J]. Parasit Vectors, 2019, 12(1): 464. |
| [9] | ROY P. Bluetongue virus structure and assembly[J]. Curr Opin Virol, 2017, 24: 115–123. |
| [10] |
易华山, 赵瑶, 马鲜平, 等. 蓝舌病毒结构与组装机制研究进展[J]. 家畜生态学报, 2020, 41(7): 79–84.
YI H S, ZHAO Y, MA X P, et al. Advance in structure and assembly mechanism of bluetongue virus[J]. Acta Ecologae Animalis Domastici, 2020, 41(7): 79–84. (in Chinese) |
| [11] | MOHI B P, ROY P. Bluetongue virus capsid assembly and maturation[J]. Viruses, 2014, 6(8): 3250–3270. |
| [12] | MA J G, ZHANG X X, ZHENG W B, et al. Seroprevalence and risk factors of bluetongue virus infection in Tibetan sheep and Yaks in Tibetan Plateau, China[J]. Biomed Res Int, 2017, 2017(4): 513903. |
| [13] | QIN S M, YANG H, ZHANG Y X, et al. Full genome sequence of the first bluetongue virus serotype 21 (BTV-21) isolated from China: evidence for genetic reassortment between BTV-21 and bluetongue virus serotype 16 (BTV-16)[J]. Arch Virol, 2018, 167(5): 1379–1382. |
| [14] |
吕敏娜, 杨恒, 孙铭飞, 等. 蓝舌病病毒7型毒株的分离与分子鉴定[J]. 畜牧兽医学报, 2017, 48(7): 1281–1287.
LV M N, YANG H, SUN M F, et al. Isolation and identification of bluetongue virus serotype 7 field isolate[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(7): 1281–1287. (in Chinese) |
| [15] | RIES C, BEER M, HOFFMANN B. BTV antibody longevity in cattle five to eight years post BTV-8 vaccination[J]. Vaccine, 2019, 37(20): 2656–2660. |
| [16] | HILKE J, STROBEL H, WOELKE S, et al. Presence of antibodies against bluetongue virus (BTV) in sheep 5 to 7. 5 years after vaccination with inactivated BTV-8 vaccines[J]. Viruses, 2019, 11(6): 553. |
| [17] |
马洪超, 孙淑芳, 陶茂辉, 等. 应用套入式聚合酶链反应(Nested-PCR)检测蓝舌病病毒的研究[J]. 畜牧兽医学报, 2000, 31(2): 145–149.
MA H C, SUN S F, TAO M H, et al. Nested polymerase chain reaction for detection of bluetongue virus[J]. Acta Veterinaria et Zootechnica Sinica, 2000, 31(2): 145–149. (in Chinese) |
| [18] | RATINIER M, SHAW A E, BARRY G, et al. Bluetongue virus NS4 protein is an interferon antagonist and a determinant of virus virulence[J]. J Virol, 2016, 90(11): 5427–5439. |
| [19] |
赵瑶, 徐栋, 易华山, 等. Ⅰ型蓝舌病毒NS4基因的克隆及序列分析[J]. 西南大学学报:自然科学版, 2020, 42(9): 77–86.
ZHAO Y, XU D, YI H S, et al. Cloning and sequence analysis of Ⅰ serotype bluetongue virus NS4 gene[J]. Journal of Southwest University: Natural Science Edition, 2020, 42(9): 77–86. (in Chinese) |
| [20] | CELMA C C, BHATTACHARYA B, ESCHBAUMER M, et al. Pathogenicity study in sheep using reverse-genetics-based reassortant bluetongue viruses[J]. Vet Microbiol, 2014, 174(1-2): 139–147. |
| [21] | SHAW A E, RATINIER M, NUNES S F, et al. Reassortment between two serologically unrelated bluetongue virus strains is flexible and can involve any genome segment[J]. J Virol, 2013, 87(1): 543–557. |
| [22] |
李佳璇, 臧明鑫, 谢双羽, 等. 蓝舌病病毒4型特异性竞争ELISA检测方法的建立[J]. 生物工程学报, 2017, 33(8): 1284–1291.
LI J X, ZANG M X, XIE S Y, et al. Establishment of two competitive ELISAs for specific detection of bluetongue virus serotype 4[J]. Chinese Journal of Biotechnology, 2017, 33(8): 1284–1291. (in Chinese) |
| [23] |
苗海生, 李乐, 朱建波, 等. 蓝舌病病毒阻断ELISA抗体检测方法的建立[J]. 中国预防兽医学报, 2014, 36(2): 111–115.
MIAO H S, LI L, ZHU J B, et al. Establishment of the blocking ELISA method for detection of the antibody titer against bluetongue virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(2): 111–115. (in Chinese) |
| [24] |
苗海生, 李乐, 廖德芳, 等. 蓝舌病病毒抗原捕获ELISA检测方法的建立[J]. 中国预防兽医学报, 2015, 37(3): 216–219.
MIAO H S, LI L, LIAO D F, et al. Establishment of AC-ELISA for detection of bluetongue virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(3): 216–219. (in Chinese) |
| [25] | ORŁOWSKA A, Z · MUDZI N ' SKI J F, SMRECZAK M, et al. Diagnostic reliability of different RT-PCR protocols for the detection of bluetongue virus serotype 14 (BTV-14)[J]. J Vet Res, 2017, 61(4): 391–395. |
| [26] |
杨继飞, 杨苏珍, 杨艳艳, 等. 以合成肽为抗原建立口蹄疫病毒非结构蛋白抗体检测ELISA试剂盒[J]. 中国农业科学, 2010, 43(6): 1242–1247.
YANG J F, YANG S Z, YANG Y Y, et al. Development of an ELISA for detection of Foot-and-Mouth nonstructural protein antibody with synthetic peptides[J]. Scientia Agricultura Sinica, 2010, 43(6): 1242–1247. (in Chinese) |
| [27] | JANOWICZ A, CAPORALE M, SHAW A, et al. Multiple genome segments determine virulence of bluetongue virus serotype 8[J]. J Virol, 2015, 89(10): 5238–5249. |
| [28] | FEENSTRA F, DROLET B S, BOONSTRA J, et al. Non-structural protein NS3/NS3a is required for propagation of bluetongue virus in Culicoides sonorensis[J]. Parasit Vectors, 2015, 8(9): 476. |



